| |
| Med Sci (Paris). 34(1): 24–26. doi: 10.1051/medsci/20183401007.La voie Notch dans le cancer bronchique à petites cellules Un oncogène et un suppresseur de tumeur Romane Oliverio1* and Julien Sage1** 1Departments of pediatrics and genetics, Stanford university, 265 campus drive, Stanford, CA 94305, États-Unis MeSH keywords: Animaux, Tumeurs colorectales, Cellules épithéliales, Transition épithélio-mésenchymateuse, Canal potassique KCNQ1, Souris, Protéines suppresseurs de tumeurs, Voie de signalisation Wnt, anatomopathologie, physiopathologie, physiologie |
Le cancer bronchique à petites cellules (CBPC), une tumeur neuroendocrine avec peu d’options de traitement Le cancer bronchique à petites cellules (CBPC) est un carcinome neuroendocrinien (NE) qui représente environ 15 % de l’ensemble des cas de cancers du poumon. Très largement associé à un tabagisme intensif, il est le sous-type de cancer du poumon le plus agressif. Au moment du premier diagnostic clinique, la plupart des patients présentent des métastases, et le taux de survie moyen à deux ans, pour un cancer généralisé, reste encore aujourd’hui inférieur à 5 %. Cette mauvaise statistique peut s’expliquer à la fois par le nombre élevé de métastases et par une forte tendance à la rechute rapide après une chimiothérapie classique (généralement, une combinaison cisplatine/étoposide ou carboplatine/ étoposide) à laquelle la majorité des patients répond pourtant favorablement dans un premier temps. En dépit de nombreux essais cliniques, aucune thérapie ciblée n’a encore été approuvée pour traiter ce type de cancer du poumon. Les mécanismes responsables de cette extrême résistance à diverses formes de traitement sont très mal connus [1, 2]. |
La voie de signalisation Notch : inhibition de la différenciation neuroendocrine et rôle suppresseur de tumeur dans le CBPC La voie de signalisation juxtacrine Notch est impliquée dans les mécanismes développementaux chez les métazoaires. Elle contribue à la création du lien entre le destin d’une cellule et celui de son environnement. Les produits des gènes Notch sont des récepteurs transmembranaires (Notch1-4) [3] (➔). (➔) Voir la Nouvelle de C. Le Caignec, m/s n° 6-7, juin juillet 2011, page 593 Leur domaine extracellulaire présente des motifs caractéristiques permettant leur interaction avec une famille de ligands qui sont eux-mêmes des protéines transmembranaires. À la suite de son interaction avec un ligand, le récepteur subit un clivage protéique. Le domaine intracy-toplasmique est alors transféré vers le noyau où il agit sur la régulation de la transcription de gènes cibles. La voie de signalisation Notch est généralement activée lors des stades précoces du développement dans les cellules souches ou des progéniteurs. Elle a une influence sur les mécanismes prolifératifs ou apoptotiques des cellules cibles, ainsi que sur la différenciation cellulaire. Elle peut avoir, selon le contexte, un rôle oncogénique ou de suppresseur de tumeur. L’activation de la voie Notch a, par exemple, un effet fortement oncogénique dans les leucémies aiguës lymphoblastiques de type T (LAL-T) et, au contraire, un rôle de suppresseur de tumeur dans différents types de carcinomes cellulaires squameux [4]. Lors du développement normal du poumon, la voie Notch, lorsqu’elle est activée, inhibe la différenciation de cellules progénitrices en cellules NE (neuroendocrines) et promeut la formation de cellules épithéliales non-NE [5]. Des études menées précédemment ont montré un rôle de suppresseur de tumeur de la voie Notch dans le CBPC [6]. Le séquençage de tumeurs humaines a aussi démontré la présence de mutations inhibitrices dans les gènes de la famille Notch dans environ 20 % des cas de CBPC [7]. Nous avons observé, dans un modèle murin du CBPC et dans des cellules tumorales humaines, que les cellules présentant les caractéristiques les plus neuroendocrines, étaient les plus tumorigéniques [8]. Nous avons aussi montré que l’activation de la voie Notch induit la perte de marqueurs de différenciation NE, ainsi qu’un ralentissement du cycle cellulaire, ce qui limite la prolifération et la croissance tumorale [6]. Ces résultats indiquent que l’activation de la voie Notch est intrinsèquement inhibitrice dans le CBPC. |
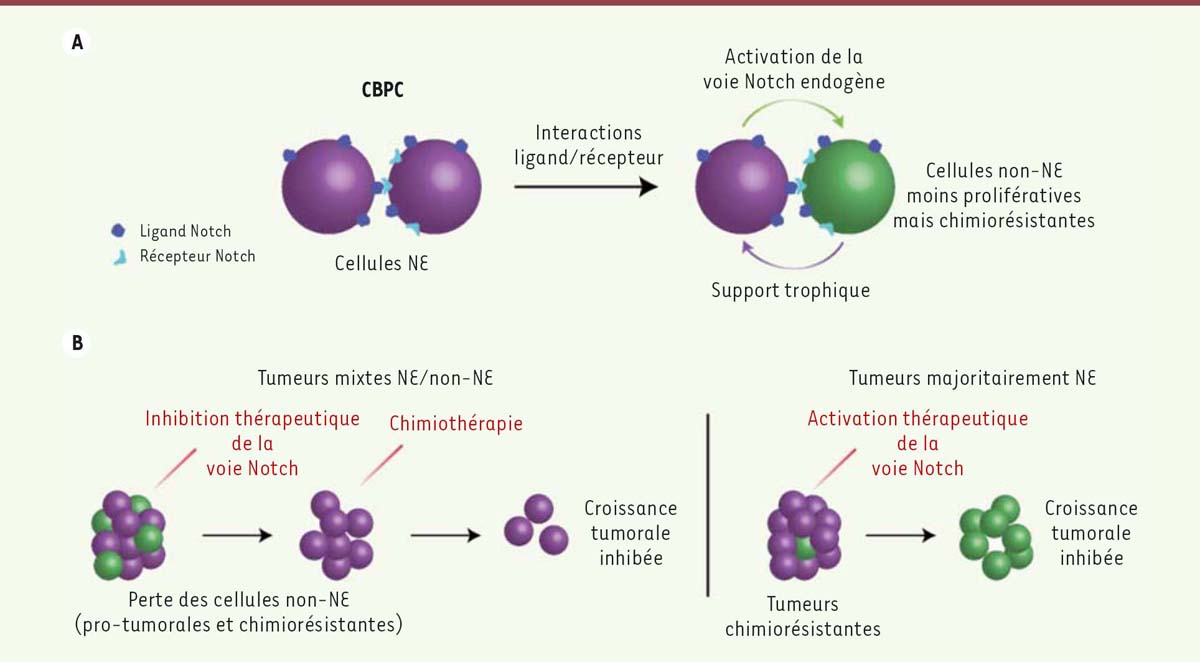
Hétérogénéité intratumorale : implication de la voie Notch dans la génération d’une niche cellulaire qui stimule la croissance des cellules neuroendocrines cancéreuses Plus récemment, notre équipe a observé que la voie de signalisation Notch pouvait avoir un rôle oncogénique dans le CBPC [9]. Initialement, nous avons étudié l’implication de cette voie en mesurant les niveaux d’expression d’une cible transcriptionnelle de Notch, Hes1. Nous avons mené notre étude sur un modèle tumoral murin ainsi que sur des tumeurs humaines, et avons découvert qu’une large majorité de ces tumeurs exprimaient des niveaux détectables de Hes1. À la suite de cette découverte, nous avons analysé des cellules individuelles, et nous avons observé que, si la majorité des cellules tumorales NE exprime seulement des ligands pour la voie Notch, une partie d’entre elles exprime également un récepteur ; nos données montrent la capacité de ces cellules à répondre à la signalisation Notch et à la présence de ligand sur les cellules tumorales voisines ou d’autres cellules dans l’environnement tumoral. Les cellules NE du CBPC fournissent donc des ligands Notch aux cellules cancéreuses adjacentes pourvues des récepteurs associés, et contribuent de cette manière, à leur transition en cellules non-NE qui expriment Hes1. Une part non négligeable des cellules tumorales active ainsi la voie de signalisation Notch de façon endogène ; ces cellules cancéreuses non-NE se divisent plus lentement que les cellules NE, ce qui est en accord avec un rôle intrinsèque de suppresseur de tumeur pour la voie Notch dans les cellules NE [9]. Cette hétérogénéité cellulaire est présente dans 70 à 75 % des tumeurs humaines examinées, et plus d’un tiers des tumeurs contiennent au moins 20 % de cellules pour lesquelles l’expression de Hes1 est détectable par immunohistochimie [9]. La caractérisation de cellules non-NE dans le CBPC soulève deux questions : tout d’abord, quels sont les mécanismes moléculaires par lesquels la voie Notch modifie la différenciation des cellules NE en cellules non-NE ? Ces cellules non-NE jouent-elles, par ailleurs, un rôle dans le développement tumoral ou la réponse aux chimiothérapies ? Pour répondre à la première question, nous avons analysé le transcriptome de ces deux populations, ce qui nous a permis d’identifier et de valider l’induction du répresseur de transcription Rest [10] par Notch comme un nouveau médiateur de cette transition NE/non-NE dans les cellules du CBPC [9]. S’agissant du rôle potentiel des cellules non-NE dans la croissance tumorale, nous avons observé que ces cellules étaient intrinsèquement plus résistantes à un traitement à base de cisplatine et d’étoposide, peutêtre en partie parce qu’elles se divisent moins rapidement. En conduisant des expériences de co-culture, nous avons également montré que les cellules non-NE peuvent sécréter des facteurs qui facilitent la croissance des cellules NE. En conséquence, dans un modèle d’allo-greffe, une association entre le tarextu-mab (antagoniste de Notch2/3) [11] et une combinaison carboplatine/irinoté-can donne de meilleurs résultats que ces deux traitements appliqués séparément. De plus, dans les modèles utilisés, le traitement au tarextumab retarde l’acquisition d’une chimiorésistance ainsi que la rechute. Ces résultats témoignent du rôle également pro-tumorigénique de la voie de signalisation Notch dans le CBPC. En effet, l’induction, par cette voie de signalisation, de cellules nonNE permet aux tumeurs de générer leur propre support trophique. La croissance de celles-ci est effectivement plus lente que celle des cellules NE (rôle suppresseur de tumeur de la voie Notch), mais elles répondent moins favorablement à une chimiothérapie classique — voire y sont résistantes-et offrent un cadre de croissance propice aux cellules cancéreuses NE (Figure 1A).  | Figure. 1 Figure 1. Activation de la voie Notch et hétérogénéité cellulaire dans le CBPC. A. La majorité des cellules dans le CBPC ont des caractéristiques de différenciation neuroendocrine (NE) et expriment à leur surface des ligands de la voie Notch. Certaines de ces cellules expriment également des récepteurs de Notch et peuvent activer la voie Notch, ce qui inhibe la différenciation NE et réduit la prolifération cellulaire. L’activation de la voie Notch est intrinsèquement anti-tumorale dans ce contexte. Les cellules non-NE ainsi générées peuvent néanmoins servir de support aux cellules NE et stimuler leur croissance en secrétant des facteurs de croissance. La voie Notch joue ainsi un rôle pro-tumorigénique. B. Ces observations suggèrent que dans les tumeurs qui génèrent des cellules non-NE, l’inhibition de la voie Notch pourrait empêcher la formation de ces cellules de support, et une combinaison avec chimiothérapie pourrait inhiber la croissance tumorale. Inversement, dans le cas de tumeurs composées principalement de cellules NE et chimiorésistantes, l’activation thérapeutique de la voie Notch pourrait ralentir la croissance de ces tumeurs. |
|
Implications thérapeutiques : activer ou inhiber la voie Notch dans le CBPC Nos observations suggèrent deux approches personnalisées pour le traitement du CBPC (Figure 1B). Dans le cas de tumeurs avec peu ou pas de cellules non-NE, définies par une faible activation de la voie Notch, il serait plus adapté de développer des stratégies qui activent cette voie, peut-être par des mécanismes épigénétiques de réactivation de l’expression des gènes Notch. Au contraire, dans le cas de tumeurs comportant une fraction importante de cellules non-NE avec activation de la voie Notch, nos résultats justifient le fait de combiner un traitement fondé sur l’inhibition de la voie Notch (pour bloquer la génération de cellules qui supportent la croissance tumorale) avec une chimiothérapie classique (qui attaque principalement les cellules NE). Cette stratégie devrait permettre à la fois de limiter la chimiorésis-tance et de réduire le taux de rechute. Les essais cliniques de phase 1b menés par OncoMed Pharmaceuticals montraient, pour le traitement au tarextumab, une amélioration globale du taux de survie des patients sélectionnés-atteints d’un CBPC et dont les tumeurs exprimaient de hauts niveaux de gènes cibles de la voie Notch (https://clinicaltrials.gov/ct2/ show/NCT01859741). Malheureusement, l’étude clinique de phase 2, menée sur une cohorte de patients plus importante, n’a pas permis de confirmer ces résultats (résultats annoncés publiquement mais non encore publiés). Notre hypothèse est que notre approche pourrait être surtout appropriée pour les patients atteints de CBPC de stade initial, quand les tumeurs sont moins agressives. Cette dualité du rôle de la voie de signalisation Notch dans le CBPC est révélatrice de la complexité des fonctions développementales et de leur implication dans les différents types de cancer, complexité qui sera un facteur majeur à prendre en compte dans le développement de nouvelles stratégies thérapeutiques personnalisées. En outre, notre étude souligne qu’une meilleure connaissance de la diversité cellulaire intra-tumorale peut avoir une grande importance dans le développement de nouveaux protocoles thérapeutiques. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. |
1. Kalemkerian GP. Small cell lung cancer . Semin Respir Crit Care Med. 2016;; 37 : :783.-96. 2. Sabari JK, Lok BH, Laird JH, et al. Unravelling the biology of SCLC: implications for therapy . Nat Rev Clin Oncol. 2017;; 14 : :549.-61. 3. Le Caignec C. Pathologies humaines et récepteur Notch . Med Sci (Paris). 2011;; 27 : :593.-5. 4. Ntziachristos P, Lim JS, Sage J, Aifantis I. From fly wings to targeted cancer therapies: a centennial for notch signaling . Cancer Cell. 2014;; 25 : :318.-34. 5. Ito T, Udaka N, Yazawa T, et al. Basic helix-loop-helix transcription factors regulate the neuroendocrine differentiation of fetal mouse pulmonary epithelium . Development. 2000;; 127 : :3913.-21. 6. Sriuranpong V, Borges MW, Ravi RK, et al. Notch signaling induces cell cycle arrest in small cell lung cancer cells . Cancer Res. 2001;; 61 : :3200.-5. 7. George J, Lim JS, Jang SJ, et al. Comprehensive genomic profiles of small cell lung cancer . Nature. 2015;; 524 : :47.-53. 8. Jahchan NS, Lim JS, Bola B, et al. Identification and targeting of long-term tumor-propagating cells in small cell lung cancer . Cell Rep. 2016;; 16 : :644.-56. 9. Lim JS, Ibaseta A, Fischer MM, et al. Intratumoural heterogeneity generated by Notch signalling promotes small-cell lung cancer . Nature. 2017;; 545 : :360.-4. 10. Chen ZF, Paquette AJ, Anderson DJ. NRSF/REST is required in vivo for repression of multiple neuronal target genes during embryogenesis . Nat Genet. 1998;; 20 : :136.-42. 11. Yen WC, Fischer MM, Axelrod F, et al. Targeting Notch signaling with a Notch2/Notch3 antagonist (tarextumab) inhibits tumor growth and decreases tumor-initiating cell frequency . Clin Cancer Res. 2015;; 21 : :2084.-95. |