| |
| Med Sci (Paris). 34(2): 114–116. doi: 10.1051/medsci/20183402004.Vésicules extracellulaires stromales et régulation des cellules souches et progéniteurs hématopoïétiques Grégoire Stik,1,2 Laurence Petit,1 Pierre Charbord,1 Thierry Jaffredo,1 and Charles Durand1* 1Sorbonne université, UPMC université Paris 06, institut de biologie Paris-Seine (IBPS), CNRS UMR7622, Inserm U1156, laboratoire de biologie du développement, 9, quai Saint-Bernard, 75005Paris, France 2Adresse actuelle : CRG, PRBB, 08003, Barcelona, Espagne |
Les cellules souches hématopoïétiques (CSH), localisées chez l’adulte dans la moelle osseuse, sont responsables du renouvellement continu des différentes populations de cellules sanguines. Les CSH sont intimement régulées par des cellules stromales qui constituent un microenvironnement (ou niche) essentiel à leur survie et leur auto-renouvellement. Actuellement, la caractérisation cellulaire de la niche médullaire des CSH fait l’objet d’intenses investigations. Sur le plan moléculaire, le dialogue entre CSH et cellules de leur microenvironnement met notamment en jeu des molécules de signalisation (facteurs de croissance, cytokines, chimiokines et morphogènes) et des molécules d’adhérence cellulaire et de remodelage par synthèse et dégradation de la matrice extracellulaire. Comprendre la complexité du dialogue entre les CSH et leur niche représente donc un enjeu essentiel dans le domaine de la biologie des cellules souches et de la médecine régénératrice compte tenu des applications importantes en thérapie cellulaire. |
Les CSH et leur microenvironnement L’élément cellulaire clé de la niche médullaire est la cellule stromale mésenchymateuse (CSM) qui établit avec les CSH une interface privilégiée au sein de la moelle osseuse. Ainsi, les CSM positives pour la nestine (nestine+), capables de s’auto-renouveler et de donner naissance à plusieurs types de cellules mésenchymateuses, sont physiquement associées aux CSH. Leur déplétion entraîne une diminution importante du nombre de CSH dans la moelle osseuse [1]. Les dérivés des CSM, tels que les ostéoblastes, les cellules endothéliales et les péricytes, sont également des composants essentiels de la niche médullaire (définissant respectivement une niche endostéale et une niche péri-vasculaire) [2]. Il est important de noter que la niche des CSH apparaît d’une grande complexité dans la mesure où divers types cellulaires, incluant les cellules de Schwann non myélinisées, les macrophages et les mégacaryocytes, les cellules T régulatrices et les ostéoclastes, ont été décrits comme jouant un rôle de premier plan dans le contrôle des CSH [3]. À cette régulation locale s’ajoute, par ailleurs, une régulation systémique. En effet, les rythmes circadiens, le système nerveux sympathique et des hormones telles que les glucocorticoïdes, influencent également de façon critique la biologie des CSH et leur mobilisation dans le sang. De nombreuses études utilisant des lignées de souris génétiquement modifiées et des tests fonctionnels appropriés permettant de quantifier et d’analyser le potentiel des cellules souches et des progéniteurs hématopoïétiques (CSPH) ont clairement souligné l’importance de la chimiokine CXCL12 (C-X-C motif chemokine 12) et de la cytokine SCF (stem cell factor) dans la régulation extrinsèque des CSPH chez l’adulte. Plus récemment, nous avons développé une approche inspirée de la biologie des systèmes pour extraire le cœur moléculaire de la fonction stromale [4] (➔) (➔)Voir la Nouvelle de P. Charbord et al., m/s n° 1, janvier 2015, page 12 La comparaison du profil d’expression génique de lignées de cellules stromales murines différant dans leur capacité à soutenir ex vivo des CSPH nous a permis d’isoler un ensemble de gènes (inférieur à 500) dont nous avons pu montrer qu’il était à la fois représentatif et prédictif de la fonction de soutien des CSPH [5]. |
Rôles des vésicules extracellulaires d’origine stromale Les vésicules extracellulaires (VE) apparaissent aujourd’hui comme des médiateurs clés de la communication cellulaire à courte et longue distance dans des contextes aussi bien physiologiques que pathologiques [6]. Les VE sont délimitées par une bicouche lipidique. Elles peuvent contenir des protéines et différents types d’ARN codants et non codants. Plusieurs types de VE ont été identifiés selon, principalement, leurs diamètres et leurs voies de biogenèse. Les microparticules sont le résultat de bourgeonnements à partir de la membrane plasmique. Les exosomes qui sont de plus petite taille et de diamètre inférieur à 150 nm, sont eux retrouvés à l’intérieur des cellules dans des corps multi-vésiculaires et sont libérés dans le milieu extracellulaire après fusion avec la membrane plasmique [6]. Tirant avantage de deux lignées de cellules stromales établies à partir du foie fœtal de souris et différant sur le plan fonctionnel dans leur capacité à soutenir les CSPH ex vivo (l’une de ces lignées présente une forte activité de soutien, l’autre en est dépourvue), nous avons récemment montré que ces cellules stromales contenaient de nombreux corps multi-vésiculaires et qu’elles sécrétaient des VE [7]. Nous avons observé que les CSPH exprimant les antigènes c-kit (stem cell factor receptor) et Sca-1 (stem cell antigen-1), et négatives pour l’expression des marqueurs de différenciation des lignages érythroïde, myéloïde et lymphoïde (lineage negative) capturaient spécifiquement les VE produites par les cellules stromales ayant une forte activité de soutien. Cette internalisation s’accompagne d’un maintien du potentiel clonogénique des CSPH (probablement en empêchant les cellules ciblées par les VE de progresser vers l’apoptose) et modifie leur profil d’expression génique. Des expériences de séquençage à haut débit ont révélé, par ailleurs, que les VE exprimaient une signature moléculaire complexe différente de celle des cellules dont elles sont issues [7]. |
Cette étude, en accord avec de récents travaux sur le rôle des VE délivrées par les CSM [8, 9], révèle que les VE constituent un composant essentiel du dialogue entre les CSPH et les cellules de leur microenvironnement. Des analyses protéomiques sont actuellement menées pour tenter d’identifier les mécanismes moléculaires impliqués dans l’adressage spécifique des VE vers les CSPH. Ces recherches pourraient permettre à terme de transférer dans les CSPH normales et leucémiques des molécules d’intérêt thérapeutique et/ou des facteurs permettant de les amplifier ex vivo à des fins de thérapie cellulaire. |
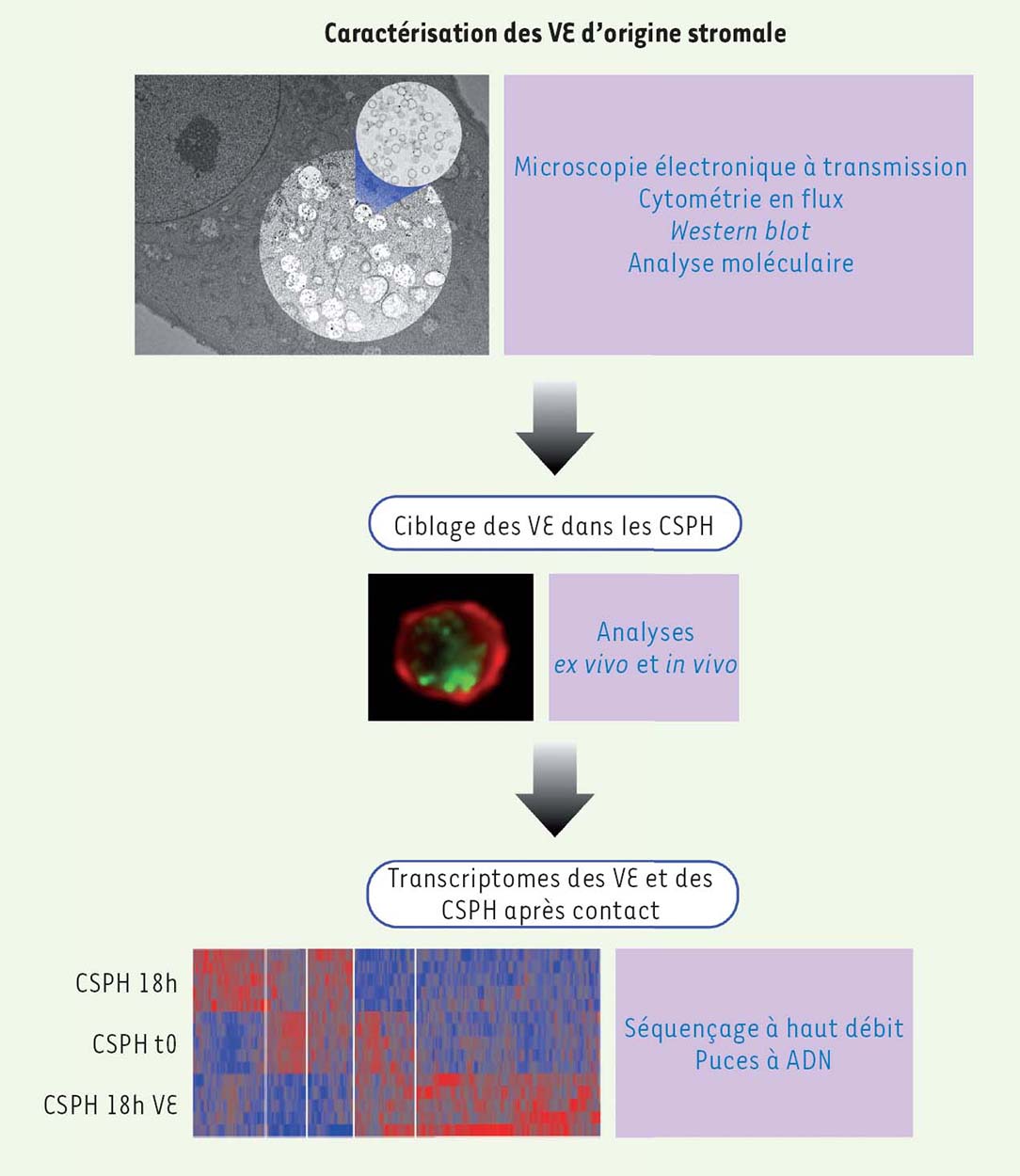
Les auteurs remercient Sophie Gournet (Institut de biologie Paris Seine, UMR 7622, Paris) pour son aide précieuse dans la préparation de la Figure 1. Cette étude a bénéficié du soutien financier de la Fondation pour la Recherche Médicale (DEQ20100318258) et de l’Agence Nationale pour la Recherche (ANR/CIRM 0001-02).  | Figure 1 Caractérisation des vésicules extracellulaires d’origine stromale. Diverses approches expérimentales (la microscopie électronique à transmission, la cytométrie en flux, le western blot et l’analyse du contenu moléculaire) ont permis de montrer que les cellules stromales sécrètent des vésicules extracellulaires (VE). L’image du haut illustre le cytoplasme des cellules stromales soutenant de façon efficace les cellules souches et des progéniteurs hématopoïétiques (CSPH). Un agrandissement des corps multi-vésiculaires révèle la présence de vésicules de plus petite taille. Les VE sont capturées par les CSPH ex vivo et in vivo. Dans l’image centrale, les VE ont été marquées avec un composé fluorescent (vert) et les CSPH sont reconnus à l’aide d’un anticorps monoclonal qui marque leur membrane plasmique (en rouge). Des approches à haut débit montrent que les VE, dont la signature génétique est complexe, influencent le profil d’expression génique des CSPH. L’image en bas représente le profil d’expression, révélé par hybridation de puces à ADN, des CSPH après purification (CSPH t0) ou après 18 heures de culture en l’absence (CSPH 18h) ou en présence (CSPH 18h VE) des VE produites par les cellules stromales supportrices. |
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. |
1. Mendez-Ferrer S, Michurina TV, Ferraro F, et al. Mesenchymal and haematopoietic stem cells form a unique bone marrow niche. Nature. 2010;; 466 : :829.-34. 2. Morrison SJ, Scadden DT. The bone marrow niche for haematopoietic stem cells. Nature. 2014;; 505 : :327.-34. 3. Crane GM, Jeffery E, Morrison SJ. Adult haematopoietic stem cell niches. Nat Rev Immunol. 2017;; 17 : :573.-90. 4. Charbord P, Jaffredo T, Durand C. Le coeur moléculaire de la fonction de niche des cellules souches hématopoïétiques. Med Sci (Paris). 2015;; 31 : :12.-4. 5. Charbord P, Pouget C, Binder H, et al. A systems biology approach for defining the molecular framework of the hematopoietic stem cell niche. Cell Stem Cell. 2014;; 15 : :376.-91. 6. Tkach M, Thery C. Communication by extracellular vesicles: where we are and where we need to go. Cell. 2016;; 164 : :1226.-32. 7. Stik G, Crequit S, Petit L, et al. Extracellular vesicles of stromal origin target and support hematopoietic stem and progenitor cells. J Cell Biol. 2017;; 216 : :2217.-30. 8. Wen S, Dooner M, Cheng Y, et al. Mesenchymal stromal cell-derived extracellular vesicles rescue radiation damage to murine marrow hematopoietic cells. Leukemia. 2016;; 30 : :2221.-31. 9. De Luca L, Trino S, Laurenzana I, et al. MiRNAs and piRNAs from bone marrow mesenchymal stem cell extracellular vesicles induce cell survival and inhibit cell differentiation of cord blood hematopoietic stem cells. : a new insight in transplantation. Oncotarget. 2016;; 7 : :6676.-92. |