| |
| Med Sci (Paris). 34(2): 123–125. doi: 10.1051/medsci/20183402007.Champignons pathogènes Un nouvel espoir de traitement des infections généralisées Carlo Petosa,1 Jérôme Govin,2 and Flore Mietton1,2* 1Université Grenoble Alpes, CNRS, CEA, Institut de Biologie Structurale, 38000Grenoble, France 2Université Grenoble Alpes, CEA, Inserm, Institut de Biosciences et Biotechnologies de Grenoble, Laboratoire Biologie à Grande Échelle, 38000Grenoble, France |
Candida albicans, un champignon pathogène dangereux Les champignons pathogènes sont responsables d’infections généralisées et représentent un problème majeur de santé mondiale, avec 2 millions de malades chaque année. Candidose, méningite cryptococcique, aspergillose et pneumocystose sont responsables à elles seules de plus de 800 000 décès par an [1]. Les patients immunodéprimés sont particulièrement vulnérables à ces infections, notamment ceux atteints par le virus de l’immunodéficience humaine, ceux traités par chimiothérapie ou les receveurs de greffes d’organes. Sur les plans épidémiologique et pharmacoéconomique, ces infections invasives représentent aujourd’hui un poids sociétal considérable, en France [2] et dans le monde [3]. Parmi les différentes espèces de champignons, Candida albicans est impliqué dans plus de la moitié des candidoses et est toujours considéré comme un agent pathogène majeur. Cette levure est responsable d’infections des muqueuses gynécologique et digestive, qui peuvent évoluer en maladies systémiques. Cela concerne 0,3 % des admissions hospitalières en France et 50 % des patients touchés par ces infections généralisées en meurent [4]. L’arsenal de médicaments antifongiques à la disposition des hôpitaux se limite à quatre classes de molécules : les polyènes qui ciblent la membrane cellulaire du champignon et les échinocandines qui agissent sur sa paroi; les azolés, qui inhibent la synthèse de l’ergostérol (équivalent du cholestérol chez les cellules animales) et la flucytosine, qui interfère avec celle des acides nucléiques [5]. Leur efficacité clinique pour traiter les infections invasives est très limitée. L’utilisation massive de ces drogues, en lien avec l’augmentation des patients à risque, a favorisé l’émergence de souches résistantes. De plus, la toxicité et le coût élevé de ces traitements entraînent un besoin urgent de développer de nouvelles stratégies thérapeutiques [6]. |
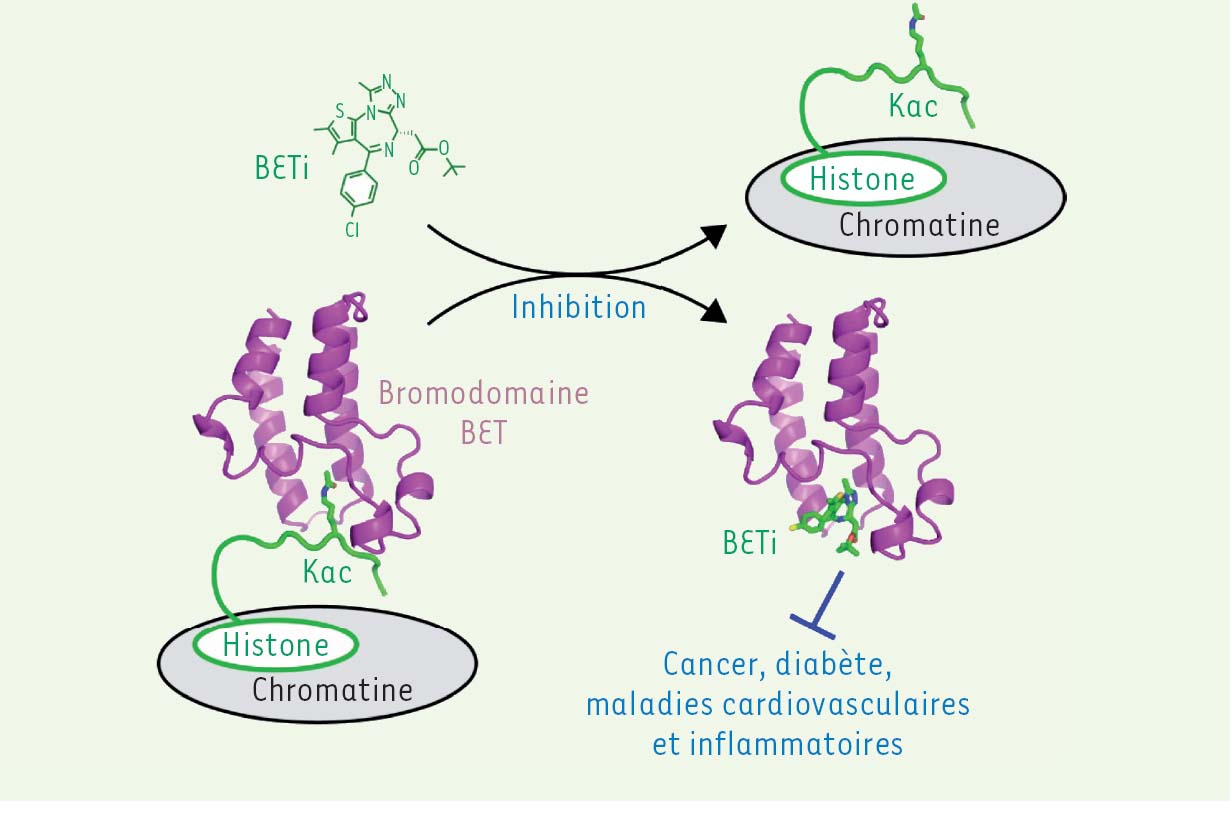
Les protéines BET, une nouvelle cible antifongique Les protéines de la famille BET (bromodomain and extra-terminal) ont été très conservées au cours de l’évolution et sont retrouvées à la fois chez les champignons et chez l’homme. Ces protéines possèdent deux régions particulières, appelées bromodomaines, dont la poche hydrophobe reconnaît les lysines acétylées des histones. Cette liaison leur permet de se fixer à la chromatine et de moduler l’expression des gènes [7, 8] (➔). (➔)Voir la Nouvelle de S. Rousseaux et al., m/s n° 2, février 2010, page 130 Ces dernières années, de petites molécules inhibitrices, qui bloquent la poche de liaison des bromodomaines BET, ont été développées avec succès chez l’homme (Figure 1). Les protéines BET ne sont alors plus capables de remplir leur mission, ce qui entraîne une dérégulation massive du programme d’expression génique. Le potentiel thérapeutique de ces inhibiteurs est large et est actuellement confirmé par plusieurs essais cliniques dédiés au traitement des cancers, du diabète, des maladies inflammatoires et cardiovasculaires [9].  | Figure 1 Inhibition d’un bromodomaine BET humain par une petite molécule. Les bromodomaines BET s’associent à la chromatine en reconnaissant les lysines acétylees (Kac) des histones. La fixation d’une petite molécule inhibitrice (BETi) dans la poche de liaison du bromodomaine décroche la protéine de la chromatine et module le niveau d’expression de nombreux gènes associés à diverses maladies. |
Comme de nombreux champignons pathogènes, la levure Candida albicans ne possède qu’un seul membre de la famille BET, appelé Bdf1 (bromodomain factor 1). Cette protéine est un régulateur global de la transcription chez la levure boulangère, Saccharomyces cerevisiae [10]. Nous avons uni nos efforts avec l’Université de Californie du Sud, l’Institut californien de recherche biomédicale (Calibr), le CHU de Grenoble et l’Institut Pasteur afin d’explorer le potentiel de Bdf1 comme nouvelle cible thérapeutique pour traiter les infections causées par C. albicans [11]. Par des expériences de génétique de la levure et à l’aide d’un promoteur inductible, nous avons retiré le gène BDF1 chez C. albicans : quand la protéine n’est plus exprimée, il en résulte une absence de croissance, ce qui démontre que la présence de Bdf1 est indispensable à la survie de la levure. De même, la délétion ou la mutation ponctuelle des deux bromodomaines de Bdf1 inhibe la croissance de C. albicans. Cela démontre que la présence de bromodomaines fonctionnels de Bdf1 est essentielle à la survie du pathogène. Enfin chez la souris, la virulence de C. albicans dépend également de la présence de Bdf1 et de la fonctionnalité de ses bromodomaines. L’analyse de la structure atomique des deux bromodomaines de Bdf1 a révélé que leurs poches de liaison étaient plus larges de celles des protéines BET humaines. Ces différences structurales expliquent pourquoi les inhibiteurs de bromodomaines BET humains sont inefficaces contre Bdf1 et suggèrent que les bromodomaines de Bdf1 pourraient être inhibés de manière sélective. |
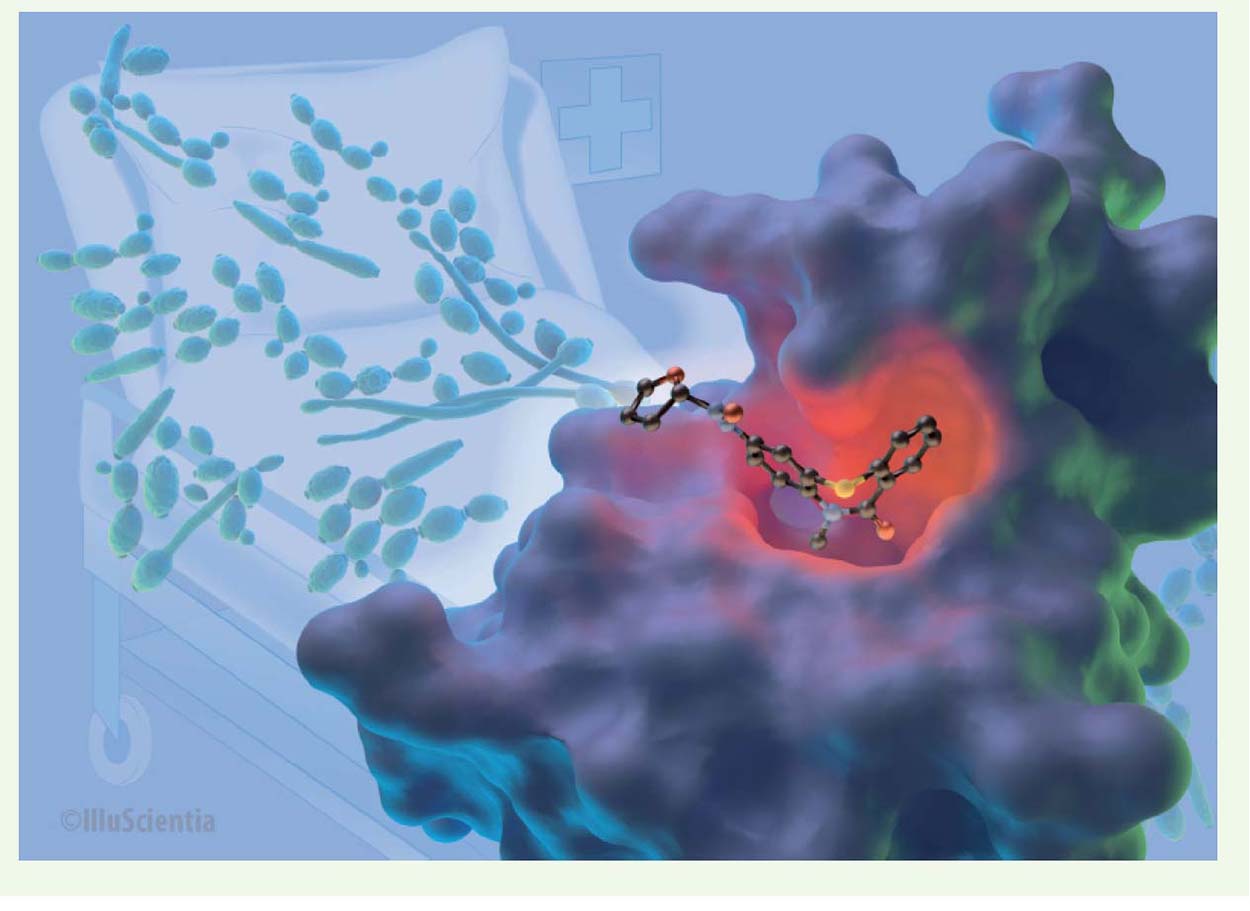
Identification de nouvelles molécules inhibitrices par un criblage à haut débit L’identification d’inhibiteurs sélectifs des bromodomaines de Bdf1 a nécessité la mise au point et la miniaturisation d’un test in vitro de mesure de fluorescence. Ce test est fondé sur la mesure de l’interaction entre le bromodomaine et son substrat, un peptide histone acétylé. L’ajout d’un inhibiteur diminue le signal fluorescent mesuré. Ce test a été robotisé pour cribler une chimiothèque de 80 000 composés, ce qui a permis d’identifier une centaine de molécules actives pour chacun des deux bromodomaines de Bdf1. Les meilleurs composés présentent une concentration inhibitrice médiane (CI50) de l’ordre du micromolaire et une sélectivité plus de vingt fois supérieure pour Bdf1 en comparaison de son homologue humain. L’analyse structurale de ces composés liés aux bromodomaines de Bdf1 a permis d’identifier les résidus clés de leur mode de liaison et permettra, à terme, d’élaborer des inhibiteurs encore plus puissants et plus sélectifs (Figure 2). Enfin, nous avons démontré qu’au moins une de ces molécules possède la capacité d’interférer avec la croissance de C. albicans.  | Figure 2 Modèle tridimensionnel du premier bromodomaine de Bdf1, en complexe avec un inhibiteur spécifique (© IlluScientia). L’arrière-plan présente des cellules du champignon pathogène Candida albicans. |
Nos résultats établissent la preuve de concept que des petites molécules peuvent inhiber sélectivement les bromodomaines d’une protéine BET fongique, in vitro et dans un contexte cellulaire, tout en limitant leurs effets secondaires puisqu’elles épargnent les bromodomaines humains. Ces résultats, très prometteurs, ouvrent la voie au développement d’une nouvelle classe de médicaments antifongiques ciblant la protéine chromatinienne Bdf1. Cette étude a été menée sur Candida albicans, mais la conservation de la protéine Bdf1 parmi les espèces de champignons pathogènes laisse espérer qu’elle puisse représenter une cible thérapeutique pour un large spectre d’infections fongiques. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. |
1. Brown G D, Denning DW, Gow NA, et al. Hidden killers: human fungal infections. Sci Transl Med. 2012;; 4 : 165rv113.. 2. Gangneux JP, Bougnoux ME, Hennequin C, et al. LIFE program, SFMM-study group. An estimation of burden of serious fungal infections in France . J Mycol Med. 2016;; 26 : :385.-90. 3. The burden of fungal disease: new evidence to show the scale of the problem across the globe. ( Life., 2017 : http://go.nature.com/2sMKpuN). 4. Leleu G, Aegerter P, Guidet B, Collège des utilisateurs de base de données en réanimation. Systemic candidiasis in intensive care units: a multicenter. , matched-cohort study. J Crit Care. 2002;; 17 : :168.-75. 5. Pound M W, Townsend M L, Dimondi V, et al. Overview of treatment options for invasive fungal infections. Med Mycol. 2011;; 49 : :561.-80. 6. Denning D W, Bromley MJ. Infectious disease. How to bolster the antifungal pipeline. Science. 2015;; 347 : :1414.-6. 7. Filippakopoulos P, Knapp S. Targeting bromodomains: epigenetic readers of lysine acetylation. Nat Rev Drug Discov. 2014;; 13 : :337.-56. 8. Rousseaux S, Petosa C, Müller CW, Khochbin S. Du nouveau dans la compréhension de la programmation postméiotique du génome mâle. Med Sci (Paris). 2010;; 26 : :130.-2. 9. Ferri E, Petosa C, McKenna CE. Bromodomains: structure, function and pharmacology of inhibition. Biochem Pharmacol. 2016;; 106 : :1.-18. 10. García-Oliver E, Ramus C, Perot J, et al. Bdf1 bromodomains are essential for meiosis and the expression of meiotic-specific genes. PLoS Genet. 2017;; 13 : e1006541.. 11. Mietton F, Ferri E, Champleboux M, et al. Selective BET bromodomain inhibition as an antifungal therapeutic strategy. Nat Commun. 2017;; 8 : :15482.. |