| |
| Med Sci (Paris). 34(2): 132–135. doi: 10.1051/medsci/20183402010.Rôle du métabolisme des céramides adipocytaires dans le brunissement du tissu adipeux blanc Impact sur le métabolisme énergétique au cours de l’obésité Axelle Le Marec,1* Selvee Sungeelee,2** Amina Zeghouani,2## Laurine Gonzalez,2*** and Hervé Le Stunff1,3# 1Unité biologie fonctionnelle et adaptative, CNRS UMR 8251, Université Paris DiderotParis, France 2M1 Biologie Santé, Université Paris-Saclay, 91405Orsay, France 3Endocrinologie moléculaire de la prise alimentaire, Université Paris-Sud, CNRS UMR 9197, Institut des neurosciences Paris-SaclayOrsay, France |
Les adipocytes sont les cellules du tissu adipeux qui ont la capacité de stocker les acides gras sous la forme de triglycérides, mais également de renseigner le système nerveux central et d’autres organes périphériques sur le statut énergétique de l’organisme via la sécrétion de lipides, peptides, hormones et cytokines [1]. Cette communication inter-organe semble importante puisqu’elle pourrait jouer un rôle dans la perturbation de l’homéostasie glucidique chez des patients atteints d’un diabète de type 2 [2]. Le défaut de stockage des acides gras sous forme de triglycérides par les adipocytes est également un élément clé dans le développement du diabète car il conduirait à leur stockage ectopique dans d’autres tissus périphériques [3]. Ainsi, l’obésité conduit à l’accumulation ectopique de lipides, comme les céramides, dans les tissus périphériques comme le muscle et entraîne l’installation d’une résistance à l’insuline et le déclenchement du diabète de type 2 [4]. Les céramides sont des lipides présents dans les membranes cellulaires qui peuvent avoir des fonctions de signalisation [5]. Il existe plusieurs voies de production des céramides, dont la voie de synthèse de novo [5]. Celle-ci a lieu dans le réticulum endoplasmique de la cellule. La première étape est catalysée par la sérine palmitoyl-transférase (SPT2) qui catalyse la condensation d’un palmitoyl-CoA et d’une sérine pour produire la 3-cétosphinganine. Ce lipide sera ensuite transformé en céramides par une succession de réactions enzymatiques [5]. Nous avons montré que, en cas d’obésité, une stimulation de la voie de synthèse de novo de ces céramides conduit à leur accumulation et joue un rôle important dans la résistance à l’insuline dans plusieurs tissus périphériques, incluant le tissu adipeux [6]. Le tissu adipeux est complexe car il existe plusieurs types de cellules adipocytaires qui sont définis par leurs capacités à stocker des lipides (tissu adipeux blanc) ou à produire de la chaleur (tissu adipeux brun) à partir de ces lipides. De façon intéressante, les adipocytes blancs peuvent être remodelés et adopter un phénotype intermédiaire appelé tissu adipeux beige (ce qui correspond au processus de brunissement) [7]. Il a été proposé que la répartition dans l’organisme de ces différents tissus adipeux pourrait donc jouer un rôle clé dans la régulation du diabète de type 2 associé à l’obésité [7]. Étant donné le rôle central des céramides dans le dysfonctionnement du tissu adipeux blanc au cours de l’obésité, il devenait intéressant de déterminer si le métabolisme des céramides pouvait également contrôler le remodelage du tissu adipeux blanc. |
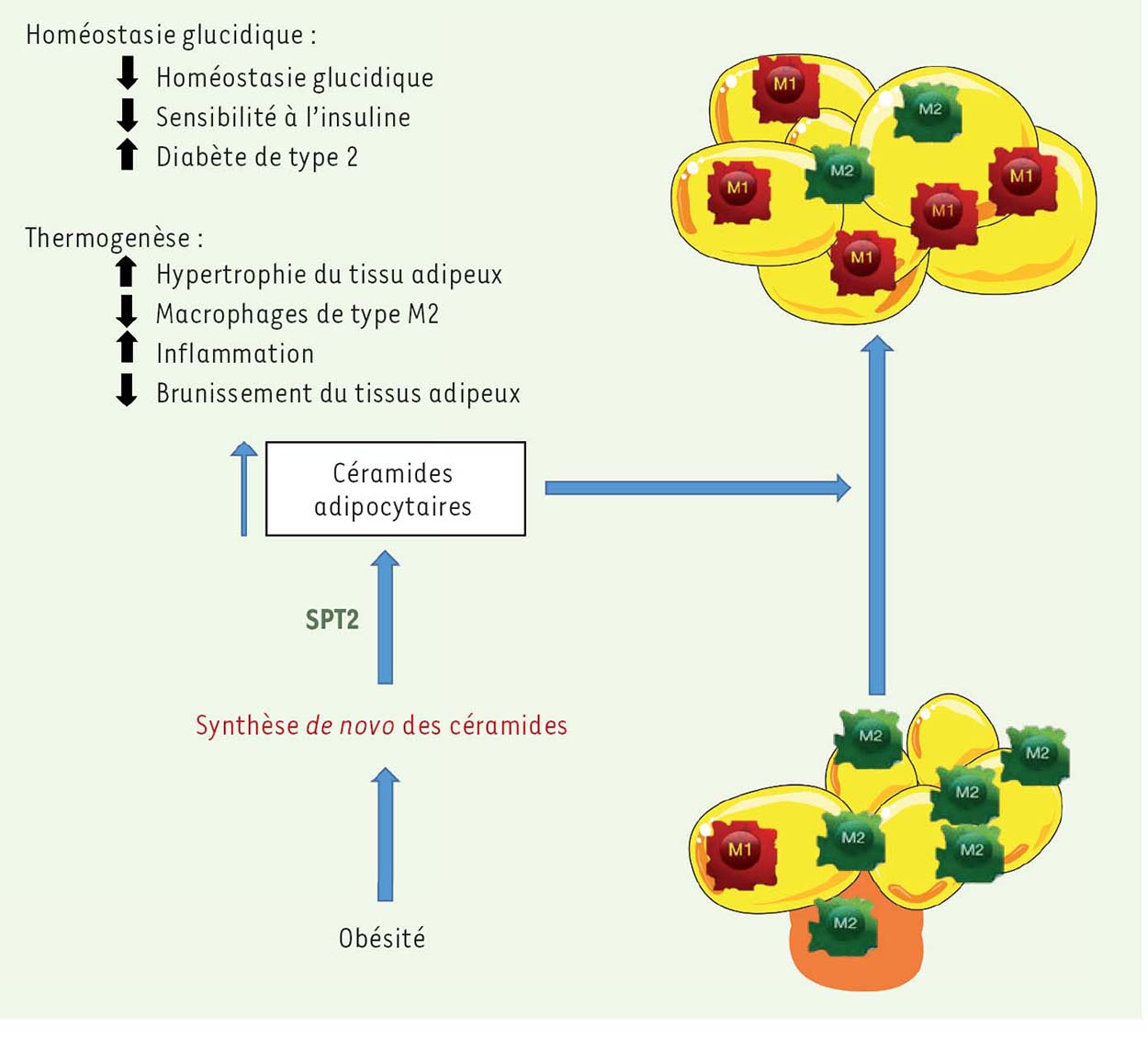
Métabolisme des céramides, inflammation et thermogenèse L’inhibition de la sérine palmitoyl-transférase entraîne un brunissement du tissu adipeux blanc La myriocine est un inhibiteur sélectif de la sérine palmitoyl-transférase, capable de contrecarrer la formation de céramides et donc l’installation d’une résistance à l’insuline périphérique induite par l’obésité [ 3, 4]. Récemment, l’équipe de S.A. Summers a exploré l’impact de cet inhibiteur sur l’homéostasie du tissu adipeux blanc [ 8]. Administrée à des souris obèses, la myriocine entraîne une diminution de la masse adipeuse associée à une augmentation de la dépense énergétique. L’absence de modulation de l’activité locomotrice ou de la prise alimentaire suggérait un rôle potentiel du remodelage du tissu adipeux blanc et/ou une augmentation de l’activité « thermogénique » du tissu adipeux brun dans cette diminution. De fait, l’inhibition de la sérine palmitoyltransférase conduit à une augmentation de la transcription des gènes codant pour des enzymes de la thermogenèse comme la protéine découplante mitochondriale UCP1 dans le tissu adipeux blanc. L’augmentation de l’expression de ces gènes dans le tissu adipeux est corrélée à une augmentation de la tyrosine hydroxylase, enzyme régulant la synthèse des catécholamines, connues pour favoriser la thermogenèse [ 9]. Un autre acteur du tissu adipeux intervenant dans cette régulation de la thermogenèse est le macrophage : il est connu qu’un changement de polarisation des macrophages de type M1 (pro-inflammatoire) en type M2 (antiinflammatoire) joue un rôle dans l’augmentation de la dépense énergétique, le brunissement des adipocytes blancs et l’amélioration de l’action de l’insuline au cours de l’obésité [ 9, 10]. Le traitement par la myriocine entraîne une augmentation des macrophages de type M2 associée à une diminution des cytokines pro-inflammatoires, telles que l’interleukine-6 et le TNFα. Ainsi, il apparaît que la synthèse de novo des céramides dans le tissu adipeux blanc inhibe le brunissement des adipocytes blancs en favorisant un profil pro-inflammatoire des macrophages au cours de l’obésité.  | Figure 1 Rôle des céramides adipocytaires dans la régulation de la thermogenèse. Le tissu adipeux blanc est connu pour s’adapter à son environnement. Ainsi, il subit des phases d’hypertrophie et d’hyperplasie au cours de l’obésité afin de stocker l’excès de lipides. Les adi pocytes blancs peuvent également être remodelés et adopter un phénotype intermédiaire appelé adipocytes « beiges appelé « brunissement ». Ce mécanisme favorise la ß-oxydation mitochondriale des lipides qui les transforme en énergie qui sera éliminée sous forme de chaleur (thermogenèse). On sait que l’obésité, via la synthèse de novo des céramides, conduit à l’installation d’une résistance à l’insuline et donc à une dérégulation de l’homéostasie glucidique qui favorise l’apparition du diabète de type 2. Récemment, l’équipe de Scott Summers à montré que cette synthèse de novo de céramides adipocytaires |
Interaction entre les céramides adipocytaires et le phénotype des macrophages dans la régulation de la thermogenèse Le tissu adipeux est composé de différents types cellulaires incluant des adipocytes, des macrophages et des lymphocytes [ 11]. Afin de déterminer le rôle de la synthèse de novo des céramides adipocytaires dans la régulation de la thermogenèse, l’équipe de S.A. Summers a développé un modèle de souris dans lequel une délétion spécifique de la sous-unité 2 de la sérine palmitoyl-transférase est créée dans les adipocytes blancs 1. Lorsque les souris Sptlc2Adipo-/- sont soumises à un régime obésogène, elles présentent - comme les souris traitées par la myriocine - une diminution de leur tissu adipeux blanc associée à une augmentation de leur dépense énergétique comparativement aux souris sauvages contrôles exprimant l’enzyme. L’analyse transcriptionnelle du tissu adipeux blanc des souris Sptlc2Adipo-/- révèle également une augmentation de l’expression des gènes « thermogéniques » associée à un profil de macrophage de type M2, antiinflammatoire. De plus, l’homéostasie glucidique est améliorée chez les souris Sptlc2Adipo-/- via une amélioration de la sensibilité à l’insuline dans le tissu adipeux sous-cutané. De façon intéressante, l’ablation spécifique de la SPT2 dans les macrophages, un autre type cellulaire du tissu adipeux, ne reproduit pas le phénotype observé chez les souris Sptlc2Adlpo-/-. Ainsi, la synthèse de novo des céramides dans les adipocytes blancs inhibe leur brunissement en réprimant le profil de macrophages anti-inflammatoires. La répression du profil de macrophage de type M2 conduit à une inhibition de la synthèse de la tyrosine hydroxylase, responsable de la synthèse des catécholamines, des régulateurs positifs du brunissement des adipocytes blancs. |
Céramides adipocytaires et régulation de la thermogenèse La thermogenèse dans le tissu adipeux brun est le mécanisme majeur de thermorégulation chez les petits mammifères et les nouveau-nés [12]. La libération de noradrénaline par le système sympathique agissant sur des récepteurs β-adrénergiques du tissu adipeux semble être importante pour cette activité [13]. De façon intéressante, l’équipe de S.A. Summers a démontré que l’activation des récepteurs β-adrénergiques, dont on sait qu’elle stimule le brunissement, conduit également à une diminution de la synthèse de novo des céramides. L’adaptation au froid, qui augmente le brunissement des adipocytes blancs, est également associée à une diminution de l’expression de SPT2 et du taux de céramides dans ce tissu, soulignant le lien entre thermogenèse et métabolisme des céramides. La respiration mitochondriale non couplée est un mécanisme qui permet aux adipocytes bruns de dissiper l’énergie d’oxydation des lipides sous forme de chaleur [14]. Ainsi, le taux de respiration mitochondriale non couplée peut être considéré comme un indice de l’induction du brunissement du tissu adipeux blanc. À l’aide d’une approche pharmacologique, les chercheurs ont démontré que l’augmentation du taux de céramides endogènes inhibe la respiration mitochondriale non couplée et qu’à l’inverse, la déplétion de céramides favorise celleci. Enfin, l’induction des gènes « thermogéniques » dans les adipocytes par un activateur de la thermogenèse est inhibée par des analogues de céramides. Ainsi, il apparaît que les céramides, outre leur rôle dans le développement de la résistance à l’insuline, inhibent l’activité respiratoire des mitochondries du tissu adipeux. |
Conclusions et perspectives L’ensemble de ces résultats ouvrent des perspectives prometteuses quant au ciblage thérapeutique du métabolisme des céramides dans le traitement de l’obésité et du développement du diabète de type 2. En effet, l’inhibition de la synthèse des céramides, outre son action sur la sensibilité à l’insuline [3, 4, 6], pourrait influencer le phénotype du tissu adipeux blanc, favorisant le passage vers son brunissement afin d’augmenter les dépenses énergétiques et, ainsi, d’améliorer le profil métabolique des sujets obèses. Néanmoins, ces observations restent encore à confirmer chez l’homme. De façon intéressante, les auteurs de cette étude ont montré une augmentation du taux de céramides dans le tissu adipeux blanc des patients obèses et diabétiques. Par ailleurs, étant donné que les céramides sont sécrétés dans la circulation sanguine, il serait important d’étudier leur rôle dans la communication entre le tissu adipeux et le foie, ce dernier étant à la fois une cible des céramides et un acteur prépondérant dans le développement du diabète de type 2 [6]. En effet, cette étude a montré que l’inhibition de la synthèse de novo des céramides dans le tissu adipeux blanc améliore l’homéostasie glucidique via une meilleure sensibilité à l’insuline, mais également via une diminution de la stéatose induite par l’obésité. Ces résultats sont à rapprocher de ceux obtenus par une autre équipe : la surexpression d’une céramidase, enzyme dégradant les céramides, dans le tissu adipeux améliore l’homéostasie glucidique en augmentant l’action de l’insuline dans le foie [15]. Si beaucoup d’arguments expérimentaux impliquent les céramides adipocytaires dans la régulation de la thermogenèse, il reste à en déterminer les mécanismes moléculaires. Il s’agit notamment de comprendre comment les céramides induisent l’expression des gènes « thermogéniques » et le recrutement de macrophages antiinflammatoires. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. |
Footnotes |
1. Rutkowski JM, Stern JH, Scherer PE. The cell biology of fat expression. J Cell Biol. 2015;; 208 : :501.-12. 2. Yamada T, Oka Y, Katagiri H. Inter-organ metabolic communication involved in energy homeostasis. : potential therapeutic targets for obesity and metabolic syndrome. Pharmacol Ther. 2008;; 117 : :188.-98. 3. Chavez J, Summers S. Lipid oversupply, selective insulin resistance, and lipotoxycity: molecular mechanisms. Biochim Biophys Acta. 2010;; 1801 : :252.-65. 4. Chaurasia B, Summers SA. Ceramides-lipotoxic inducers of metabolic disorders. Trends Endocrinol Metab. 2015;; 26 : :538.-50. 5. Hannun YA, Obeid LM. The ceramide-centric universe of lipid-mediated cell regulation: stress encounters of the lipid kind . J Biol Chem. 2002;; 277 ::25847.-50. 6. Bellini L, Campana M, Mahfouz R, et al. Targeting sphingolipid metabolism in the treatment of obesity/type 2 diabetes. Expert Opin Ther Targets. 2015;; 19 : :1037.-50. 7. Kusminski CM, Bickel PE, Scherer PE. Targeting adipose tissue in the treatment of obesity-associated diabetes. Nat Rev Drug Discov. 2016;; 15 : :639.-60. 8. Chaurasia B, Kaddai VA, Lancaster GI, et al. Adipocyte ceramides regulate subcutaneous adipose browning, inflammation, and metabolism. Cell Metab. 2016;; 24 : :820.-34. 9. Nguyen KD, Qiu Y, Cui X, et al. Alternatively activated macrophages produce catecholamines to sustain adaptive thermogenesis. Nature. 2011;; 480 : :104.-8. 10. Odegaard JI, Chawla A. Alternative macrophage activation and metabolism. Annu Rev Pathol. 2011;; 6 : :275.-97. 11. Lynes MD, Tseng YH. Deciphering adipose tissue heterogeneity. Ann NY Acad Sci. 2017; doi: 10.1111/ nyas.13398.. 12. Teulier L, Rouanet JL, Letexier D, et al. Coldacclimation- induced non-shivering thermogenesis in birds is associated with upregulation of avian UCP but not with innate uncoupling or altered ATP efficiency. J Exp Biol. 2010;; 213 : :2476.-82. 13. Collins S, Surwit RS. The beta-adrenergic receptors and the control of adipose tissue metabolism and thermogenesis. Recent Prog Horm Res. 2001;; 56 : :309.-28. 14. Ricquier D. UCP1, the mitochondrial uncoupling protein of brown adipocyte: A personal contribution and a historical perspective. Biochimie. 2017;; 134 : :3.-8. 15. Xia JY, Holland WL, Kusminski CM, et al. Targeted induction of ceramide degradation leads to Improved systemic metabolism and reduced hepatic steatosis. Cell Metab. 2015;; 22 : :266.-78. |