Pendant le développement embryonnaire, la destinée des cellules est déterminée par les informations sur leurs positions dont elles disposent. La différenciation cellulaire déclenche souvent des modifications dans l’organisation de l’embryon qui, en retour, créent de nouvelles informations de positionnement. Ces cycles de morphogénèse et de différenciation sont des processus indispensables pour que l’embryon s’organise correctement. C’est la raison pour laquelle il est nécessaire que la morphogénèse et la détermination du destin cellulaire soient intimement coordonnées. Une des façons de synchroniser ces évènements est d’avoir des points de contrôles, à l’instar de ceux mis en place lors du cycle cellulaire, qui arrêtent le cycle tant que certains critères ne sont pas atteints. Une étude de Shahbazi et ses collègues, parue récemment dans Nature [1], révèle les mécanismes d’un point de contrôle développemental qui agit durant les tout premiers jours de l’embryon du mammifère.
Chez de nombreux mammifères, aux stades initiaux du développement, l’embryon forme une structure, appelée blastocyste, qui s’implante dans l’utérus maternel [2]. Cette implantation peut être mise en suspend par l’action d’hormones maternelles qui induisent un état de dormance du blastocyste appelé diapause [3]. Cette diapause est supposée avoir eu un impact important dans l’évolution et dans l’apparition d’un état « naïf » des cellules souches embryonnaires (cellules ES) [3]. En effet, les cellules pluripotentes de l’embryon, mises en culture, peuvent être maintenues indifférenciées tant que le milieu de culture est approvisionné en leukemia inhibitory factor (LIF) [4], capable de maintenir la pluripotence des cellules ES. En son absence, les cellules ES sont « amorcées » (primed) et s’engagent dans les différentes voies de différenciation. In vivo, le LIF est sécrété par l’embryon lui-même, en réponse aux hormones maternelles qui contrôlent la diapause, et maintient la pluripotence des cellules.
En sortie de diapause, les cellules doivent non seulement initier leur programme de différenciation, mais également redémarrer le programme morphogénétique incluant la formation de la cavité amniotique, une cavité qui va accueillir l’embryon et les fluides qui l’entourent lors de la gestation.
La formation de cavités aqueuses est commune dans le développement embryonnaire (par exemple, les néphrons dans le rein, les vaisseaux sanguins ou les ventricules cérébraux). Les événements moléculaires et cellulaires conduisant à la formation de telles cavités ont été caractérisés in vitro, notamment en utilisant des lignées de cellules épithéliales, qui maintiennent un contact intercellulaire fort, et une polarité apico-basale [5]. Dans certaines conditions, les cellules épithéliales forment une lumière au niveau de leur pôle apical, via un transport polarisé de fluide et de protéines. Ces protéines sont de type sialomucine, des protéines présentant des acides sialiques et chargées négativement. Elles permettront de repousser, électriquement, les membranes apicales. Les protéines de jonctions serrées empêcheront le fluide de s’échapper en réalisant des contacts entre cellules, assurant ainsi l’imperméabilité de la cavité.
Le maintien des cellules dans un état naïf jouerait donc un rôle de point de contrôle dans le développement embryonnaire. Il éviterait la formation prématurée de la cavité amniotique. Ce rôle reste à démontrer in vivo. En mettant à profit les méthodes de culture d’embryons ex utero [6, 7], Shahbazi et ses collègues ont révélé le mécanisme coordonnant la fin de la pluripotence et la formation de la cavité amniotique.
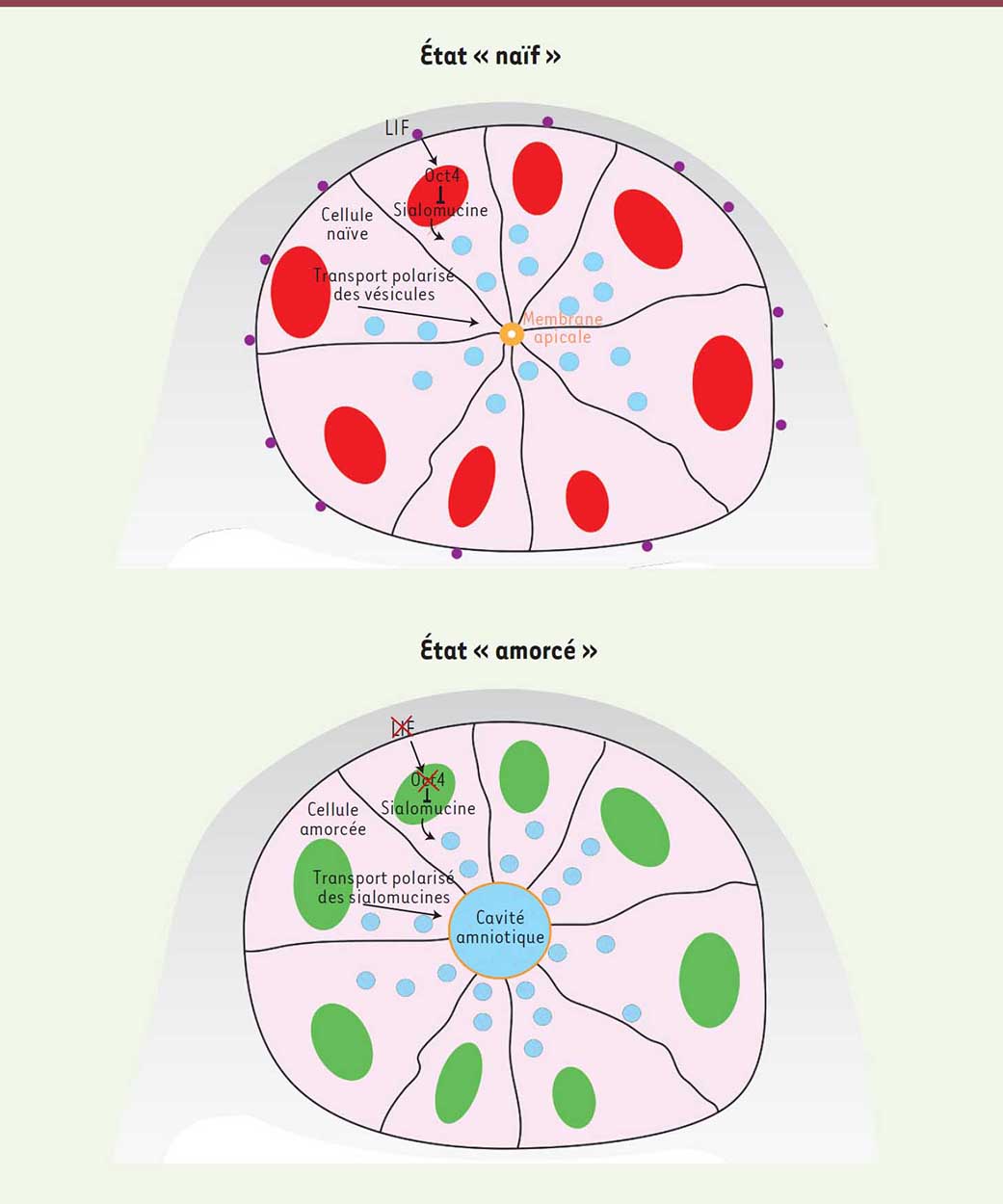
Ces auteurs ont ainsi, d’abord, noté que la baisse d’expression des gènes de la pluripotence coïncidait avec l’apparition de la cavité amniotique, à la fois chez l’homme et chez la souris. Ils ont ensuite observé que le maintien dans un état naïf, par l’apport artificiel de LIF, empêchait les embryons de former une cavité. Pour disséquer la régulation moléculaire précise qui lierait la sortie de la pluripotence avec la formation de la cavité, les auteurs ont utilisé les cellules ES comme substitut de l’embryon. Ils ont ainsi pu montrer que, dans leur état naïf, les cellules ES se réarrangent en rosette, polarisant leurs interfaces, leurs jonctions serrées et leur transport vésiculaire, mais ne formaient pas de cavité. Les cellules restent donc prêtes, dans cette configuration, jusqu’à ce que l’inhibition par le LIF soit levée. Alors, les cellules ES déclenchent l’expression de sialomucines, dont Podxl (podocalyxin), et forment une cavité. Une étape clé contrôlant la coordination entre formation de la cavité et sortie de la pluripotence est donc l’expression de ces sialomucines, qui permettraient aux membranes apicales de devenir répulsives.
Les auteurs ont ensuite analysé les données génomiques disponibles afin de déterminer comment la fin de la pluripotence peut contrôler la formation de la cavité. Cette analyse a révélé un rôle plausible du facteur de transcription Oct4 dans la régulation de l’expression des sialomucines (Figure 1). En considérant une récente étude qui décrit les effets de l’absence de Oct4 dans l’embryon préimplantatoire humain [8], ces résultats suggèrent plusieurs fonctions clés de ce facteur dans le développement précoce des embryons humains. Bien que l’expression des sialomucines soit nécessaire, elle n’est pas suffisante pour induire la formation de la cavité. Les sialomucines requièrent donc la présence d’autres protéines, comme la cinguline, une protéine de jonctions serrées exprimée en l’absence de LIF. Une étude récente a en effet suggéré que cette protéine permettait l’ancrage de vésicules à la membrane apicale des cellules lors de la formation de cavités [9]. De nouvelles études permettront sans aucun doute d’identifier le cocktail de molécules suffisant pour déclencher la formation de la cavité par les cellules naïves.
| Figure 1 Lorsque l’embryon humain ou murin s’implante dans l’utérus, la cavité amniotique, dans laquelle le fœtus se développe, se forme au sein de l’épiblaste (en rose). Les cellules de l’épiblaste rassemblent leurs bords apicaux (en orange) et orientent leur trafic vésiculaire vers le point de rencontre. Tant que la protéine LIF (leukaemia inhibitory factor), produite par le tissu extra-embryonnaire (en gris), est présente, aucune cavité ne se forme. Simultanément, le LIF maintient l’épiblaste à l’état pluripotent pendant lequel s’exprime le facteur de transcription Oct4 (en rouge). Quand le LIF cesse d’être produit, les cellules de l’épiblaste initient leur différenciation (en vert), ne produisent plus d’Oct4 et commencent à exprimer des sialomucines. Ces sialomucines, chargées négativement, permettent aux membranes apicales de se repousser mutuellement et rendent possible l’ouverture de la cavité amniotique. |
Le travail de Shahbazi et de ses collègues a mis en évidence un mécanisme par lequel les embryons coordonnent la fin de la pluripotence avec la formation de la cavité amniotique. Dans ce scénario, les cellules naïves forment un épithélium polarisé et mettent en suspens la cavitation. Ce n’est que lorsque les cellules deviennent « amorcées » que leurs membranes apicales se repoussent, permettant ainsi l’accumulation de liquide. Ceci fournit les premiers éléments d’un rôle biologique de l’état naïf, agissant comme un point de contrôle, assurant que la cavité amniotique ne se forme que lorsque les cellules se sont engagées dans leurs voies de différenciation. Chez l’embryon, la morphogenèse et la différenciation sont ainsi synchrones.