| |
| Med Sci (Paris). 34(3): 231–237. doi: 10.1051/medsci/20183403011.Tim-3 Biomarqueur et cible thérapeutique en cancérologie Clémence Granier,1,2** Alain Gey,1,3 Charles Dariane,1,2,4 Arnaud Mejean,4 Marc-Olivier Timsit,4 Charlotte Blanc,1 Virginie Verkarre,5 Camélia Radulescu,6 Elisabeth Fabre,7 Yann Vano,7,8 Stéphane Oudard,1,7 Cécile Badoual,1,2,5 and Éric Tartour1,2,3* 1Inserm U970, université Paris Descartes Sorbonne Paris-Cité, Paris, France 2Équipe labellisée Ligue contre le cancer, Paris, France 3Hôpital européen Georges Pompidou, service d’immunologie biologique, 20, rue Leblanc, 75015Paris, France 4Hôpital européen Georges Pompidou, Service de chirurgie urologique, APHP, Paris, France 5Hôpital européen Georges Pompidou, Service d’anatomie pathologique, APHP, Paris, France 6Hôpital Foch, Service d’anatomie pathologique, Suresnes, France 7Hôpital européen Georges Pompidou, Service d’oncologie médicale, APHPParis, France 8Inserm U1138, université Paris Descartes Sorbonne Paris-Cité, Paris, France |
Vignette (Photo : lymphocytes T [bleu] exprimant parfois PD-1 [rouge] et TIM-3 [vert] infiltrant un carcinome rénal. © Plateforme d’imagerie PARCC/HEGP). Les lymphocytes T (LT) exprimant de multiples molécules de co-stimulation inhibitrices (PD-1, Tim-3, Lag-3, etc.) perdent leur activité anti-tumorale. PD-1 est une cible thérapeutique majeure dans le traitement du cancer, mais son expression isolée ne signe pas une dysfonction. Tim-3 est exprimée par de nombreux types cellulaires et inhibe les LT effecteurs ou augmente l’activité des cellules suppressives. Au sein de nombreuses tumeurs, les lymphocytes T-CD8 co-exprimant PD-1 et Tim-3 perdent leur fonctionnalité et sont de mauvais pronostic. De plus, Tim-3 apparaît comme un biomarqueur de résistance au blocage de l’axe PD-1/PD-L1. L’efficacité anti-tumorale d’un double blocage PD-1 et Tim-3 dans des modèles précliniques conforte ce rationnel de cibler Tim-3 pour lever certaines résistances à l’immunothérapie. L’avènement du succès des immunothérapies dans le traitement du cancer est lié à la compréhension des mécanismes intimes régissant l’activation des lymphocytes T (LT). La première étape de cette activation consiste en la reconnaissance, par le récepteur T (TCR) du lymphocyte, de l’antigène sous la forme d’un peptide associé à une molécule du complexe majeur d’histocompatibilité (CMH) présentée par une cellule présentatrice d’antigène (CPA). Cet événement est accompagné d’un signal de co-stimulation délivré par la CPA qui permet une activation lymphocytaire optimale [1]. La première molécule de co-stimulation (MC) qui a été décrite, le CD28, apparaît précocement à la surface du LT. Elle s’associe avec CD80/86 (ou B7.1/B7.2) exprimé par la CPA. Elle présente une capacité activatrice importante, puisque l’administration d’anticorps agoniste ciblant cette molécule chez l’homme entraîne une libération massive de cytokines conduisant à des défaillances multi-organes [2]. D’autres MC activatrices (CD40, CD137, CD27, CD134 ou OX40, etc.) participent à l’activation de sous-populations lymphocytaires T dans les organes lymphoïdes. L’effet stimulant des MC activatrices est contrebalancé par des MC inhibitrices : CTLA-4 (cytotoxic T lymphocyte associated protein 4 ou CD-152), PD-1 (program death ligand 1 ou CD279), Tim-3 (T-cell immunoglobulin and mucin containing protein-3 ou CD366), Lag-3 (lymphocyte activation gene 3 ou CD223), TIGIT (T cell immunoreceptor with Ig and ITIM domains), ou VISTA (V-domain immunoglobulin [Ig]-containing suppressor of T-cell activation). Ces MC inhibitrices apparaissent progressivement après l’activation des lymphocytes, entraînant une régulation négative à la fin de la réponse immunitaire. Un co-inhibiteur clé, intervenant au sein des organes lymphoïdes, est la molécule CTLA-4 qui se lie aux mêmes ligands que CD28 (CD80/86). L’implication de ces molécules dans la tolérance immunitaire a été démontrée grâce à différents modèles de souris déficientes en ces MC inhibitrices : les souris CTLA-4-/- développent des lymphoproliférations massives conduisant à des défaillances multi-organes; les souris PD-1-/- et Lag-3-/- présentent, quant à elles, des manifestations auto-immunes; et les souris TIGIT-/-, une activation lymphocytaire excessive après stimulation antigénique [3-5] (➔). (➔) Voir la Nouvelle de C. Badoual et al., m/s n° 6-7, juin-juillet 2013, page 570 Cette revue synthétise l’état des connaissances sur la MC inhibitrice Tim-3, qui ont justifié de la proposer comme biomarqueur de résistance à l’immunothérapie et comme nouvelle cible thérapeutique. |
Surexpression des MC inhibitrices dans les contextes de stimulation antigénique chronique Physiologiquement, la régulation négative de l’activation lymphocytaire par les MC inhibitrices est indispensable, notamment pour éviter l’apparition d’un emballement auto-immun et permettre le retour au repos du lymphocyte, qui n’exprimera alors plus ces MC inhibitrices. Cependant, dans certains cas, ce mécanisme est exploité par les pathogènes ou les tumeurs pour bloquer la réponse immunitaire anti-infectieuse ou anti-tumorale. En effet, dans des conditions d’exposition chronique à l’antigène (viral ou tumoral), l’expression des MC inhibitrices persiste et le LT perd alors progressivement ses fonctions : sa capacité de sécrétion d’interleukine-2 et de TNFα (tumor necrosis factor), ses fonctions cytotoxiques et prolifératives, et sa capacité de produire de l’IFNγ (interféron gamma) [6]. Il existe ainsi une palette d’altérations fonctionnelles allant d’une perte de fonction modérée à une dysfonction sévère de la cellule. La nomenclature des LT-CD8 en fonction de leur niveau de fonctionnalité et de leur phénotype, a été récemment redéfini par un consensus [7]. Plus le LT exprime de MC inhibitrices, plus sa fonctionnalité est altérée. Néanmoins, même si dans un contexte de stimulation chronique l’expression de MC inhibitrices signe une perte importante des fonctions du LT, il est important de rappeler que ces MC peuvent aussi être exprimées physiologiquement après une activation cellulaire. Pour mieux discriminer un LT activé d’un LT en différenciation terminale et dysfonctionnel, plusieurs groupes se sont intéressés en utilisant des techniques d’analyse, après séparation unicellulaire chez l’homme et chez la souris, à des modules de gènes de dysfonction indépendants de l’activation. Chez la souris, les LT dysfonctionnels ont ainsi été déterminés par une signature GATA3 et HELIOS (des facteurs de transcription à doigt de zinc), le métabolisme du zinc participant à la dysfonction cellulaire [8, 9]. Chez l’homme, dans une série de 5 patients atteints de mélanomes, TIGIT est apparu comme la seule MC Inhibitrice à ressortir comme témoin d’épuisement lymphocytaire (indépendamment des gènes d’activation) [10]. |
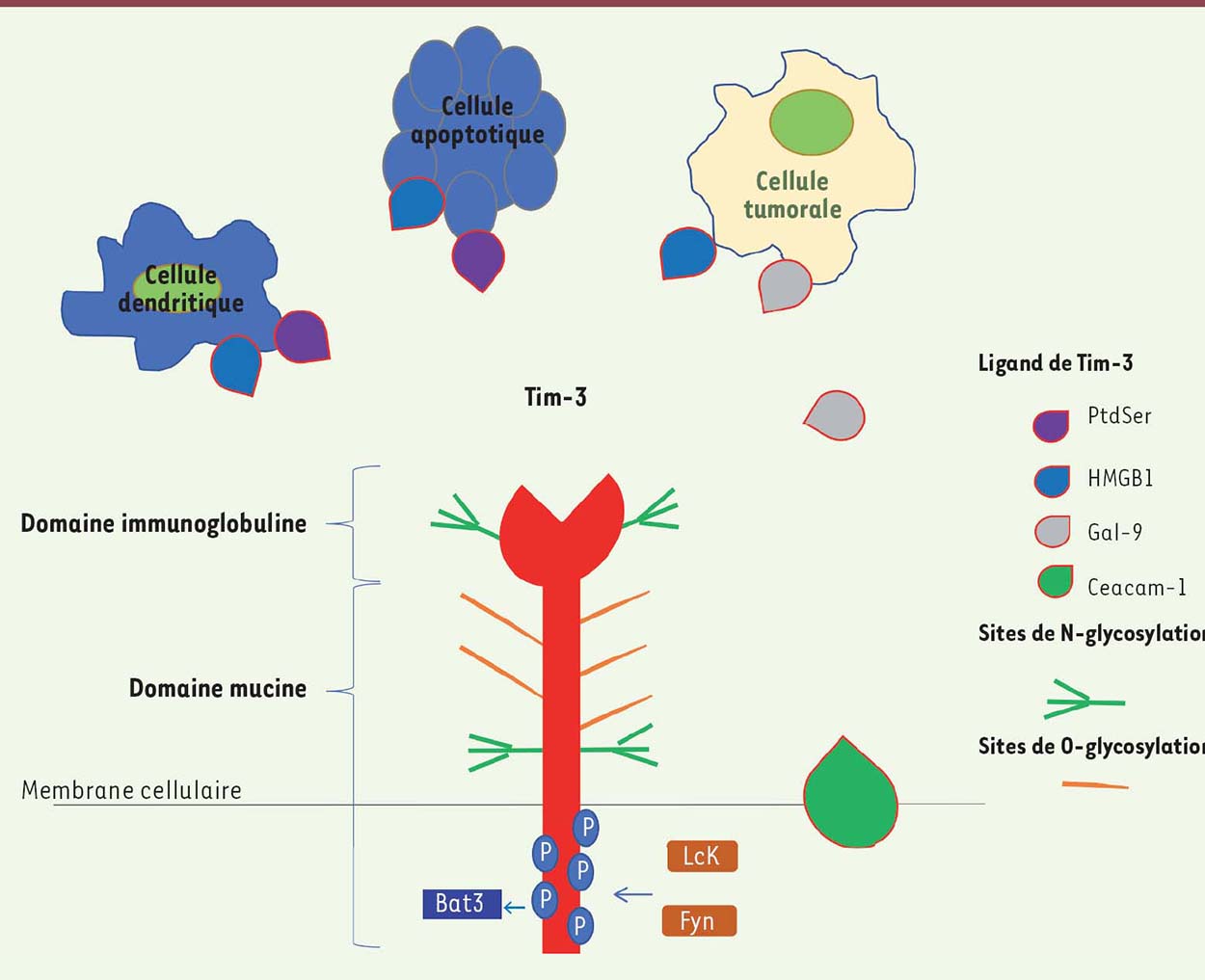
Expression de Tim-3 et caractérisation de ses Ligands Tim-3 a été caractérisée initialement comme une molécule transmembranaire présente sur les lymphocytes Th1 (T helper de type 1) producteurs d’IFNγ. Son domaine extracellulaire de type domaine variable d’immunoglobuline est fusionné à un domaine mucine. Son domaine intracytoplasmique contient des résidus tyrosines responsables, après leur phosphorylation, de la transduction du signal dans la cellule (Figure 1). La structure de Tim-3 est homologue à celle du récepteur cellulaire de l’hépatite A; elle est codée par le gène HAVCR2 (hepatitis A virus cellular receptor 2) [11]. Tim-3 peut être exprimée à la surface des LT mémoires ou activés (les LT-CD4 Th1, les LT régulateurs [Treg] et les LT-CD8 cytotoxiques [Tc1]), des lymphocytes B, des cellules NK (natural killer), mais également sur les monocytes, les macrophages, les cellules dendritiques (CD) et les cellules myéloïdes suppressives (Figure 2).  | Figure 1. Tim-3 : structure et ligands. Tim-3 (T-cell immunoglobulin and mucin containing protein-3) possède un domaine extracellulaire type immunoglobuline, qui reconnaît différents ligands, et un domaine type mucine portant différents sites de glycosylation. La partie intracytoplasmique contient des tyrosines, cibles de phosphorylation. Les différents ligands de Tim-3 sont représentés. Les cellules dendritiques expriment (1) la phosphatidylsérine, dont la liaison à Tim-3 est impliquée dans l’élimination des corps apoptotiques, et (2) HMGB1 (high mobility group protein B1) qui interfère avec la reconnaissance des acides nucléiques (signal de danger, activateur de l’immunité). Lorsque le ligand Gal-9 (galectine-9) ou CEACAM-1 (carcinoembryonic antigen cell adhesion molecule 1) se lie, la phosphorylation des tyrosines libère la protéine chaperonne Bat3 (HLA-B associated transcrit 3). Fyn peut alors se lier et induire un signal intracellulaire inhibiteur. |
Le premier ligand de Tim-3 ayant été identifié, la galectine-9 (Gal-9), permet de réguler les LT Th1, les LT Th17 et les LT-CD8 après sa liaison à Tim-3 qui dépend de sa glycosylation [12, 13]. Gal-9 peut être exprimée par les cellules tumorales [14]. Au niveau des CD, Tim-3 reconnaît 2 types de ligands : la phosphatidylsérine (PtdSer) et HMGB1 (high mobility group protein B1). Sa liaison à la phosphatidylsérine, exprimée à la surface des cellules en apoptose, participe à l’internalisation des corps et des cellules apoptotiques, et dans la présentation croisée par les CD [15]. Son interaction avec HMGB1 interfère, quant à elle, avec la capacité de senseur d’ADN de la molécule. HMGB1 joue en effet un rôle essentiel dans le transport des acides nucléiques vers les endosomes, étape clé dans la détection des signaux de danger et des facteurs de stress, et la mise en place des réponses immunitaires anti-tumorales. Dans le microenvironnement tumoral, Tim-3 exprimée par les CD intratumorales peut se lier à HMGB1 et bloquer le transport d’acides nucléiques dans les endosomes. La liaison Tim-3/ HMGB1 supprime également les réponses immunitaires innées dépendant de l’engagement des TLR (Toll-like receptors) qui reconnaissent les acides nucléiques. Ces mécanismes sont tolérogènes. Plus récemment, Ceacam-1 (carcinoembryonic antigen cell adhesion molecule 1), une molécule d’adhérence co-exprimée à la surface des LT intratumoraux dysfonctionnels Tim-3+, a été décrite comme un nouveau ligand de Tim-3. Ceacam-1 est indispensable à la stabilisation et à l’action régulatrice de Tim-3, en formant des liaisons en cis (correspondant à un hétérodimère formé sur la même cellule) ou en trans (les deux molécules étant exprimées par des cellules différentes). Dans un modèle murin de cancer colorectal, le blocage simultané de Tim-3 et Ceacam-1 a une action anti-tumorale [16]. |
Régulation de l’expression de Tim-3 et signalisation intracellulaire Le domaine intracytoplasmique de Tim-3 présente 5 tyrosines conservées qui forment un motif singulier, dont la phosphorylation par différentes kinases (des kinases de la famille Src : Lck et Fyn) va initier la transduction du signal dans la cellule. À l’état basal, les résidus tyrosines Y256 et Y263 intracytoplasmiques de Tim-3 interagissent avec la protéine chaperonne Bat3 (HLA-B associated transcrit 3) qui bloque son activité. Lorsque les ligands Gal-9 ou Ceacam-1 se fixe à Tim-3, la phosphorylation des tyrosines ainsi induite libère Bat3 permettant à Fyn de se lier au domaine intracytoplasmique de Tim-3 et de délivrer un signal inhibiteur [17]. Les signaux de transduction inhibiteurs de Tim-3 sont différents de ceux d’autres récepteurs inhibiteurs. Ainsi, TIGIT possède, comme PD-1, un motif intracellulaire conservé de type ITIM (immunoreceptor tyrosine-based inhibition motif) qui délivre des signaux inhibiteurs faisant intervenir des phosphatases de type SHP (Src homology region 2 domain-containing phosphatase). Lag-3 possède lui un domaine intracytoplasmique singulier sans tyrosine. Il interagit de façon synergique avec PD-1 (Tableau I) [18]. Tableau I
|
Tim-3 |
Lag-3 |
| Structure Ligands |
Domaines immunoglobuline et mucine Gal-9, HMGB-1, Ceacam-1, Ptd-Ser |
Domaine immunoglobuline type CD4 CMH-II, LSECtine, Gal-3 |
| Cibles cellulaires |
|
|
| Lymphocytes T-CD8 |
Dysfonction, ↘ IFNγ(interféron gamma) |
Dysfonction, ↘ IFNγ |
| Lymphocytes T-CD4 helper |
Dysfonction,↘ IFNγ |
_ |
| Motif intracellulaire de signalisation |
Résidus Tyrosine / Bat3 Bat3 antagoniste |
KIEELE résidu Lysine Coopération PD-1 |
| Lymphocytes T-CD4 régulateurs |
↗ Activité suppressive |
↗ Activité suppressive |
| Cellules natural killer (NK) |
Expression importante ↗ IFNγ in vitro (liaison Gal-9) Dysfonction paradoxale in vivo |
Dysfonction |
| Cellules dendritiques (CD) |
Bloque la reconnaissance TLR (Toll-like receptor) |
CD plasmacytoïde : forte expression |
| Monocyte/macrophage |
Élimination corps apoptotiques |
_ |
|
Dysfonction |
_ |
| Distribution ligand/récepteur dans les ganglions drainants |
Système nerveux central, mésentère |
Pancréas, cœur |
| Modèles expérimentaux |
Expression Tim-3 : protège contre l’autoimmunité dans l’encéphalomyélite et la sclérose en plaques |
Souris PD-1 et Lag-3 double KO : endocardite et pancréatite létales |
Analyse comparative de la structure et des fonctions de Tim-3 et Lag-3. Ptd-Ser : phosphatidylsérine. |
L’expression de Tim-3 à la membrane des LT est influencée par différents mécanismes. L’hétérodimère formé avec Ceacam-1 favorise sa maturation et son expression à la membrane [16]. Une activation cellulaire, certaines cytokines, comme l’IL(interleukine)-12, l’IL-27 ou ses inducteurs comme l’IFNβ, régulent également cette expression [19]. La co-culture de macrophages de type M2 (un type de macrophages alternatifs) avec des LT induit également l’expression de Tim-3 et de PD-1 [20]. Enfin, l’IL-10 et le VEGF-A (vascular endothelial growth factor A) stimulent de façon synergique l’expression de Tim-3 sur les CD [21]. |
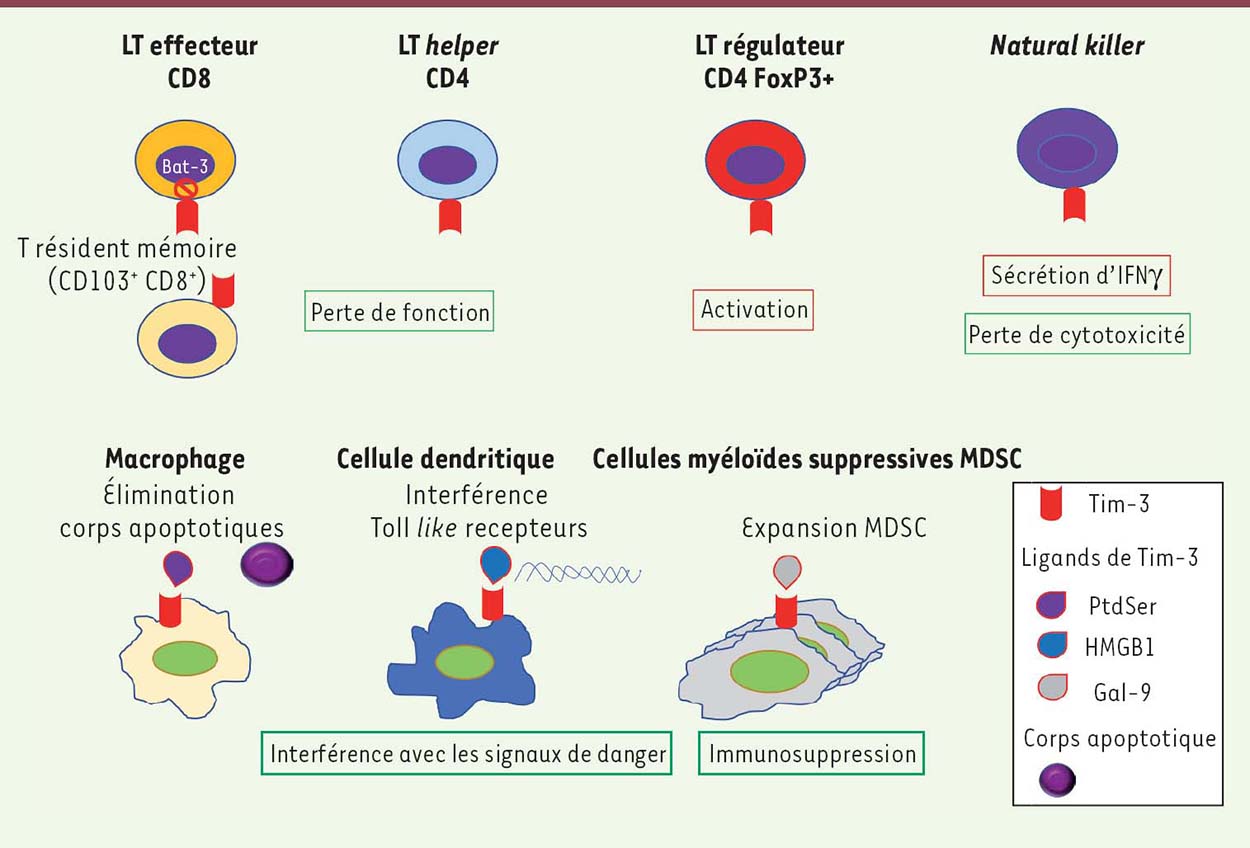
Mécanismes d’action de Tim-3 Comme les autres MC inhibitrices, Tim-3 est à l’origine d’un ensemble de mécanismes qui participent à la tolérance antigénique, mais de façon moins marquée que PD-1 et surtout que CTLA-4 qui a une action centrale. Au niveau des LT-CD8 effecteurs, l’engagement de Tim-3 inhibe la signalisation du TCR, via l’activation de NFκB (nuclear factor-kappa B) et NFAT (nuclear factor of activated T-cells), ainsi que la production d’IL-2 et l’expression de la molécule d’activation CD69. Au contraire, sur les LT régulateurs (Treg), Tim-3 accroît l’activité suppressive des cellules possiblement via une augmentation d’expression d’IL-10, de granzyme B et de perforine [22]. De façon intéressante, dans l’infection par le virus de l’hépatite C, les Treg Tim-3+ co-expriment plus fréquemment le marqueur de prolifération Ki67 [23]. De plus, les Treg qui expriment de forts taux de PD-1 et de Tim-3 co-expriment couramment TIGIT qui potentialise également leur activité suppressive [24]. Sur les cellules NK, notamment après leur activation, Tim-3 est fortement exprimée, son rôle variant en fonction du contexte. Sa liaison à Gal-9 est requise pour la sécrétion d’IFNγ [25] et son expression est corrélée à un certain état de maturation cellulaire. Son engagement avec des ligands comme des anticorps entraîne une perte de cytotoxicité des cellules [26]. Dans les mélanomes ou les cancers du poumon, une surexpression de Tim-3 sur les cellules NK est associée à une perte de fonctionnalité antitumorale, faisant de cette molécule de co-stimulation, un facteur de mauvais pronostic [27, 28]. Tim-3 module la réponse aux TLR. Sur les macrophages, elle régule négativement la réponse au lipopolysaccharide (LPS) bactérien qui dépend de TLR4. Sur les monocytes, elle bloque la production de cytokines inflammatoires et l’activation cellulaire induites par certains ligands des TLR (comme HMGB1 qui est reconnu par les TLR4 et TLR2) [29]. L’engagement de Tim-3 avec son ligand Gal-9 intervient également dans la différenciation des cellules myéloïdes suppressives MDSC (myeloid-derived suppressive cells), connues pour avoir un rôle immunosuppressif, en particulier dans un contexte tumoral. La Figure 2 donne un aperçu des rôles de Tim-3 en fonction des différents types cellulaires qui l’expriment. Le Tableau I compare l’expression cellulaire et tissulaire ainsi que les rôles différentiels de Tim-3 et de Lag-3.  | Figure 2. Effet de Tim-3 sur différents types cellulaires. L’expression de Tim-3 sur différents types cellulaires induit préférentiellement un effet tolérogène, après engagement avec ses ligands : lymphocytes T (LT) effecteurs dysfonctionnels, activation des T régulateurs, expansion des cellules myéloïdes suppressives (MDSC). Le versant dit « inné » de l’immunité est également soumis à cette régulation négative par interférence avec la reconnaissance d’ADN par les cellules dendritiques. Pour les cellules NK (natural killer), l’impact de l’expression de Tim-3 est plus variable selon les études, mais est de mauvais pronostic dans certaines situations tumorales. |
|
Phénotype et fonction des LT exprimant Tim-3 en cancérologie L’expression lymphocytaire des différentes MC inhibitrices (PD-1, Tim-3, Lag-3, TIGIT, ou CTLA-4) a été examinée in situ dans différents cancers in vitro et in vivo [30]. Dans la grande majorité des cas, les LT-CD8 exprimant Tim-3 co-expriment également PD-1 [14, 31], qui est alors surexprimé, ce qui caractérise les LT ayant une perte de leurs capacités fonctionnelles [32]. Les marqueurs d’activation CD38 et HLA-DR sont plus souvent détectés sur les LT-CD8-Tim-3+ que sur les LT-CD8 Tim-3neg [33], les LT-CD8-Tim-3+ étant enrichis en LT reconnaissant les cellules tumorales [34]. Plus récemment, différents groupes, dont le nôtre, ont montré que les LT-CD8 résidents mémoires, considérés comme une population active de LT effecteurs à activité anti-tumorale, co-expriment également PD-1 et Tim-3 de façon plus importante que les LT-CD8 non-résidents [35-37]. Chez des patients atteints de mélanome, de cancer du poumon ou de lymphome B folliculaire, la co-expression de PD-1 et de Tim-3 caractérise des populations lymphocytaires qui sont les moins fonctionnelles. Chez des patients atteints de carcinome rénal, l’expression de PD-1 seule n’entraîne pas de défaut d’activation des LT-CD8 mais sa co-expression avec Tim-3 conduit à une perte de fonctionnalité des cellules [14]. Enfin, dans un modèle d’hépatocarcinome, les LT-CD4-Tim-3+ expriment moins fréquemment le marqueur de prolifération Ki67 que les LT-CD4-Tim-3neg [38]. Le caractère dysfonctionnel des LT-CD8 exprimant Tim-3 est donc retrouvé au travers de plusieurs études et dans différents types histologiques de cancers. La co-expression de Lag-3 et de PD-1 sur les LT-CD8 est également un témoin d’une perte de fonctions de ces cellules, qui a été décrite dans le cancer de l’ovaire [18]. Le double blocage de Lag-3 et de PD-1 permet de restaurer cette perte de fonctionnalité et a une action anti-tumorale dans un modèle préclinique [39]. Les résultats semblent plus controversés pour l’expression de TIGIT sur les LT-CD8, même si une combinaison d’anticorps ciblant TIGIT et PD-1 sur les LT-CD8 augmente la prolifération de ces cellules par rapport à une monothérapie [40]. La majorité des lymphocytes Treg expriment Tim-3 dans le microenvironnement tumoral et TIGIT joue un rôle clé dans l’établissement de l’imunosuppression tumorale locale via son expression sur ces lymphocytes [24]. |
Tim-3 biomarqueur pronostique et de résistance à l’immunothérapie Biomarqueur pronostique Nous avons montré que la co-expression de PD-1 et Tim-3 sur les LT-CD8 intratumoraux était associée à un mauvais pronostic chez les patients atteints de cancer du rein [ 14]. Giraldo et al. ont également montré que la co-expression de PD-1, de Tim-3 et de Lag3 par les LT-CD8 de patients atteints de cancer du rein localisé caractérisait un groupe de patients à fort risque de récidive [ 41]. Un impact pronostic négatif des LT exprimant Tim-3 a également été retrouvé chez des patients atteints de lymphome folliculaire [42] ou de cancer du foie [38]. Chez des patients atteints de cancer du poumon, la co-expression de Tim-3 et d’autres MC inhibitrices est associée à la progression de la maladie [32]. À noter que, dans plusieurs études réalisée sur la population chinoise, des polymorphismes de Tim-3 ont été associés à un risque accru de cancers (à localisation digestive, en particulier, mais aussi pulmonaire, mammaire et rénale) [43]. Expression de Tim-3 sur les LT-CD8 : marqueur de résistance à l’immunothérapie. Dans un modèle d’infection virale chronique, deux souspopulations de LT-CD8-PD-1 ont été décrites : l’une Tbet ( T-box transcription factor) high - Eomes ( Eomesodermin) low qui reste fonctionnelle, l’autre Tbet low - Eomes high, qui exprime également Tim-3 et les autres récepteurs inhibiteurs [ 44]. Une étude récente, réalisée après une immunothérapie ciblant l’axe PD-1/PD-L1 ( program death ligand 1), a montré, par ailleurs, que les LT-CD8 exprimant PD-1 et CD28 étaient nécessaires à l’efficacité du traitement. Or, les LT-CD8 PD-1 + qui co-expriment Tim-3 sont majoritairement négatifs pour l’expression de CD28 [ 45]. Une augmentation d’expression de Tim-3 par les LT-CD8 est également retrouvée chez des souris résistantes aux traitements par immunothérapie anti-PD-1, en comparaison à des souris répondeuses à ces traitements [ 46]. Chez des patients atteints de cancers des voies aérodigestives supérieures, l’administration d’anticorps anti-PD-1 augmente l’expression de Tim-3 par les lymphocytes T [ 47]. Cette régulation positive de Tim-3 en lien avec le blocage de PD-1 a été confirmée chez des souris déficientes pour PD-1, leurs LT exprimant fortement Tim-3 ainsi que d’autres récepteurs inhibiteurs, concordant avec un phénotype dysfonctionnel [ 48, 49]. Enfin, dans une étude pilote, Pignon et al ont rapporté que les patients atteints de cancers du rein métastatiques traités par des molécules bloquant l’axe PD-1/PD-L1 et dont la tumeur était infiltrée par un grand nombre de LT-CD8 co-exprimant PD-1 et Tim-3 étaient résistants à cette immunothérapie [ 50]. Enfin, le groupe de O.R. Torras a montré que l’augmentation d’expression de Tim-3 était associée à la résistance aux traitement anti-PD-1/PD-L1 chez des patients atteints de cancers du rein métastatiques [ 51]. |
Tim-3 cible thérapeutique en cancérologie Contrairement aux souris déficientes pour CTLA-4 et PD1, qui présentent des létalités auto-immunes respectivement précoces ou tardives, les souris déficientes pour Tim-3 ne développent pas de manifestations auto-immunes particulières. Cette observation reflète certainement les différents degrés d’implication de ces MC inhibitrices dans le contrôle de la tolérance immunitaire. Elle suppose une moindre toxicité auto-immune pour des traitements impliquant des anti-Tim-3. La combinaison d’anticorps anti-PD-1/PD-L1 et anti-Tim-3 est plus efficace que la monothérapie et permet de surmonter certaines résistances observées après l’administration d’anti-PD-1 [52]. Ces combinaisons thérapeutiques, associées à des vaccins anti-tumoraux, améliorent aussi l’efficacité vaccinale [39, 49]. Une étude récente a montré que la combinaison d’un anti-Tim-3 et d’un anti-PD-1, associée à une radiothérapie stéréotaxique, permettait la guérison de souris porteuses de glioblastomes [53]. |
La mise en évidence de Tim-3 comme étant responsable d’une résistance au blocage de l’axe PD-1/PD-L1 confère à cette molécule un rôle possible de biomarqueur de résistance à certaines immunothérapies. L’augmentation préférentielle de Tim-3, et non d’autres récepteurs inhibiteurs (comme TIGIT ou CTLA-4), après blocage de l’axe PD-1/PD-L1 plaide en faveur d’un intérêt particulier de la combinaison thérapeutique ciblant PD-1/PD-L1 et Tim-3. En revanche, les anticorps anti-CTLA-4 ne semblent pas augmenter l’expression de Tim-3, justifiant ainsi la moindre utilité de l’association de cette thérapie avec des anti-Tim-3. Certaines études précliniques montrent que ces combinaisons thérapeutiques sont plus efficaces à un stade précoce de la maladie [54]. L’analyse du microenvironnement tumoral afin d’identifier les patients dont les LT-CD8 co-exprimeraient PD-1 et Tim-3 pourraient permettre de mieux sélectionner ceux pour lesquels une combinaison thérapeutique d’anti-PD-1 et d’anti-Tim-3 serait la plus rationnelle avant le traitement, ou de prédire une résistance durant le traitement [14]. Dans ce but, les technologies de multiplexage in situ qui permettent de révéler l’expression de plusieurs molécules simultanément et donc d’identifier des co-expressions de MC inhibitrices sur les LT-CD8 apparaissent être des outils intéressants. Différents anticorps dirigés contre Tim-3 (TSR022, LY3321367) ou des aptamères1 la bloquant [55] sont aujourd’hui disponibles. Des essais cliniques de phase I et/ou II réalisés chez des patients atteints de différents cancers, comparent les effets de l’administration de ces anti-Tim-3 seuls ou en association avec des anti-PD-1 (NCT02817633, NCT02608268) ou un anti-PD-L1 (NCT03099109). Ces nouvelles combinaisons thérapeutiques représentent ainsi les approches d’immunothérapie de deuxième génération. |
Ce travail a été soutenu par le SIRIC Carpem (C Granier), Labex Immuno-Oncology, INCA PL-BIO, ANR (Selectimmuno), Cancéropole Île-de-France. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. |
Footnotes |
1. Jenkins MK, Schwartz RH. Antigen presentation by chemically modified splenocytes induces antigen-specific T cell unresponsiveness in vitro and in vivo . J Exp Med. 1987;; 165 : :302.-19. 2. Suntharalingam G, Perry MR, Ward S, et al. . Cytokine storm in a phase 1 trial of the anti-CD28 monoclonal antibody TGN1412 . N Engl J Med. 2006;; 355 : :1018.-28. 3. Badoual C, Combe P, Gey A, et al. . Signification et intérêt clinique de l’expression de PD-1 et PDL-1 dans les tumeurs . Med Sci (Paris). 2013;; 29 : :570.-2. 4. Bettini M, Szymczak-Workman AL, Forbes K, et al. . Cutting edge: accelerated autoimmune diabetes in the absence of LAG-3 . J Immunol. 2011;; 187 : :3493.-8. 5. Joller N, Hafler JP, Brynedal B, et al. . Cutting edge: TIGIT has T cell-intrinsic inhibitory functions . J Immunol. 2011;; 186 : :1338.-42. 6. Wherry EJ. T cell exhaustion . Nat immunol. 2011;; 12 : :492.-9. 7. Apetoh L, Smyth MJ, Drake CG, et al. . Consensus nomenclature for CD8+ T cell phenotypes in cancer . Oncoimmunology. 2015;; 4 : :e998538.. 8. Kim HJ, Barnitz RA, Kreslavsky T, et al. . Stable inhibitory activity of regulatory T cells requires the transcription factor Helios . Science. 2015;; 350 : :334.-9. 9. Singer M, Wang C, Cong L, et al. . A distinct gene module for dysfunction uncoupled from activation in tumor-infiltrating T Cells . Cell. 2016;; 166 : 1500-11 e9.. 10. Tirosh I, Izar B, Prakadan SM, et al. . Dissecting the multicellular ecosystem of metastatic melanoma by single-cell RNA-seq . Science. 2016;; 352 : :189.-96. 11. Monney L, Sabatos CA, Gaglia JL, et al. . Th1-specific cell surface protein Tim-3 regulates macrophage activation and severity of an autoimmune disease . Nature. 2002;; 415 : :536.-41. 12. Zhu C, Anderson AC, Schubart A, et al. . The Tim-3 ligand galectin-9 negatively regulates T helper type 1 immunity . Nat immunol. 2005;; 6 : :1245.-52. 13. Oomizu S, Arikawa T, Niki T, et al. . Galectin-9 suppresses Th17 cell development in an IL-2-dependent but Tim-3-independent manner . Clin immunol. 2012;; 143 : :51.-8. 14. Granier C, Dariane C, Combe P, et al. . Tim-3 Expression on tumor-infiltrating PD-1+CD8+ T cells correlates with poor clinical outcome in renal cell carcinoma . Cancer Res. 2017;; 77 : :1075.-82. 15. Nakayama M, Akiba H, Takeda K, et al. . Tim-3 mediates phagocytosis of apoptotic cells and crosspresentation . Blood. 2009;; 113 : :3821.-30. 16. Huang YH, Zhu C, Kondo Y, et al. . CEACAM1 regulates TIM-3-mediated tolerance and exhaustion . Nature. 2015;; 517 : :386.-90. 17. Rangachari M, Zhu C, Sakuishi K, et al. . Bat3 promotes T cell responses and autoimmunity by repressing Tim-3-mediated cell death and exhaustion . Nat Med. 2012;; 18 : :1394.-400. 18. Huang RY, Eppolito C, Lele S, et al. . LAG3 and PD1 co-inhibitory molecules collaborate to limit CD8+ T cell signaling and dampen antitumor immunity in a murine ovarian cancer model . Oncotarget. 2015;; 6 : :27359.-77. 19. Zhu C, Sakuishi K, Xiao S, et al. . An IL-27/NFIL3 signalling axis drives Tim-3 and IL-10 expression and T-cell dysfunction . Nat commun. 2015;; 6 : :6072.. 20. Dannenmann SR, Thielicke J, Stockli M, et al. . Tumor-associated macrophages subvert T-cell function and correlate with reduced survival in clear cell renal cell carcinoma . Oncoimmunology. 2013;; 2 : :e23562.. 21. Chiba S, Baghdadi M, Akiba H, et al. . Tumor-infiltrating DCs suppress nucleic acid-mediated innate immune responses through interactions between the receptor TIM-3 and the alarmin HMGB1 . Nat immunol. 2012;; 13 : :832.-42. 22. Sakuishi K, Ngiow SF, Sullivan JM, et al. . TIM3+FOXP3+ regulatory T cells are tissue-specific promoters of T-cell dysfunction in cancer . Oncoimmunology. 2013;; 2 : :e23849.. 23. Moorman JP, Wang JM, Zhang Y, et al. . Tim-3 pathway controls regulatory and effector T cell balance during hepatitis C virus infection . J Immunol. 2012;; 189 : :755.-66. 24. Kurtulus S, Sakuishi K, Ngiow SF, et al. . TIGIT predominantly regulates the immune response via regulatory T cells . J Clin Invest. 2015;; 125 : :4053.-62. 25. Gleason MK, Lenvik TR, McCullar V, et al. . Tim-3 is an inducible human natural killer cell receptor that enhances interferon gamma production in response to galectin-9 . Blood. 2012;; 119 : :3064.-72. 26. Ndhlovu LC, Lopez-Verges S, Barbour JD, et al. . Tim-3 marks human natural killer cell maturation and suppresses cell-mediated cytotoxicity . Blood. 2012;; 119 : :3734.-43. 27. da Silva IP, Gallois A, Jimenez-Baranda S, et al. . Reversal of NK-cell exhaustion in advanced melanoma by Tim-3 blockade . Cancer Immunol Res. 2014;; 2 : :410.-22. 28. Xu L, Huang Y, Tan L, et al. . Increased Tim-3 expression in peripheral NK cells predicts a poorer prognosis and Tim-3 blockade improves NK cell-mediated cytotoxicity in human lung adenocarcinoma . Int immunopharmacol. 2015;; 29 : :635.-41. 29. Yang X, Jiang X, Chen G, et al. . T cell Ig mucin-3 promotes homeostasis of sepsis by negatively regulating the TLR response . J Immunol. 2013;; 190 : :2068.-79. 30. Giraldo NA, Becht E, Pages F, et al. . Orchestration and prognostic significance of immune checkpoints in the microenvironment of primary and metastatic renal cell cancer . Clin Cancer Res. 2015;; 21 : :3031.-40. 31. Badoual C, Hans S, Merillon N, et al. . PD-1-expressing tumor-infiltrating T cells are a favorable prognostic biomarker in HPV-associated head and neck cancer . Cancer Res. 2013;; 73 : :128.-38. 32. Thommen DS, Schreiner J, Muller P, et al. . Progression of lung cancer is associated with increased dysfunction of T cells defined by coexpression of multiple inhibitory receptors . Cancer Immunol Res. 2015;; 3 : :1344.-55. 33. Fourcade J, Sun Z, Benallaoua M, et al. . Upregulation of Tim-3 and PD-1 expression is associated with tumor antigen-specific CD8+ T cell dysfunction in melanoma patients . J Exp Med. 2010;; 207 : :2175.-86. 34. Gros A, Robbins PF, Yao X, et al. . PD-1 identifies the patient-specific CD8+ tumor-reactive repertoire infiltrating human tumors . J Clin Invest. 2014;; 124 : :2246.-59. 35. Djenidi F, Adam J, Goubar A, et al. . CD8+CD103+ tumor-infiltrating lymphocytes are tumor-specific tissue-resident memory T cells and a prognostic factor for survival in lung cancer patients . J Immunol. 2015;; 194 : :3475.-86. 36. Nizard M, Roussel H, Diniz MO, et al. . Induction of resident memory T cells enhances the efficacy of cancer vaccine . Nat commun. 2017;; 8 : :15221.. 37. Sandoval F, Terme M, Nizard M, et al. . Mucosal imprinting of vaccine-induced CD8+ T cells is crucial to inhibit the growth of mucosal tumors . Sci Transl Med. 2013;; 5 : 172ra20.. 38. Li H, Wu K, Tao K, et al. . Tim-3/galectin-9 signaling pathway mediates T-cell dysfunction and predicts poor prognosis in patients with hepatitis B virusassociated hepatocellular carcinoma . Hepatology. 2012;; 56 : :1342.-51. 39. Ngiow SF, von Scheidt B, Akiba H, et al. . Anti-TIM3 antibody promotes T cell IFN-gamma-mediated antitumor immunity and suppresses established tumors . Cancer Res. 2011;; 71 : :3540.-51. 40. Chauvin JM, Pagliano O, Fourcade J, et al. . TIGIT and PD-1 impair tumor antigen-specific CD8+ T cells in melanoma patients . J Clin Invest. 2015;; 125 : :2046.-58. 41. Giraldo NA, Becht E, Vano Y, et al. . Tumor-infiltrating and peripheral blood T-cell immunophenotypes predict early relapse in localized clear cell renal cell carcinoma . Clin Cancer Res. 2017;; 23 : :4416.-28. 42. Yang ZZ, Grote DM, Ziesmer SC, et al. . IL-12 upregulates TIM-3 expression and induces T cell exhaustion in patients with follicular B cell non-Hodgkin lymphoma . J Clin Invest. 2012;; 122 : :1271.-82. 43. Gao X, Yang J, He Y, Zhang J. Quantitative assessment of TIM-3 polymorphisms and cancer risk in Chinese Han population . Oncotarget. 2016;; 7 : :35768.-75. 44. Paley MA, Kroy DC, Odorizzi PM, et al. . Progenitor and terminal subsets of CD8+ T cells cooperate to contain chronic viral infection . Science. 2012;; 338 : :1220.-5. 45. Kamphorst AO, Wieland A, Nasti T, et al. . Rescue of exhausted CD8 T cells by PD-1-targeted therapies is CD28-dependent . Science. 2017;; 355 : :1423.-7. 46. Koyama S, Akbay EA, Li YY, et al. . Adaptive resistance to therapeutic PD-1 blockade is associated with upregulation of alternative immune checkpoints . Nat Commun. 2016;; 7 : :10501.. 47. Shayan G, Srivastava R, Li J, et al. . Adaptive resistance to anti-PD1 therapy by Tim-3 upregulation is mediated by the PI3K-Akt pathway in head and neck cancer . Oncoimmunology. 2016;; 6 : e1261779.. 48. Odorizzi PM, Pauken KE, Paley MA, et al. . Genetic absence of PD-1 promotes accumulation of terminally differentiated exhausted CD8+ T cells . J Exp Med. 2015;; 212 : :1125.-37. 49. Zhou Q, Munger ME, Veenstra RG, et al. . Coexpression of Tim-3 and PD-1 identifies a CD8+ T-cell exhaustion phenotype in mice with disseminated acute myelogenous leukemia . Blood. 2011;; 117 : :4501.-10. 50. Pignon J-C, Jegede O, Mahoney KM, et al. . Impact of immune checkpoint protein expression in tumor cells and tumor infiltrating CD8+ T cells on clinical benefit from PD-1 blockade in metastatic clear cell renal cell carcinoma (mccRCC) . J Clin Oncol. 2017;; 35 : :477.. 51. Torras OR, Marin-Aguilera M, Jiménez N, et al. . Molecular profile of sunitinib resistance in clear-cell renal cell carcinoma . Cancer Res. 2017;; 77 (suppl 13) : abstract. :785.. 52. Sakuishi K, Apetoh L, Sullivan JM, et al. . Targeting Tim-3 and PD-1 pathways to reverse T cell exhaustion and restore anti-tumor immunity . J Exp Med. 2010;; 207 : :2187.-94. 53. Kim JE, Patel MA, Mangraviti A, et al. . Combination therapy with anti-PD-1, anti-TIM-3, and focal radiation results in regression of murine gliomas . Clin Cancer Res. 2016;; 23 : :124.-36. 54. Takamura S, Tsuji-Kawahara S, Yagita H, et al. . Premature terminal exhaustion of Friend virus-specific effector CD8+ T cells by rapid induction of multiple inhibitory receptors . J Immunol. 2010;; 184 : :4696.-707. 55. Gefen T, Castro I, Muharemagic D, et al. . A TIM-3 oligonucleotide aptamer enhances T cell functions and potentiates tumor immunity in mice . Mol Ther. 2017;; 25 : :2280.-8. |