| |
| Med Sci (Paris). 34(4): 291–293. doi: 10.1051/medsci/20183404004.La synergie immunophage au cœur du succès de la phagothérapie pulmonaire Mathieu De Jode,1,2 Dwayne Roach,1 and Laurent Debarbieux1* 1Institut Pasteur, groupe interactions bactériophages bactéries chez l’animal, dé partement de microbiologie, 25, rue du Docteur Roux, 75015Paris, France 2Sorbonne université, collège doctoral, F-75005Paris, France MeSH keywords: Animaux, Bactériophages, Résistance bactérienne aux médicaments, Humains, Poumon, Phagothérapie, Infections de l'appareil respiratoire, immunologie, microbiologie, méthodes, thérapie |
Les bactériophages : une solution contre les bactéries résistantes aux antibiotiques La santé publique mondiale est menacée par les bactéries devenues résistantes aux antibiotiques. En effet, certaines infections bactériennes deviennent de plus en plus difficiles à traiter et peuvent parfois conduire à des impasses thérapeutiques lorsqu’elles sont causées par des germes multirésistants. Face à une telle situation, la recherche académique se mobilise pour proposer des solutions qui peinent à émerger de l’industrie pharmaceutique [
1]. L’une d’entre elles repose sur l’utilisation de virus infectant les bactéries : les bactériophages. En attaquant les bactéries par des mécanismes différents de ceux des antibiotiques, les bactério-phages permettent le traitement d’infections ayant pour origine des germes multi-résistants [
2]. Cependant, les conditions assurant le succès d’une phagothérapie restent imprécises et notamment la prise en considération de l’hôte (le patient) demeure négligée [
3] ➔.
➔
Voir la Synthèse de N. Dufour et L. Debarbieux, m/s n° 4, avril 2017, page 410
à l’aide d’un modèle murin d’infection respiratoire aiguë causée par la bactérie Pseudomonas aeruginosa (pathogène classé par l’Organisation mondiale de la santé comme prioritaire pour la recherche de nouveaux antibactériens), nous avons étudié le rôle du système immunitaire au cours d’une phagothérapie par le bactério-phage virulent PAK_P1 [
4]. |
Bactériophages, bactéries et immunité Les interactions entre les bactériophages et les bactéries dans un cadre thérapeutique sont encore mal connues, même si elles ont fait l’objet d’études extensives dans les tubes à essai [
5]. Par exemple, l’exposition de bactéries à une grande quantité d’un seul bactériophage entraîne l’inévitable sélection de bactéries résistantes à ce virus [
6]. Divers mécanismes de résistance ont été décrits, mais l’une des particularités des bactériophages tient au fait qu’ils peuvent eux-mêmes développer des mécanismes pour contrer cette résistance [
7]. Les caractéristiques des interactions entre bactériophages et bactéries étant facilement mesurables (constante d’affinité, vitesse de croissance, probabilité de rencontre, etc.), des modèles mathématiques représentant la variation de ces deux populations antagonistes ont été proposés [5]. Cependant, ces connaissances acquises essentiellement in vitro ne permettent pas d’expliquer complètement les observations recueillies in vivo laissant le champ libre à des interprétations infondées nuisant au développement de la phagothérapie [
8]. Lors d’une utilisation thérapeutique, les interactions entre bactériophages et bactéries peuvent être influencées par les pressions exercées par le système immunitaire de l’hôte. En effet, celui-ci affecte plus ou moins fortement la croissance du pathogène et peut limiter l’action du bactériophage. De plus, ces deux effets peuvent être altérés chez un hôte immunodéprimé avec, pour conséquence, une modification de l’efficacité du traitement antimicrobien. Pour identifier l’influence du système immunitaire au cours d’une phagothérapie, nous avons testé l’impact de la variation de l’immuno-compétence de l’hôte dans notre modèle murin d’infection respiratoire, et avons couplé cette étude à l’élaboration d’un modèle mathématique permettant de réaliser des prédictions sur les interactions tripartites entre bactériophages, bactéries et réponse de l’hôte (Figure 1) [
9]. 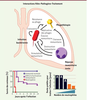 | Figure 1.
Interaction hôte pathogène et traitement. Le schéma du haut représente des interactions tripartites entre le bactériophage (phagothérapie, en jaune), la bactérie pathogène (infection bactérienne en rouge) et les cellules immunitaires (réponse immunitaire innée, en violet). En bas à gauche sont présentées les courbes de survie illustrant l’efficacité d’une phagothérapie dans différents contextes immunitaires. Les résultats de la simulation de l’efficacité d’une phagothérapie en fonction de la quantité de neutrophiles sont représentés sur la droite. |
|
L’importance de la réponse immunitaire au cours d’une phagothérapie Nous avions précédemment montré que le phage PAK_P1 permet de traiter efficacement une infection pulmonaire chez des animaux immunocompétents (100 % de survie des animaux traités par comparaison à aucune survie pour les non-traités), laissant supposer que la seule action antibactérienne des bactériophages était suffisante pour assurer le succès du traitement [4]. Pour évaluer la part du système immunitaire dans le traitement par le bactériophage PAK_P1, nous avons appliqué le même protocole à des souris invalidées pour le gène codant la protéine Myd88 (myeloid differentiation primary response 88). Cette protéine participant à la signalisation induite par les récepteurs TLR (Toll-like receptors) reconnaissant des motifs microbiens, est essentielle au déclenchement de la réponse immunitaire innée et, par conséquent, de tels animaux sont plus sensibles à l’infection par P. aeruginosa. Infectées par une dose 100 fois inférieure à celle utilisée chez les animaux immunocompétents, les souris MyD88-/- développent toujours une infection respiratoire aiguë qui, en 48 h, est fatale à la plupart d’entre elles. En appliquant un traitement par le bactériophage PAK_P1, la survie de ces animaux infectés était légèrement augmentée, un résultat bien moindre que celui obtenu avec des souris immunocompétentes (Figure 1). Cette expérience démontrait donc que l’efficacité du traitement par le bactério-phage PAK_P1 dépendait bien de l’activation d’une réponse immunitaire. Grâce à l’utilisation d’une souche de P. aeruginosa bioluminescente (émettant constitutivement de la lumière), nous avons pu quantifier l’infection pour un même animal au cours du temps, et obtenir ainsi des données dynamiques. L’intensité de la lumière mesurée chez les animaux MyD88-/- traités par le bactériophage décline entre 8 et 24 h après infection, montrant que le bactériophage est bien capable de réduire la quantité de bactéries dans les poumons. Pourtant, entre 24 et 48 h, cette intensité augmente de nouveau pour ne plus chuter jusqu’au décès des animaux. Un tel profil suggérait donc que les bactéries responsables du décès des animaux pouvaient être devenues résistantes au bactériophage PAK_P1, ce qui fût confirmé par l’analyse de plusieurs bactéries prélevées 24 h après infection. Une fois la cause de l’échec thérapeutique identifiée, il restait à déterminer quels étaient les composants du système immunitaire qui étaient impliqués dans le succès de la phagothérapie chez les animaux immunocompétents. Pour tester le rôle des cellules lymphoïdes (principalement les lymphocytes B et T), nous avons étudié des souris invalidées pour les gènes Rag2 (recombination activating gene 2) et Il2rg (interleukin 2 receptor subunit gamma). Chez ces animaux, incapables de développer une réponse lymphocytaire, le traitement de l’infection pulmonaire par le bactériophage est tout aussi efficace que chez des animaux immunocompétents, nous amenant à conclure que les cellules lymphoïdes ne sont pas impliquées dans le succès d’une phagothérapie [9]. À l’aide d’un anticorps, nous avons ensuite spécifiquement ciblé les neutrophiles, qui sont les premières cellules immunitaires recrutées au site infectieux. Chez les souris devenues neutropéniques, le traitement par le bactériophage PAK_P1 s’est avéré inefficace. Le rôle des neutrophiles dans l’efficacité de la phagothérapie est donc majeur (Figure 1). Nous avons par ailleurs montré que le bactériophage PAK_P1 ne déclenchait pas par lui-même, à court (24 h) et long (4 jours) termes, de production significative de cytokines dans les poumons des animaux sains, démontrant ainsi son innocuité [9]. |
La synergie immunophage et ses implications Notre travail a permis de révéler l’action synergique des bactériophages et du système immunitaire contre les bactéries. Rapidement après son application, le bactériophage détruit les bactéries et soumet celles-ci à une pression de sélection qui engendre la croissance de bactéries qui lui sont résistantes. Cependant, lorsque le système immunitaire est fonctionnel, celui-ci détecte les bactéries et met en place via un réseau complexe de signalisation une réponse qui les prendra en charge (notamment via les neutrophiles) qu’elles soient susceptibles ou résistantes au bactériophage (Figure 1). Au contraire, lorsque le système immunitaire est altéré, et en particulier en cas de neutropénie, l’absence d’action synergique empêche le contrôle des bactéries résistantes au bactériophage, qui peuvent alors provoquer une infection fatale. Au cours des différentes étapes de ce travail, nous avons progressivement élaboré plusieurs modèles mathématiques décrivant les différentes situations testées. Finalement, nous proposons aujourd’hui deux modèles qui, de manière équivalente, permettent de simuler fidèlement l’implication du système immunitaire au cours d’une phagothérapie [9]. Ces modèles (se différenciant dans la prise en compte de l’hétérogénéité des interactions au sein du poumon) permettent d’anticiper qu’un déficit d’environ 50 % du nombre de neutrophiles pourrait conduire à un échec de la phagothérapie (Figure 1). Ce travail démontre l’importance des interactions tripartites entre bactériophages, bactéries et cellules immunitaires, dont la compréhension permettra à terme de mieux appréhender la mise en place des futurs traitements. Bien que proposée il y a un siècle, brièvement développée au niveau mondial avant les antibiotiques puis globalement abandonnée, la phagothérapie recèle encore bien des secrets tout en tenant ses promesses, comme en atteste le succès de récents traitements en Europe et aux États-Unis [
10,
11]. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Brogan
DM
,
Mossialos
E
. A critical analysis of the review on antimicrobial resistance report and the infectious disease financing facility . Global Health.
2016;; 12 : :8.. 2.
Roach
DR
,
Debarbieux
L
. Phage therapy: awakening a sleeping giant . Emerg Top Life Sci.
2017;; 1 : :93.-103. 3. Dufour N, Debarbieux L, La phagothérapie. Une arme crédible face à l’antibiorésistance. Med Sci (Paris).
2017;; 33 : :410.-6. 4.
Debarbieux
L
,
Leduc
D
,
Maura
D
, et al.
Bacteriophages can treat and prevent Pseudomonas aeruginosa lung infections . J Infect Dis.
2010;; 201 : :1096.-104. 5.
Weitz
JS
. Quantitative viral ecology: dynamics of viruses and their microbial hosts.
Priceton, New Jersey: : Princeton University Press; , 2015. 6.
Luria
SE
,
Delbruck
M
. Mutations of bacteria from virus sensitivity to virus resistance . Genetics.
1943;; 28 : :491.-511. 7.
Labrie
SJ
,
Samson
JE
,
Moineau
S
. Bacteriophage resistance mechanisms . Nat Rev Microbiol.
2010;; 8 : :317.-27. 8.
Henry
M
,
Lavigne
R
,
Debarbieux
L
. Predicting in vivo efficacy of therapeutic bacteriophages used to treat pulmonary infections . Antimicrob Agents Chemother.
2013;; 57 : :5961.-8. 9.
Roach
DR
,
Leung
CY
,
Henry
M
, et al.
Synergy between the host immune system and bacteriophage is essential for successful phage therapy against an acute respiratory pathogen . Cell Host Microbe.
2017;; 22 : :38.-47e4. 10.
Jennes
S
,
Merabishvili
M
,
Soentjens
P
, et al.
Use of bacteriophages in the treatment of colistin-only-sensitive Pseudomonas aeruginosa septicaemia in a patient with acute kidney injury-a case report . Crit Care.
2017;; 21 : :129.. 11.
Schooley
RT
,
Biswas
B
,
Gill
JJ
, et al.
Development and use of personalized bacteriophage-based therapeutic cocktails to treat a patient with a disseminated resistant Acinetobacter baumannii infection . Antimicrob Agents Chemother.
2017;; 61. pii: :e00954.-17. doi: 10.1128/AAC.00954-17.. |