Les lymphocytes B matures expriment à leur surface un récepteur spécifique appelé BCR (pour B-cell receptor) constitué d’une immunoglobuline (Ig) d’isotype μ (IgM) et δ (IgD) spécifique d’un antigène. Cette Ig est associée à diverses chaînes de transduction qui permettent une signalisation efficace. Les IgM et IgD membranaires sont produites après épissage alternatif d’un long transcrit comprenant la partie variable de l’Ig (région VDJ) et les régions codantes des gènes constants μ et δ. La recombinaison de classe (CSR, pour class switch recombination) également appelée recombinaison isotypique ou commutation de classe, permet au lymphocyte B d’exprimer à sa surface un BCR d’un isotype différent des isotype μ et δ (Figure 1) [ 1] ➔.
➔ Voir la Synthèse de S. Péron et al., m/s n° 5, mai 2012, page 551
Cette nouvelle Ig de surface diffère uniquement par la partie constante de sa chaîne lourde assurant ainsi des fonctions effectrices différentes. La région variable ne subissant aucune modification1,, la spécificité et l’affinité pour l’antigène sont conservées. La recombinaison isotypique se produit entre deux régions switch (S), localisées en amont de chaque gène constant, excepté Cδ [1]. Les régions S sont riches en désoxynucléotides guanine et cytosine et sont de taille variable (de 1 à 12 kb). La recombinaison s’effectue toujours entre une région S donneuse (en général Sμ) et une région S receveuse variant selon l’environnement cytokinique. L’ADN situé entre ces deux régions S est excisé, circularisé puis éliminé. Les régions codantes sont, quant à elles, liées entre elles pour conduire à la juxtaposition d’un exon codant une chaîne lourde et un segment de la partie variable VDJ de l’Ig. La transcription et l’épissage de cette chaîne aboutissent à l’expression d’un nouvel isotype d’Ig.
D’un point de vue moléculaire, l’enzyme AID (activation-induced cytidine deaminase) désamine des cytosines en uraciles dans les régions S. Les mésappariements générés entre le déoxy-uracile et le déoxyguanine dans ces régions sont excisés par l’enzyme UNG (uracyle-ADN glycolase) créant des sites abasiques qui conduisent à l’apparition de cassures simple brin (SSB pour single strand break). Ces SSB peuvent devenir des cassures double brin (DSB pour double strand break) si elles sont proches sur les deux brins d’ADN. Les cassures sont reconnues et prises en charge par un grand nombre de complexes protéiques qui forment des foyers de réparation qui stabilisent les DSB et recrutent les molécules impliquées dans deux voies de réparation de l’ADN : la voie de réparation classique ou NHEJ (non-homologous end-joining), et la voie alternative A-EJ (alternative end-joining) qui utilise des micro-homologies de séquences entre les régions S à recombiner. L’analyse de la jonction Sμ-Sx générée permet de définir la voie de réparation impliquée. Ainsi, la liaison franche (aussi appelée jonction directe) entre les deux régions S, ou la présence de quelques bases homologues aux deux régions S (jonction par micro-homologie), révèle une activité de type NHEJ. À l’inverse, la présence de plusieurs bases homologues aux deux régions S traduit une activité de type A-EJ. Des mutations, conséquences directes des mécanismes de réparation, sont également présentes à proximité de la jonction1. Des mutations éloignées de la jonction sont interprétées comme un stigmate du ciblage d’AID sur ces régions.
La recombinaison isotypique se produit donc entre deux régions S localisées en amont de chaque gène constant excepté Cδ. Le paradigme a longtemps été « absence de région Sδ devant Cδ, donc pas de recombinaison isotypique vers les IgD » et ceci malgré la description depuis plusieurs années de myélomes à IgD avec délétion de Cμ [ 2]. La démonstration d’une recombinaison isotypique vers les IgD n’est que très récente (Figure 1) [ 3- 5].
Comment a-t-elle pu rester si longtemps ignorée ? Principalement parce qu’elle est totalement atypique et qu’elle ne respecte quasiment aucune des règles canoniques de la recombinaison isotypique classique. Il n’y a pas de région S évidente et structurée devant Cδ, comme devant les gènes Cγ, Cε et Cα. Seule est présente une petite séquence S rudimentaire (appelée σδ pour Sδ-like) en 5’ de Cδ [ 6]. Le switch vers les IgD n’est observable que dans des sous-populations lymphocytaires B très particulières : les lymphocytes B des voies aériennes [3], digestives [4, 5] et péritonéales [7, 8]. Il est absent des populations spléniques et ganglionnaires à partir desquelles les mécanismes de recombinaisons isotypiques vers les IgG, IgE et IgA (et la plupart des bases de l’immunologie lymphocytaire B) ont été décrits. Contrairement aux autres recombinaisons, la recombinaison isotypique vers les IgD n’est pas inductible in vitro, par des cocktails cytokiniques, comme ce qui est observé pour les cellules B de la rate par exemple après stimulation par le LPS (lypo-polysaccharide) et l’interleukine-4 (IL-4) pour une commutation IgG1, ou par le LPS et le TGFβ (transforming growth factor β) pour une IgA. Contrairement aux recombinaisons isotypiques conventionnelles vers les IgG, IgA et IgE, celle vers les IgD n’est pas sous le contrôle de la région régulatrice en 3’(3’RR) du locus des chaînes lourdes d’Ig (IgH) [4, 8].
Cette région régulatrice est essentielle pour le recrutement d’AID sur la région S receveuse [ 9] ➔.
➔ Voir la Synthèse de A. Saintamand et al., m/s n° 11, novembre 2017, page 663
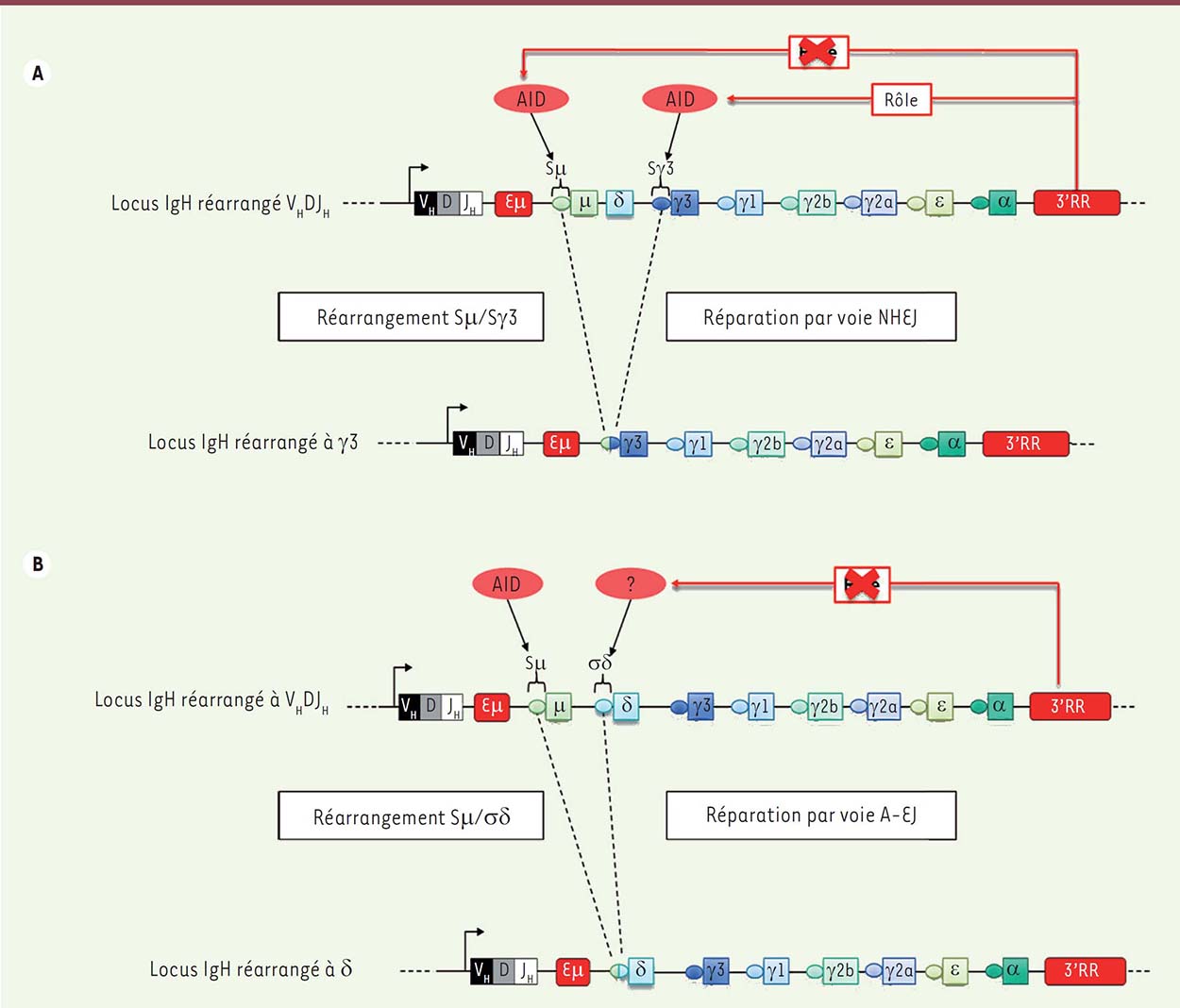
| Figure 1.
La recombinaison isotypique (ou commutation de classe). A. Recombinaison isotypique vers IgG3 (immunoglobuline d’isotype G3). Attaque de l’enzyme AID (activation-induced cytidine deaminase) sur Sμ et Sγ3 pour générer des cassures de l’ADN. Il existe une contribution importante de la région régulatrice en 3’(3’RR) du locus IgH pour le ciblage d’AID sur la région switch receveuse (ici Sγ3). La ligature Sμ-Sγ3 fait appel principalement à la voie de réparation NHEJ (non-homologous end-joining). B.
Recombinaison isotypique vers IgD. Attaque de l’enzyme AID sur Sμ. Pas de contribution de la 3’RR pour le ciblage d’AID sur la région σδ. La ligature Sμ-σδ fait appel principalement à la voie de réparation A-EJ (alternative end-joining).
|
L’analyse des jonctions Sμ-σδ par les nouvelles technologies de séquençage à haut débit, indique une majorité de jonctions par micro-homologie et donc une réparation des DSB par la voie A-EJ plutôt que par la voie NHEJ contrairement à la recombinaison isotypique classique [ 7, 8]. Toujours par séquençage à haut débit, l’analyse des mutations autour des jonctions Sμ-σδ décrit des stigmates AID en 5’ de Sμ, mais pas en 3’ de σδ [8]. Cette contribution d’AID sur Sμ est cohérente avec son action lors de la recombinaison de classe vers les IgG, IgA et IgE ainsi qu’avec l’absence de jonctions Sμ-σδ chez les souris déficientes pour AID [ 10]. Par contre, l’absence de stigmates AID sur la jonction σδ, contrairement à ceux observés sur les régions Sγ, Sε et Sα receveuses lors de la commutation vers les IgG, IgE et IgA est intrigante. Elle suggère une attaque par une activité enzymatique différente d’AID. L’absence de ces stigmates est cohérente avec l’absence de participation de la région 3’RR à la recombinaison isotypique vers les IgD puisque c’est elle qui assure le recrutement d’AID sur la région S receveuse, en l’occurrence CTS. AID appartient à la famille des déaminases APOBEC (apolipoprotein B mRNA editing enzyme-catalytic). Une attaque de la région CTS par un autre membre de la famille APOBEC lors de la recombinaison isotypique vers les IgD est donc envisageable, mais jusqu’ici non démontrée.
Si l’existence de la recombinaison isotypique vers les IgD est maintenant reconnue, sa mécanistique précise et ses fonctions restent à élucider. La récente mise en évidence d’une recombinaison vers les IgD qui dépend de la flore bactérienne intestinale (et d’une stimulation impliquant les TLR [Toll-like receptor]) suggère qu’elle peut contribuer, in vivo, à la régulation homéostatique des communautés microbiennes [5]. Ces données renforcent l’hypothèse d’un caractère très ancien de la recombinaison isotypique vers les IgD et donc de sa régulation particulière par rapport à celles vers les IgG, IgA et IgE.