| |
| Med Sci (Paris). 34(4): 303–306. doi: 10.1051/medsci/20183404008.Petits mais costauds Les exosomes neuronaux contrôlent l’intégrité vasculaire cérébrale Julien Saint-Pol1* and Fabien Gosselet1 1Laboratoire de la barrière hémato-encéphaliqe (LBHE), EA 2465, université d’Artois, rue Jean Souvraz - SP18, 62307 Lens, France MeSH keywords: Animaux, Barrière hémato-encéphalique, Encéphale, Communication cellulaire, Exosomes, Humains, microARN, Neurones, physiologie, vascularisation, métabolisme |
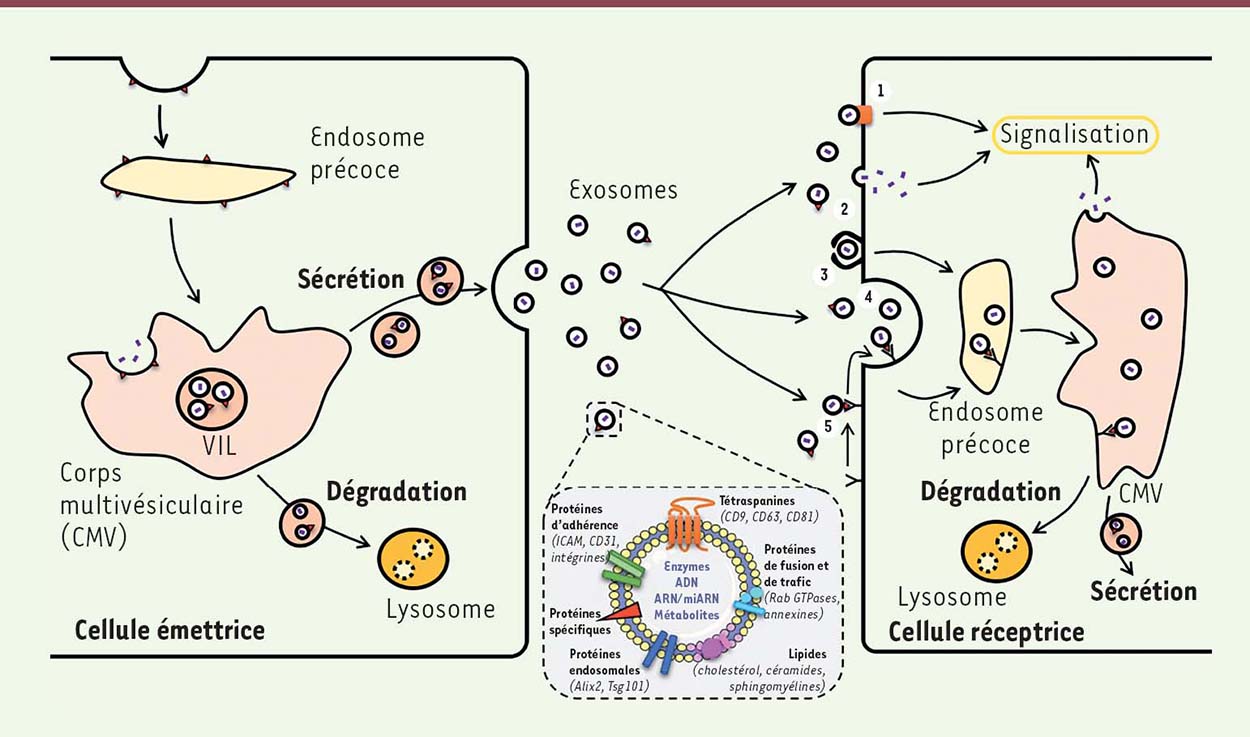
Les exosomes, vecteurs nanoscopiques de communication cellule-cellule Depuis une décennie, une nouvelle voie de communication de cellule à cellule faisant intervenir des vésicules extracellulaires (VE) et plus particulièrement les exosomes, a été mise en évidence. Longtemps considérés comme des vecteurs d’élimination de déchets intracellulaires, les exosomes sont des vésicules nanoscopiques de 30 à 100 nm de diamètre, qui, contrairement aux autres VE telles que les ectosomes ou les corps apoptotiques, ont une origine intracellulaire, plus précisément endosomale. Les exosomes prennent, en effet, naissance dans les corps multivésiculaires (CMV). Ils s’accumulent dans les vésicules intraluminales (VIL), puis sont libérés par exocytose dans le milieu extracellulaire après la fusion des VIL avec la membrane plasmique [
1] (Figure 1). Les exosomes sont impliqués dans de nombreux processus physiologiques, comme l’angiogenèse, la réponse immunitaire, mais également en contextes pathologiques comme dans le cancer ou les maladies neurodégénératives [
2]. Leur capacité de régulation physiopathologique est liée à leur composition membranaire mais aussi à leur contenu intravésiculaire. Les exosomes portent en effet à leur surface des protéines caractéristiques telles que des molécules d’adhérence, des tétraspanines1, (CD9, CD37, CD63 et CD81), ainsi que des protéines endosomales comme Alix (ALG-2 interacting protein X) et Tsg101 (tumor susceptibility gene 101) [2] (Figure 1). Ces signatures protéiques différent selon l’origine cellulaire des exosomes et sont possiblement impliquées dans l’interaction avec la cellule ciblée. Ces protéines membranaires, présentes sur les exosomes, permettent en effet leur fusion avec la membrane plasmique de la cellule cible, ou leur endocytose après reconnaissance d’un récepteur exprimé à la surface de la cellule cible [1] (Figure 1). La lumière des exosomes contient des enzymes, divers métabolites et des acides nucléiques comme de l’ADN, des ARN parfois fragmentés, ou des microARN (miARN) impliqués dans la régulation de l’expression génique (Figure 1). L’enrichissement de certains miARN dans les exosomes peut dépendre du type cellulaire dont ils sont issus. Il peut également traduire l’état physiopathologique d’un tissu ou d’un organe. Ainsi, l’augmentation de sécrétion par les exosomes du miR-122, miARN principalement exprimé par les hépatocytes, est révélatrice d’atteintes hépatiques non-cancéreuses, liées à la dépendance alcoolique, à l’inflammation ou induites par certains médicaments [
3]. Les exosomes d’origine neuronale présentent préférentiellement un miARN, le miR-132, dont l’expression neuronale est importante, et qui est impliqué dans la régulation de l’intégrité de la barrière hémato-encéphalique [
4].
 | Figure 1.
Production, sécrétion et devenir des exosomes.
Les exosomes sont formés au sein des corps multivésiculaires (CMV) et contenus dans les vésicules intraluminales (VIL). Les CMV sont soit dégradés par la voie lysosomiale, soit adressés à la membrane plasmique pour libérer les exosomes par exocytose. Ces exosomes présentent une composition lipidique particulière : des protéines de surface communes (tétraspanines, protéines d’adhérence, Protéines d’adhérence, protéine de trafic intracellulaire et de fusion avec la membrane) ainsi que des protéines spécifiques du type cellulaire source ou émetteur. L’interaction de ces exosomes avec les cellules cibles ou réceptrices peut s’effectuer selon divers procédés : l’activation d’une cascade de seconds messagers par liaison à un récepteur ou transporteur (1); la fusion avec la membrane plasmique de la cellule cible pour libérer son contenu dans le cytoplasme (2); la transcytose soit non-spécifique [micropinocytose (3) ou endocytose aspécifique (4)] soit par l’intermédiaire d’un récepteur (5). S’ils ne sont pas dégradés, les exosomes peuvent délivrer leur contenu (ARN, ADN, microARN, métabolites, enzymes) à la cellule cible (signalisation cellulaire, régulation de l’expression de gènes, etc.). |
|
La barrière hémato-encéphalique, garante de l’homéostasie cérébrale Le contrôle de l’homéostasie cérébrale, indispensable au fonctionnement du système nerveux central, est assuré en grande partie par la barrière hématoencéphalique (BHE). Cette barrière est localisée au niveau des cellules endothéliales des microvaisseaux cérébraux [
5] ➔ (Figure 2).
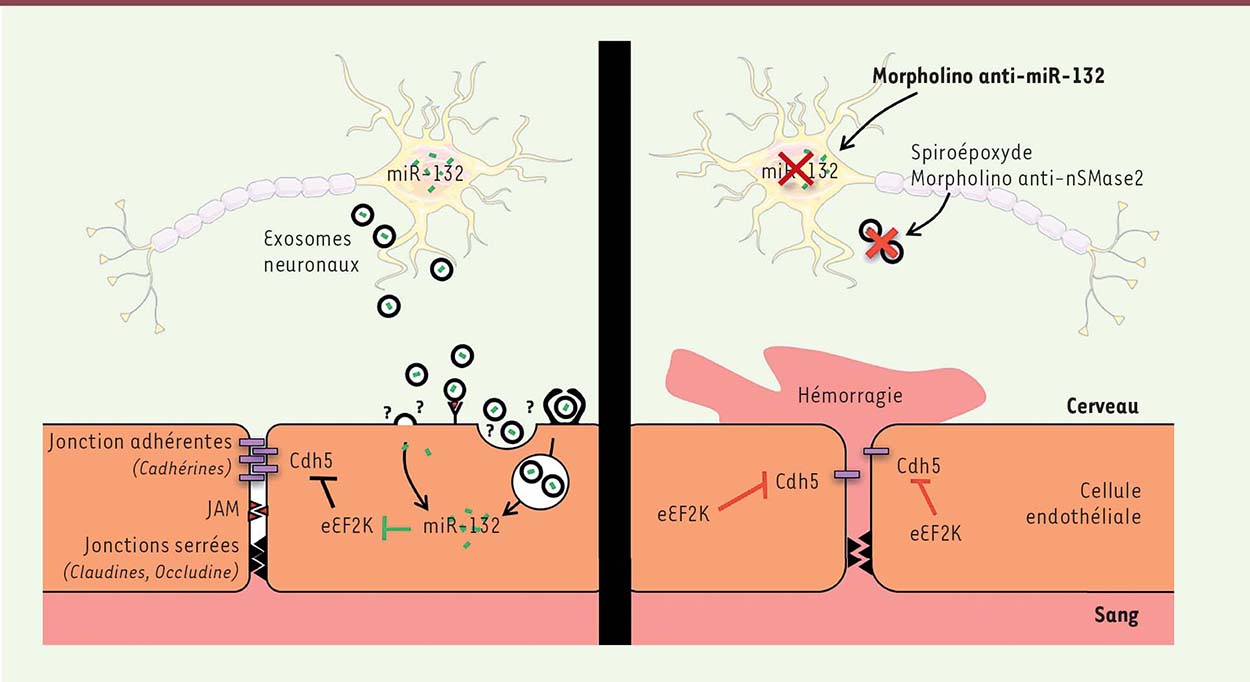
 | Figure 2.
Régulation de l’intégrité de la barrière hémato-encéphalique (BHE) par le miR-132 des exosomes neuronaux. Les exosomes neuronaux interagissent avec les cellules endothéliales des microvaisseaux cérébraux et délivrent le microARN miR-132, responsable de la régulation indirecte de l’expression de la VE-cadhérine (Cdh5) par la répression de l’expression de l’eukaryotic elongation factor 2 kinase (eEF2K). L’altération de l’expression de ce miARN entraîne une diminution de l’expression de Cdh5 au niveau des cellules endothéliales, induisant une déstabilisation des complexes jonctionnels responsables de l’intégrité physique de la BHE, et par conséquent l’apparition de processus hémorragiques au niveau des microvaisseaux cérébraux. JAM : junctional adhesion molecules; nSMase2 : sphingomyélinase 2 neuronale. |
➔
Voir la Synthèse de F. Gosselet, m/s n° 4, avril 2017, page 423
Par leurs propriétés physiques et métaboliques, les cellules endothéliales restreignent les transports transet para-cellulaires de molécules entre le sang et le cerveau [
6] ➔
➔
Voir la Synthèse de F. Gosselet et al., m/s n° 11, novembre 2011, page 987
Les transports transcellulaires nonspécifiques des macromolécules sont limités. Ils sont restreints à des transporteurs ou à des récepteurs spécifiques situés à la face apicale (côté sang) ou basolatérale (côté cerveau) des cellules endothéliales. Diverses enzymes (dont la monoamine oxydase [MAO], les enzymes de conversion de l’endothéline [ECE], la γ-glutamyltransférase [γ-GT]), ainsi que des pompes d’efflux telles que la P-glycoprotéine (P-gp) restreignent le transport transcellulaire des petites molécules. Le transport paracellulaire est fortement restreint par divers complexes de jonctions présents entre les cellules endothéliales [5] : des jonctions serrées apicales formées par les protéines ZO1 (zonula occludens-1), l’occludine, les claudines 3, 5 et 12; des jonctions médianes associées aux protéines JAM (junctional adhesion molecules); des jonctions adhérentes dépendantes du calcium, abluminales2, en relation avec la VE-cadhérine (vascular endothelial-cadherin, ou cadhérine-5 [Cdh5]). L’apparition et le maintien de la barrière hémato-encéphalique résultent d’interactions des cellules endothéliales avec leur microenvironnement cellulaire : (1) les péricytes cérébraux qui partagent avec les cellules endothéliales une membrane basale commune, (2) les astrocytes dont les prolongements pédicellaires entourent de façon continue les microvaisseaux cérébraux et (3) les neurones [
7]. Ces quatre types cellulaires forment ce qui est appelé le complexe neurovasculaire (CNV). Les intercommunications cellulaires au sein du CNV permettent d’assurer le contrôle de l’homéostasie cérébrale et ainsi un fonctionnement cérébral optimal. |
miR-132 régule l’intégrité physique de la BHE Une étude menée chez le poisson zèbre par Xu et al. a permis de renforcer la théorie selon laquelle les neurones régulaient l’intégrité de la BHE, et ce de manière originale par l’intermédiaire du miARN miR-132. Le miR-132, dont l’expression est majoritairement neuronale, est véhiculé par les exosomes neuronaux [4]. Ce miRNA a été impliqué dans les processus de morphogenèse neuronale, dans la régulation du rythme circadien [
8], mais également dans des neuropathologies comme la maladie d’Alzheimer [
9]. En utilisant des oligonucléotides de type morpholino, couramment utilisés pour réduire l’expression des miARN afin de bloquer l’expression de gènes, cette équipe a démontré que la suppression d’expression du miR-132 se traduisait par une augmentation de perméabilité de la BHE, avec l’apparition d’hémorragies cérébrales d’origine microvasculaire et l’entrée anormale de cellules circulantes dans le compartiment cérébral. Le recouvrement de l’endothélium microvasculaire par les péricytes, autre type cellulaire responsable de l’induction du phénotype BHE au niveau des cellules endothéliales, n’est cependant pas modifié en l’absence de miR-132, suggérant que les atteintes vasculaires observées sont liées à un processus d’origine endothéliale. La suppression pharmacologique de la sécrétion des exosomes par le spiroépoxide, ou l’inhibition de la sphingomyélinase 2 neuronale (nSMase2) qui participe à leur bourgeonnement dans les corps multivésiculaires, provoquent également l’apparition des processus hémorragiques, confirmant que le miR-132 est effectivement véhiculé par les exosomes neuronaux jusqu’aux cellules endothéliales. Le suivi d’exosomes rendus fluorescents par l’expression de la tétraspanine CD63 couplée à la green fluorescent protein (GFP) montre qu’ils sont endocytés par les cellules endothéliales. Les mécanismes impliqués dans cette endocytose restent toutefois imprécis. L’altération de l’intégrité de la BHE observée en absence d’expression du miR-132 est associée à l’altération des complexes de jonctions entre cellules endothéliales. Ces complexes apparaissent en effet, en microscopie électronique, discontinus, suggérant un rôle de miR-132 dans la régulation de l’expression des protéines de jonctions cellulaires. L’équipe de Xu a, par la suite, confirmé cette hypothèse. Ils ont en effet démontré que le miR-132 modulait négativement l’expression dans les cellules endothéliales, de la kinase eukaryotic elongation factor 2 kinase (eEF2K). La kinase eEF2K contrôle l’expression de la VE-cadhérine, impliquée dans les jonctions adhérentes (Figure 2). Le miR-132 d’origine neuronale, transporté par les exosomes, est donc capable de moduler l’intégrité de la BHE via l’augmentation indirecte de l’expression de la VE-cadhérine [4]. Ces données renforcent donc le rôle des intercommunications cellulaires au sein du CNV dans le maintien et la régulation du phénotype BHE, mais aussi soulignent l’importance des exosomes dans ces communications cellule-cellule. |
Les exosomes, vecteurs thérapeutiques ? L’intérêt suscité par les exosomes comme potentielle voie de vectorisation thérapeutique est d’autant plus grand que leur rôle dans le contrôle de processus physiopathologiques est important. Pour certains cancers [2] ou des maladies neurodégénératives comme la maladie d’Alzheimer [
10], les exosomes peuvent transporter certaines protéines spécifiques de ces pathologies (par exemple, les protéines tau qui sont anormalement phosphorylées dans la maladie d’Alzheimer [10]). Les exosomes peuvent donc s’apparenter à des biomarqueurs de pathologies [2]. D’autre part, des exosomes d’origine périphérique et transportés par la circulation sanguine ont été détectés dans le compartiment cérébral [
11]. Inversement des exosomes provenant de gliomes (donc cérébraux) ont été détectés dans la circulation sanguine [
12]. Ceci suggère l’existence de voies de transport de ces nanovésicules entre sang et cerveau au travers de la BHE. L’étude de Xu et al. a montré l’existence d’une endocytose des exosomes par les cellules endothéliales des microvaisseaux cérébraux, sans toutefois en préciser le mécanisme (Figure 2). La compréhension des modalités d’échanges d’exosomes entre sang et cerveau apparaît donc comme un challenge afin de développer des stratégies thérapeutiques fondées sur ces vésicules. Telles des « chevaux de Troie », elles pourraient en effet véhiculer des molécules pharmacologiques, ou des éléments de régulation d’expression génique comme les microARN, vers le compartiment cérébral [
13]. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. |
Footnotes |
1.
Van Niel
G
,
D’Angelo
G
,
Raposo
G.
Shedding light on the cell biology of extracellular vesicles . Nat Rev Mol Cell Biol.
2018. doi: 10.1038/nrm.2017.125.. 2.
Kalra
H
,
Drummen
GP
,
Mathivanan
S.
Focus on extracellular vesicles: introducing the next small big thing . Int J Mol Sci.
2016;; 17 : :170.. 3.
Bala
S
,
Petrasek
J
,
Mundkur
S
, et al.
Circulating microRNAs in exosomes indicate hepatocyte injury and inflammation in alcoholic, drug-induced, and inflammatory liver diseases . Hepatology.
2012;; 56 : :1946.-57. 4.
Xu
B
,
Zhang
Y
,
Du
XF
, et al.
Neurons secrete miR-132-containing exosomes to regulate brain vascular integrity . Cell Res.
2017;; 27 : :882.-97. 5.
Gosselet
F.
Modélisation in vitro de la barrière hémato-encéphalique.
Med Sci (Paris).
2017;; 33 : :423.-31. 6.
Gosselet
F
,
Candela
P
,
Cecchelli
R
,
Fenart
L.
La barrière hémato-encéphalique : une nouvelle cible thérapeutique dans la maladie d’Alzheimer ?
Med Sci (Paris).
2011;; 27 : :987.-92. 7.
Obermeier
B
,
Daneman
R
,
Ransohoff
RM.
Development, maintenance and disruption of the blood-brain barrier . Nat Med.
2013;; 19 : :1584.-96. 8.
Wanet
A
,
Tacheny
A
,
Arnould
T
,
Renard
P.
miR-212/132 expression and functions: within and beyond the neuronal compartment . Nucleic Acids Res.
2012;; 40 : :4742.-53. 9.
Soreq
H
,
Wolf
Y.
NeurimmiRs: microRNAs in the neuroimmune interface . Trends Mol Med.
2011;; 17 : :548.-55. 10.
Chiarini
A
,
Armato
U
,
Gardenal
E
, et al.
Amyloid beta-exposed human astrocytes overproduce phospho-Tau and overrelease it within exosomes, effects suppressed by calcilytic NPS 2143-further implications for Alzheimer’s therapy . Front Neurosci.
2017;; 11 : :217.. 11.
Matsumoto
J
,
Stewart
T
,
Banks
WA
,
Zhang
J.
The transport mechanism of extracellular vesicles at the blood-brain barrier . Curr Pharm Des.
2017. doi: 10.217 4/1381612823666170913164738.. 12.
Garcia-Romero
N
,
Carrion-Navarro
J
,
Esteban-Rubio
S
, et al.
DNA sequences within glioma-derived extracellular vesicles can cross the intact bloodbrain barrier and be detected in peripheral blood of patients . Oncotarget.
2017;; 8 : :1416.-28. 13.
Bell
BM
,
Kirk
ID
,
Hiltbrunner
S
, et al.
Designer exosomes as next-generation cancer immunotherapy . Nanomedicine.
2016;; 12 : :163.-9. |