| |
| Med Sci (Paris). 34(5): 379–382. doi: 10.1051/medsci/20183405003.Des approches multi-omiques dévoilent de nouvelles cibles thérapeutiques pour le traitement du cancer du pancréas Rémy Nicolle,1 Yuna Blum,1 Laetitia Marisa,1 Nelson Dusetti,2 and Juan Iovanna2* 1Programme cartes d’identité des tumeurs (CIT), Ligue nationale contre le cancer, 14, rue Corvisart, 75013Paris, France 2Centre de recherche en cancérologie de Marseille (CRCM), Inserm U1068, CNRS UMR 7258, Institut Paoli-Calmettes, Aix Marseille université, 163, avenue de Luminy, 13288Marseille, France MeSH keywords: Adénocarcinome, Animaux, Régulation de l'expression des gènes tumoraux, Génomique, Humains, Mutation, Tumeurs du pancréas, génétique, méthodes |
Les faux espoirs de la génomique de l’adénocarcinome pancréatique fondés sur les mutations génétiques Au cours des dernières décennies, l’analyse génétique détaillée des tumeurs a permis l’identification et la validation de gènes mutés et fréquemment dérégulés dans les tumeurs, indiquant une dépendance génétique de leur développement. Les données recueillies ont ainsi suggéré qu’il serait possible de tirer parti de ces mutations pour un ciblage thérapeutique lorsque des médicaments spécifiques étaient disponibles. Après une période très enthousiaste, il s’avère que ces cibles ne peuvent, en fait, être exploitées que chez un faible pourcentage de patients, soit parce que les médicaments pertinents ne sont pas disponibles, soit parce que les gènes mutés ne sont pas accessibles par des approches pharmacologiques. Les mutations de gènes observées dans les adénocarcinomes pancréatiques sont relativement conservées entre les tumeurs (KRAS, P53, SMAD4, CDKN2A, MLL3, TGFBR2, ARID1A et SF3B1)1, mais les gènes susceptibles d’être ciblés restent extrêmement rares. La majorité d’entre eux ne sont en effet pas associés à une activité enzymatique ou, lorsqu’elle existe, elle est souvent fondée sur une interaction protéine-protéine qui reste techniquement difficile à déstabiliser. |
L’adénocarcinome pancréatique, une maladie extrêmement hétérogène L’adénocarcinome pancréatique (AP) est l’une des affections malignes les plus meurtrières. Il est la cause d’environ 350 000 décès par an dans le monde [1]. Le pronostic de cette maladie est très mauvais avec environ seulement 5 % des patients ayant une survie supérieure à 5 ans après le diagnostic [1]. Les nombreux essais cliniques n’ont pas démontré de bénéfices significatifs en termes de survie, probablement parce que les populations de patients incluses dans ces études sont très hétérogènes. Cette hétérogénéité est illustrée par l’évolution clinique que présentent les patients, avec un temps de survie après le diagnostic variant de 2-3 mois à plus de 5 ans, ainsi qu’une forte différence de sensibilité aux traitements. Par exemple, on observe un taux de réponse objective de 31,6 % chez les patients traités par le folfirinox et de 9,4 % chez ceux traités par la gemcitabine, ce qui correspond respectivement à environ 70 % et 90 % de non-répondeurs à ces traitements [2, 3]. Cette hétérogénéité tumorale s’explique également par le fait que chaque AP est contrôlé par la combinaison de plusieurs voies intracellulaires différentes, ce qui entraîne une susceptibilité variable aux médicaments, au développement de métastases, et donc à la survie [4-6]. Par manque de connaissance de l’importance de cette hétérogénéité de réponses aux traitements, les protocoles cliniques de traitements des AP proposés jusqu’à présent ne la prennent pas en compte. Les médicaments sont choisis en fonction de l’état général du patient et du stade d’avancement de sa maladie. |
Stratification des tumeurs par des approches multi-omiques La stratification des tumeurs à l’aide de profils moléculaires à l’échelle du génome complet s’est révélée utile pour prédire les réponses thérapeutiques et l’évolution clinique de certaines maladies néoplasiques. Cependant, très peu d’études génomiques (l’étude de l’ensemble des mutations et remaniements/altérations de l’ADN) et transcriptomiques (l’étude de l’expression de l’ensemble des gènes) ont été réalisées sur l’AP. La cause principale de ce manque d’études est la difficulté d’obtention de séries fiables d’échantillons d’AP. Un obstacle majeur est la nécessité de disposer d’échantillons chirurgicaux, ce qui entraîne immédiatement l’exclusion de 85 % des patients dont les tumeurs ne sont pas résécables. Un deuxième écueil est la présence d’une proportion variable (entre 15 et 90 %) de cellules stromales non transformées qui infiltrent la tumeur, ce qui rend difficile l’analyse des processus spécifiques à la transformation [7] (→). (→) Voir la Nouvelle de C. Seiller et B. Dubois, m/s n° 10, octobre 2013, page 463 Enfin, le matériel biologique est restreint. Il ne permet pas d’entreprendre des analyses simultanées omiques et fonctionnelles. Il est donc impossible d’associer les caractéristiques moléculaires et fonctionnelles pour une même tumeur. Les xénogreffes dérivées des tumeurs de patients (PDTX) apparaissent de plus en plus comme une approche privilégiée pour des études précliniques. Les xénogreffes consistent à implanter un fragment de tumeur directement à un animal hôte, une souris immunodéprimée en général, sans passage préalable par des cultures cellulaires in vitro. Les PDTX montrent certains avantages sur les lignées cellulaires comme, par exemple, la préservation de l’organisation en 3 dimensions, conservant ainsi une morphologie et une hétérogénéité proches de la tumeur d’origine du patient. Une autre caractéristique importante des PDTX est qu’elles permettent, simultanément avec la caractérisation détaillée de la tumeur, des études in vivo grâce à des passages successifs chez la souris. Tout en présentant certaines limitations, en particulier celles dues à l’environnement hôte, les PDTX sont actuellement les modèles les plus proches de la maladie humaine. Un autre avantage exceptionnel des PDTX est la possibilité de les produire à partir d’un nombre très limité de cellules recueillies, par exemple au cours d’une biopsie écho-endoscopique, un examen qui est pratiqué chez tous les patients à des fins diagnostiques. Pour la première fois, une parfaite représentativité de toute la panoplie des AP existants a pu être obtenue et est ainsi disponible [8]. Nous avons développé et caractérisé, par des approches multi-omiques, une banque d’environ 200 PDTX pancréatiques qui nous a permis de tirer un certain nombre de conclusions, et d’identifier de nombreuses cibles thérapeutiques nouvelles (Figure 1).
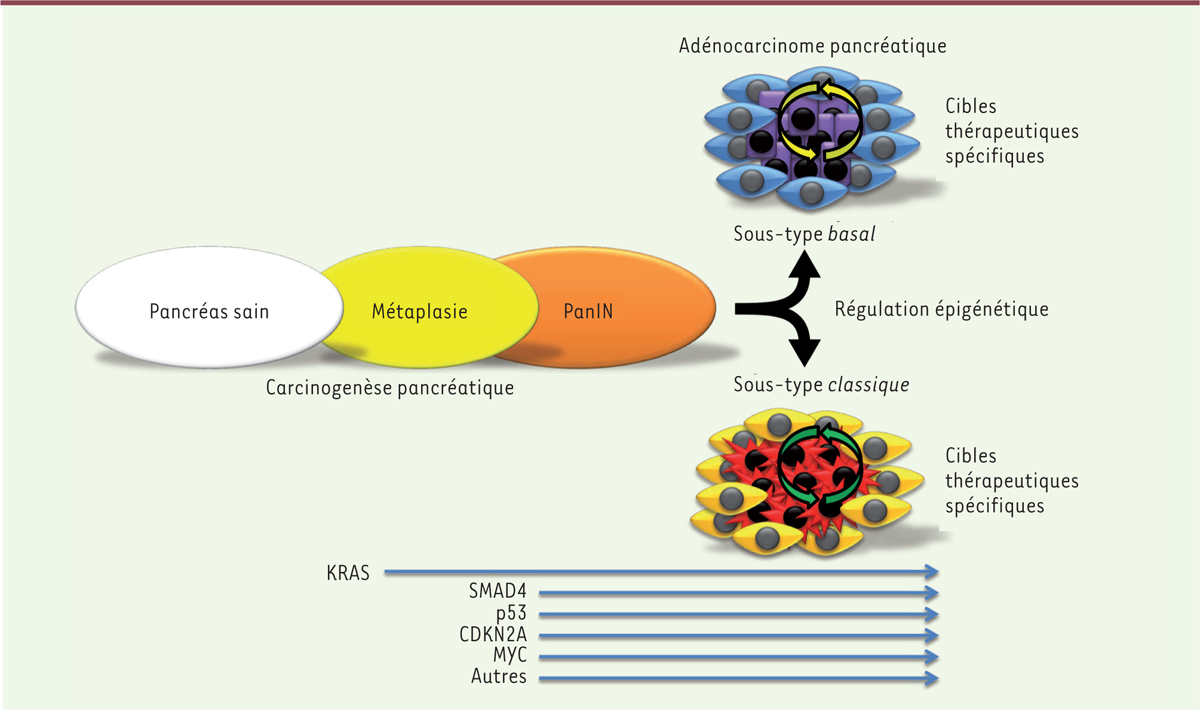
 | Figure 1.
Modèle de développement du cancer pancréatique. Le cancer pancréatique est une maladie qui progresse par étapes successives (métaplasie, PanIN [pancreatic intraepithelial neoplasia] et cancer) comme conséquence de la combinaison de certaines mutations génétiques successives. Deux sous-types principaux de cancer pancréatique (classique et basal) se développent. Les anomalies génétiques sont similaires entre ces deux sous-types, mais leur développement différentiel est régulé au niveau épigénétique (par les miARN [microARN] et lncARN [long non-coding ARN], et par méthylation de l’ADN, etc.). La composante stromale de chacun de ces deux sous-types est spécifique et un dialogue moléculaire unique entre les cellules cancéreuses et stromales s’établit. L’analyse multi-omique permet l’identification de cibles thérapeutiques spécifiques. Le modèle de xénogreffes dérivées des tumeurs de patients (PDTX) permet, à la fois, d’identifier les cibles et de les valider. Les PDTX représentent une source quasi-infinie de matériel vivant gardant les caractéristiques de la tumeur d’origine. KRAS : Kirsten rat sarcoma virus ; SMAD4 : mothers against decapentaplegic homolog 4 ; CDKN2A : cyclin-dependent kinase 2a/p16 ; MYC est un facteur de transcription. |
|
Les PDTX reproduisent l’hétérogénéité des AP L’une des principales spécificités d’une PDTX est la possibilité d’observer une infiltration des cellules cancéreuses humaines greffées par les cellules stromales murines hôtes. En différenciant les signaux provenant des deux espèces (homme et souris), il est ainsi possible d’étudier indépendamment les profils moléculaires des cellules cancéreuses et du stroma. L’analyse des profils moléculaires spécifiques des cellules cancéreuses, exemptes des signaux non néoplasiques, a permis de dévoiler pour la première fois une convergence entre les profils épigénétiques et transcriptomiques des cellules d’AP, à l’inverse des altérations génétiques qui n’ont pas pu être associées aux différents sous-types d’AP. Cette constatation est cruciale car elle révèle la notion d’une identité épigénétique des sous-types d’AP. Ainsi, les mutations, amplifications et délétions génétiques seraient les responsables du processus de transformation des AP, alors que la réponse aux traitements et le phénotype des tumeurs seraient très probablement contrôlés au niveau épigénétique. Cette constatation est d’une pertinence clinique exceptionnelle puisque les médicaments épigénétiques émergents pourront être utilisés pour cibler ces caractéristiques tumorales et les modifier. Ces données ouvrent par conséquent une voie prometteuse dans le traitement des patients présentant un AP. On peut imaginer qu’un traitement épigénétique approprié puisse transformer une tumeur d’évolution clinique très défavorable en un phénotype de meilleur pronostique, ou même qu’une tumeur résistante puisse devenir sensible à un médicament. Au-delà de la description des voies de signalisation altérées dans les AP par ces approches multi-omiques, la distinction entre l’expression génique des cellules cancéreuses humaines et celle des cellules stromales murines infiltrées permet une analyse précise du dialogue moléculaire qu’elles établissent. L’analyse de la diversité du stroma recruté par les cellules cancéreuses a révélé une convergence parfaite avec les sous-types d’AP, ce qui indiquerait que la composition et la fonction du microenvironnement tumoral seraient contrôlées par les cellules tumorales. |
La dissociation entre cellules cancéreuses et stroma, obtenue par traitement bio-informatique et fondée sur les profils transcriptomiques, offre la possibilité d’analyser finement les processus cellulaires de chaque sous-type et d’en déduire leurs interactions. Le sous-type basal, le plus agressif associé à une plus courte survie des patients, a révélé des dérégulations importantes dans les voies liées à l’oncogenèse, au cycle cellulaire et une plus forte activation de la glycolyse. Ce résultat conforte l’hypothèse selon laquelle la diversité des AP est régulée au niveau épigénétique et non génétique. L’analyse des voies stromales du sous-type basal a démontré que les gènes impliqués dans les adhérences focales et le guidage des axones sont surexprimés par le compartiment stromal. Cette observation sous-entend un type de communication spécifique entre les cellules cancéreuses et les fibroblastes adjacents. Enfin, la voie de signalisation WNT (wingless) est activée dans les cellules cancéreuses de manière autocrine, mais également paracrine, par la production de ligands WNT différents. La majorité des gènes impliqués dans ces voies sont également associés à un profil de méthylation de l’ADN et à une dérégulation des miARN (microARN) qui les contrôlent. |
AP de sous-type classiqueL’analyse de l’expression des gènes dans le sous-type classique a révélé l’activation de nombreuses voies. La majorité de ces voies sont liées à la fonction digestive pancréatique (la digestion des graisses et des protéines, les sécrétions pancréatique et biliaire), au métabolisme (l’absorption des graisses et des protéines, le transport de petites molécules), ou aux métabolites (le glucose, le fructose, le mannose, l’arginine, la proline, et les acides linoléique et arachidonique). Les cellules cancéreuses classiques acquièrent donc des fonctions cellulaires habituellement imputées à d’autres tissus gastro-intestinaux. Elles conservent cependant certaines fonctions digestives pancréatiques. La pseudo-activité digestive de ces cellules a été particulièrement mise en évidence par l’analyse métabolomique2 qui démontre une diminution du taux des triacylglycérols associée à une augmentation de l’expression des lipases avec pour conséquence une dérégulation des acides gras [9] (→).
(→) Voir la Synthèse de V. Dormoy et T. Massfelde, m/s n° 5, mai 2017, page 463
Les tumeurs classiques présentent également une augmentation de la concentration de plusieurs glycérophospholipides, indiquant une importante dérégulation du métabolisme lipidique. Un grand nombre de transporteurs de petites molécules est surexprimé dans les tumeurs classiques comme, par exemple, ceux du glucose (SLC2A2 [solute carrier family 2 member 2]) et de la glutamine (SLC1A1). Les transporteurs de cholestérol sont également surexprimés, comme le régulateur de son absorption au niveau intestinal NPC1L1 (Niemann-pick C1-like 1) dont le gène est totalement hypométhylé. L’analyse du métabolome indique donc un niveau plus élevé d’esters de cholestérol dans les tumeurs classiques. L’analyse du compartiment stromal a révélé, en parallèle, une activation des gènes impliqués dans le métabolisme lipidique et la synthèse du cholestérol. Ces résultats illustrent le dialogue entre les deux compartiments, avec une forte synthèse stromale de cholestérol associée à une absorption aberrante par les cellules cancéreuses classiques. |
À la découverte de cibles thérapeutiques originales : NPC1L1 comme preuve de concept Comme remarqué précédemment, un avantage important des modèles PDTX est qu’ils sont une source perpétuelle de matière vivante, tout en conservant les caractéristiques biologiques originales des cellules transplantées. Chaque xénogreffe peut être, simultanément, analysée au niveau moléculaire et utilisée pour tester des hypothèses biologiques. Nous avons choisi comme preuve de concept, le transporteur du cholestérol NPC1L1, qui représente une cible thérapeutique originale pour le traitement de certains AP. Les tests précliniques ont démontré que l’inhibition de sa fonction, par action de son inhibiteur spécifique, l’ézétimib, avait un important effet sur la survie des cellules greffées, et réduisait très fortement la croissance tumorale. Nos données démontrent ainsi que le transporteur NPC1L1 représente une cible thérapeutique intéressante et prometteuse. La conclusion la plus importante de cette étude est que l’utilisation de l’approche multi-omique permet de révéler de nouvelles options thérapeutiques pour le traitement des patients ayant développé un AP. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2016 . CA Cancer J Clin. 2016; ; 66 : :7.–30. 2.
Burris HA, 3rd, Moore MJ, Andersen J, et al. Improvements in survival and clinical benefit with gemcitabine as first-line therapy for patients with advanced pancreas cancer: a randomized trial . J Clin Oncol. 1997; ; 15 : :2403.–2413. 3.
Conroy T, Desseigne F, Ychou M, et al. Folfirinox versus gemcitabine for metastatic pancreatic cancer . N Engl J Med. 2011; ; 364 : :1817.–1825. 4.
Costello E, Greenhalf W, Neoptolemos JP. New biomarkers and targets in pancreatic cancer and their application to treatment . Nat Rev Gastroenterol Hepatol. 2012; ; 9 : :435.–444. 5.
Iovanna J, Mallmann MC, Goncalves A, et al. Current knowledge on pancreatic cancer . Front Oncol. 2012; ; 2 : :6.. 6.
Vincent A, Herman J, Schulick R, et al. Pancreatic cancer . Lancet. 2011; ; 378 : :607.–620. 7.
Carolane Seiller C, Dubois B. Rôle protumoral des lymphocytes B dans le cancer du pancréas : vers de nouvelles pistes thérapeutiques . Med Sci (Paris). 2017;; 33 : :859.–62. 8.
Nicolle R, Blum Y, Marisa L, et al. Pancreatic adenocarcinoma therapeutic targets revealed by tumor-stroma cross-talk analyses in patient-derived xenografts . Cell Rep. 2017; ; 21 : :2458.–2470. 9.
Dormoy V, Massfelde T. La métabolomique au service de la médecine : l’exemple du carcinome rénal . Med Sci (Paris). 2013; ; 29 : :463.–468. |