| |
| Med Sci (Paris). 34(5): 386–388. doi: 10.1051/medsci/20183405005.Une voie dopaminergique descendante pour contrôler le mouvement Maxime Fougère1 and Dimitri Ryczko1,2* 1Département de pharmacologie-physiologie, faculté de médecine et des sciences de la santé, université de Sherbrooke, 3001, 12e Avenue Nord, J1H 5N4Sherbrooke, Québec, Canada 2Centre de recherche du centre hospitalier universitaire de Sherbrooke, J1H 5N4Sherbrooke, Québec, Canada MeSH keywords: Animaux, Neurones dopaminergiques, Humains, Locomotion, physiologie |
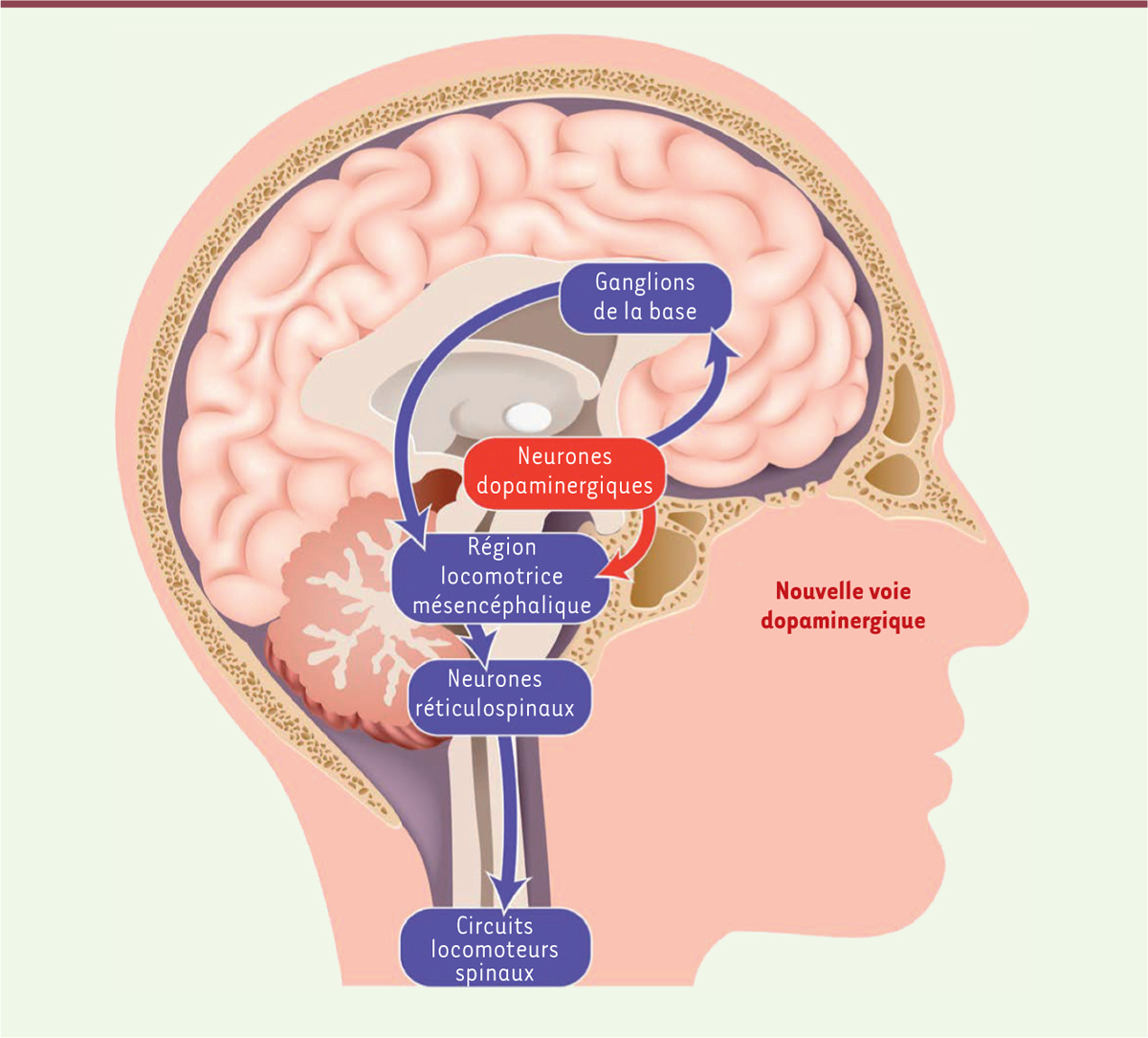
La locomotion est une activité quotidienne fondamentale. Elle se manifeste sous différentes formes comme la marche chez l’humain, la nage chez le poisson ou le vol chez l’oiseau. Chez les vertébrés, les neurones dopaminergiques méso-diencéphaliques sont connus pour jouer un rôle important dans la modulation de la locomotion. L’augmentation de la concentration de dopamine à la synapse par les psychostimulants ou la lévodopa1 entraîne une augmentation de l’activité locomotrice. À l’inverse, lorsque les neurones dopaminergiques meurent, comme dans la maladie de Parkinson, des déficits locomoteurs apparaissent. Traditionnellement, les effets locomoteurs de la dopamine sont associés aux projections ascendantes des neurones dopaminergiques de la substantia nigra pars compacta vers les ganglions de la base, un groupe de structures cérébrales impliquées dans la programmation du mouvement [1] (Figure 1). En retour, les ganglions de la base projettent vers la région locomotrice mésencéphalique (mesencephalic locomotor region, MLR) [2, 3], une région du tronc cérébral contrôlant la locomotion chez les vertébrés. La MLR envoie des projections vers les neurones réticulospinaux, qui relaient la commande locomotrice vers la moelle épinière (Figure 1). Découverte initialement chez le chat [2], la MLR a ensuite été identifiée chez les poissons, les amphibiens, les autres mammifères et les oiseaux [4]. Anatomiquement, la MLR correspond au noyau pédonculopontin et au noyau latérodorsal du tegmentum chez les vertébrés basaux2,. Chez le mammifère, elle comprend le noyau pédonculopontin et le noyau cunéiforme [4]. Chez l’humain, l’activité locomotrice est associée à une activation de la MLR, et des déficits locomoteurs apparaissent quand cette région est lésée [4]. Ainsi, dans les circuits nerveux que nous venons de décrire, le lien entre les neurones dopaminergiques et le circuit locomoteur est classiquement considéré comme indirect, puisqu’il implique un relai par les ganglions de la base.
 | Figure 1.
Schématisation des voies dopaminergiques impliquées dans le contrôle locomoteur. La voie dopaminergique descendante innerve la région locomotrice mésencéphalique, une région du tronc cérébral contrôlant les mouvements locomoteurs chez les vertébrés (image © istockphoto.com). |
|
Une voie dopaminergique descendante innerve la région locomotrice mésencéphalique Une série d’études récentes a montré qu’en plus de leurs projections ascendantes aux ganglions de la base, les neurones dopaminergiques envoient des projections descendantes directement à la MLR [5-8] (pour une revue voir [4]) (Figure 1). Une innervation dopaminergique de la MLR a tout d’abord été décrite chez le singe [9]. L’origine et le rôle de cette innervation étaient cependant inconnus. Des études réalisées chez différentes espèces ont permis de faire progresser ces questions importantes. Chez la lamproie (un poisson primitif) [5, 6, 8] et la salamandre [7], l’origine de la voie dopaminergique descendante est le tubercule postérieur. Cette région du diencéphale est considérée homologue à la substantia nigra pars compacta et/ou à l’aire tegmentale ventrale, car elle envoie des projections ascendantes aux ganglions de la base [4]. Chez le rat, l’innervation dopaminergique du noyau pédonculopontin (une partie de la MLR) est issue principalement de la substantia nigra pars compacta et, dans une moindre mesure, de la région rétrorubrale [7]. Finalement, l’innervation dopaminergique du noyau pédonculopontin est également conservée chez l’humain [7]. Au niveau comportemental, la voie dopaminergique descendante joue un rôle important dans le contrôle locomoteur chez les vertébrés basaux, et pourrait l’être chez les mammifères. Chez la lamproie et la salamandre, la stimulation de la région dopaminergique provoque dans la MLR une libération de dopamine, qui est précisément associée, dans le temps, à l’activation des neurones réticulospinaux responsables de relayer la commande locomotrice vers la moelle épinière [5, 7]. L’utilisation d’une préparation semi-intacte de lamproie dans laquelle le cerveau est exposé tandis que l’animal nage, a permis de montrer que la dopamine libérée dans la MLR augmente la fréquence des mouvements locomoteurs à travers l’activation des récepteurs D1 [5]. Chez le rat, la stimulation de la substantia nigra pars compacta entraîne une libération de dopamine dans le noyau pédonculopontin in vivo, qui est augmentée par l’injection intrapéritonéale d’amphétamine qui bloque la recapture de dopamine à la synapse [7]. Cette observation suggère que la voie descendante dopaminergique pourrait être impliquée dans les effets locomoteurs induits par des psychostimulants ou un traitement par la lévodopa. La dopamine n’agit pas seule dans la MLR, mais, en synergie avec le glutamate, elle contrôle le niveau d’activation de la MLR [8, 10] (→). (→) Voir la Synthèse de M. Thibault et al., m/s n° 2, février 2010, page 165 Chez la lamproie, la région dopaminergique contient également des neurones glutamatergiques qui envoient des projections descendantes directes vers la MLR, en parallèle avec les projections dopaminergiques [8]. Il existe probablement une interaction très proche entre ces deux neurotransmetteurs, car certains neurones projetant à la MLR contiennent à la fois de la dopamine et du glutamate [8]. La stimulation progressive de la région comprenant ces deux types de neurones entraîne graduellement une activation de la MLR et une augmentation de la vitesse des mouvements locomoteurs chez la lamproie [8]. La composante glutamatergique contribue à l’activation graduelle des mouvements locomoteurs, alors que la composante dopaminergique amplifie la composante glutamatergique par l’activation des récepteurs D1 [5, 8]. Au niveau comportemental, cette interaction entre le glutamate et la dopamine permettrait probablement de réguler le niveau d’activation des cellules de la MLR à la manière d’un gradateur, et ainsi d’ajuster finement la vitesse locomotrice dans le cadre de comportements d’approche d’une proie ou d’évitement d’un prédateur [8]. |
La voie dopaminergique descendante innervant le tronc cérébral constitue ainsi un substrat additionnel modulant le contrôle du mouvement. La dopamine est donc capable de moduler en parallèle plusieurs régions motrices, des ganglions de la base au tronc cérébral. Ces résultats pourraient avoir des implications dans notre compréhension du rôle de la dopamine dans le contrôle moteur en conditions pathologiques. Il est établi avec certitude que les neurones dopaminergiques dégénèrent dans la maladie de Parkinson, ce qui conduit à une perte de la voie dopaminergique ascendante vers les ganglions de la base. Toutefois, la voie descendante que nous décrivons ici est probablement également déficiente. De manière intéressante, l’innervation dopaminergique de la MLR est fortement diminuée chez le singe traité au 1-méthyl-4-phényl-1,2,3,6-tétrahydropyridine (MPTP), un modèle animal de la maladie de Parkinson [9]. La dégénérescence de la voie descendante dopaminergique pourrait causer une perte d’amplification des commandes locomotrices, et ainsi participer, au moins en partie, aux déficits locomoteurs rapportés dans cette pathologie. De plus, l’innervation dopaminergique du tronc cérébral pourrait contribuer à réguler d’autres fonctions motrices. Chez la lamproie, on sait, depuis peu, que des projections descendantes dopaminergiques influencent la détection d’une cible dans le champ visuel à travers l’innervation du tectum optique, une région du tronc cérébral contrôlant le mouvement des yeux et considérée homologue au colliculus supérieur chez le mammifère [11]. Si cette innervation est elle aussi conservée, les mouvements anormaux des yeux décrits chez les patients parkinsoniens pourraient mettre en jeu une dégénérescence de l’innervation dopaminergique du tronc cérébral. Globalement ces études soulignent l’importance de mieux appréhender le rôle de l’innervation dopaminergique du tronc cérébral chez le mammifère. Les recherches futures viseront à décrypter les mécanismes impliqués dans ce contrôle descendant, ce qui pourrait permettre d’identifier de nouvelles stratégies pour améliorer la fonction motrice en conditions pathologiques. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Carlsson A. The occurrence, distribution and physiological role of catecholamines in the nervous system . Pharmacol Rev. 1959; ; 11 : :490.–493. 2.
Shik ML, Severin FV, Orlovskii GN. Control of walking and running by means of electric stimulation of the midbrain . Biofizika. 1966; ; 11 : :659.–666. 3.
Roseberry TK, Lee AM, Lalive AL, et al. Cell-type-specific control of brainstem locomotor circuits by basal ganglia . Cell. 2016; ; 164 : :526.–537. 4.
Ryczko D, Dubuc R. Dopamine and the brainstem locomotor networks: from lamprey to human . Front Neurosci. 2017; ; 11 : :295.. 5.
Ryczko D, Grätsch S, Auclair F, et al. Forebrain dopamine neurons project down to a brainstem region controlling locomotion . Proc Natl Acad Sci USA. 2013; ; 110 : :E3235.–E3242. 6.
Pérez-Fernández J, Stephenson-Jones M, Suryanarayana SM, et al. Evolutionarily conserved organization of the dopaminergic system in lamprey: SNc/VTA afferent and efferent connectivity and D2 receptor expression . J Comp Neurol. 2014; ; 522 : :3775.–3794. 7.
Ryczko D, Cone JJ, Alpert MH, et al. A descending dopamine pathway conserved from basal vertebrates to mammals . Proc Natl Acad Sci USA. 2016; ; 113 : :E2240.–E2249. 8.
Ryczko D, Grätsch S, Schläger L, et al. Nigral glutamatergic neurons control the speed of locomotion . J Neurosci. 2017; ; 37 : :9759.–9770. 9.
Rolland AS, Tandé D, Herrero MT, et al. Evidence for a dopaminergic innervation of the pedunculopontine nucleus in monkeys, and its drastic reduction after MPTP intoxication . J Neurochem. 2009; ; 110 : :1321.–1329. 10.
Thibault D, Kortleven C, Fasano C, et al. Découvertes récentes sur la fonction et la plasticité des voies dopaminergiques du cerveau . Med Sci (Paris). 2010; ; 26 : :165.–170. 11.
Pérez-Fernández J, Kardamakis AA, Suzuki DG, et al. Direct Dopaminergic Projections from the SNc Modulate Visuomotor Transformation in the Lamprey Tectum . Neuron. 2017; ; 96 : :910.–924. |