| |
| Med Sci (Paris). 34(5): 401–403. doi: 10.1051/medsci/20183405010.Utiliser le système CRISPR/Cas9 SAM (synergic activation mediator) pour identifier des facteurs de restriction antiviraux par criblage génomique Blanche Dekeyzer,1 Marie Hoareau,1 and Gabriel Laghlali1 1École normale supérieure de Lyon, département de biologie, Master biologie, Lyon, France MeSH keywords: Animaux, Antiviraux, Systèmes CRISPR-Cas, Dépistage génétique, Humains, Maladies virales, pharmacologie, génétique, méthodes, immunologie |
Criblage transcriptionnel grâce à CRISPR/Cas9 SAM Un facteur de restriction est une protéine cellulaire qui, en interférant avec le cycle réplicatif d’un virus donné ou d’un ensemble de virus, confère aux cellules qui l’expriment la capacité de résister à l’infection. Dans le but d’identifier de nouveaux facteurs de restriction, Heaton et al. [
1] ont développé une approche de crible génomique visant à identifier les gènes dont la surexpression offre aux cellules cibles une résistance à l’infection. Pour cela, les auteurs ont utilisé le système CRISPR/Cas9 SAM (synergic activation mediator). Cet outil génétique, dérivé du système CRISPR/Cas9 bactérien, permet en fait d’activer la transcription d’un gène donné en ciblant sa région promotrice à l’aide d’un petit ARN guide [
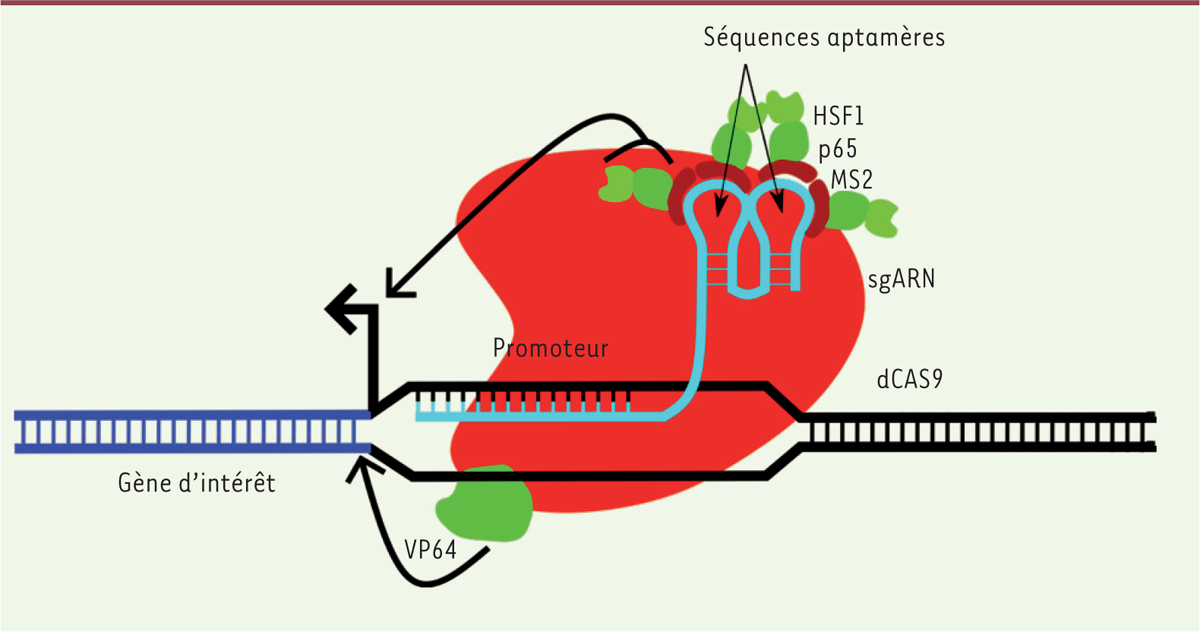
2]. Il est composé de l’activateur transcriptionnel VP641 fusionné à Cas9 (dont l’activité nucléase a été supprimée), ainsi que d’une deuxième protéine de fusion regroupant les domaines d’activation transcriptionnelle des protéines p65 et HSF1 (Heat shock factor 1) ainsi qu’un domaine d’adressage issu de la protéine MS2 (protéine d’enveloppe du bactériophage MS2). Outre sa fonction naturelle de recrutement de Cas9, l’ARN guide est modifié de sorte à posséder une séquence aptamère capable de lier MS2. Le système permet donc l’adressage, via l’ARN guide modifié, de VP64, p65 et HSF1 au promoteur du gène cible, et permet ainsi l’activation synergique de la transcription de ce gène (
Figure 1
).
 | Figure 1.
CRISPR/Cas9 SAM, un puissant activateur transcriptionnel. La protéine Cas9 désactivée (dCAS9, en rouge) est fusionnée à VP64 (en vert), un activateur transcriptionnel, et lie l’ARN guide (sgARN, en bleu turquoise) composé de la séquence complémentaire à la région ciblée sur l’ADN ainsi que d’une partie aptamérique permettant l’association avec un complexe d’activation supplémentaire. Ce complexe est composé des domaines d’activation des protéines p65 et HSF1 (en vert) ainsi que de la protéine MS2 (en rouge sombre), qui reconnaît l’aptamère. Ce système permet une triple activation de la transcription du gène cible grâce à l’action synergique de VP64, p65 et HSF1. |
Dans cette étude « preuve de concept », les auteurs ont recherché des facteurs de restriction spécifiques du virus de la grippe, ou virus Influenza. Le genre Influenzavirus A (IVA) regroupe les sous-types viraux d’origine aviaire, bien qu’ils puissent infecter de nombreuses autres espèces dont l’homme. Les virus du genre IVA représentent une menace importante pour la santé humaine dans la mesure où des recombinaisons entre souches hautement virulentes et d’autres facilement transmissibles à l’homme sont possibles. En effet, ces virus au génome segmenté peuvent facilement recombiner, notamment chez le porc, qui est sensible à un grand nombre de souches et offre donc un milieu propice à leur recombinaison. |
Identification d’une glycosyltransférase comme facteur de restriction à l’infection par le virus Influenzavirus A
Dans l’expérience de Heaton et al., les auteurs cherchent des gènes qui, lorsqu’ils sont surexprimés, apportent une résistance à l’infection par le virus IVA. Pour cela, ils ont ciblé les régions promotrices du génome entier à l’aide d’une bibliothèque d’ARN guides, dans des cellules naturellement sensibles au virus (cellules épithéliales pulmonaires humaines) et exprimant le système CRISPR/Cas9 SAM. Ces cellules ont préalablement été modifiées pour contenir le gène d’une protéine fluorescente, dont l’expression dépend de l’excision d’un codon stop par une recombinase Cre. En infectant ces cellules par un virus IVA modifié permettant l’expression de Cre, il est ainsi possible de distinguer les cellules infectées, qui expriment la protéine fluorescente, des cellules non infectées, qui n’expriment pas la protéine fluorescente. Les auteurs ont alors isolé les cellules qui n’avaient pas été infectées par le virus, c’est-à-dire qui avaient acquis une résistance à l’infection en réponse à la surexpression d’un gène par CRISPR/Cas9 SAM. Les ARN guides ayant conféré la résistance à ces cellules ont été séquencés pour identifier les gènes ainsi ciblés. Le gène codant B4GALNT2 (beta-1,4 N-acetylgalactosaminyltransferase 2) s’est avéré être le meilleur résultat du crible, suggérant que la protéine B4GALNT2 pourrait être un facteur de restriction contre le virus de la grippe. B4GALNT2 est une glycosyltransférase dont l’activité enzymatique permet, entre autres, le transfert d’un groupement GalNac (N-acétylgalactosamine) sur le résidu galactose des sucres qui possèdent une liaison acide sialique-galactose terminale. Sachant que le virus de la grippe utilise les acides sialyloligosaccharidiques (acide sialique lié à un galactose) membranaires comme récepteurs pour entrer dans ses cellules cibles, on peut dès lors imaginer que B4GALNT2 serait capable de modifier ces récepteurs, ce qui affecterait leur reconnaissance par le virus. Afin de confirmer cette hypothèse, les auteurs ont d’abord vérifié l’implication de l’activité glycosyltransférase de B4GALNT2 dans la résistance à l’infection par IVA, en utilisant une lignée de cellules exprimant une B4GALNT2 mutée au niveau de son site actif. Les cellules surexprimant la version mutée de B4GALNT2 n’ont pas montré de résistance particulière à l’infection par rapport aux cellules non modifiées, indiquant que l’activité glycosyltransférase est nécessaire à la fonction antivirale de cette protéine. L’attachement du virus à la surface des cellules cibles a ensuite été testé dans des cellules surexprimant B4GALNT2, à l’aide de particules virales marquées par fluorescence. Les résultats ont montré que la surexpression de B4GALNT2 entraînait effectivement un défaut de liaison du virus à la surface cellulaire, les étapes suivantes du processus d’infection étant, elles, similaires avec ou sans surexpression de l’enzyme. Pour caractériser les bases moléculaires de la modification de l’attachement viral par B4GALNT2, une analyse par spectrométrie de masse des glycanes cellulaires a été mise en œuvre et a permis d’identifier un type de N-glycanes présent spécifiquement dans les cellules surexprimant B4GALNT2. Des analyses plus détaillées de la composition des sucres à la surface cellulaire et des liens entre résidus glucidiques ont révélé que B4GALNT2 ajoutait bien un GalNac sur les résidus galactose liés aux acides sialiques, activité déjà connue de l’enzyme. Aucune autre modification n’a été mise en évidence. L’ajout d’un GalNac au galactose sur lequel est lié l’acide sialique utilisé par le virus semble donc suffisant pour bloquer l’interaction par encombrement stérique du site de reconnaissance. |
Bases moléculaires du tropisme des virus aviaires et humains Il est intéressant de noter que le tropisme d’hôte (humain ou aviaire) des différentes souches de virus de la grippe est principalement dû à la préférence du virus pour un type donné de branchement de l’acide sialique sur le galactose au niveau du récepteur cellulaire. Ainsi, les souches aviaires utilisent préférentiellement l’acide sialique couplé au galactose en position 2-3 (liaison dite en α2,3), tandis que les souches humaines reconnaissent plus facilement l’acide sialique couplé au galactose en position 2-6 (liaisons en α2,6). Différents essais visant à déterminer la capacité de B4GALNT2 à modifier ces deux types de sucres ont montré que seuls les galactoses branchés en α2,3 étaient ciblés par l’enzyme. La souche virale qui avait été utilisée pour les expériences précédentes (H1N1 strain A/Puerto Rico 8/1934) est une souche humaine, mais dont le passage répété sur des embryons de poulet a permis l’acquisition d’une préférence pour les récepteurs de type aviaire (liaison en α2,3). L’efficacité de B4GALNT2 comme facteur de restriction a donc par la suite été testée pour d’autres souches aviaires de la grippe, à fort potentiel pathogène chez les oiseaux et chez l’homme. Conformément à ce que l’on pouvait attendre, les différentes souches aviaires testées ont toutes vu leur pouvoir infectieux réduit dans les cellules surexprimant B4GALNT2, confirmant le rôle de facteur de restriction de cette enzyme contre les souches aviaires du virus de la grippe. |
Le système CRISPR/Cas9 SAM : un outil précieux dans la lutte antivirale Tandis que la plupart des cribles réalisés jusqu’à aujourd’hui s’étaient concentrés sur l’identification des facteurs nécessaires à l’infection par le virus de la grippe, cette étude démontre pour la première fois la faisabilité d’un crible visant à identifier les facteurs dont l’activité inhibe l’infection. Ces deux approches sont complémentaires et permettront de mieux appréhender les interactions complexes qui s’établissent entre le virus et son hôte au cours de l’infection. Le système CRISPR/Cas9 SAM prouve donc son efficacité pour l’identification de facteurs de restriction antiviraux. Le facteur de restriction B4GALNT2 décrit dans cette étude est spécifique aux virus aviaires, qui peuvent cependant constituer une menace pour l’homme. On peut facilement supposer que d’autres facteurs de restriction spécifiques aux virus humains existent, qu’il serait également intéressant d’identifier. Le développement de l’utilisation du système CRISPR/Cas9 SAM devrait être d’une grande utilité dans la recherche d’autres protéines cellulaires à action antivirale, que ce soit contre le virus de la grippe ou contre d’autres virus. Il est également important de souligner que l’outil CRISPR/Cas9 SAM peut être exploité à d’autres fins en virologie, notamment de thérapie anti-infectieuse. Par exemple, dans le cadre de l’infection par le virus de l’immunodéficience humaine (VIH), la persistance de provirus latents dans les cellules infectées est l’une des failles les plus importantes des thérapies actuelles. Le système CRISPR/Cas9 SAM pourrait être adapté pour cibler les régions activatrices des provirus latents [
3], ce qui pourrait permettre de réactiver le virus dans ses réservoirs cellulaires et d’éliminer ensuite les cellules exprimant le virus. La réactivation ciblée de ces provirus par CRISPR/Cas9 SAM pourrait ainsi s’avérer être une stratégie efficace pour l’élimination des réservoirs de l’infection. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Heaton
BE
,
Kennedy
EM
,
Dumm
RE
, et al.
A CRISPR activation screen indentifies a pan-avian influenza virus inhibitory host factor . Cell Rep.
2017; ; 20 : :1503.–1512. 2.
Konermann
S
,
Brigham
MD
,
Trevino
AE
, et al.
Genome-scale transcriptional activation by an engineered CRISPR-Cas9 complex . Nature.
2015; ; 517 : :583.–588. 3.
Zhang
Y
,
Yin
C
,
Zhang
T
, et al.
CRISPR/gRNA-directed synergistic activation mediator (SAM) induces specific, persistent and robust reactivation of the HIV-1 latent reservoirs . Sci Rep.
2015; ; 5 : :16277.. |