| |
| Med Sci (Paris). 34(6-7): 501–504. doi: 10.1051/medsci/20183406002.L’inhibition du récepteur de l’EGF sur les cellules immunitaires réduit l’athérosclérose expérimentale Lynda Zeboudj,1 Pierre-Louis Tharaux,1 and Hafid Ait-Oufella1,2* 1Inserm U970, centre de recherches cardiovasculaires de Paris, université René Descartes, Paris 5, 75005Paris, France 2Service de réanimation médicale, hôpital Saint-Antoine, AP-HP, université Pierre-et-Marie Curie, Paris 6, 56, rue Leblanc, 75015Paris, France MeSH keywords: Animaux, Athérosclérose, Récepteurs ErbB, Humains, Leucocytes, Inhibiteurs de protéines kinases, traitement médicamenteux, immunologie, métabolisme, antagonistes et inhibiteurs, pharmacologie |
Les maladies cardiovasculaires Épidémiologie Les maladies cardiovasculaires, incluant l’infarctus du myocarde et les accidents vasculaires cérébraux, représentent un problème de santé publique majeur avec plus de 17 millions de décès en 2015, soit un tiers de la mortalité mondiale totale. Les projections épidémiologiques à l’horizon 2030 sont encore plus alarmantes avec 23 millions de décès estimés [ 1], et ce malgré l’amélioration des stratégies de prévention et de traitement. Physiopathologie Les travaux réalisés chez l’animal et chez l’homme ont clairement montré que l’athérosclérose, la principale étiologie des maladies cardiovasculaires, est une maladie inflammatoire chronique des artères de gros et moyen calibres [ 2] ( →).
(→) Voir la Synthèse de M. Hamze et al., m/s n° 10, octobre 2014, page 874
Les différentes étapes de l’athérogenèse comprennent la rétention et l’oxydation des lipoprotéines dans l’espace sous-endothélial, l’activation des cellules endothéliales et le recrutement des monocytes circulants dans la paroi vasculaire. Au niveau de l’intima, la tunique interne du vaisseau sanguin, les monocytes se différencient en macrophages tissulaires sous l’effet du facteur de croissance M-CSF (macrophage colony-stimulating factor). Les macrophages jouent un rôle clé dans le développement de l’athérosclérose, du fait de leur accumulation locale, de leur transformation en cellules spumeuses, de leur capacité à amplifier la réponse immuno-inflammatoire en produisant des cytokines pro-inflammatoires comme l’IL(interleukine)-12 p70 et le TNF-α (tumor necrosis factor-alpha), ou en activant localement les lymphocytes T CD4+ de type Th1 (T helper type 1) [3]. Les macrophages participent également à la rupture des lésions d’athérosclérose (et aux thromboses artérielles consécutives) par de nombreux mécanismes : production de métalloprotéases matricielles, apoptose et formation de noyaux nécrotiques. Bien que les cellules de l’immunité innée jouent un rôle central dans la physiopathologie des maladies cardiovasculaires athéro-thrombotiques, nous ne disposons pas actuellement de traitement permettant de limiter spécifiquement leur pathogénicité. |
Le récepteur du facteur de croissance épidermique Généralités Le récepteur du facteur de croissance épidermique (EGF-R, epidermal growth factor-receptor) est un récepteur transmembranaire à activité tyrosine kinase, appartenant à la famille Erb-B ( erythroblastic oncogene), qui comporte 4 isoformes. L’activation de l’EGF-R, soit directement par ses ligands (comme l’HB-EGF [ heparin-binding EGF-like growth factor], le TGF-α [ transforming growth factor-α], l’amphiréguline), soit par transactivation, induit une transition conformationnelle avec une homo- ou un hétéro-dimérisation [ 4]. L’EGF-R est exprimé par de nombreuses tumeurs, mais également par les cellules inflammatoires et vasculaires. Il est impliqué dans la survie cellulaire, la migration, l’adhérence et la prolifération cellulaire. C’est pourquoi, des thérapies ciblant l’EGF-R (les anticorps bloquant ou les inhibiteurs de tyrosine kinases) ont été développées avec succès pour le traitement des cancers bronchiques et pancréatiques [ 5]. EGF-R et athérosclérose - Données préliminaires La stimulation de l’EGF-R participe au chimiotactisme des monocytes in vitro [ 6]. Lamb et ses collaborateurs ont détecté une expression d’EGF-R chez des lapins soumis à un régime gras à la fois sur les leucocytes circulants et sur les macrophages au sein des plaques d’athérosclérose [ 5]. Chez le primate, le régime riche en matières grasses induit une augmentation des taux plasmatiques d’HB-EGF, un des ligands de l’EGF-R, ainsi qu’une augmentation de la phosphorylation de l’EGF-R dans la paroi artérielle. Ces anomalies disparaissent en quelques mois après retour à un régime normal [ 7]. L’EGF-R ainsi que ses ligands sont également présents en grande quantité dans les plaques d’athérosclérose chez l’homme [ 8]. Les concentrations plasmatiques d’HB-EGF chez les patients coronariens sont plus élevées que celles de volontaires sains et elles sont corrélées à la cholestérolémie [ 9]. L’ensemble de ces données suggère que l’EGF-R est impliqué dans la physiopathologie de l’athérosclérose. Cependant son rôle exact dans l’activité des cellules inflammatoires n’est pas connu tout comme les mécanismes physiopathologiques pro-athérogènes qu’il régule. Modulation de l’EGF-R et athérosclérose Expression de l’EGF-RNous avons confirmé que l’EGF-R est exprimé dans les plaques d’athérosclérose de souris Ldlr-/-
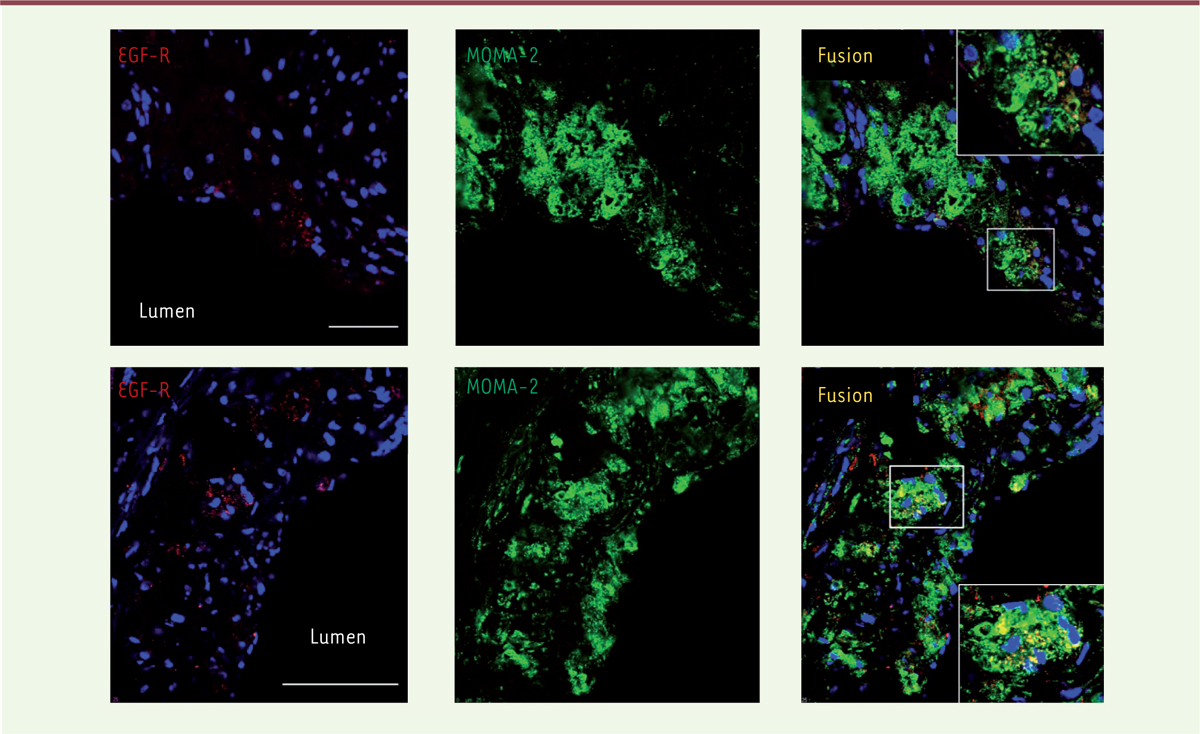
(déficientes en récepteur des lipoprotéines de basse densité) à un stade précoce de la maladie vasculaire (soit après 4 semaines de régime riche en matières grasses). L’EGF-R, et un marqueur spécifique des monocytes/macrophages (MOMA-2) et des lymphocytes T sont co-localisés par immunofluorescence (Figure 1) [10]. À un stade plus avancé de la maladie, l’expression de l’EGF-R dans les plaques d’athérosclérose est plus importante, préférentiellement localisée autour du noyau nécrotique, riche en débris apoptotiques et en cristaux de cholestérol [11].
 | Figure 1.
L’EGF-R est exprimé dans les plaques d’athérosclérose. Marquage par immunofluorescence révélant la présence du récepteur de l’EGF ( epidermal growth factor, EGF-R) (en rouge) dans les plaques d’athérosclérose de souris Ldlr-/- à un stade précoce (en haut) et un stade plus avancé (en bas) de l’athérosclérose. L’EGF-R est colocalisé (en jaune) avec les macrophages, repérés par un marqueur spécifique (MOMA+, en vert) (figure adaptée de [ 11]). |
Inhibition pharmacologique de l’EGF-R Afin d’évaluer le rôle de l’EGF-R dans l’athérogenèse, nous avons utilisé un inhibiteur pharmacologique spécifique de l’activité tyrosine kinase de l’EGF-R, l’Erlotinib. Nous avons montré que le traitement prolongé par voie orale par l’Erlotinib de souris déficientes en récepteur des lipoprotéines de basse densité (Ldlr-/-
) soumises à un régime riche en matières grasses réduit significativement le développement et la progression de l’athérosclérose au niveau du sinus aortique et le long de l’aorte thoraco-abdominale, sans effet sur la cholestérolémie [10]. Le traitement affecte la réponse immunitaire systémique et plus spécifiquement la réponse adaptative, dans la mesure où les lymphocytes T CD4+ spléniques des souris traitées par l’Erlotinib prolifèrent moins ex vivo et produisent moins de cytokines, comme l’IL-2 (interleukine-2), l’IL-4 et l’IFN-γ (interféron-γ). In vitro, l’incubation de lymphocytes T CD4+ de souris avec un inhibiteur pharmacologique spécifique de l’activité tyrosine kinase de l’EGF-R réduit la prolifération cellulaire et la production de cytokines de façon dose-dépendante sans induire d’apoptose. Ces données ont été confirmées sur des lymphocytes T humains [10]. Délétion spécifique de l’EGF-R dans les lymphocytes T CD4+ En utilisant un système Cre-Lox1,, nous avons généré une lignée de souris ayant une délétion spécifique du gène codant l’EGF-R dans les lymphocytes T CD4+ (Cd4Cre+ Egf-rlox/lox). Pour étudier les conséquences de cette déficience sur l’athérosclérose, nous avons utilisé un modèle chimère. Des souris Ldlr-/-
ont été irradiées puis transplantées avec une moelle isolée de souris Cd4Cre+Egf-rlox/lox
2, ou de souris contrôles Cd4Cre+Egf-r+/+
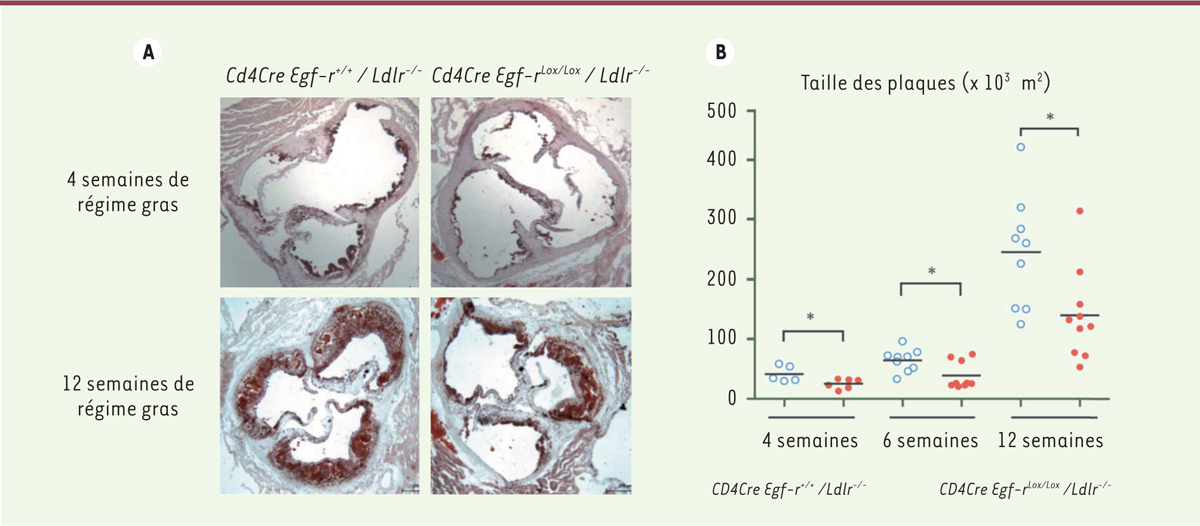
. La déficience spécifique en EGF-R sur les lymphocytes T CD4+ réduit leur activation (évaluée par l’expression de CD69 et de CD44high), leur prolifération in vivo et ex vivo, la production de cytokines pro-athérogènes comme l’IFN-γ et leur capacité migratoire dans les lésions vasculaires. Finalement, nous avons montré que la déficience spécifique en EGF-R sur les lymphocytes T CD4+ réduit le développement de l’athérosclérose à différents temps (4, 6 et 12 semaines de régime riche en matières grasses) sans affecter la cholestérolémie (Figure 2) [10].
 | Figure 2.
La déficience en EGF-R spécifiquement sur les lymphocytes T CD4+ réduit l’athérosclérose. Des souris Ldlr-/- ont été irradiées et transplantées avec des cellules de moelle osseuse isolées de souris contrôles Cd4Cre Egf-r+/+ ou de souris Cd4Cre Egf-rlox/lox déficientes en EGF-R (récepteur de l’EGF [ epidermal growth factor]) spécifiquement sur les lymphocytes T CD4 +. À différents temps d’un régime riche en matières grasses, les plaques d’athérosclérose ont été colorées à l’huile rouge ( A) au niveau du sinus aortique et quantifiées ( B). *p < 0,05. Les souris Ldlr-/- sont déficientes en récepteur des lipoprotéines de basse densité. Les souris ( Cd4Cre+ Egf-rlox/lox) sont porteuses d’une délétion spécifique de l’EGF-R dans les lymphocytes T CD4 + (figure adaptée de [ 11]). |
Délétion spécifique de l’EGF-R dans les cellules myéloïdes Pour étudier spécifiquement le rôle de l’EGF-R exprimé par les monocytes/macrophages dans le contexte de l’athérosclérose, nous avons généré une lignée de souris LysMCre+Egf-rlox/lox
. La même approche expérimentale, que celle précédemment décrite, a été utilisée avec des souris Ldlr-/-
chimères irradiées et transplantées avec la moelle de souris LysMCre+Egf-rlox/lox
ou de souris contrôle LysMCre-Egf-rlox/lox
. L’invalidation de l’EGF-R sur les cellules myéloïdes induit une réduction de la taille des lésions d’athérosclérose de l’ordre de 43 % après 4 semaines de régime riche en matière grasses, sans modifier la cholestérolémie. La réduction de la taille des plaques a également été observée à des stades plus avancés de la maladie vasculaire (après 7 et 12 semaines de régime riche en matières grasses) [11]. Les mécanismes athéro-protecteurs liés à l’invalidation de l’EGF-R sur les cellules myéloïdes sont probablement multiples : tout d’abord, en limitant le recrutement inflammatoire dans la paroi artérielle dans la mesure où dans les plaques des souris chimères Ldlr-/-/LysMCre+Egf-rlox/lox
une diminution significative de l’infiltration macrophagique est observée ; ensuite, par un effet sur la réponse cytokinique puisque la délétion en EGF-R s’accompagne d’une réduction significative de la production macrophagique ex vivo de TNF-α et d’IL-6, deux médiateurs pro-athérogènes ; enfin, un autre mécanisme qui pourrait expliquer la réduction des plaques d’athérosclérose chez la souris chimère Ldlr-/-/LysMCre+Egf+-rlox/lox
concerne le métabolisme des lipides. En effet, nous avons montré que les macrophages déficients en EGF-R (ou traités avec un inhibiteur spécifique de son activité tyrosine kinase) ont une capacité réduite d’endocytose des lipides oxydés. Parmi les récepteurs scavengers (éboueurs) impliqués dans ce processus, seul CD363, est diminué en l’absence d’EGF-R aux niveaux transcriptionnel et protéique (quantifiée par cytométrie en flux et western-blot). Dans les plaques d’athérosclérose des souris chimères l’expression du CD36 est également diminuée dans le groupe déficient en EGF-R sur les cellules myéloïdes, corroborant les résultats obtenus in vitro [11]. |
L’EGF-R est exprimé par les cellules myéloïdes et les lymphocytes T. Son inhibition pharmacologique ou sa déficience génétique dans des modèles murins diminue l’activité pro-inflammatoire et pro-athérogène des macrophages, induit une anergie lymphocytaire T et in fine réduit le développement et la progression de l’athérosclérose expérimentale. Ces résultats sont rassurants sur le plan cardiovasculaire concernant l’utilisation des inhibiteurs de l’EGF-R chez les patients atteints de cancer et suggèrent même que ces molécules pourraient être utilisées comme traitement immunomodulateur des maladies cardiovasculaires. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Beaglehole R, Bonita R. Global public health: a scorecard . Lancet. 2008; ; 372 : :1988.–1996. 2.
Hamze M, Desmetz C, Guglielmi P. Les lymplocytes B : une cible prometteuse pour traiter l’arthérosclérose ? . Med Sci (Paris). 2014; ; 30 : :874.–881. 3.
Hansson GK. Inflammation, atherosclerosis, and coronary artery disease . N Engl J Med. 2005; ; 352 : :1685.–1695. 4.
Avraham R, Yarden Y. Feedback regulation of EGFR signalling: decision making by early and delayed loops . Nat Rev Mol Cell Biol. 2011; ; 12 : :104.–117. 5.
Gschwind A, Fischer OM, Ullrich A. The discovery of receptor tyrosine kinases: targets for cancer therapy . Nat Rev Cancer. 2004; ; 4 : :361.–370. 6.
Lamb DJ, Modjtahedi H, Plant NJ, Ferns GA. EGF mediates monocyte chemotaxis and macrophage proliferation and EGF receptor is expressed in atherosclerotic plaques . Atherosclerosis. 2004; ; 176 : :21.–26. 7.
Stanic B, Pandey D, Fulton DJ, Miller FJ, Jr. Increased epidermal growth factor-like ligands are associated with elevated vascular nicotinamide adenine dinucleotide phosphate oxidase in a primate model of atherosclerosis . Arterioscler Thromb Vasc Biol. 2012; ; 32 : :2452.–2460. 8.
Nakata A, Miyagawa J, Yamashita S, et al. Localization of heparin-binding epidermal growth factor-like growth factor in human coronary arteries. Possible roles of HB-EGF in the formation of coronary atherosclerosis . Circulation. 1996; ; 94 : :2778.–2786. 9.
Matsumoto S, Kishida K, Shimomura I, et al. Increased plasma HB-EGF associated with obesity and coronary artery disease . Biochem Biophys Res Commun. 2002; ; 292 : :781.–786. 10.
Zeboudj L, Maitre M, Guyonnet L, et al. Selective EGF-receptor inhibition in CD4+ T cells induces anergy and limits atherosclerosis . J Am Coll Cardiol. 2018; ; 71 : :160.–172. 11.
Zeboudj L, Giraud A, Guyonnet L, et al. Selective EGFR (epidermal growth factor receptor) deletion in myeloid cells limits atherosclerosis-Brief report . Arterioscler Thromb Vasc Biol. 2018; ; 38 : :114.–119. |