Dans les organismes multicellulaires, les cellules génèrent et subissent des forces mécaniques qui se propagent entre elles et en leur sein. Ces forces peuvent façonner les cellules, les tissus et les organes, et également déclencher des signaux biochimiques. Ce processus, appelé mécanotransduction, suppose que les forces mécaniques atteignent in fine des protéines qu’elles remodèlent tout comme elles déforment les objets à toutes autres échelles [1]. Les changements de conformation induits par les forces modifient les affinités des protéines, et donc leurs activités [2]. Les cascades de réactions biochimiques qui s’en suivent peuvent finalement conduire à des changements d’activité et de devenir des cellules.
Dans un épithélium simple, les cellules forment des feuilles en s’associant directement les unes aux autres par le biais de complexes d’adhérence intercellulaires, tels que les jonctions adhérentes [3]. L’E-cadhérine, le composant central de la jonction adhérente, est une protéine transmembranaire dont la partie cytoplasmique assure un couplage mécanique entre la membrane plasmique et le cytosquelette cortical [4], lequel lui applique une tension sensible aux signaux intra- et extracellulaires [5] (Figure 1). Les événements biochimiques en aval de ces changements de tension n’étaient cependant pas décrits.
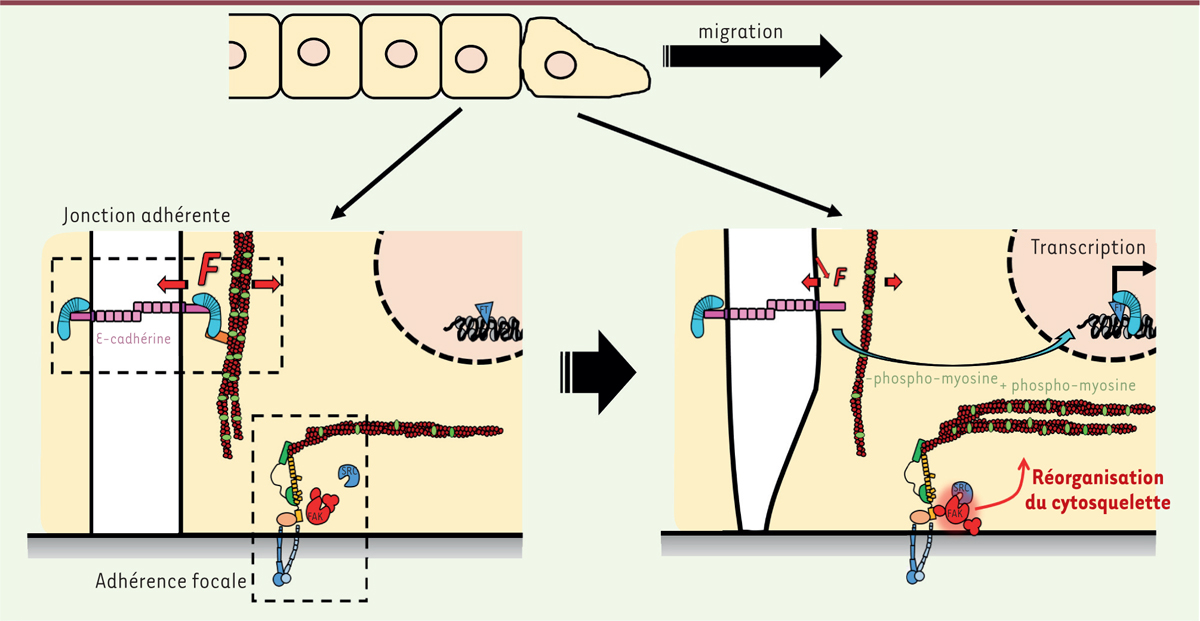
| Figure 1.
Induction mécanique de la transcription dépendante de la β-caténine et impliquant la tension de l’E-cadhérine en réponse au remodelage du cytosquelette induit par l’activation de FAK (focal adhesion kinase). Haut : une couche de cellules epitheliales dont les cellules peripheriques ont entame leur migration. Bas gauche : cellules a l’arriere du front de migration dans lesquelles l’E-cadherine est sous tension et retient la β-catenine a la membrane. Bas droite : dans les cellules peripheriques en migration, l’activation de FAK sous l’effet du de-confinement cellulaire et grace a l’activite de Src (Rous sarcoma oncogene) provoque la reorganisation du cytosquelette. Celle-ci se manifeste par la formation a partir des adherences focales de fibres de stress enrichies en phospho-myosine (representee en vert). La relaxation du cytosquelette cortical qui en resulte provoque la relaxation de la tension de l’E-cadherine et la liberation de la β-catenine vers le noyau ou elle active la transcription. |
Une interaction directe entre le domaine cytoplasmique de l’E-cadhérine et la β-caténine est nécessaire pour ancrer les jonctions adhérentes au cytosquelette d’actine [6]. Dans le noyau, la β-caténine est également un cofacteur de transcription effecteur du morphogène Wnt. L’E-cadhérine est un régulateur de l’activité transcriptionnelle de la β-caténine, mais le mécanisme de cette modulation restait à découvrir. Il n’existait notamment aucune preuve que la β-caténine nucléaire était préalablement liée à l’E-cadhérine.
La localisation nucléaire et l’activité transcriptionnelle de la β-caténine étaient néanmoins connues pour être mécaniquement inductibles dans une variété de conditions physiologiques et pathologiques [7, 8] (→).
(→) Voir la Nouvelle de C. Kieffer et al., m/s n° 8-9, août-septembre 2016, page 713
Cette induction survient, en effet, au cours d’événements morphogénétiques partageant des caractéristiques de la transition épithélium-mésenchyme (TEM), les cellules acquérant un phénotype plus prolifératif et/ou migrateur. Le processus semblait impliquer la phosphorylation de la β-caténine sur un site cible de l’oncogène Src (rous sarcoma oncogene), in vitro, phosphorylation qui fait décroître l’affinité de la β-caténine pour l’E-cadhérine. Un modèle attractif postulait donc que l’induction mécanique de l’activité transcriptionnelle de la β-caténine résultait de cette phosphorylation. Les événements initiaux de cette mécanotransduction, et l’implication des changements de tension moléculaire de l’E-cadhérine demeuraient cependant inconnus.
Nous avons donc cherché à : (1) déterminer la relation entre la tension de l’E-cadhérine, la localisation de la β-caténine et son activité nucléaire ; (2) tester l’existence du transport de la β-caténine entre la membrane et le noyau ; et (3) caractériser les mécanismes sous-jacents dans des cellules migrant selon une TEM. Nous avons combiné, dans des cellules épithéliales vivantes en culture, l’imagerie de fluorescence de rapporteurs de localisation, d’activité, mais également de tension de l’E-cadhérine, de la β-caténine et de leurs régulateurs, en présence de perturbations génétiques et pharmacologiques [9].
En utilisant la microscopie de tension moléculaire [10], nous avons déterminé que la tension exercée sur l’E-cadhérine diminue de quelques pico-Newton dans les cellules en migration. Cette relaxation est associée à une accumulation nucléaire de la β-caténine et à son activité transcriptionnelle (Figure 1). Nous avons également montré que cette accumulation était la conséquence d’une libération substantielle de β-caténine de la membrane dans laquelle était localisée l’E-cadhérine, et ne pouvait s’expliquer par d’éventuelles différences de taux de dégradation ou de synthèse de β-caténine. La relaxation de la tension dans l’E-cadhérine pourrait ainsi être responsable de la libération de la β-caténine. Mais quels sont les mécanismes qui déterminent cette relaxation ?
Nous avons confirmé la nécessité d’une activité de Src pour la translocation de la β-caténine et donc pour son activité nucléaire, mais également pour la relaxation de l’E-cadhérine. Ces résultats révèlent donc que l’E-cadhérine se comporte comme un mécano-senseur de l’activité intracellulaire, qui agit en aval de Src plutôt qu’en combinaison.
En utilisant des mutants, nous avons par ailleurs montré que ni la β-caténine, ni l’E-cadhérine, ni d’autres protéines du complexe, ne sont les cibles de Src, responsables de la relaxation de la tension de l’E-cadhérine et de la translocation nucléaire de la β-caténine. Ces résultats contredisent le modèle initialement proposé. La libération de la β-caténine de l’E-cadhérine n’est donc pas la conséquence d’une moindre affinité entre les deux protéines induite par cette modification post-traductionnelle. Nous avons montré que la cible de la kinase Src est en réalité FAK (focal adhesion kinase), une kinase des adhérences focales, ces complexes focaux permettant aux cellules d’adhérer à la matrice extracellulaire et de migrer (Figure 1).
Ce n’est cependant pas l’augmentation de l’activité de Src dans les cellules en migration qui provoque l’activation de FAK et, en conséquence, la relaxation de l’E-cadhérine et la translocation nucléaire de la β-caténine. L’activité de Src est nécessaire, mais son niveau endogène n’est pas suffisant. L’activation de FAK nécessite, de plus, le dé-confinement cellulaire qu’accompagne la migration des cellules épithéliales. FAK se comporte donc comme un intégrateur de signaux biochimiques intracellulaires et de signaux mécaniques extracellulaires en amont de la tension mécanique de l’E-cadhérine. La sensibilité de FAK aux contraintes stériques provenant des cellules voisines résulte de sa capacité de s’auto-activer par autophosphorylation, éventuellement indépendamment de toute autre stimulation biochimique, et probablement sous l’effet d’une tension mécanique, comme le suggèrent des simulations numériques [11]. Comment une modification de l’activité d’une kinase des complexes d’adhérence à la matrice extracellulaire peut-elle perturber les forces mécaniques exercées sur des protéines d’adhérence entre cellules voisines ?
Nous avons montré que l’activation de FAK provoque un remodelage du cytosquelette qui se traduit par la formation de fibres de stress entre les adhérences focales. Celles-ci s’enrichissent en phospho-myosine, la forme active du moteur moléculaire, aux dépens du cytosquelette cortical voisin des jonctions adhérentes (Figure 1). À l’aide d’un mutant du gène codant l’E-cadhérine, nous avons enfin montré qu’une diminution de tension du cytosquelette cortical est suffisante pour la relaxation de l’E-cadhérine et ne requiert pas le détachement de la β-caténine. La dissociation de la β-caténine ne peut ainsi être la cause de la relaxation de l’E-cadhérine, mais l’inverse est possible.
Ces résultats sont cohérents avec un modèle selon lequel l’affinité entre les deux protéines augmente avec la tension mécanique appliquée sur leur lien, une propriété contre-intuitive, mais déjà observée pour d’autres interactions moléculaires [6]. Des expériences impliquant des molécules uniques in vitro permettront d’évaluer précisément ce point. Notre travail apporte néanmoins pour la première fois la preuve directe d’un processus de régulation mécanique impliquant l’E-cadhérine en amont de l’activité transcriptionnelle de la β-caténine. Nos résultats démontrent également que l’E-cadhérine agit plutôt comme un mécano-senseur de la mécanique intracellulaire, laquelle relaie l’information mécanique extracellulaire initialement perçue par des protéines des adhérences focales dont le fonctionnement reste à élucider (Figure 1).