| |
| Med Sci (Paris). 34(6-7): 512–515. doi: 10.1051/medsci/20183406006.Les facteurs du pore nucléaire : un collectif gagnant pour la translocation et l’intégration du VIH-1 François Berry,1 Pierre Khalfi,2 Florra Maillot,1 Paul Seigneres,2 Samy Sid Ahmed,2 and Francesca Di Nunzio3* 1Université Paris Diderot, 5, rue Thomas Mann, 75013Paris, France 2Sorbonne Université, 4, place Jussieu, 75005Paris, France 3Unité de virologie moléculaire et vaccinologie, Institut Pasteur, 28, rue du Docteur Roux, 75015Paris, France MeSH keywords: Génome viral, Infections à VIH, VIH-1 (Virus de l'Immunodéficience Humaine de type 1), Humains, Pore nucléaire, Intégration virale, virologie, pathogénicité |
Les virus à génome constitué d’ADN (Hepadnaviridae, Herpes, etc.), et certains virus à ARN (Orthomyxoviridae) doivent accéder au noyau de la cellule pour se répliquer, mais l’enveloppe nucléaire constitue une barrière protectrice. Les virus ont donc développé divers mécanismes permettant de contourner cette barrière afin de pouvoir accéder au noyau et à son contenu. Certains, comme les Retroviridae, ont même acquis la capacité d’intégrer leur génome viral au sein du génome de la cellule hôte, on parle alors de provirus. Dans cette nouvelle, nous détaillerons les découvertes récentes sur le rôle des complexes des pores nucléaires (nuclear pore complex [NPC]) dans les mécanismes de pénétration et de transcription du génome du virus de l’immunodéficience humaine de type 1 (VIH-1). Deux stratégies ont été développées par les Retroviridae afin de pénétrer dans le noyau. Certains rétrovirus, tels que le HTLV-1 (human T-lymphotropic virus-1), le RSV (rous sarcoma virus) ou le MLV (murine leukaemia virus), s’intègrent après la mitose de la cellule, profitant de la dissociation de l’enveloppe nucléaire au cours de la métaphase [1]. Ce mécanisme ne leur permet donc pas d’infecter des cellules quiescentes. Les lentivirus (dont le VIH-1) ont, quant à eux, la capacité d’interagir avec les NPC afin de permettre la translocation de leur génome dans le noyau [1], et de nouvelles interactions ont récemment été décrites entre les protéines du VIH-1 et divers facteurs cellulaires, qui permettent la translocation, l’intégration et la régulation transcriptionelle des provirus. |
Après sa pénétration dans la cellule cible, le VIH-1 se dirige vers le noyau grâce au transport microtubulaire. À la suite de l’ancrage du virus aux NPC, le génome ARN diploïde va terminer sa rétro-transcription et générer deux brins d’ADN bicaténaires associés à des protéines virales. Ce complexe est appelé le « complexe de pré-intégration » (pre-integration complex, PIC). En raison de sa taille (d’environ 56 nm), il ne peut traverser les NPC (qui sont des canaux d’un diamètre de 39 nm) par diffusion passive, et l’intervention de nombreux partenaires cellulaires et viraux est donc nécessaire. Plusieurs protéines du VIH-1, comme l’intégrase ou les protéines de matrice, possèdent une séquence de localisation nucléaire (nuclear localisation sequence : NLS) nécessaire pour l’import nucléaire par les karyophérines, comme l’importine β qui interagit avec la protéine Vpr (viral protein R) [1]. Si ces protéines peuvent être importées dans le noyau, cela ne signifie pas qu’elles sont responsables de l’import du PIC. On peut, par exemple, noter que la protéine Vpr est absente dans les vecteurs lentiviraux, mais que ceux-ci ont néanmoins la capacité d’être transloqués efficacement dans le noyau. Il a été démontré que la présence d’une séquence de 99 nucléotides localisée au centre du génome viral, appelée ADN flap, facilite l’import nucléaire et donc augmente le niveau d’infection. Cette séquence a été inclue dans les dernières versions de vecteurs lentiviraux et contribue à leur succès en thérapie génique [2]. De récentes études ont permis de mettre en évidence d’autres facteurs impliqués dans la translocation nucléaire, comme les protéines de la capside (CA) qui interagissent avec les nucléoporines NUP358/RanBP2 et NUP153, permettant respectivement l’ancrage du virus aux NPC et l’import du génome viral [3] (Figures 1 et 2). D’autres partenaires protéiques tels que la CypA (Cyclophiline A) ou le facteur CPSF6 (cleavage and polyadenylation specific factor) induisent des changements de conformation des protéines de la capside, facilitant ainsi leur interaction avec les protéines NUP358/RanBP2, NUP153 et la transportine-3 (TPNO3) et donc, l’import nucléaire du PIC [4]. Une controverse existe cependant à propos du déroulement de la décapsidation : la capside atteint-elle le noyau intacte ? Une étude récente a montré la présence de pores, formés dans les hexamères de capside, à la surface du core viral [5]. Ceux-ci permettraient l’entrée des désoxyribonucléotides (dNTP) nécessaires à la transcription inverse du génome, qui se déroule pendant le transport de la capside au sein du cytoplasme. Cette hypothèse est corroborée par l’importance de la capside dans l’interaction avec la protéine NUP153. En effet, la protéine NUP153 se lie par ses motifs phénylalanine-glycine (FG) à une poche hydrophobe, présente lorsque la capside est sous forme hexamérique, mais absente dans la forme monomérique [4]. Les formes de capsides hexamèriques sont présentes dans les capsides intègres ou partiellement intactes, suggérant que la capside du VIH-1 serait, au moins partiellement, intacte lorsqu’elle atteint l’enveloppe nucléaire. Une spécificité de séquence a également été démontrée dans cette liaison : l’acide aminé N57 (asparagine 57) des protéines de la capside est important pour la liaison à la protéine NUP153 et donc pour le passage par les NPC, tandis que les résidus K70 (lysine 70) et N74 (asparagine 74) modulent l’affinité de la capside pour la Nup153 [4]. La région C-terminale de la protéine NUP153, contenant 29 motifs FG, est responsable de l’interaction avec la capside du VIH-1 [6]. De plus, la région responsable de l’association entre la capside et le facteur CPSF6 a été déterminée : les régions codées par l’exon 7 (et plus particulièrement les acides aminés 314 à 322) du facteur CPSF6 seraient responsables de l’interaction avec l’acide aminé 74 de la capside virale du VIH-1.
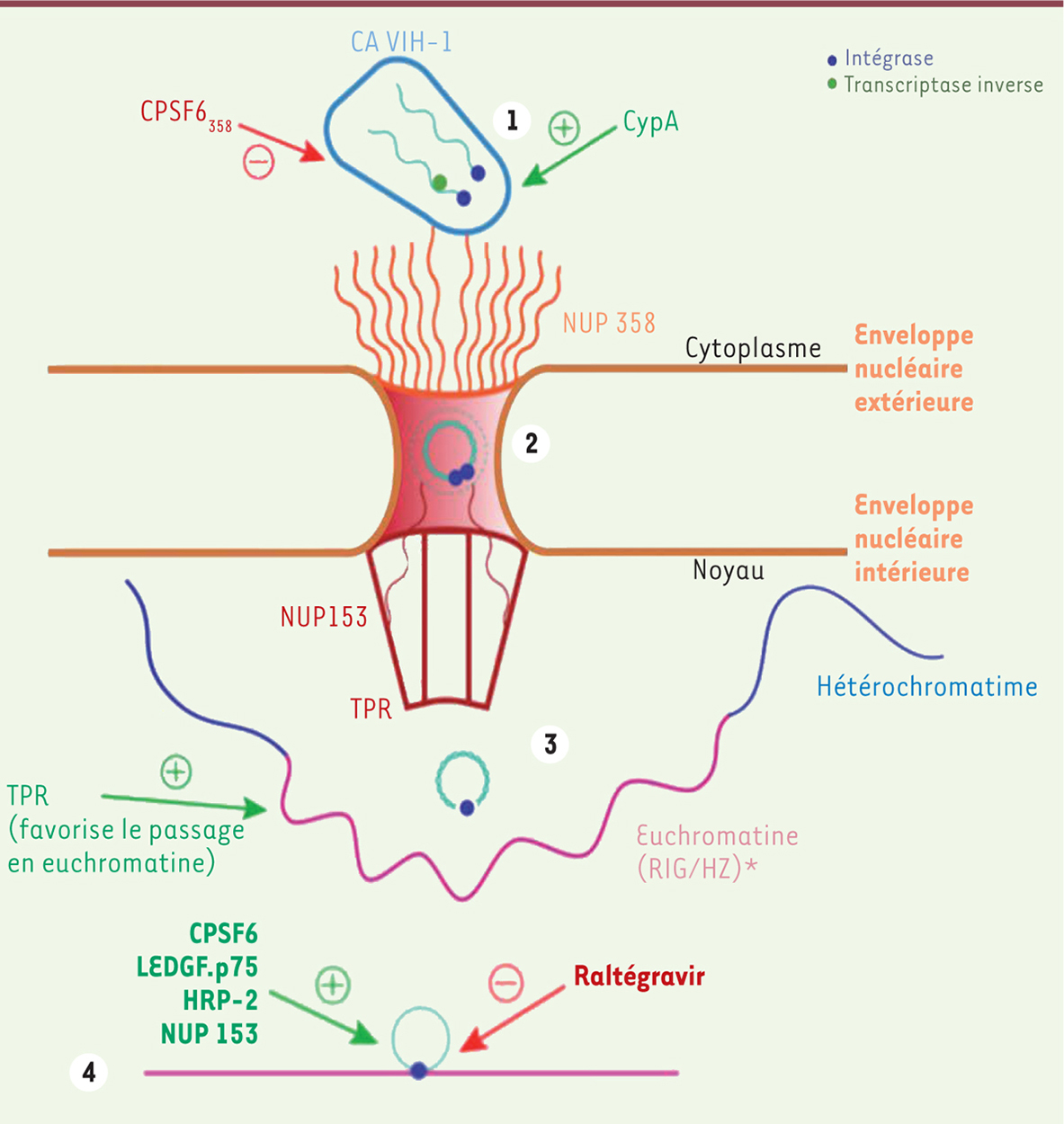
 | Figure 1.
Interaction entre un complexe du pore nucléaire et le virus de l’immunodéficience humaine-1 (VIH-1). Rôle des différents facteurs cellulaires et viraux impliqués. À la suite de la rétro-transcription du génome viral, différentes étapes sont nécessaires pour traverser le pore nucléaire. 1. l’ancrage de la capside au pore nucléaire à travers la Nup358. 2. la liaison aux motifs FG de la nucléoporine NUP153 et le passage à travers le pore nucléaire. 3. l’interaction du complexe de pré-intégration avec l’euchromatine, au niveau de zones d’intégration spécifiques, appelées RIG (recurrent integration genes) et HZ (hotter zones). 4. l’intégration dans les RIG et enfin 5. le génome viral est intégré au génome cellulaire. Les flèches rouges indiquent une inhibition par des antiviraux (comme le raltégravir), et les flèches vertes un effet facilitant le processus. CA : capside ; CPSF6 : cleavage and polyadenylation specific factor ; CypA : peptidyl-isomérase qui se lie à la capside ; HRP-2 : hepatoma-derived growth factor related protein 2 ; LEDGF/p75 : lens epithelium-derived growth factor (modèle de translocation et intégration du VIH-1 simplifié). |
 | Figure 2.
Partenaires cellulaires du VIH-1 (virus de l’immunodéficience humaine-1) et du MLV (Moloney leukemia virus). Partenaires impliqués dans l’import et l’intégration de ces virus et classification des facteurs cellulaires qui interagissent directement avec la capside (CA) ou l’intégrase (IN) du VIH-1 et du MLV. RanBPP2 et Nup153 : deux nucléoporines ; CPSF6 : cleavage and polyadenylation specific factor ; Brd4 : bromo-domain 4. |
La régulation de ces différentes étapes réplicatives commence à être de mieux en mieux caractérisée. Dans un premier temps, la décapsidation complète ou partielle des particules virales est nécessaire à l’entrée des PIC dans le noyau ; en effet, l’important encombrement stérique causé par la taille des capsides intègres ne permet pas la traversée du pore nucléaire. Le PIC doit ensuite établir des contacts stables avec les NPC et cette étape est cruciale pour la translocation nucléaire. En effet, au cours de l’infection, seuls les complexes viraux établissant un contact stable avec les NPC (d’une durée supérieure à 20 minutes) sont transloqués au sein du noyau [7]. Ces contacts dépendent de la présence de la capside, mais également de la nucléoporine NUP358/RanBP2. Si ces différentes étapes sont bien caractérisées, la régulation d’un certain nombre d’entre elles est encore en cours d’investigation. Certains facteurs cellulaires, comme la CypA, régulent également le processus de translocation. En effet, cette peptidyl-isomérase se lie à la capside, promouvant ainsi la réplication du VIH-1 et, par conséquent, son infectivité. CypA possède également un rôle important dans la régulation temporelle de cette interaction [7]. Il a été établi que la capside était nécessaire pour la formation de contacts stables avec l’enveloppe nucléaire. On a ainsi observé que la rupture de liaison entre la protéine CypA et les protéines de la capside inhibait l’infection par le virus [7]. L’interaction entre la protéine CypA et la capside module la décapsidation et permet de lever la dépendance à certaines protéines des NPC pour l’import. C’est le rôle principal de cette isomérase, qui va donc ralentir l’import nucléaire en exerçant un contrôle fin des processus de décapsidation. L’interruption de la liaison entre la protéine CypA et les protéines de capside (par des drogues comme la cyclosporine A) entraîne, en effet, une baisse significative des temps de résidence des complexes dans le cytoplasme et l’enveloppe nucléaire, sans influencer l’efficacité de l’import. Il a été montré que le temps de résidence au niveau de l’enveloppe nucléaire et la translocation dans le noyau des complexes étaient deux événements indépendants, tous deux régulés par l’interaction entre la protéine CypA et les protéines de la capside. Une des hypothèses proposées est que l’import est ralenti par la protéine CypA afin d’éviter toute modification de l’ADN viral par des nucléases/enzymes de réparation au sein du noyau [7]. L’import du génome viral est donc assuré par de nombreuses protéines virales interagissant avec des facteurs cellulaires, notamment les protéines NUP. L’ancrage aux NPC et la décapsidation semblent être fortement connectés à l’import du PIC et dépendre de la capside. Les différents acides aminés impliqués, modulant l’accès à la poche hydrophobe et donc l’accès aux motifs FG ainsi qu’à la boucle de liaison à la protéine CypA, pourraient expliquer les variations observées entre les mécanismes d’import nucléaire des différentes sous-familles de Retroviridae. |
Intégration et contrôle de l’expression Les Retroviridae ont la particularité de répliquer leur génome suite à l’intégration de ce dernier dans celui de l’hôte. Leur translocation nucléaire est donc nécessaire à l’intégration et à l’expression du génome viral. Cette intégration est réalisée par une enzyme : l’intégrase virale et ses cofacteurs, permettant ainsi une intégration dans des régions spécifiques du génome. Des facteurs comme LEDGF/p75 (lens epithelium-derived growth factor), CPSF6, ou HRP-2 (hepatoma-derived growth factor related protein 2) permettent, par exemple, une intégration ciblée dans la chromatine transcriptionnellement active [8, 9]. Les protéines NUP153 et NUP98 ont également été impliquées dans un processus d’intégration préférentielle dans des régions riches en gènes [3]. La liaison du PIC avec tous ces facteurs dirige le génome du VIH-1 dans certaines régions actives de la chromatine, défavorisant son intégration près du site d’initiation de la transcription, TSS (transcription start site), ou dans les îlots CpG (qui sont quant à eux, la cible de plusieurs autres Retroviridae), et la favorisant en revanche, près de la région 3’ des gènes [9]. LEDGF/p75 interagit avec l’intégrase du VIH-1 afin de faciliter l’intégration de l’ADN viral dans le génome de la cellule hôte (Figure 2). Plus précisément, pendant le processus d’intégration, l’intégrase se lie à l’ADN de la cellule hôte formant des structures d’ordre supérieur (les intasomes) qui sont stabilisées par LEDGF/p75. La structure cristalline du domaine IBD (integrase-binding domain) de LEDGF/p75 et du CCD (catalytic core domain) de l’intégrase du VIH-1 a permis de mettre en évidence les acides aminés nécessaires à leur interaction. La chaîne hydrophobe de l’IBD de LEDGF/p75 contient l’acide aminé Ile en position 365 qui interagit avec les résidus du CCD de l’intégrase : Met-178, Leu-102, Ala-128, Ala-129, Trp-131 et Trp-132. Il est également à noter que le complexe de protéines appelé FACT (facilitates chromatin transcription) a récemment été impliquée dans la liaison de LEDGF/p75 à l’intégrase et dans l’intégration dans une chromatine décondensée [10]. Si le facteur LEDGF/p75 permet une intégration dans des zones précises du génome de l’hôte, il a été montré que ce n’est pas la seule protéine à faciliter l’amarrage des complexes viraux à la chromatine : il semble que d’autres facteurs participent également à cette fonction. Les protéines du panier interne du pore nucléaire NUP153 et Tpr ont également été identifiées comme actrices de l’intégration et de la réplication du VIH-1 [6]. La protéine Tpr, nucléoporine principale du panier du pore nucléaire, régule la condensation de la chromatine au niveau du pore [12] et participe directement ou indirectement à l’intégration du VIH-1 dans les gènes actifs localisés en dessous du NPC [6, 11]. De plus, Tpr est responsable de la création d’un environnement chromatinien favorable à la réplication du VIH-1 en dessous du NPC [6]. Des récentes expériences indirectes suggèrent la possibilité que les protéines de la capside du virus, capables de lier les protéines NUP, pourraient participer à cibler l’intégration du VIH-1 dans le génome de la cellule hôte [8]. La cinétique des mouvements nucléaires des complexes viraux a permis de mettre en évidence deux phases faisant suite à l’import : une première phase rapide au cours de laquelle les complexes ont une forte mobilité, puis une seconde phase où ils se déplacent plus lentement. Cette cinétique reflète les mouvements des complexes viraux au moment de l’amarrage de l’ADN viral à la chromatine transcriptionnellement active, le déplacement quantifié pendant la phase lente étant semblable à celui de la chromatine au sein du noyau [7]. L’intégration et le contrôle du provirus sont donc possibles grâce à de nombreux facteurs et structures, dont les NPC. Par des expériences de fluorescence, les régions topologiques du noyau préférentiellement ciblées pour l’intégration des provirus ont été localisées à proximité de l’enveloppe nucléaire [6, 11]. L’importance des nucléoporines, et notamment des protéines NUP153 et Tpr, dans le processus concerté de translocation et d’intégration explique cette localisation dans les régions transcriptionnellement actives de la périphérie du noyau [6] (Figure 1). |
L’interaction pore nucléaire-VIH-1 est essentielle pour les deux mécanismes étudiés. Le premier, de manière intuitive, est la translocation du génome du VIH-1 dans le noyau, via l’interaction des motifs FG des nucléoporines avec la capside du VIH-1. Cette interaction remet en cause certaines théories sur la décapsidation du VIH-1 et représente un exemple intéressant de détournement de la machinerie cellulaire par un virus. Le second est l’intégration du génome par interaction directe ou indirecte avec les protéines NUP. Les nucléoporines, en interagissant avec la capside, permettent l’import du PIC à travers le pore et aident à localiser de façon préférentielle les provirus en périphérie du noyau, dans des zones transcriptionnellement actives, notamment dans certaines régions géniques (en dehors des TSS et des îlots CpG) [1, 13] (→).
(→) Voir la Nouvelle de E. Fabre, m/s n° 5, mai 2006, page 483
Cette interaction ciblée permet une expression optimale des gènes viraux, qui est importante pour générer la nouvelle progénie virale. Ces deux mécanismes soulignent l’importance de l’interaction entre le VIH-1 (et les lentivirus en général) et les pores nucléaires (Figure 1). Ces derniers ne représentent donc pas un obstacle au cycle viral, mais un facteur essentiel pour la fitness1 du virus. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Di Nunzio F. Nuclear pore complexes, genome organization and HIV-1 infection . In : D’Angelo M (ed). Nuclear pore complexes in genome organization, function and maintenance . New York: : Springer; , 2018 : :183.–199. 2.
Zennou V, Petit C, Guetard D, et al. HIV-1 genome nuclear import is mediated by a central DNA flap . Cell. 2000; ; 101 : :173.–185. 3.
Di Nunzio F, Fricke T, Miccio A, et al. Nup153 and Nup98 bind the HIV-1 core and contribute to the early steps of HIV-1 replication . Virology. 2013; ; 440 : :8.–18. 4.
Price AJ, Jacques DA, McEwan WA, et al. Host cofactors and pharmacologic ligands share an essential interface in HIV-1 capsid that is lost upon disassembly . PLoS Pathog. 2014; ; 10 : :e1004459.. 5.
Jacques DA, McEwan WA, Hilditch L, et al. HIV-1 uses dynamic capsid pores to import nucleotides and fuel encapsidated DNA synthesis . Nature. 2016; ; 536 : :349.–353. 6.
Lelek M, Casartelli N, Pellin D, et al. Chromatin organization at the nuclear pore favours HIV replication . Nat Commun. 2015; ; 6 : :6483.. 7.
Burdick RC, Delviks-Frankenberry KA, Chen J, et al. Dynamics and regulation of nuclear import and nuclear movements of HIV-1 complexes . PLoS Pathog. 2017; ; 13 : :e1006570.. 8.
Sowd GA, Serrao E, Wang H, et al. A critical role for alternative polyadenylation factor CPSF6 in targeting HIV-1 integration to transcriptionally active chromatin . Proc Natl Acad Sci USA. 2016; ; 113 : :E1054.–E1063. 9.
Ciuffi A, Llano M, Poeschla E, et al. A role for LEDGF/p75 in targeting HIV DNA integration . Nat Med. 2005; ; 11 : :1287.–1289. 10.
Matysiak J, Lesbats P, Mauro E, et al. Modulation of chromatin structure by the FACT histone chaperone complex regulates HIV-1 integration . Retrovirology. 2017; ; 14 : :39.. 11.
Marini B, Kertesz-Farkas A, Ali H, et al. Nuclear architecture dictates HIV-1 integration site selection . Nature. 2015; ; 521 : :227.–231. 12.
Krull S, Dörries J, Boysen B, et al. Protein Tpr is required for establishing nuclear pore-associated zones of heterochromatin exclusion . EMBO J. 2010; ; 29 : :1659.–1673. 13.
Fabre E. Pore nucléaire et organisation fonctionnelle de la chromatine . Med Sci (Paris). 2006; ; 22 : :483.–484. |