| |
| Med Sci (Paris). 34(6-7): 522–524. doi: 10.1051/medsci/20183406009.Une endocytose frustrée pour une migration accomplie Nadia Elkhatib1 and Guillaume Montagnac1* 1Inserm U1170, Institut Gustave Roussy, université Paris-Saclay, 114, rue Edouard Vaillant, 94805Villejuif, France MeSH keywords: Mouvement cellulaire, Vésicules tapissées de clathrine, Endocytose, physiologie |
L’endocytose est un processus essentiel qui permet à la cellule d’acquérir des éléments qui ne peuvent traverser la membrane cellulaire. Pour internaliser des composants du milieu extérieur, la cellule invagine de petites portions de sa membrane plasmique de façon à former des vésicules qui bourgeonnent dans le cytosol. De telles invaginations ont été identifiées dès 1964 et ont, très tôt, été proposées comme étant les structures assurant l’endocytose des récepteurs membranaires et de leurs ligands [1]. La cellule dispose de différentes machineries pour générer des invaginations de la membrane plasmique à l’origine de la formation de vésicules d’endocytose. Parmi celles-ci, la plus connue et la plus répandue fait intervenir la clathrine. Dans le modèle aujourd’hui largement accepté, la clathrine est recrutée à la membrane plasmique par des adaptateurs spécifiques, dont le plus important est le complexe AP-2 (adapter protein–2) [2]. AP-2 recrute également directement, ou indirectement via d’autres adaptateurs, les récepteurs destinés à être internaliser. La polymérisation de la clathrine produit ensuite les forces nécessaires à l’invagination progressive de la membrane plasmique. Ces invaginations, dénommées puits recouverts de clathrine (PRC), se poursuivent jusqu’à la formation d’une vésicule reliée à la membrane plasmique par un fin cou. La libération de la vésicule d’endocytose dans le cytosol est contrôlée par la dynamine, une protéine qui coupe le cou de la vésicule en formation. Les récepteurs et les ligands ainsi internalisés dans ces vésicules sont soit adressés aux lysosomes pour y être dégradés, soit recyclés vers la membrane plasmique. Ce système permet à la cellule de réguler, dans le temps et dans l’espace, la composition de sa membrane plasmique. Ce processus intervient dans de nombreuses fonctions cellulaires incluant la division, la migration et la polarité cellulaires. |
Des fibres dans des puits Dans le cas de la migration cellulaire, un modèle reconnu propose que les PRC génèrent des vésicules d’endocytose à l’arrière de la cellule. Elles seront ensuite transportées et incorporées à l’avant de celle-ci [3]. Ainsi, la membrane disponible pour l’élongation de la protrusion s’accroît. Des molécules d’adhérence sont internalisées à l’arrière de la cellule puis transportées vers l’avant où elles peuvent participer à la création de nouvelles adhérences cellulaires, nommées adhérences focales, qui stabilisent la protrusion. Ce modèle très élégant ne satisfait pas toutes les observations puisque, par exemple, de nombreuses structures d’endocytose sont en réalité situées à l’avant des cellules [4,5]. Ce modèle est, de plus, essentiellement dérivé d’études réalisées in vitro avec des cellules migrant sur des substrats plans, en verre ou en plastique, et donc non physiologiques [6] (→).
(→) Voir la Synthèse de B. Goud et D. Louvard, m/s n° 1, janvier 2018, page 63
In vivo, la migration cellulaire est réalisée dans des environnements beaucoup plus complexes. Par exemple, pour rejoindre le système circulatoire et générer des métastases dans des organes distants, les cellules cancéreuses, qui s’échappent de la tumeur primaire, doivent migrer dans le stroma, un environnement en 3 dimensions (3D), essentiellement composé de fibres de collagène [7, 8] (→).
(→) Voir la Nouvelle de G. Montagnac et P. Chavrier, m/s n° 2, février 2014, page 130
La reconstitution in vitro des réseaux de fibres de collagène en 3D a récemment permis de montrer que les PRC de cellules cancéreuses s’accumulent le long des fibres (Figure 1) [9]. La raison de cette accumulation est double. D’une part, la courbure imposée par les fibres à la membrane plasmique induit localement la nucléation des PRC. D’autre part, la durée de vie des PRC au contact des fibres est beaucoup plus longue que celle des PRC classiques. Nous avons observé qu’une protéine d’adhérence, l’intégrine β1, s’accumule dans les PRC en contact avec les fibres. Cette sous-unité des intégrines compose le principal récepteur du collagène, et sa présence dans les PRC conduit à leur immobilisation sur les fibres. Des analyses en microscopie électronique ont, de plus, permis de déterminer qu’au contact des fibres de collagène les PRC forment des tubes qui s’enroulent autour des fibres. Les PRC tentent ainsi d’endocyter les fibres, mais cette endocytose est impossible car les fibres sont beaucoup trop longues (d’une longueur supérieure à la cellule elle-même) et ne peuvent être internalisées dans de petites invaginations membranaires. Ces PRC privés de leur fonction se retrouvent « frustrés » et ont, en conséquence, une durée de vie plus longue que celle des PRC classiques.
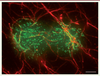 | Figure 1.
Les puits recouverts de clathrine s’accumulent le long des fibres de collagène. A. Des cellules de la lignee MDA-MB-231, issues d’un adenocarcinome mammaire humain, migrent dans un reseau en 3-dimensions de fibres de collagene qui miment le stroma (en rouge). B. Les puits recouverts de clathrine (PRC, en vert) s’accumulent le long de ces fibres de collagene (barre d’echelle : 5 μm). |
|
Des pinces pour la migration des cellules Nous avons démontré que les PRC sont nécessaires à la migration des cellules dans ces environnements constitués de fibres de collagène. Il ne s’agit cependant pas simplement d’une conséquence de leur rôle dans l’endocytose, comme le proposait le modèle classique exposé précédemment. En effet, l’inhibition de la dynamine, qui empêche le bourgeonnement des PRC, a des effets relativement modestes, tandis que l’ablation totale des PRC (par inhibition de l’adaptateur AP-2) conduit à une inhibition drastique de la migration. Les PRC présents sur les fibres sont riches en intégrine β1 et s’enroulent autour des fibres de collagène. Nous avons donc émis l’hypothèse que ces PRC particuliers pourraient constituer des structures d’adhérence. En absence de PRC, les cellules ne sont plus capables de capter et de mouvoir les fibres de collagène éparpillées sur un substrat plan. La simple inhibition de l’endocytose (par inhibition de la dynamine) n’altère pas cette capacité. En combinant ces résultats avec nos observations morphologiques des PRC sur les fibres, nous avons conclu que la cellule utilise les PRC comme de petites pinces pour attraper les fibres [9]. Pour valider cette hypothèse de pinces moléculaires qui favoriseraient la migration des cellules dans des réseaux de collagène, nous avons entrepris de visualiser directement ce possible rôle des PRC. Les cellules migrant dans des environnements 3D sont très allongées et présentent à leur extrémité des adhérences focales sur lesquelles les cellules tirent pour se hisser vers l’avant [10]. Nous avons sectionné, par un laser, l’extrémité des protrusions des cellules en migration, juste en deçà des adhérences focales. La rétraction modeste de la protrusion observée indique que la cellule tirait effectivement sur ces adhérences au moment de la coupure. L’inhibition de l’endocytose (par inhibition de la dynamine) ne modifie pas cette rétraction. En revanche, l’ablation totale des PRC conduit à une rétraction de la protrusion beaucoup plus importante. Les PRC, en pinçant les fibres de collagène situées tout autour, constituent donc des points d’ancrage qui stabilisent la protrusion. Les PRC représentent ainsi des structures d’adhérence originales permettant à la cellule de construire des protrusions stables qui supportent une migration rapide des cellules cancéreuses. Ces résultats inattendus révèlent que, pour s’adapter à son environnement, la cellule redirige des structures initialement destinées à une autre fonction. Nos résultats indiquent que des PRC pinçant des fibres de collagène sont également retrouvés dans des cellules non-motiles. Il est donc envisageable qu’au delà de favoriser la migration des cellules cancéreuses, les PRC jouent un rôle plus universel dans l’adhérence au substrat. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Roth TF, Porter KR. Yolk protein uptake in theoocyte of the mosquito Aedes aegypti L. . J Cell Biol. 1964; ; 20 : :313.–332. 2.
McMahon HT, Boucrot E. Molecular mechanism and physiological functions of clathrin-mediated endocytosis . Nat Rev Mol Cell Biol. 2011; ; 12 : :517.–533. 3.
Bretscher MS. Getting membrane flow and the cytoskeleton to cooperate in moving cells . Cell. 1996; ; 87 : :601.–606. 4.
Howes MT, Kirkham M, Riches J, et al. Clathrin-independent carriers form a high capacity endocytic sorting system at the leading edge of migrating cells . J Cell Biol. 2010; ; 190 : :675.–691. 5.
Montagnac G, Meas-Yedid V, Irondelle M, et al. alphaTAT1 catalyses microtubule acetylation at clathrin-coated pits . Nature. 2013; ; 502 : :567.–570. 6.
Goud B, Louvard D. Mettre la cellule au coeur de la recherche contre le cancer . Med Sci (Paris). 2018; ; 34 : :63.–71. 7.
Friedl P, Alexander S. Cancer invasion and the microenvironment: plasticity and reciprocity . Cell. 2011; ; 147 : :992.–1009. 8.
Montagnac G, Chavrier P. Quand les microtubules rencontrent les puits recouverts de clathrine et permettent aux cellules de tenir le cap . Med Sci (Paris). 2014; ; 30 : :130.–133. 9.
Elkhatib N, Bresteau E, Baschieri F, et al. Tubular clathrin/AP-2 lattices pinch collagen fibers to support 3D cell migration . Science. 2017;; 356 : :eaal4713.. 10.
Doyle A D, Carvajal N, Jin A, et al. Local 3D matrix microenvironment regulated cell migration through spatiotemporal dynamics of contractility-dependent adhesions . Nat Commun. 2015; ; 6 : :8720.. |