| |
| Med Sci (Paris). 34(6-7): 524–526. doi: 10.1051/medsci/20183406010.Progéniteurs adipeux, myofibroblastes et fibrose Il suffira d’un cil ? Nicole Arrighi,1 Christian Dani,1 and Pascal Peraldi1* 1Université Côte d’Azur, CNRS UMR7277, Inserm U1091, Institut de biologie de Valrose, 28, avenue de Valombrose, 06107Nice Cedex 2, France MeSH keywords: Tissu adipeux, Animaux, Différenciation cellulaire, Cils vibratiles, Fibrose, Humains, Myofibroblastes, Cellules souches, cytologie, physiologie, physiopathologie |
Les myofibroblastes sont des cellules impliquées dans la réparation tissulaire. Par leurs capacités à secréter des protéines de la matrice extracellulaire (telles que le collagène) et grâce à leurs propriétés contractiles liées à l’expression de α-SMA (α-actine du muscle lisse), elles participent à la cicatrisation [1]. En conditions physiologiques, les myofibroblastes disparaissent quand la plaie est consolidée et seule la cicatrice reste apparente. Cependant, dans des situations pathologiques, souvent associées à un état d’inflammation chronique, les myofibroblastes persistent et continuent de produire de la matrice extracellulaire. Ce processus, appelé fibrose, perturbe l’homéostasie et le fonctionnement des tissus pouvant conduire à des situations graves, voire au décès du patient. Les myofibroblastes sont des cellules particulières. Il en existe plusieurs types qui produisent des protéines de la matrice extracellulaire de façon différente. Tous les myofibroblastes ne proviennent pas d’un même précurseur : selon le tissu affecté, ils peuvent dériver de fibroblastes locaux, ou provenir de cellules épithéliales ayant subi une transition épithélio-mésenchymateuse, ou même être générés à partir de progéniteurs adipeux (PA). Les PA sont localisés dans le tissu adipeux, mais également dans d’autres tissus tels que les muscles. Leur capacité à former des myofibroblastes dans les muscles et le tissu adipeux peut avoir des conséquences biologiques. En effet, l’inflammation modérée chronique observée chez les personnes obèses est à l’origine d’une fibrose dans le tissu adipeux, qui serait en partie responsable de l’état de résistance à l’insuline de ces patients [2]. Dans la myopathie de Duchenne, l’inflammation chronique des tissus musculaires provoque un envahissement par les myofibroblastes et la déstructuration du muscle. |
Les myofibroblastes ciliés issus des progéniteurs adipeux Notre laboratoire s’intéresse depuis plusieurs années à la caractérisation et à l’étude de la différenciation des PA [3]. Récemment, nous avons mis en évidence la fonction du cil primaire dans la différenciation adipocytaire des PA [4, 5]. Le cil primaire est une organelle en forme d’antenne, qui est présent dans la quasi totalité des cellules de mammifères [6] (→). (→) Voir l’Éditorial de M. Bornens, m/s n° 11, novembre 2014, page 935 et l’ensemble des Synthèses de ce numéro thématique Cils primaires et ciliopathies Brièvement, le cil est formé d’un corps basal et d’un axonème composé de 9 doublets de microtubules [7]. Le cil a plusieurs fonctions. C’est un mécanorécepteur dans les cellules rénales, tandis qu’il porte les photorécepteurs dans les bâtonnets et les cônes de la rétine. De par son importance biologique, les mutations de protéines impliquées dans la structure et la fonction du cil primaire sont responsables de ciliopathies, qui regroupent des syndromes variables comme la cécité et l’obésité [8, 9] (→).
(→) Voir la Synthèse de K. Chennen et al. m/s n° 11, novembre 2014, page 1034
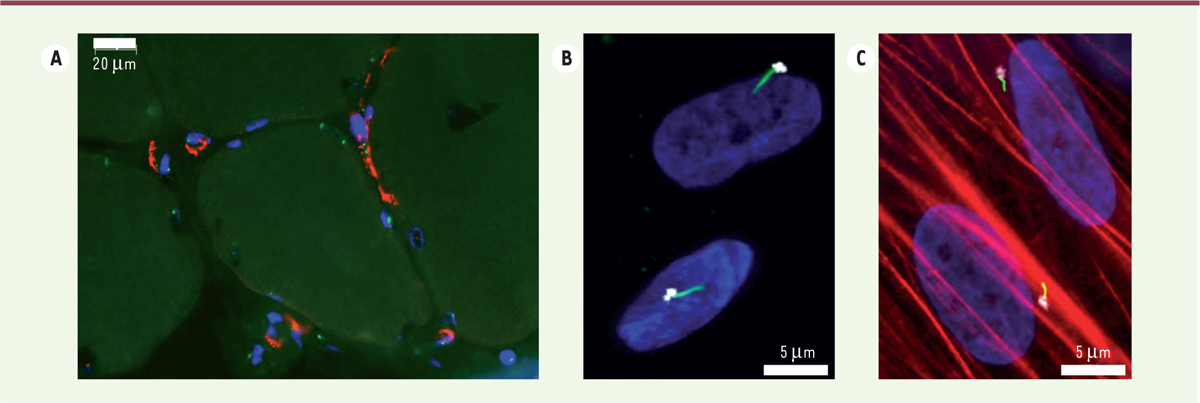
L’intérêt pour le cil primaire a été stimulé par la découverte de son rôle majeur dans le contrôle des voies de signalisation d’Hedgehog1 et du TGF-β1 (transforming growth factor β1). Il est intéressant de noter que ces deux morphogènes, et tout particulièrement le TGF-β1, sont connus pour induire la différenciation myofibroblastique. Nous avons étudié la fonction du cil primaire dans la différenciation des PA en myofibroblastes [10]. Nous avons observé que, dans les muscles de patients atteints de myopathie de Duchenne, un grand nombre de cellules étaient ciliées et, parmi celles-ci, les myofibroblastes (Figure 1A). Pour étudier la fonction de ce cil, nous avons analysé in vitro la différenciation de deux types de PA isolés soit de tissu adipeux, soit de muscles. Dans les deux cas, la différenciation des PA en myofibroblastes, induite par le TGF-β1, a été associée à un raccourcissement du cil primaire, qui conserve cependant ses propriétés de signalisation cellulaire (Figure 1B et 1C). La cause et la fonction de cette diminution de taille restent actuellement inconnues.
 | Figure 1.
Les myofibroblastes sont ciliés in vivo et in vitro. A. Coupe transversale de muscle dystrophique et marquages immunocytochimiques. La tubuline acétylée marque l’axonème du cil primaire (points verts) et l’α-actine du muscle lisse (α-SMA, en rouge) révèle les myofibroblastes. Les noyaux sont colorés par le Hoechst 33258 en bleu. B. In vitro, les progéniteurs adipeux présentent un cil primaire (en vert) qui s’allonge à partir du corps basal, révélé par la péricentrine (en gris). C. En présence de TGF-β1 (transforming growth factor-β1), les cellules se différencient en myofibroblastes (α-SMA en rouge) et la taille du cil primaire est réduite. |
|
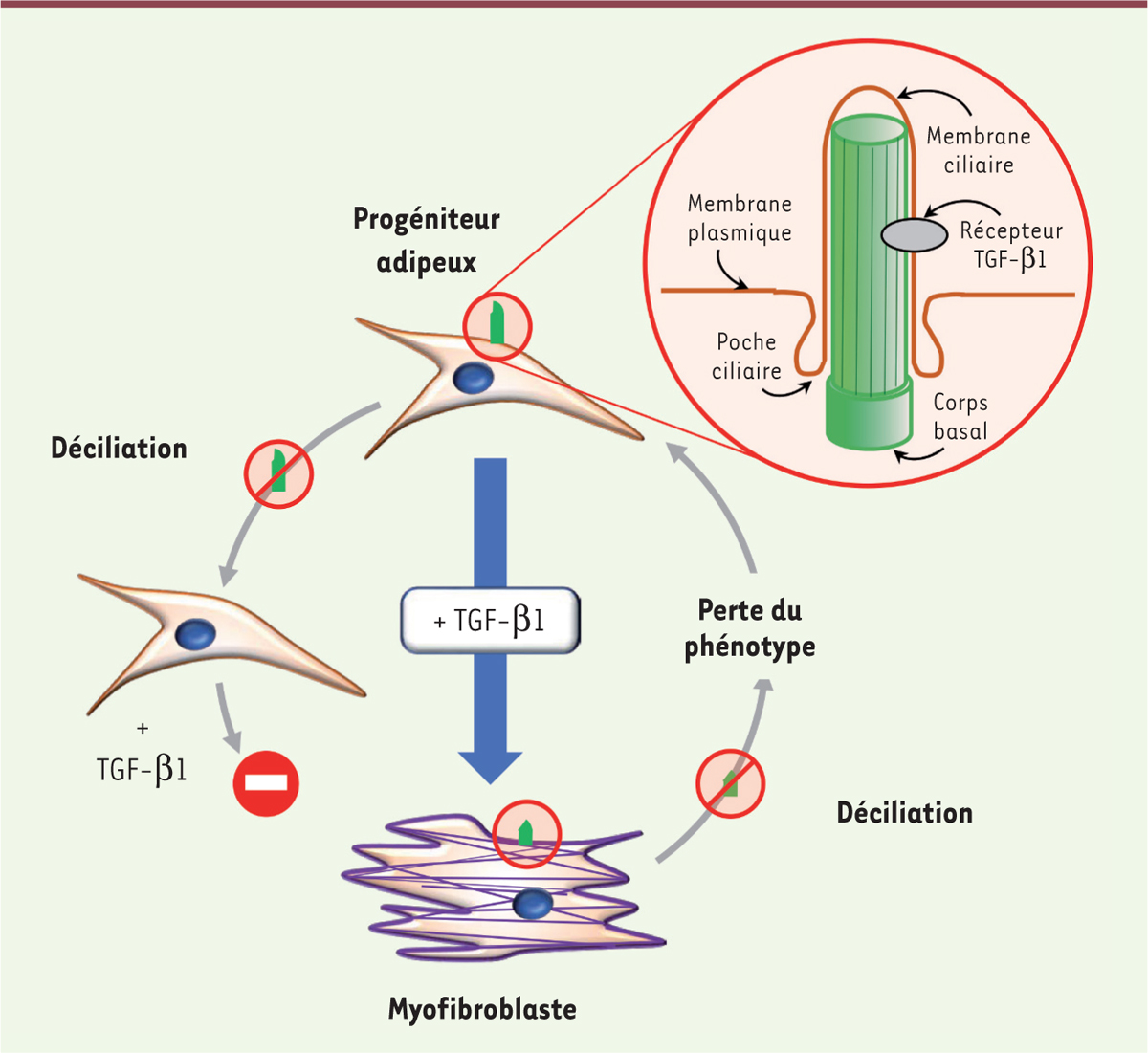
Le cil primaire du myofibroblaste : pilier de la fibrose Le cil joue-t-il un rôle crucial dans la différenciation des PA en myofibroblastes ? Nous avons « décilié » les PA par une approche pharmacologique (grâce à une molécule appelée HPI-42 ou ciliobrévine A) et par une technique de biologie moléculaire en utilisant des ARN interférents dirigés contre Kif3a (kinesin family member 3A), une protéine indispensable à la structure du cil primaire. Grâce à plusieurs techniques (immunofluorescence, RT-PCR [reverse transcription- polymerase chain reaction] quantitative, tri cellulaire, western-blot), nous avons pu montrer que les PA « déciliés » perdaient leur capacité à se différencier en myofibroblastes. Le cil primaire apparaît donc non seulement comme un élément nécessaire à la différenciation des PA en myofibroblastes, mais est également indispensable pour le maintien du phénotype différencié. Une « déciliation » des myofibroblastes induit, en effet, une diminution de l’expression des marqueurs myofibroblastiques (Figure 2).
 | Figure 2.
Le rôle du cil primaire dans la différenciation fibrogénique induite par le TGF-β1. Le TGF-β1 (transforming growth factor-β1) induit la différenciation des progéniteurs adipeux en myofibroblastes. La perte du cil (ou déciliation) empêche cette différenciation, et la ≪ déciliation ≫ du myofibroblaste conduit à la perte du phénotype. |
D’un point de vue mécanistique, nous avons observé que dans les PA, la voie de signalisation du TGF-β1 dépendait du cil primaire. Dans les cellules « déciliées » le TGF-β1 perd, en effet, sa capacité à induire la phosphorylation des facteurs de transcription Smad et leur translocation nucléaire, des évènements nécessaires à la différenciation en myofibroblaste. Ces résultats soulignent le rôle primordial du cil primaire dans la différenciation et le maintien des myofibroblastes obtenus à partir de PA humains. Le cil primaire peut-il donc être considéré comme une cible thérapeutique potentielle pour le traitement de la fibrose ? Cette question est d’autant plus pertinente que le cil primaire contrôle également les voies de signalisation Hedgehog, Wnt et PDGF (platelet-derived growth factor), qui sont des molécules à fort potentiel fibrotique. Des approches thérapeutiques affectant spécifiquement ces molécules sont d’ailleurs proposées pour le traitement de la fibrose. Théoriquement, le cil pourrait également être une cible thérapeutique. Il a récemment été observé que la délétion du cil primaire, dans les muscles de souris modèles de la myopathie de Duchenne, augmente la régénération musculaire [11]. Le cil primaire est cependant présent dans quasiment toutes les cellules de l’organisme et des perturbations de la fonction ciliaire sont responsables de ciliopathies. Pour être efficace et ne pas affecter l’ensemble de l’organisme, l’inhibition du cil primaire devrait cibler spécifiquement les PA au niveau de la zone fibrotique. Un article publié récemment révèle que la dysfonction des cils primaires des PA pourrait être impliquée dans la pathologie de l’obésité [12]. L’ensemble de ces travaux souligne l’importance du cil primaire dans les physiopathologies associées aux PA. L‘arsenal pharmacologique, qui permet présentement d’affecter le cil, est très peu développé et inenvisageable in vivo. Une meilleure compréhension de la structure du cil primaire et la découverte de nouvelles molécules, qui pourraient affecter sa structure et sa fonction, seraient des atouts précieux pour le traitement de pathologies liées au cil primaire telles que la fibrose. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Darby IA, Zakuan N, Billet F, Desmouliere A. The myofibroblast, a key cell in normal and pathological tissue repair . Cell Mol Life Sci. 2016; ; 73 : :1145.–1157. 2.
Crewe C, An YA, Scherer PE. The ominous triad of adipose tissue dysfunction: inflammation, fibrosis, and impaired angiogenesis . J Clin Invest. 2017; ; 127 : :74.–82. 3.
Arrighi N, Moratal C, Clement N, et al. Characterization of adipocytes derived from fibro/adipogenic progenitors resident in human skeletal muscle . Cell Death Dis. 2015; ; 6 : :e1733.. 4.
Forcioli-Conti N, Esteve D, Bouloumie A, et al. The size of the primary cilium and acetylated tubulin are modulated during adipocyte differentiation: Analysis of HDAC6 functions in these processes . Biochimie. 2016; ; 124 : :112.–123. 5.
Forcioli-Conti N, Lacas-Gervais S, Dani C, Peraldi P. The primary cilium undergoes dynamic size modifications during adipocyte differentiation of human adipose stem cells . Biochem Biophys Res Commun. 2015; ; 458 : :117.–122. 6.
Bornens M. L’organe sensoriel central et ses dérèglements . Med Sci (Paris). 2014; ; 30 : :935.–936. 7.
Malicki JJ, Johnson CA. The cilium: cellular antenna and central processing unit . Trends Cell Biol. 2016; ; 27 : :126.–140. 8.
Novarino G, Akizu N, Gleeson JG. Modeling human disease in humans: the ciliopathies . Cell. 2011; ; 147 : :70.–79. 9.
Chennen K, Scerbo ML, Dollfus H, et al. Syndrome de Bardet-Biedl : cils et obésité : de la génétique aux approches intégratives . Med Sci (Paris). 2014; ; 30 : :1034.–1039. 10.
Arrighi N, Lypovetska K, Moratal C, et al. The primary cilium is necessary for the differentiation and the maintenance of human adipose progenitors into myofibroblasts . Sci Rep. 2017; ; 7 : :15248.. 11.
Kopinke D, Roberson EC, Reiter JF. Ciliary hedgehog signaling restricts injury-induced adipogenesis . Cell. 2017; ; 170 : :340.–51 e12. 12.
Ritter A, Friemel A, Kreis NN, et al. Primary cilia are dysfunctional in obese adipose-derived mesenchymal stem cells . Stem Cell Reports. 2018; ; 10 : :583.–599. |