| |
| Med Sci (Paris). 34(6-7): 571–579. doi: 10.1051/medsci/20183406017.Caenorhabditis elegans, un modèle d’étude du vieillissement Rachel Litke,1 Éric Boulanger,1 and Chantal Fradin1* 1Univ. Lille, Inserm, CHU Lille, U995 - LIRIC - Lille Inflammation Research International Center, Place de Verdun, F-59000Lille, France |
Le vieillissement a longtemps été considéré comme un processus physiologique irréversible et inéluctable, correspondant à l’usure passive d’un organisme. Depuis une vingtaine d’années, différents travaux ont montré que le vieillissement n’est pas un phénomène passif, mais un processus physiologique complexe impliquant plusieurs mécanismes finement régulés qui, pour la plupart, restent à être mieux caractérisés [1]. Le rôle respectif ou synergique de ces différents mécanismes dans le processus du vieillissement reste ainsi, encore à ce jour, largement méconnu. La qualité du vieillissement est définie par la présence ou l’absence de pathologie invalidante et de dépendance associées [2]. La perte de fonction de certains gènes ou la dérégulation de leur expression peuvent entraîner un vieillissement accéléré et des pathologies associées au vieillissement. Certains syndromes progéroïdes, comme le syndrome de Werner1, et le syndrome de Hutchinson-Gilford (la progéria)2, sont des maladies génétiques rares [3]. Si les mécanismes précis entraînant le vieillissement prématuré des personnes atteintes ne sont pas décrits, les gènes mutés, qui codent des protéines indispensables au maintien de la stabilité génomique, sont identifiés : gène WRN codant une protéine de la famille RecQ qui contient des domaines hélicase et exonucléase (plusieurs mutations possibles) pour le syndrome de Werner, et gène LMNA codant la laminine A (mutation ponctuelle de substitution) pour la progéria. L’instabilité génomique peut également être la conséquence du raccourcissement des télomères avec l’âge [4]. Ce processus, qui est lié aux divisions cellulaires, entraîne une perte de l’information génétique. La qualité du vieillissement est en partie héritable mais également conditionnée par ce qui est vécu au début du développement et tout au long de la vie, suite à des modifications épigénétiques entraînant des changements qui peuvent être transmissibles et réversibles [2]. Comme l’ADN génomique, l’ADN mitochondrial est la cible de mutations au cours du temps, favorisant de manière directe ou indirecte l’altération des fonctions des mitochondries, notamment les perturbations de la chaîne respiratoire et de la mitophagie dont la fonction principale est l’élimination des organelles défectueuses [5, 6] (→).
(→) Voir la Synthèse de P. Vigié et N. Camougrand, m/s n° 3, mars 2017, page 231
Le dysfonctionnement des mitochondries est à l’origine de la production d’espèces réactives de l’oxygène (ERO). À faible concentration, les ERO permettent le rétablissement et le maintien de l’homéostasie cellulaire, ce qui limite les effets du vieillissement et favorise la longévité. À dose plus importante, potentiellement amplifiée par l’exposition des cellules ou tissus à d’autres signaux de stress, ils induisent un vieillissement accéléré. L’augmentation de la production de radicaux libres avec l’âge, notamment par répression de la voie de signalisation anti-oxydante impliquant le facteur de transcription Nrf2 (nuclear factor erythroid-2-related factor 2) (Figure 1) [7], serait également à l’origine d’un déséquilibre de la balance oxydants-antioxydants naturelle. L’efficacité de la plupart des systèmes de protection cellulaire contre le stress décroît avec l’âge, entraînant une accumulation de dommages macromoléculaires, parfois irréversibles, au sein des cellules et des tissus. Le déclin fonctionnel du protéasome altère également l’homéostasie protéique engendrant l’accumulation de protéines endommagées à l’intérieur des cellules et la formation d’agrégats protéiques dans les tissus, soupçonnés d’être à l’origine des dommages observés dans certaines pathologies [8]. La modification de certaines protéines avec l’âge peut favoriser leur accumulation et/ou leur perte de fonction. Par exemple, les produits de glycation avancée (AGE, advanced glycation end products) s’accumulent dans différents organes avec l’âge [9]. Ces composés sont issus d’une modification post-traductionnelle de protéines avec l’ajout de sucres réducteurs au cours d’une réaction nommée glycation [10] (→).
(→) Voir la Synthèse de S. Jaisson et al., m/s n° 2, février 2017, page 176
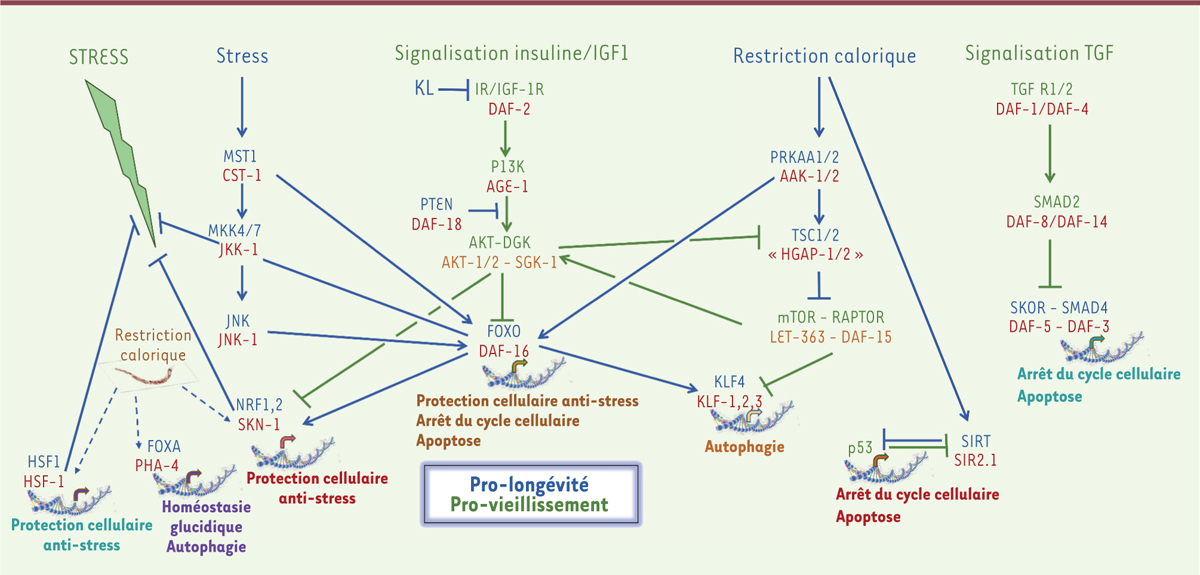
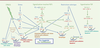 | Figure 1.
Différentes voies de signalisation cellulaire contrôlant le vieillissement et la longévité chez les mammifères. Les voies de signalisation et les molécules « pro-longévité » sont notées en bleu alors que les voies de signalisation et les protéines « pro-vieillissement » sont représentées en vert. Les protéines orthologues de Caenorhabditis elegans sont notées en marron. C. elegans ne possède pas d’orthologues de TSC1 et TSC2 mais HGAP-1 et HGAP-2, orthologues de RalGAPα et RalGAPβ, pourraient avoir une fonction similaire à TSC1/2 [ 54]. Les flèches hachurées représentent les voies de signalisation principalement décrites chez le ver (les acronymes sont développés dans le Glossaire). |
Les AGE sont des molécules qui ne sont pas facilement dégradables par les cellules, ce qui explique leur accumulation endogène et les effets pathologiques qui y sont associés, comme le diabète et ses complications [9]. Les cellules ayant accumulé différents dommages macromoléculaires entrent en état de sénescence, encore appelée vieillissement cellulaire, qui se caractérise par un arrêt irréversible de la prolifération cellulaire associé à certains changements morphologiques, métaboliques et sécrétoires. Ces cellules, qui ont perdu leurs fonctions au sein des tissus, sont source d’inflammation persistante à bas bruit (inflammaging) qui amplifierait les dommages associés au vieillissement [11]. Le vieillissement, comme tant d’autres processus biologiques, est en partie contrôlé par des voies de signalisation et processus biochimiques conservés (Figure 1), dont la majorité a été décrite chez la levure Saccharomyces cerevisiae et chez des modèles animaux dits simples, comme Drosophila melanogaster ou le ver Caenorhabditis elegans [12] (→). (→) Voir la Synthèse de S. Galas et al., m/s n° 3, mars 2012, page 297 Le modèle C. elegans pour l’étude du vieillissement a été choisi dans notre laboratoire après une analyse critique de ses avantages et de ses limites que nous exposons de manière non exhaustive dans cette revue. |
Apports du modèle Caenorhabditis elegans en biologie du vieillissement
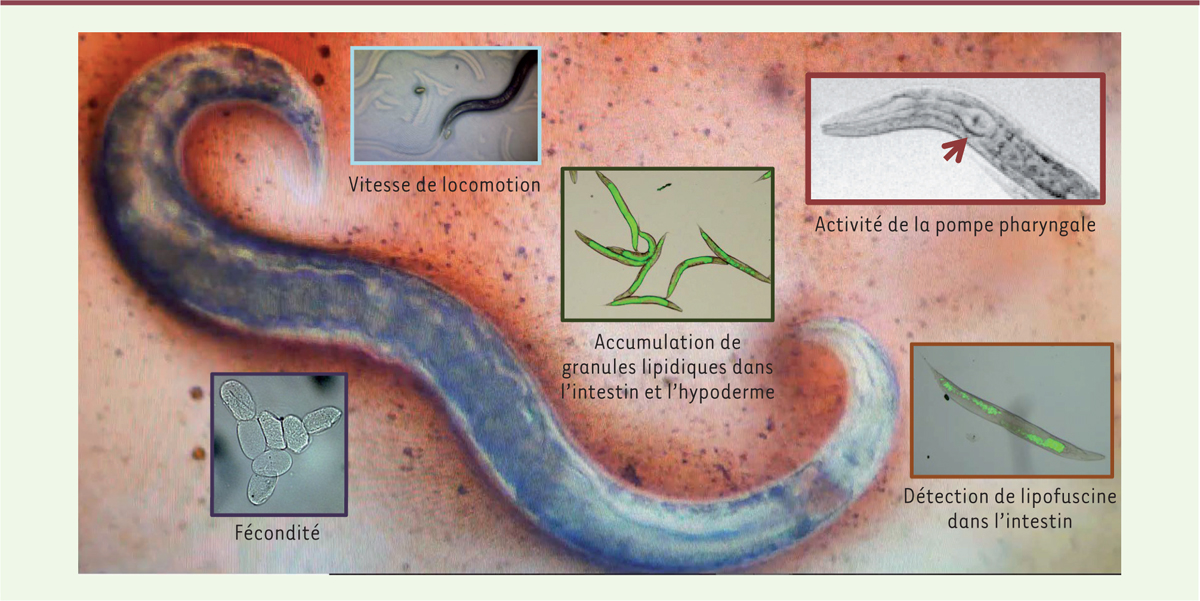
C. elegans est un nématode, ou ver rond, d’un millimètre de longueur. Sa durée de vie est très courte (environ 3 semaines) et variable selon la température à laquelle il est élevé [13]. Sa facilité d’élevage et sa faible longévité ne sont pas les seuls atouts de cet organisme comme modèle d’étude du vieillissement. Les autres avantages de ce modèle comprennent : la connaissance parfaite de son cycle de vie et de son génome ; l’autofécondation des hermaphrodites (la population de vers est composée d’une grande majorité d’hermaphrodites, avec une proportion de mâles variable selon les souches et les conditions expérimentales [14, 15]) ; sa simplicité anatomique, avec un nombre de cellules somatiques limité (959 cellules dont 302 neurones) minimisant les paramètres à prendre en compte ; l’existence d’outils moléculaires permettant de moduler facilement et efficacement l’expression de ses gènes (notamment la technique d’ARN interférence, ARNi) ou d’exprimer des protéines codées par des gènes rapporteurs ou des protéines hétérologues ; sa transparence, autorisant les études microscopiques in vivo ; et le fait qu’environ 40 % des gènes de C. elegans sont des orthologues de gènes humains, avec plus de 80 % d’orthologues pour les gènes participant aux voies de signalisation [16]. Comme il est relativement rapide de réaliser des tests de longévité chez le ver, il est possible d’analyser, dans des délais raisonnables, les effets directs de facteurs génétiques et environnementaux, comme la nutrition. Ces mesures sont complétées par l’analyse de différents marqueurs du vieillissement du ver (Figure 2). Sa mobilité ainsi que l’activité de sa pompe pharyngale diminuent en effet avec son âge. Inversement, la présence d’AGE, de lipofuscine, un pigment cellulaire composé de débris moléculaires, et de granules lipidiques, augmentent au niveau intestinal [17, 18]. Un déclin, puis l’arrêt de la fertilité, apparaissent au tiers de sa vie. Différents facteurs peuvent influencer ces marqueurs du vieillissement. Il est donc important d’en étudier plusieurs afin de valider l’apparition d’un vieillissement précoce ou retardé. Depuis sa première description comme modèle pour l’étude du développement, il y a plus de 40 ans [19], les manipulations génétiques qui ont été réalisées, ont conduit à l’identification de plus de 200 gènes ayant un impact sur la longévité du ver C. elegans (Figure 3).
 | Figure 2.
Marqueurs du vieillissement de Caenorhabditis elegans. La mobilité du ver est déterminée en évaluant la vitesse de locomotion, en mm par seconde, et en comptant le nombre de mouvements sinusoïdaux par minute lors de la reptation (milieu solide) ou de la nage (milieu liquide). L’activité de la pompe pharyngale (flèche rouge) est mesurée en comptant le nombre de contractions du bulbe terminal par minute. La fécondité est estimée après comptage des œufs viables pondus par ver hermaphrodite adulte, toutes les 12 h. Les produits de glycation (AGE) fluorescents et la lipofuscine sont détectés et mesurés par microscopie de fluorescence aux longueurs d’onde d’excitation/émission de 340 nm/400-460 nm. Les granules lipidiques sont colorés au rouge de nile puis visualisés et mesurés par microscopie de fluorescence dans le spectre du jaune-orange (excitation : 450-500 nm ; émission > 528 nm) ou du rouge (excitation : 515-560 nm ; émission > 590 nm). |
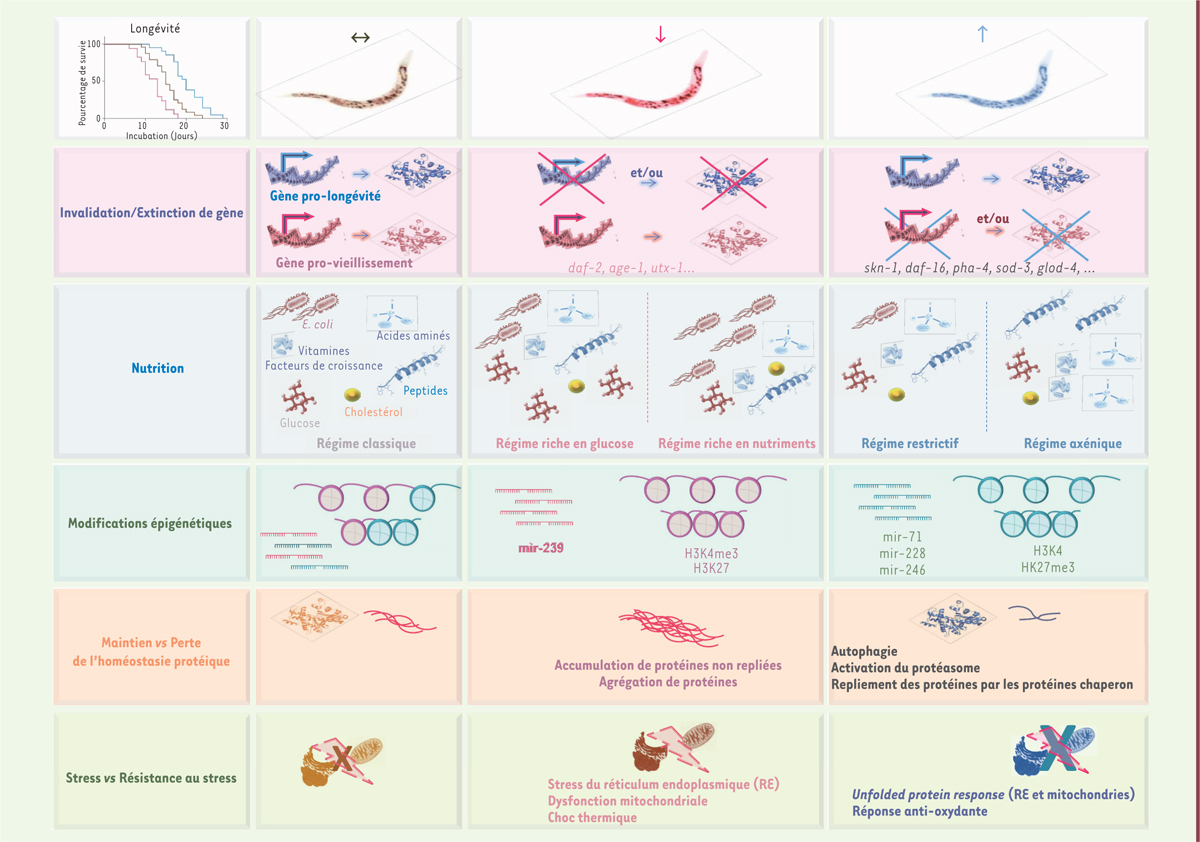
 | Figure 3.
Processus favorisant ou limitant la longévité. Différents facteurs peuvent induire un phénotype pro-longévité ou pro-vieillissement (les acronymes sont développés dans le Glossaire). |
Un premier crible génétique, effectué après mutagénèse aléatoire induite par l’EMS (éthyle méthyle sulfonate), a permis d’isoler les 5 premiers mutants présentant une longévité augmentée [20]. La cartographie génétique de 4 de ces mutants a révélé l’altération d’un même locus : age-1 (aging alteration protein 1) [21]. Cette découverte a été une avancée majeure en biologie du vieillissement : pour la première fois, il était montré que la délétion d’un seul gène pouvait avoir un impact sur la longévité d’un organisme entier. Non seulement la longévité du mutant age-1 était augmentée, mais l’apparition des marqueurs du vieillissement était, elle aussi, proportionnellement ralentie. La théorie du contrôle de la longévité, et donc du vieillissement, par certaines voies génétiques et biochimiques, a ainsi commencé à être validée et a remis en question l’aspect passif du processus du vieillissement. En 1993, Kenyon et al. identifièrent un autre gène dont la délétion augmentait également la longévité du ver et ralentissait son vieillissement : daf-2 (dauer abnormal formation protein 2) [22]. Les mutations de daf-2 et d’age-1 favorisent le passage des larves dans le stade dauer, une forme de résistance que prend le ver lorsque les conditions nutritionnelles sont pauvres. Par opposition à ces 2 mutants, le mutant daf-16 ne présente pas de stade dauer, même en condition défavorable [23]. DAF-16 joue un rôle majeur dans le phénotype « pro-longévité » des mutants daf-2 et age-1. En effet, la mutation du gène daf-16 chez les mutants daf-2 et age-1 annule ce phénotype. Contrairement aux mutations des gènes age-1 et daf-2, celle du gène daf-16 diminue la longévité des vers. Le clonage et le séquençage des différents gènes a permis d’identifier les fonctions des protéines correspondantes. AGE-1, DAF-2 et DAF-16 sont en effet respectivement, la sous-unité catalytique p110 de la phosphatidyl inositol 3-kinase (PI3K), le récepteur de l’insuline et du facteur de croissance IGF-1 (insulin growth factor-1) (IR/IGF-1R), et un facteur de transcription de la famille FOXO (forkhead box O) [21, 24]. AGE-1 et DAF-2 participent à la voie de signalisation induite par l’insuline et l’IGF-1 (Figure 1), dont l’influence sur l’accélération du vieillissement a été confirmée chez d’autres organismes, notamment la levure (via le récepteur du glucose Gpr1 [G protein-coupled receptor 1]), la drosophile et la souris [25]. La restriction calorique, largement étudiée chez le ver non muté en utilisant essentiellement des milieux de culture contenant peu de bactéries, principales sources de nourriture de C. elegans, ou des milieux de culture axéniques, augmente la longévité de cet organisme [26]. Inversement, les régimes riches en nutriments ou en glucose accélèrent le vieillissement de C. elegans (Figure 3). La voie de signalisation à laquelle participe DAF-2 est réprimée lorsque le ver est soumis à certaines conditions de restriction calorique. D’autres voies contrôlant le vieillissement, activées ou réprimées par la restriction calorique, ont été également mises en évidence (Figure 1). DAF-16 est, lui, impliqué dans différents mécanismes d’allongement de la longévité, dont la défense cellulaire contre le stress. Chez l’homme, des études épidémiologiques ont montré une association entre certains polymorphismes de son équivalent, FOXO3, et l’augmentation de la longévité [27, 28] (→). (→) Voir la Chronique génomique de B. Jordan, m/s n° 5, mai 2018, page 485 Plusieurs voies de signalisation contrôlant le vieillissement du ver, et conservées au cours de l’évolution, ont par ailleurs été mises en évidence (Figure 1). Ainsi, SKN-1 (skinhead-1)/NRF1,2 et PHA-4 (defective pharyngeal development protein 4)/FOXA (Forkhead box protein A) sont des facteurs de transcription importants pour le phénotype « pro-longévité » du ver. Contrairement à SKN-1 qui active la protection cellulaire contre le stress, PHA-4 est essentiellement impliquée dans la longévité induite par la restriction calorique, en permettant le maintien de l’homéostasie glucidique et la mise en place d’une réponse anti-stress [29]. L’activation des voies dépendantes de DAF-16 et de SKN-1 diminue avec l’âge des vers. Comme chez l’homme, les systèmes de protection cellulaire contre le stress sont diminués avec l’âge chez le ver. Inversement, la dysfonction mitochondriale, qui induit une augmentation du stress oxydatif et du stress carbonylé, augmente [30, 31]. La diminution avec l’âge des réponses anti-oxydantes, comme la production de superoxyde dismutase codée par sod-3 (pour le stress oxydant) et de la glyoxalase 1, codée par glod-4 (glyoxalase domain–containing protein 4) (pour le stress carbonylé), favorise les effets pro-vieillissement de ces stress [32, 33]. La dysfonction mitochondriale est retardée chez les mutants à longévité élevée, qui développent également un système anti-oxydant très efficace [32, 34]. Le déclin de la réponse aux stress est global puisque la réponse au stress du réticulum (UPR, unfolded protein response) est également altérée [35]. Cette dernière permet, en particulier, de maintenir l’homéostasie du protéome au niveau du réticulum. Une perte de l’homéostasie protéique cellulaire et tissulaire est observée chez les vers âgés, et elle est accélérée chez les vers présentant un phénotype pro-vieillissement, comme le mutant du gène daf-16 [36]. Elle favorise l’agrégation de protéines qui limite la survie des vers. Les vers au phénotype pro-longévité, comme le mutant du gène daf-2, présentent par contre une perte de l’homéostasie protéique retardée (Figure 3). Concernant l’épigénétique, un lien direct entre modifications des histones et longévité a pu être objectivé chez C. elegans. Différents cribles utilisant la technique d’ARNi ont en effet permis d’identifier, de manière non exhaustive, des gènes codant des méthyltransférases (ash-2, set-9, set-15 et set-26) et des déméthylases (mes-2, jmjd-2, lsd-1 et utx-1), dont l’inhibition d’expression participe au contrôle de la longévité du ver [37]. Plus concrètement, la triméthylation de l’histone H3 sur la lysine 4 (K)4 (H3K4me3) augmente avec l’âge, et sa prévention, ou la déméthylation de la protéine, augmente la longévité [38]. Inversement, la triméthylation de l’histone sur la lysine 27 (H3K27me3), qui affecte directement la voie de signalisation impliquant DAF-2 en inhibant l’expression de son gène, augmente la longévité des vers. La déméthylase UTX-1 (ubiquitously transcribed TPR on X-1) déméthyle H3K27 et permet l’augmentation de l’expression de daf-2, accélérant ainsi le vieillissement du ver [39]. L’expression de la déméthylase, à l’origine de la diminution de la méthylation de H3K4, augmente avec l’âge des vers (Figure 3). À noter que la voie de signalisation UTX/Insuline-IGF-1 est conservée chez les mammifères. Les ARN non codants, comme les micro-ARN (miARN), exprimés par le ver, peuvent également influencer sa longévité [40]. Ainsi mir-239 s’avère être un accélérateur de son vieillissement. En revanche, mir-71, mir-228 et mir-246 favorisent sa longévité. Ces miARN interviendraient, entre autres, dans la régulation de la réponse au stress thermique [41]. Ces données ainsi que celles obtenues avec d’autres modèles, ont permis d’associer différentes modifications d’histones ainsi que différents miARN, au contrôle du vieillissement chez l’homme [37, 42]. |
Les limites du modèle Caenorhabditis elegansComme tout modèle animal, C. elegans n’est pas parfait et présente certaines limites. Si son anatomie simple est un atout pour étudier et visualiser des mécanismes moléculaires, en particulier ceux qui contrôlent le vieillissement, c’est, en fait, également l’une de ses faiblesses. Le ver ne possède pas de système vasculaire, ni les organes qui en sont la cible : le cerveau, le cœur et le rein. Il est donc impossible d’étudier spécifiquement le vieillissement de ces organes et certaines des complications liées au vieillissement les touchant, comme les pathologies cérébrovasculaires ou les insuffisances rénale ou cardiaque. De même, pour le système squelettique, C. elegans étant un invertébré, il n’est pas adapté pour des recherches sur le remodelage osseux et son accélération pathologique conduisant à l’ostéoporose. L’inflammation chronique à bas bruit, qui s’instaure avec l’âge, semble influencer le vieillissement. Cette inflammation, plus connue sous le terme anglo-saxon d’inflammaging, est en effet une affection qui favoriserait le vieillissement [11]. La plupart des maladies associées au vieillissement présentent d’ailleurs un état inflammatoire. Cependant, le rôle exact de l’inflammation dans l’apparition de ces pathologies, ou leurs simples conséquences, n’est pas clairement déterminé. Il semble donc indispensable de connaître les mécanismes d’apparition de cet état inflammatoire à bas bruit et d’en connaître ses conséquences directes sur le vieillissement. Néanmoins, ne possédant ni système vasculaire ni inflammation, les causes et conséquences de l’inflammaging ne pourront pas être étudiées chez C. elegans. À la fin de son développement larvaire, le ver est constitué de 959 cellules somatiques et d’environ 2 000 cellules germinales. Il n’y a pas, chez le ver, de régénération des épithéliums, ni de reprogrammation des cellules somatiques. Il n’est donc pas possible d’étudier le renouvellement et la reprogrammation cellulaires, ni l’impact du vieillissement sur ces processus. La senescence réplicative, due en partie au raccourcissement des télomères, ne pourra donc pas être explorée chez cet organisme, sauf pour la lignée germinale. Comme il est très difficile, voire impossible de disséquer ses tissus et d’en isoler les cellules, l’étude de la senescence des cellules somatiques sera difficile. Les facteurs influençant le raccourcissement des télomères avec l’âge, de même que le rôle protecteur des télomérases, ne peuvent pas être étudiés avec ce modèle. Une analyse critique des résultats obtenus à propos de la longévité de C. elegans, concernant des molécules pro-longévité ou des mutants, est nécessaire. C. elegans possède en effet de puissants gènes pro-longévité, comme ceux codant les facteurs de transcription DAF-16 et SKN-1, qui, après induction par certaines molécules toxiques, peuvent entraîner une augmentation de longévité du ver. Leur activation est à l’origine de la synthèse de molécules anti-stress qui protègent le ver, en partie grâce à un effet hormétique3 [43]. Il est ainsi important de pouvoir différencier entre toxicité directe de ces molécules et contrôle du vieillissement qu’elles induisent. L’analyse des marqueurs de vieillissement (Figure 2) est donc indispensable afin de compléter les tests de longévité.
C. elegans est un organisme qui s’accommode de peu ou d’aucune nourriture. Le stade dauer lui permet de survivre plusieurs mois sans nourriture, et la restriction calorique favorise la longévité des vers adultes. Il est donc impératif de vérifier, comme cela a été réalisé pour les mutants des gènes daf-2 et age-1, que les phénotypes pro-longévité n’aient pas d’impact sur les capacités d’ingestion du ver, ou, tout du moins, de pouvoir différencier, par exemple, sarcopénie du pharynx [44] et inhibition d’ingestion, indépendante du vieillissement. La restriction calorique peut inhiber la voie de signalisation impliquant DAF-2 ou stimuler les voies SKN-1, PHA-4 et/ou DAF-16 (Figure 1), et donc augmenter la longévité. Si le lien entre inhibition de la voie de signalisation Insuline-IGF-1 et augmentation de longévité a été retrouvé chez d’autres organismes, dont les mammifères [25], le lien entre le « bien vieillir » et l’inhibition de la voie de signalisation Insuline-IGF-1 est moins évident chez l’homme. L’insuline et l’IGF-1 sont des hormones anabolisantes. Au cours du vieillissement, chez l’homme, elles freinent la sarcopénie ou l’insulinorésistance, facteurs de fragilité, de dépendance et du « mal vieillir » [45, 46] (→). (→) Voir la Synthèse de J. Capeau, m/s n° 8-9, août-septembre 2003, page 834 Le suivi de jeûne, intermittent ou périodique, a montré certains bénéfices sur la prévention de certaines pathologies associées au vieillissement [47]. La restriction calorique (qui est maintenue chez C. elegans jusqu’au stade ultime) ne semble pas avoir d’effet positif aux âges avancés de la vie, d’autant que chez les patients gériatriques fragiles, elle aggrave les éléments de fragilité et accélère la survenue du décès. Un régime riche ou modéré en protéines chez les personnes âgées est d’ailleurs associé à un vieillissement réussi [47]. |
Selon certaines études récentes, la longévité maximale de l’homme pourrait avoir été atteinte, ou proche de l’être [48], avec un maximum autour de 120 ans. L’objectif principal des recherches sur le vieillissement n’est donc pas de trouver les facteurs qui augmenteraient la longévité de l’homme, mais plutôt de permettre à un plus grand nombre de personnes d’atteindre cette longévité maximale, en contrôlant les mécanismes présidant aux pathologies associées au vieillissement. La notion de « bien vieillir » ou « vieillissement réussi » prend alors tout son sens. La contribution de l’organisme modèle C. elegans, en complément de modèles animaux plus complexes, sera nécessaire pour atteindre cet objectif. Même si ce modèle n’est pas adapté au vieillissement global de l’homme, il permet cependant d’étudier des mécanismes moléculaires précis qui peuvent contribuer à la compréhension de ce qu’est le vieillissement. Les avancées majeures en biologie du vieillissement, notamment pour la caractérisation des voies de signalisation qui contrôlent la longévité de C. elegans, renforcent l’intérêt d’utiliser ce modèle pour cibler les facteurs accélérateurs de vieillissement. Elles permettent de définir de nouveaux facteurs associés au « mieux vieillir » et surtout, des facteurs qui soient transposables à l’homme. Ainsi, l’analyse de l’effet de substances exogènes, auxquelles les hommes sont exposés, comme des xénobiotiques ou des composants alimentaires, et endogènes que l’organisme produit en conditions physiologiques ou pathologiques, comme les AGE [49], est primordiale. Le crible de molécules potentiellement anti-vieillissement pathologique est aussi d’intérêt. L’ingestion de substances par le ver n’étant malheureusement pas d’une efficacité reproductible, il est donc indispensable de la vérifier pour chaque composé étudié. Les contrôles seront donc importants à définir et à développer. La recherche des mécanismes contrôlant le vieillissement du ver, et conservés chez l’homme, doit se poursuivre. Même si les voies principales de signalisation sont identifiées, les différentes molécules qui y participent ne sont pas toutes décrites, de même que les voies de signalisation régulatrices annexes. Très récemment, C. elegans a permis de mettre en évidence le rôle des facteurs de transcription de la famille Kruppel-like (KLF) dans la prévention de la dysfonction vasculaire liée à l’âge (Figure 1) [50]. Cette étude démontre que, bien qu’il ne présente pas de système vasculaire, le ver permet une analyse du vieillissement de ce système, repoussant les limites de ce modèle. L’expression hétérologue de protéines humaines chez le ver permet l’analyse de leur implication dans le contrôle des voies de signalisation modulant le vieillissement. Différentes protéines ont déjà été exprimées avec succès chez le ver, en conservant leurs fonctions, ou en s’intégrant dans les voies de signalisation de cet organisme [51]. Des agonistes ou antagonistes humains de voies de signalisation ont également été testés avec succès chez le ver [32]. C. elegans s’avère donc pertinent pour l’identification de récepteurs, de ligands et de facteurs de transduction, présents chez l’homme, et capables de contrôler le vieillissement sans influence de l’inflammation et de l’immunosénescence, qui pourraient masquer certaines voies de signalisation qui sont modulées dans des modèles plus complexes. Connaître les limites d’un modèle permet d’en profiter en les transformant en avantages. Il n’est donc pas exclu de trouver, grâce à cet organisme modèle, des voies de signalisation associées au vieillissement, qui peuvent, chez les mammifères, activer une inflammation, et ainsi permettre de mieux appréhender le rôle de cette inflammation dans la sénescence et le vieillissement. L’un des intérêts du modèle C. elegans est l’étude des maladies liées à la perte de l’homéostasie protéique. L’expression, dans la paroi musculaire du ver, du peptide β-amyloïde (Aβ) humain entraîne son accumulation au cours du temps, et son agrégation, qui est responsable de sa paralysie [52]. Si ce résultat n’apporte pas de lien direct entre agrégation d’Aβ et trouble cognitif, il démontre néanmoins sa toxicité. Il montre également le potentiel de ce modèle pour révéler le rôle de molécules, ou de mécanismes qui peuvent influencer la perte d’homéostasie protéique. Le ver possède 302 neurones soit le tiers de ses cellules, il est ainsi possible d’analyser le vieillissement de ce système neuronal et son influence sur la perte d’homéostasie protéique et inversement. Récemment, un mécanisme de restauration de l’homéostasie protéique a été mis en évidence au niveau des cellules germinales du ver [53]. Ce mécanisme, qui implique l’activation des lysosomes, pourrait être stimulé dans les cellules somatiques avant leur sénescence.
C. elegans devrait permettre d’élucider des mécanismes qui altèrent la plupart des systèmes de protection cellulaire contre le stress. La régulation des systèmes DAF-16/FOXO et SKN-1/NRF1,2 au cours du vieillissement, et des processus pathologiques conduisant au vieillissement, n’est pas complètement comprise. Les mécanismes contrôlant la protection efficace contre les précurseurs des AGE, par exemple, nécessitent d’être mieux caractérisés. Leur connaissance permettra de mieux comprendre pourquoi ces AGE, qu’ils soient endogènes ou alimentaires, sont toxiques et ont un rôle dans le vieillissement. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
|
AAK-1/2
|
5’-AMP-activated protein kinase catalytic subunit alpha-1/2 |
|
AGE-1
|
phosphatidylinositol 3-kinase age-1 (aging alteration protein 1) |
|
AKT
|
protein kinase B |
|
CST-1
|
serine/threonine-protein kinase cst-1 |
|
DAF
|
Dauer abnormal formation |
|
FOXA
|
Forkhead box protein A/Hepatocyte nuclear factor |
|
FOXO
|
Forkhead box protein O |
|
GLOD-4
|
glyoxalase 1 |
|
HGAP-1/2
|
heterodimeric GTPase activating protein subunits 1/2 |
|
HSF1
|
heat shock factor protein 1 |
|
IR/IGF-1R
|
insulin receptor/insulin growth factor 1 receptor |
|
JKK-1
|
Dual specificity mitogen-activated protein kinase kinase jkk-1 |
|
JNK
|
mitogen-activated protein kinase |
|
JNK-1
|
stress-activated protein kinase jnk-1 |
|
KL
|
Klotho |
|
KLF4
|
Krueppel-like factor 4 |
|
LET-363
|
lethal protein 363 ou target of rapamycin homolog |
|
MKK4/7
|
dual specificity mitogen-activated protein kinase kinase 4/7 |
|
MST1
|
serine/threonine-protein kinase 4 |
|
mTOR
|
mammalian target of rapamycin |
|
NRF1,2
|
endoplasmic reticulum membrane sensor NFE2L (nuclear factor erythroid 2-related factor)1,2 |
|
PHA-4
|
defective pharyngeal development protein 4 |
|
PI3K
|
phosphoinositide 3-kinase |
|
PRKAA1/2
|
5’-AMP-activated protein kinase catalytic subunit alpha-1/2 |
|
p53
|
cellular tumor antigen p53 |
|
PTEN
|
phosphatidylinositol 3,4,5-trisphosphate 3-phosphatase |
|
RalGAPα/Pβ
|
Ral GTPase-activating protein subunit alpha/beta |
|
RAPTOR
|
regulatory-associated protein of mTOR |
|
SGK
|
serum/glucocorticoid-regulated kinase 1 |
|
SIR-2.1
|
regulatory protein SIR2 homolog 1 |
|
SIRT
|
NAD-dependent protein deacetylase sirtuin |
|
SKN-1:
|
skinhead-1 |
|
SKOR1/2
|
SKI family transcriptional corepressor1 / 2 |
|
SMAD
|
mothers against decapentaplegic homolog2 |
|
SOD-3
|
superoxide dismutase 3 |
|
TGFPβR1/2
|
transforming growth factor-beta receptor type I/II |
|
TSC1
|
tuberous sclerosis 1 protein, ou hamartin |
|
TSC2
|
tuberous sclerosis 2 protein ou tuberin |
|
UTX-1
|
ubiquitously transcribed TPR on X |
|
Footnotes |
1.
Lopez-Otin C, Blasco MA, Partridge L. et al. The hallmarks of aging . Cell. 2013; ; 153 : :1194.–1217. 2.
Ashapkin VV, Kutueva LI, Vanyushin BF. Aging as an epigenetic phenomenon . Curr Genomics. 2017; ; 18 : :385.–407. 3.
Dyer CA, Sinclair AJ. The premature ageing syndromes: insights into the ageing process . Age Ageing. 1998; ; 27 : :73.–80. 4.
Blackburn EH. Telomeres and telomerase . Keio J Med. 2000; ; 49 : :59.–65. 5.
Moreira OC, Estebanez B, Martinez-Florez S. et al. Mitochondrial function and mitophagy in the elderly: effects of exercise . Oxid Med Cell Longev. 2017; ; 2017 : :2012798.. 6.
Vigie P, Camougrand N. Mitophagie et contrôle qualité des mitochondries . Med Sci (Paris). 2017; ; 33 : :231.–237. 7.
Kubben N, Zhang W, Wang L. et al. Repression of the antioxidant NRF2 pathway in premature aging . Cell. 2016; ; 165 : :1361.–1374. 8.
Moreno-Gonzalez I, Soto C. Misfolded protein aggregates: mechanisms, structures and potential for disease transmission . Semin Cell Dev Biol. 2011; ; 22 : :482.–487. 9.
Frimat M, Daroux M, Litke R. et al. Kidney, heart and brain: three organs targeted by ageing and glycation . Clin Sci (Lond). 2017; ; 131 : :1069.–1092. 10.
Jaisson S, Desmons A, Gorisse L, Gillery P. Vieillissement moléculaire des protéines : quel rôle en physiopathologie ? . Med Sci (Paris). 2017; ; 33 : :176.–182. 11.
Fulop T, Dupuis G, Witkowski JM, Larbi A. The Role of Immunosenescence in the Development of Age-Related Diseases . Rev Invest Clin. 2016; ; 68 : :84.–91. 12.
Galas S, Chateau MT, Pomies P. et al. Aperçu de la diversité des modèles animaux dédiés à l’étude du vieillissement . Med Sci (Paris). 2012; ; 28 : :297.–304. 13.
Klass MR. Aging in the nematode Caenorhabditis elegans: major biological and environmental factors influencing life span . Mech Ageing Dev. 1977; ; 6 : :413.–429. 14.
Anderson JL, Morran LT, Phillips PC. Outcrossing and the maintenance of males within C. elegans populations . J Hered. 2010; ; 101 : (suppl 1):S62.–S74. 15.
Timmons L, Luna H, Martinez J. et al. Systematic comparison of bacterial feeding strains for increased yield of Caenorhabditis elegans males by RNA interference-induced non-disjunction . FEBS Lett. 2014; ; 588 : :3347.–3351. 16.
Shaye DD, Greenwald I. OrthoList: a compendium of C. elegans genes with human orthologs . PLoS One. 2011; ; 6 : :e20085.. 17.
Collins JJ, Huang C, Hughes S, Kornfeld K. The measurement and analysis of age-related changes in Caenorhabditis elegans . WormBook. 2008 ; :1.–21. 18. Mobbs CV, Hof PR. Body composition and aging . Basel: : Karger; , 2010; ; 37 : :I.–VI. 19.
Brenner S. The genetics of behaviour . Br Med Bull. 1973; ; 29 : :269.–271. 20.
Klass MR. A method for the isolation of longevity mutants in the nematode Caenorhabditis elegans and initial results . Mech Ageing Dev. 1983; ; 22 : :279.–286. 21.
Friedman DB, Johnson TE. A mutation in the age-1 gene in Caenorhabditis elegans lengthens life and reduces hermaphrodite fertility . Genetics. 1988; ; 118 : :75.–86. 22.
Kenyon C, Chang J, Gensch E. et al. A C. elegans mutant that lives twice as long as wild type . Nature. 1993; ; 366 : :461.–464. 23. Riddle DL, Albert PS. Genetic and environmental regulation of dauer larva development . In: Riddle DL, Blumenthal T, Meyer BJ, Priess JR, eds. C elegans II . New York: : Cold Spring Harbor; , 1997. 24.
Kimura KD, Tissenbaum HA, Liu Y, Ruvkun G. daf-2, an insulin receptor-like gene that regulates longevity and diapause in Caenorhabditis elegans . Science. 1997; ; 277 : :942.–946. 25.
Van Heemst D. Insulin, IGF-1 and longevity . Aging Dis. 2010; ; 1 : :147.–157. 26.
Greer EL, Brunet A. Different dietary restriction regimens extend lifespan by both independent and overlapping genetic pathways in C. elegans . Aging Cell. 2009; ; 8 : :113.–127. 27.
Jordan B. Gènes et longévité : nouvelles données, nouvelles controverses . Med Sci (Paris). 2018; ; 34 : :485.–487. 28.
Willcox BJ, Donlon TA, He Q. et al. FOXO3A genotype is strongly associated with human longevity . Proc Natl Acad Sci USA. 2008; ; 105 : :13987.–13992. 29.
Panowski SH, Wolff S, Aguilaniu H. et al. PHA-4/Foxa mediates diet-restriction-induced longevity of C. elegans . Nature. 2007; ; 447 : :550.–555. 30.
Chaudhuri J, Bose N, Gong J. et al. A Caenorhabditis elegans model elucidates a conserved role for TRPA1-Nrf signaling in reactive alpha-dicarbonyl detoxification . Curr Biol. 2016; ; 26 : :3014.–3025. 31.
Dingley S, Polyak E, Lightfoot R. et al. Mitochondrial respiratory chain dysfunction variably increases oxidant stress in Caenorhabditis elegans . Mitochondrion. 2010; ; 10 : :125.–136. 32.
Mendler M, Schlotterer A, Ibrahim Y. et al. daf-16/FOXO and glod-4/glyoxalase-1 are required for the life-prolonging effect of human insulin under high glucose conditions in Caenorhabditis elegans . Diabetologia. 2015; ; 58 : :393.–401. 33.
Xu J, Guo Y, Sui T. et al. Molecular mechanisms of anti-oxidant and anti-aging effects induced by convallatoxin in Caenorhabditis elegans . Free Radic Res. 2017; ; 51 : :529.–544. 34.
Feng J, Bussiere F, Hekimi S. Mitochondrial electron transport is a key determinant of life span in Caenorhabditis elegans . Dev Cell. 2001; ; 1 : :633.–644. 35.
Taylor RC, Dillin A. XBP-1 is a cell-nonautonomous regulator of stress resistance and longevity . Cell. 2013; ; 153 : :1435.–1447. 36.
Walther DM, Kasturi P, Zheng M. et al. Widespread proteome remodeling and aggregation in aging C. elegans . Cell. 2015; ; 161 : :919.–932. 37.
McCauley BS, Dang W. Histone methylation and aging: lessons learned from model systems . Biochim Biophys Acta. 2014; ; 1839 : :1454.–1462. 38.
Greer EL, Maures TJ, Hauswirth AG. et al. Members of the H3K4 trimethylation complex regulate lifespan in a germline-dependent manner in C. elegans . Nature. 2010; ; 466 : :383.–387. 39.
Jin C, Li J, Green CD. et al. Histone demethylase UTX-1 regulates C. elegans life span by targeting the insulin/IGF-1 signaling pathway . Cell Metab. 2011; ; 14 : :161.–172. 40.
Pincus Z, Smith-Vikos T, Slack FJ. MicroRNA predictors of longevity in Caenorhabditis elegans . PLoS Genet. 2011; ; 7 : :e1002306.. 41.
Nehammer C, Podolska A, Mackowiak SD. et al. Specific microRNAs regulate heat stress responses in Caenorhabditis elegans . Sci Rep. 2015; ; 5 : :8866.. 42.
Smith-Vikos T, Liu Z, Parsons C. et al. A serum miRNA profile of human longevity: findings from the Baltimore longitudinal study of aging (BLSA) . Aging (Albany NY). 2016; ; 8 : :2971.–2987. 43.
Przybysz AJ, Choe KP, Roberts LJ, Strange K. Increased age reduces DAF-16 and SKN-1 signaling and the hormetic response of Caenorhabditis elegans to the xenobiotic juglone . Mech Ageing Dev. 2009; ; 130 : :357.–369. 44.
Chow DK, Glenn CF, Johnston JL. et al. Sarcopenia in the Caenorhabditis elegans pharynx correlates with muscle contraction rate over lifespan . Exp Gerontol. 2006; ; 41 : :252.–260. 45.
Capeau J. Voies de signalisation de l’insuline : mécanismes affectés dans l’insulino-résistance . Med Sci (Paris). 2003; ; 19 : :834.–839. 46.
Perrini S, Laviola L, Carreira MC. et al. The GH/IGF1 axis and signaling pathways in the muscle and bone: mechanisms underlying age-related skeletal muscle wasting and osteoporosis . J Endocrinol. 2010; ; 205 : :201.–210. 47.
Levine ME, Suarez JA, Brandhorst S. et al. Low protein intake is associated with a major reduction in IGF-1, cancer, and overall mortality in the 65 and younger but not older population . Cell Metab. 2014; ; 19 : :407.–417. 48.
Dong X, Milholland B, Vijg J. Evidence for a limit to human lifespan . Nature. 2016; ; 538 : :257.–259. 49.
Guilbaud A, Niquet-Leridon C, Boulanger E, Tessier FJ. How can diet affect the accumulation of advanced glycation end-products in the human body? Foods. 2016; :5.. 50.
Hsieh PN, Zhou G, Yuan Y. et al. A conserved KLF-autophagy pathway modulates nematode lifespan and mammalian age-associated vascular dysfunction . Nat Commun. 2017; ; 8 : :914.. 51.
Teng MS, Dekkers MP, Ng BL. et al. Expression of mammalian GPCRs in C. elegans generates novel behavioural responses to human ligands . BMC Biol. 2006; ; 4 : :22.. 52.
Dostal V, Link CD. Assaying beta-amyloid toxicity using a transgenic C. elegans model . J Vis Exp. 2010;; 44 : :2252.. 53.
Bohnert KA, Kenyon C A lysosomal switch triggers proteostasis renewal in the immortal C. elegans germ lineage . Nature. 2017;; 551 : :629.–633. 54.
Martin TD, Chen XW, Kaplan RE. et al. Ral and Rheb GTPase activating proteins integrate mTOR and GTPase signaling in aging, autophagy, and tumor cell invasion . Mol Cell. 2014; ; 53 : :209.–220. |