| |
| Med Sci (Paris). 34(8-9): 637–639. doi: 10.1051/medsci/20183408002.La Reptine, nouvelle cible thérapeutique pour le syndrome métabolique et la stéatose hépatique Joaquim Javary,1 Nathalie Allain-Courtois,2 and Samira Benhamouche-Trouillet3* 1IRIC, université de Montréal, 2950 chemin de polytechnique, Montréal, QC H3T 1J4, Canada 2Inserm U1053, université de Bordeaux, 146 rue Léo Saignat, 33076Bordeaux, France 3Inserm U1193, centre hépato-biliaire, 12, avenue Paul Vaillant Couturier, 94807Villejuif Cedex, France MeSH keywords: ATPases associated with diverse cellular activities, Animaux, Protéines de transport, Helicase, Humains, Foie, Syndrome métabolique X, Stéatose hépatique non alcoolique, Transduction du signal, Sérine-thréonine kinases TOR, métabolisme, physiopathologie |
Le foie : un régulateur important du métabolisme glucido-lipidique Le foie est impliqué dans un grand nombre de fonctions vitales pour l’organisme et permet, en particulier, d’assurer l’homéostasie énergétique en régulant le métabolisme glucido-lipidique. Le foie, irrigué par la veine porte provenant de l’intestin, occupe une position stratégique pour traiter les nutriments absorbés. Après un repas, le sang est riche en glucose, en acides aminés et en acides gras. Les acides gras sont stockés par le tissu adipeux blanc, les acides aminés par le muscle, et le foie stocke le glucose sous forme de glycogène et de lipides, qui seront exportés dans le tissu adipeux. Durant la phase de jeûne et lors d’un besoin énergétique, le foie libère le glucose dans la circulation à partir des stocks de glycogène et, lorsque ceux-ci sont épuisés, le synthétise (par néoglucogenèse) à partir de différents substrats, dont les acides aminés. Durant un jeûne prolongé, le foie convertit les acides gras en corps cétoniques qui deviennent alors un substrat énergétique pour le cerveau. La transition métabolique entre les états « à jeun » et « postprandiaux » est finement régulée par la balance hormonale glucagon/insuline, qui contrôle chacune des cascades de signalisation et également par des facteurs de transcription en aval [1]. Le glucagon est une hormone hyperglycémiante, produite par les cellules α du pancréas lors du jeûne ou durant l’activité physique. Dans le foie, le glucagon induit la dégradation du glycogène en glucose et active la néoglucogenèse. À l’inverse, l’insuline est une hormone hypoglycémiante, produite par les cellules β du pancréas durant la phase postprandiale. Elle induit dans le foie le stockage du glucose en glycogène et triglycérides (TG) et inhibe la production de glucose. L’augmentation de la prévalence de l’obésité dans les pays occidentaux est devenue un enjeu de santé publique important, responsable d’un désordre métabolique appelé syndrome métabolique (SM), qui se traduit par une résistance à l’insuline, une intolérance au glucose (qui progresse le plus souvent vers un diabète de type 2), et une hyperlipidémie, et/ou une hypertension artérielle. La composante hépatique du SM est une accumulation de graisses dans le foie, dite stéatose hépatique non alcoolique (ou NAFLD pour non alcoholic fatty liver disease), avec une prévalence globale estimée à 25 % [2, 3] (→). (→) Voir la Synthèse de P. Gual et al., m/s n° 4, mars 2017, page 252 Elle est devenue la cause majeure des maladies hépatiques chroniques pouvant conduire à la cirrhose et au carcinome hépatocellulaire (CHC). En cas d’insuffisance hépatique, le seul traitement efficace est la transplantation. Le développement de nouvelles approches thérapeutiques est donc actuellement un défi majeur. |
Il y a quelques années, notre équipe a découvert que la Reptine, une AAA+-ATPase (ATPase associated with a variety of cellular activities), est surexprimée dans une large proportion des CHC [4] et que l’inhibition de son expression [5] ou de son activité ATPasique [6] entraînait une régression des tumeurs de CHC humains implantées chez la souris. La Reptine est une protéine multifonctionnelle impliquée dans différentes fonctions cellulaires, telles que le remodelage de la chromatine, la régulation de la transcription et le co-chaperonnage de complexes moléculaires [7]. Afin de comprendre son rôle dans la physiopathologie hépatique, nous avons développé un modèle de souris permettant d’inhiber l’expression du gène Reptin spécifiquement dans les hépatocytes après administration d’un agent chimique, le tamoxifène, ou d'un virus ciblant le foie et codant la protéine Cre recombinase capable d’exciser le gène [8]. Nous avons alors étudié les conséquences de la perte de la Reptine dans le foie et observé que les souris avaient un poids diminué dès 15 jours après l’administration de tamoxifène et, qu’en particulier, la masse graisseuse diminuait. Les souris présentaient, de plus, une diminution de la glycémie, de la lipidémie et de la cholestérolémie, suggérant un rôle de la Reptine dans le contrôle du métabolisme glucido-lipidique dans le foie. |
Des travaux antérieurs avaient montré que la Reptine régulait la stabilité de la protéine mTOR (mammalian target of rapamycine). mTOR est une enzyme sérine/thréonine kinase atypique de la famille des PIKK (phosphatidylnositol-3-phosphate kinase-related kinases) capable de percevoir et d’intégrer les informations extracellulaires de multiples voies de signalisation, telles que les facteurs de croissance IGF-1 et IGF-2 (insulin growth factor 1/2) et l’insuline, mais également intracellulaires, comme la quantité de nutriments disponibles pour la cellule ainsi que le statut énergétique. mTOR forme dans la cellule deux complexes moléculaires distincts, mTORC1 et mTORC2, qui ont été impliqués dans la croissance, le développement, le métabolisme et le vieillissement, et dont les perturbations sont responsables d’obésité, de diabète et de cancer [9, 10]. Nous avons posé l’hypothèse que la Reptine régulait la protéine mTOR dans le foie et nos résultats montrent en effet que l’inhibition de la Reptine conduit à une diminution quantitative de la protéine mTOR. Nous avons obtenu des résultats similaires après inhibition pharmacologique de l’activité ATPase de la Reptine dans des hépatocytes isolés. Nous avons ensuite étudié plus précisément les conséquences moléculaires de la perte de Reptine en soumettant les souris à un jeûne, puis en les nourrissant à nouveau pour induire une sécrétion d’insuline par le pancréas. La perte ou l’inhibition de la Reptine entraîne une forte inhibition de l’activité du complexe mTORC1 dans les hépatocytes, associée à une diminution du programme transcriptionnel de la lipogenèse de novo et de la synthèse du cholestérol. Cependant, de façon surprenante, nous avons observé une augmentation de l’activité du complexe mTORC2 associée à un renforcement de l’inhibition de la transcription des gènes de la néoglucogenèse et de la production hépatique de glucose. L’inhibition de la Reptine conduit ainsi à une augmentation de la sensibilité physiologique du foie à l’insuline. Nous avons testé si tel était également le cas dans des conditions pathologiques de résistance à l’insuline. Nous avons nourri pendant 12 semaines des souris avec un régime riche en lipides conduisant à un diabète de type 2 ainsi qu’à une stéatose hépatique chez ces animaux. Nous avons ensuite induit la délétion du gène Reptin et avons observé chez ces animaux la suppression complète des symptômes pathologiques du syndrome métabolique, à savoir l’intolérance au glucose, l’hyperglycémie à jeun, l’hyperlipidémie ainsi que la stéatose hépatique. Parallèlement, l’inhibition de l’activité ATPase de la Reptine dans des hépatocytes isolés conduit à une inhibition de la lipogenèse et de la néoglucogenèse, des voies dérégulées dans les situations de résistance à l’insuline. L’activité ATPasique de la Reptine est donc requise pour ces processus et son inhibition pharmacologique pourrait représenter une nouvelle approche thérapeutique pour la résistance sélective à l’insuline dans le foie (Figure 1).
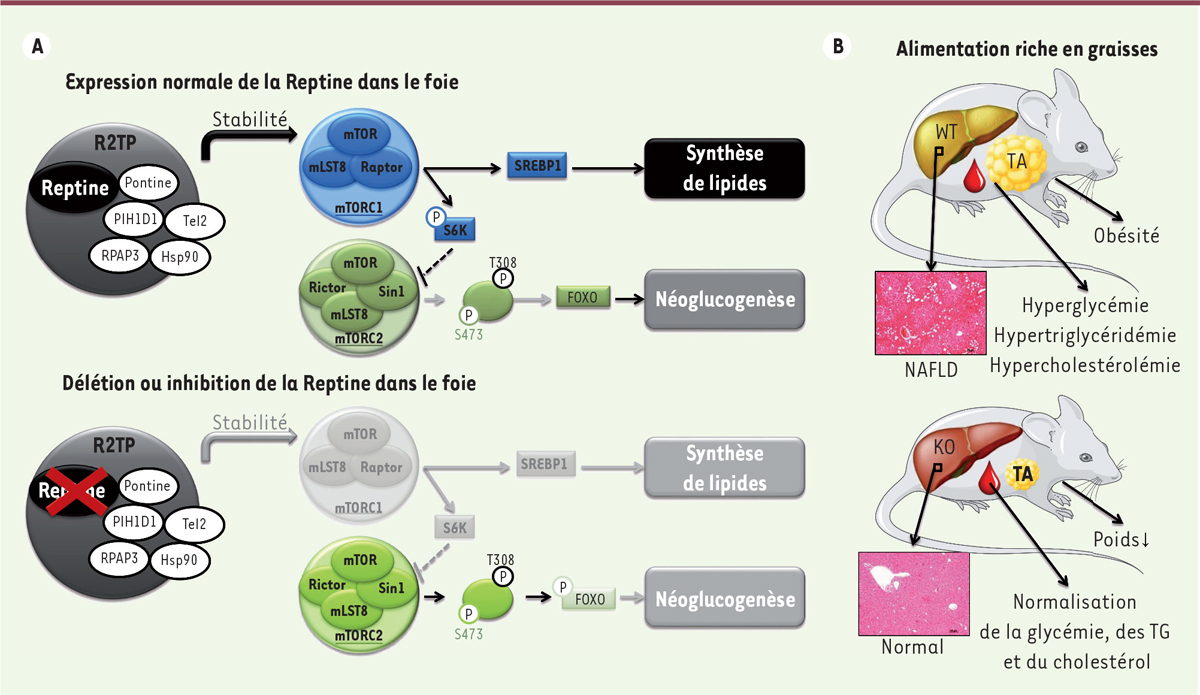
 | Figure 1.
La Reptine régule la signalisation mTOR et le métabolisme glucido-lipidique dans le foie. A. Sur la partie supérieure : dans le foie, l’expression normale de la Reptine, au sein du complexe R2TP - le complexe R2TP contient quatre protéines : deux ATPases AAA+ très similaires entre elles, RVB1 et RVB2 (connues sous les nom de Pontine et Reptine) et un hétérodimère formé des protéines RPAP3 (RNA polymerase II -associated protein 3) et PIH1D1 (PIH1 domain-containing protein 1) -, permet l’assemblage et la stabilité de la protéine mTOR (mammalian target of rapamycine) et du complexe mTORC1. En présence d’insuline, il y a activation du complexe mTORC1 et de ses cibles, telles que SREBP1C (sterol regulatory element-binding protein-1C) qui va activer la synthèse des lipides. Le complexe mTORC2 est également activé par l’insuline et permet l’activation complète d’AKT (protein kinase B) par phosphorylation sur la sérine 473 (S473), entraînant la phosphorylation de FoxO (Forkhead box O protein) et donc l’inhibition de la néoglucogenèse. Toutefois, il existe des rétrocontrôles négatifs freinant l’activité de mTORC2 via notamment S6K (ribosomal protein S6 kinase). Sur la partie inférieure : en l’absence de Reptine ou après inhibition de son activité ATPase, il y a une forte déplétion de la protéine mTOR. L’activité du complexe mTORC1 et de ses cibles en aval est ainsi fortement inhibée, menant donc à une inhibition de la synthèse des lipides. Cependant, de façon surprenante, l’activité du complexe mTORC2 et de ses cibles en aval est augmentée et conduit à un renforcement de l’inhibition de la néoglucogenèse. Cet effet différentiel de l’inhibition de Reptine sur les complexes mTORC1 et mTORC2 peut s’expliquer notamment par la perte du rétrocontrôle négatif de S6K sur mTORC2. B. Sur la partie supérieure : avec une alimentation riche en graisses, les souris « sauvages » (WT : wild type) développent une obésité associée à une résistance à l’insuline, qui se traduit par une hyperglycémie, une hyperlipidémie et une augmentation de la masse du tissu adipeux (TA). Dans le foie, la conséquence de l’obésité est une résistance sélective à l’insuline conduisant à une stéatose hépatique avec une accumulation de triglycérides hépatiques et à une augmentation de la production hépatique de glucose. Sur la partie inférieure : quand on supprime l’expression de la Reptine (knock out Reptin) dans le foie des souris obèses recevant une alimentation riche en graisses, on supprime complètement les phénotypes pathologiques en seulement 15 jours. En effet, le poids total de la souris ainsi que la masse graisseuse sont diminués. La tolérance au glucose, la glycémie, la triglycéridémie et la cholestérolémie sont restaurées à la normale. Enfin, la stéatose hépatique est supprimée et le niveau de triglycérides hépatiques revient à la normale. Hsp90 : heat shock protein 90 ; mLST8 : mTOR-associated protein, LST8 homolog, également dénommée mammalian lethal with SEC13 protein 8 ; NAFLD : non alcoholic fatty liver disease ; Raptor : regulatory-associated protein of mTOR ; SREBP1 : sterol regulatory element-binding protein 1 ; Tel2 : orthologue de CLK2/Clk-2/Rad-5 ; TG : triglygérides. |
|
La Reptine a été décrite pour être surexprimée dans de nombreux cancers, mais son rôle physiologique dans un organe de mammifère n’avait jamais été exploré. Nos résultats montrent que la Reptine est un rhéostat de la signalisation mTOR et de l’homéostasie glucido-lipidique dans le foie. Les effets opposés sur les signalisations mTORC1 et mTORC2 sont vraisemblablement liés à des mécanismes de rétrocontrôles négatifs, mais des études complémentaires sont nécessaires pour comprendre complètement l’impact de la Reptine sur cette signalisation mTOR. Notamment, il n’est pas exclu que ces effets soient également liés au rôle épigénétique de la Reptine. De manière intéressante, alors que l’administration chronique de Rapamycine, l’inhibiteur par excellence de l’activité de mTOR, conduit à l’inhibition des deux complexes [11], ce modèle représente un outil unique pour étudier la modulation différentielle de mTORC1 et mTORC2. Ces résultats ouvrent de nouveaux champs d’investigation concernant le rôle de la Reptine dans la croissance cellulaire et la physiopathologie hépatique. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Rui L. Energy metabolism in the liver . Compr Physiol. 2014; ; 4 : :177.–197. 2.
Younossi ZM Koenig AB Abdelatif D et al. Global epidemiology of nonalcoholic fatty liver disease-Meta-analytic assessment of prevalence, incidence, and outcomes . Hepatology. 2016; ; 64 : :73.–84. 3.
Gual P Gilgenkrantz H Lotersztajn S L’autophagie dans les maladies chroniques du foie : un ami qui vous veut (presque) toujours du bien ! . Med Sci (Paris). 2017; ; 33 : :252.–259. 4.
Rousseau B Menard L Haurie V et al. Overexpression and role of the ATPase and putative DNA helicase RuvB-like 2 in human hepatocellular carcinoma . Hepatology. 2007; ; 46 : :1108.–1118. 5.
Menard L Taras D Grigoletto A et al. In vivo silencing of Reptin blocks the progression of human hepatocellular carcinoma in xenografts and is associated with replicative senescence . J Hepatol. 2010; ; 52 : :681.–689. 6.
Grigoletto A Neaud V Allain-Courtois N et al. The ATPase activity of reptin is required for its effects on tumor cell growth and viability in hepatocellular carcinoma . Mol Cancer Res. 2013; ; 11 : :133.–139. 7.
Mao YQ Houry WA The role of Pontin and Reptin in cellular physiology and cancer etiology . Front Mol Biosci. 2017; ; 4 : :58.. 8.
Javary J, Allain-Courtois N, Saucisse N, et al. Liver Reptin/RUVBL2 controls glucose and lipid metabolism with opposite actions on mTORC1 and mTORC2 signalling . Gut 2017. ; pii: gutjnl-2017-314208.. 9.
Laplante M Sabatini DM mTOR signaling in growth control and disease . Cell. 2012; ; 149 : :274.–293. 10.
Albert V Hall MN mTOR signaling in cellular and organismal energetics . Curr Opin Cell Biol. 2015; ; 33 : :55.–66. 11.
Lamming DW Ye L Katajisto P et al. Rapamycin-induced insulin resistance is mediated by mTORC2 loss and uncoupled from longevity . Science. 2012; ; 335 : :1638.–1643. |