| |
| Med Sci (Paris). 34(8-9): 649–651. doi: 10.1051/medsci/20183408006.Les péricytes des îlots de Langerhans régulent localement le diamètre des capillaires et le flux sanguin Laure Alexandre-Heymann1* and Étienne Larger1** 1Institut Cochin, Inserm U1016, Hôpital Cochin - APHP, service de diabétologie, 123, boulevard de Port-Royal, 75014Paris, France MeSH keywords: Animaux, Vaisseaux capillaires, Diabète de type 2, Humains, Ilots pancréatiques, Péricytes, Débit sanguin régional, physiopathologie, cytologie, physiologie |
Le diabète de type 2 (DT2) est un ensemble de maladies caractérisées par la combinaison d’anomalies de la sensibilité et de la sécrétion d’insuline, dont les déterminants principaux sont le surpoids, la sédentarité et l’âge. Cependant, si on a beaucoup entendu parler d’épidémie de diabète de type 2 associée à l’augmentation de la prévalence de l’obésité, on a ignoré l’augmentation de prévalence du diabète de type 2 associée au vieillissement de la population. Pourtant, une grande étude écossaise a bien souligné que l’âge au diagnostic avançant, le surpoids a un rôle moindre dans le déterminisme du diabète [1]. Cette observation pourrait être en partie expliquée par la dysfonction des vaisseaux pancréatiques, dont le rôle dans les anomalies de sécrétion de l’insuline du diabète de type 2 est évoqué depuis une dizaine d’années [2, 3] (→). (→) Voir la Synthèse de E. Larger, m/s n° 8-9, août-septembre 2003, page 840 Cependant, jusqu’à présent, seul un nombre restreint d’études expérimentales supporte cette hypothèse. C’est l’objet du travail publié en mars 2018 par Almaça et ses collaborateurs, qui souligne un rôle potentiellement important des capillaires insulaires dans la physiopathologie du diabète, en montrant comment les flux sanguins sont étroitement associés à la sécrétion d’insuline [4]. Les péricytes1 (PC) jouent un rôle important dans la fonction des capillaires, la régulation de la perméabilité vasculaire et le flux sanguin [5]. Ainsi, les PC régulent le diamètre des capillaires de la rétine, du cerveau et du rein [6,7], et il a été montré que la perte des péricytes est le premier signe anatomique de la rétinopathie diabétique. Un premier travail avait montré que la destruction des péricytes par un système impliquant le facteur de transcription Nkx3.2 sous l’effet de la toxine diphtérique conduisait à des anomalies de sécrétion de l’insuline avec hyperglycémie et dédifférenciation des cellules bêta [8]. Almaça et ses collaborateurs ont donc cherché à préciser le rôle des péricytes des îlots de Langerhans et leur association à la sécrétion d’insuline. |
Les péricytes recouvrent en grande partie les capillaires insulaires La première partie de leur travail montre que chez la souris comme chez l’homme, les PC représentent environ 3 % des cellules de l’îlot de Langerhans, et sont pourvus d’extensions cytoplasmiques recouvrant une grande partie des cellules endothéliales : la surface des capillaires recouverte par les PC est estimée à environ 40 %. Chez les quelques sujets ayant un diabète de type 2 qui ont pu être étudiés dans le cadre de ce travail, le nombre de péricytes par îlot était plus faible que chez les témoins, et cette réduction semblait associée à la durée de diabète. |
Les péricytes insulaires ont des propriétés contractiles Cinquante pour cent des PC insulaires expriment l’isoforme d’actine présent dans les cellules musculaires lisses (αSMA, smooth muscle actin). Les coupes de pancréas ex vivo (CPEV) représentent une nouvelle technologie offrant la possibilité d’étudier in vitro les régulations de fonction des îlots de Langerhans dans leur environnement naturel [9]. Les auteurs ont ainsi pu étudier les mouvements calciques intracellulaires au sein des PC en réponse à divers stimulus. Le modèle a été validé en montrant une vasoconstriction des capillaires insulaires en réponse à l’endothéline 1 : on observe alors une augmentation de la concentration du calcium cytosolique dans les PC, suivie d’une contraction intense et prolongée d’une partie des capillaires insulaires. Plusieurs types de vasoconstricteurs ont été testés, mais c’est toujours le même sous-groupe de capillaires insulaires qui répond. Ce sous-groupe représente environ 20 % des capillaires de l’îlot, ce qui correspond à la proportion de capillaires recouvert par des PC exprimant l’αSMA. |
L’activation des cellules bêta induit vasodilatation et augmentation du flux sanguin via l’inhibition de l’activité des péricytes Après avoir montré que les PC sont présents autour des capillaires insulaires et peuvent en contrôler les modifications de diamètre en réponse à différents stimulus, les auteurs ont cherché à comprendre les effets des variations glycémiques sur ce système complexe. Une augmentation de la concentration de glucose appliquée aux CPEV conduit à une diminution de la concentration en calcium cytosolique dans les PC insulaires, et à la dilatation d’un sous-groupe de capillaires insulaires, l’augmentation de diamètre étant estimée à 36 %. Ces variations de concentration calcique ne sont en revanche pas observées dans les capillaires acinaires ni dans les artérioles pancréatiques. Les auteurs ont émis l’hypothèse que l’augmentation de l’activité des cellules bêta est associée à une augmentation de la concentration d’adénosine extracellulaire. Ils ont montré dans le modèle CPEV que l’adénosine, ou le 5′-(N-ethylcarboxamido)adenosine (NECA, agoniste non spécifique du récepteur de l’adénosine), reproduisent les effets de l’augmentation du taux de glucose sur les PC insulaires. À l’inverse, la théophylline (antagoniste non spécifique du récepteur de l’adénosine) ou le PSB36 (antagoniste sélectif du récepteur A1 de l’adénosine) inhibent l’effet de l’hyperglycémie sur les péricytes insulaires. Un autre modèle a été utilisé pour mesurer directement le flux sanguin au niveau des îlots. Dans ce modèle initialement décrit par Berggren, des îlots sont greffés dans la chambre antérieure de l’œil2 [10]. Les îlots sont ainsi revascularisés et, grâce à la transparence de l’œil, on peut observer directement le flux sanguin après injection de dextran fluorescéiné. Chez les souris hyperglycémiques, on observe la vasodilatation d’une partie des capillaires et la perfusion de segments des îlots qui ne l’étaient pas à des niveaux de glycémie inférieurs. |
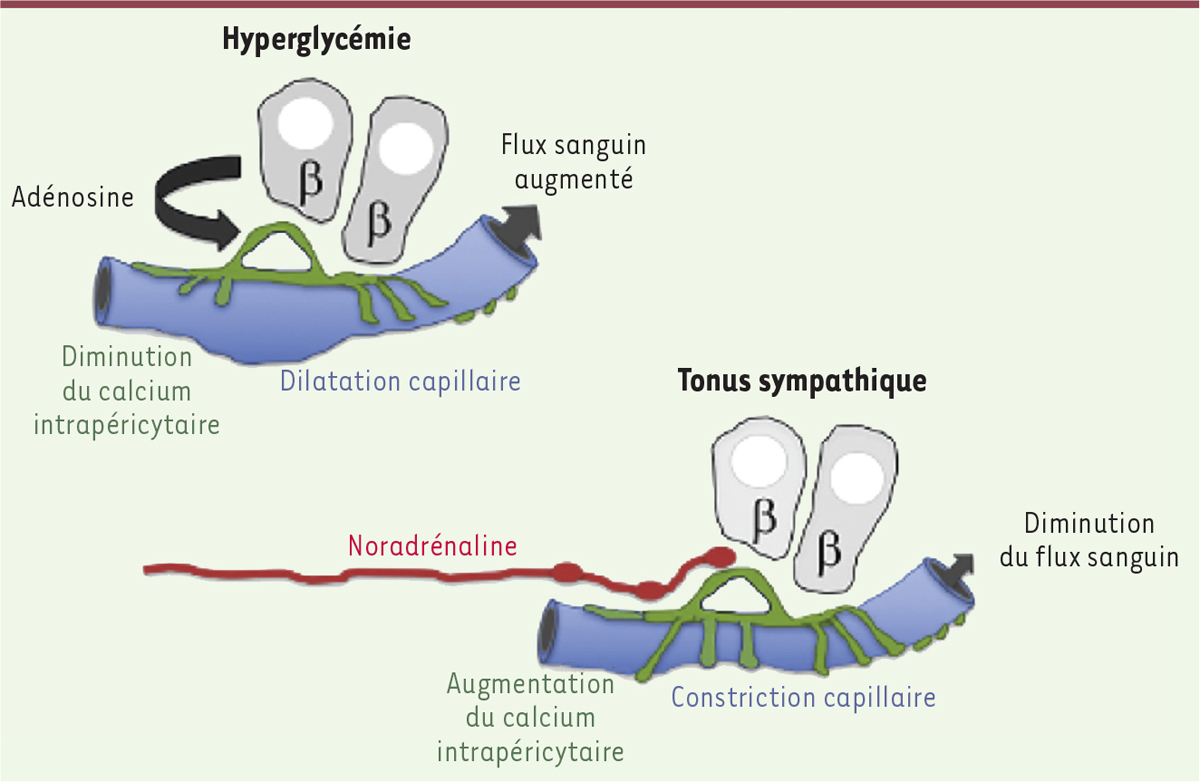
L’activité des péricytes est également régulée par des signaux nerveux Dans les îlots humains et murins, les artérioles et les capillaires sont innervés par des axones du système sympathique [11]. Un marquage immunohistochimique a permis de montrer que les axones sympathiques sont en contact proche avec les PC exprimant l’αSMA. L’application de 50 à 100 µM d’adrénaline, ou de 10 µM de noradrénaline, sur les CPEV induit une augmentation importante de la concentration en calcium cytosolique dans les PC et la vasoconstriction d’une partie des capillaires. L’adrénaline a également un effet vasoconstricteur puissant au niveau des artérioles. Pour tester l’effet de la sécrétion endogène et locale de noradrénaline, Almaça et ses collaborateurs ont appliqué 50 µM de tyramine (sympathomimétique qui stimule le relargage des neurotransmetteurs par les terminaisons nerveuses) sur les CPEV : le calcium intracytosolique des PC augmente également. Dans le modèle de greffe d’îlots en chambre antérieure de l’œil, l’instillation de gouttes ophtalmiques de phényléphrine (un agoniste du récepteur α1 de l’adrénaline) provoque une augmentation de la concentration du calcium cytosolique des PC insulaires, une contraction d’une partie des capillaires insulaires, mais aussi une diminution du flux sanguin d’un grand nombre de capillaires. Les neurotransmetteurs du système sympathique activent donc les PC in vivo, induisent une vasoconstriction et diminuent le flux sanguin insulaire. Il est à rapprocher de ceci le fait que la sécrétion d’insuline est inhibée au cours de l’effort physique par des mécanismes dont on sait qu’ils dépendent des catécholamines (Figure 1).
 | Figure 1.
Régulation du flux sanguin insulaire. Les péricytes (en vert) représentent environ 3 % des cellules des îlots de Langerhans et sont pourvus d’extensions cytoplasmiques recouvrant une grande partie des cellules endothéliales. L’augmentation de l’activité des cellules bêta-pancréatiques est associée à une augmentation de la concentration d’adénosine extracellulaire qui reproduit les effets de l’augmentation du taux de glucose sur les péricytes insulaires. L’adénosine induit une diminution du Ca2+ intrapéricytaire, une dilatation du vaisseau et une augmentation du flux sanguin. Inversement, les neurotransmetteurs du système sympathique, comme la noradrénaline, activent les péricytes (représentés en vert) et induisent une vasoconstriction et donc une diminution du flux sanguin insulaire. |
Ce travail est fondamental car il montre comment s’établit le dialogue entre les cellules bêta et leurs capillaires, comment l’augmentation d’activité des cellules bêta conduit à une vasodilatation par action sur les péricytes insulaires et comment des effets systémiques, communiqués par le système nerveux autonome, peuvent moduler la fonction des cellules bêta par réduction du flux sanguin insulaire. Enfin l’amorce d’observation d’une réduction des péricytes chez des patients ayant un diabète de type 2 soulève des interrogations sur le possible rôle d’une dysfonction vasculaire dans la progression des anomalies de sécrétion de l’insuline au cours du diabète de type 2. Ce travail pourrait ainsi aller dans le sens d’une intégration des signaux nerveux par le pancréas, mais également d’un rôle important de la microvascularisation dans l’histoire naturelle du diabète de type 2. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Logue J Walker JJ Colhoun HM et al. Do men develop type 2 diabetes at lower body mass indices than women? . Diabetologia. 2011; ; 54 : :3003.–3006. 2.
Lammert E. The vascular trigger of type II diabetes mellitus . Exp Clin Endocrinol Diabetes. 2008; ; 116 : (suppl 1)
:S21.–S25. 3.
Larger E. Hyperclycémie et angiogenèse . Med Sci (Paris). 2003; ; 19 : :840.–846. 4.
Almaça J Weitz J Rodriguez-Diaz R et al. The pericyte of the pancreatic islet regulates capillary diameter and local blood flow . Cell Metab. 2018; ; 27 : :630.–44.e4. 5.
Armulik A Abramsson A Betsholtz C Endothelial/pericyte interactions . Circ Res. 2005; ; 97 : :512.–523. 6.
Hall CN Reynell C Gesslein B et al. Capillary pericytes regulate cerebral blood flow in health and disease . Nature. 2014; ; 508 : :55.–60. 7.
Peppiatt CM Howarth C Mobbs P et al. Bidirectional control of CNS capillary diameter by pericytes . Nature. 2006; ; 443 : :700.–704. 8.
Sasson A Rachi E Sakhneny L et al. Islet pericytes are required for β-cell maturity . Diabetes. 2016; ; 65 : :3008.–3014. 9.
Marciniak A Cohrs CM Tsata V et al. Using pancreas tissue slices for in situ studies of islet of Langerhans and acinar cell biology . Nat Protoc. 2014; ; 9 : :2809.–2822. 10.
Speier S Nyqvist D Cabrera O et al. Noninvasive in vivo imaging of pancreatic islet cell biology . Nat Med. 2008; ; 14 : :574.–578. 11.
Rodriguez-Diaz R Abdulreda MH Formoso AL et al. Innervation patterns of autonomic axons in the human endocrine pancreas . Cell Metabolism. 2011; ; 14 : :45.–54. |