Jusqu’à récemment, le décryptage du rôle joué par les différentes régions cérébrales dans la génération des rythmes de l’électroencéphalogramme (EEG) reposait sur l’enregistrement d’activités neuronales effectué sur des préparations anesthésiées. De telles préparations sont cependant peu adaptées pour étudier l’activité et la synchronisation des réseaux neuronaux pendant le cycle veille/sommeil ou lors de modifications physio(patho)logiques du niveau de vigilance. Les avancées des techniques électrophysiologiques ont changé la donne. Il est en effet devenu possible au moyen de tétrodes ou d’électrodes multicanaux d’enregistrer simultanément les activités unitaires d’ensembles neuronaux chez des animaux vigiles. Ces enregistrements peuvent être éventuellement combinés à des manipulations de l’activité neuronale permettant d’étudier la contribution de canaux voltage-dépendants et de récepteurs des neurotransmetteurs à la dynamique des réseaux [1].
Lors du sommeil à onde lente1,, les relations réciproques entre le cortex et le thalamus, constituant la boucle thalamocorticale, sont essentielles à l’émergence d’un grand nombre d’activités rythmiques, particulièrement les fuseaux, les oscillations lentes et de type delta2,. Dans cette boucle, les neurones glutamatergiques (excitateurs) corticothalamiques et thalamocorticaux sont réciproquement connectés ; les neurones corticothalamiques projettent également sur les neurones GABAergiques (inhibiteurs) localisés dans le noyau réticulé thalamique (NRT), induisant une inhibition de type feed-forward 3 des neurones thalamocorticaux. Enfin, les neurones thalamocorticaux projettent en retour sur les neurones du NRT (Figure 1A). L’interaction dynamique des différentes structures de la boucle thalamocorticale est également à la base d’activités rythmiques pathologiques, telles celles de l’épilepsie de type absence chez l’enfant. Cette épilepsie non-convulsive est caractérisée par la répétition fréquente de brefs épisodes de perte de conscience associés à l’apparition sur l’EEG d’une oscillation spécifique, les décharges pointe-ondes [2].
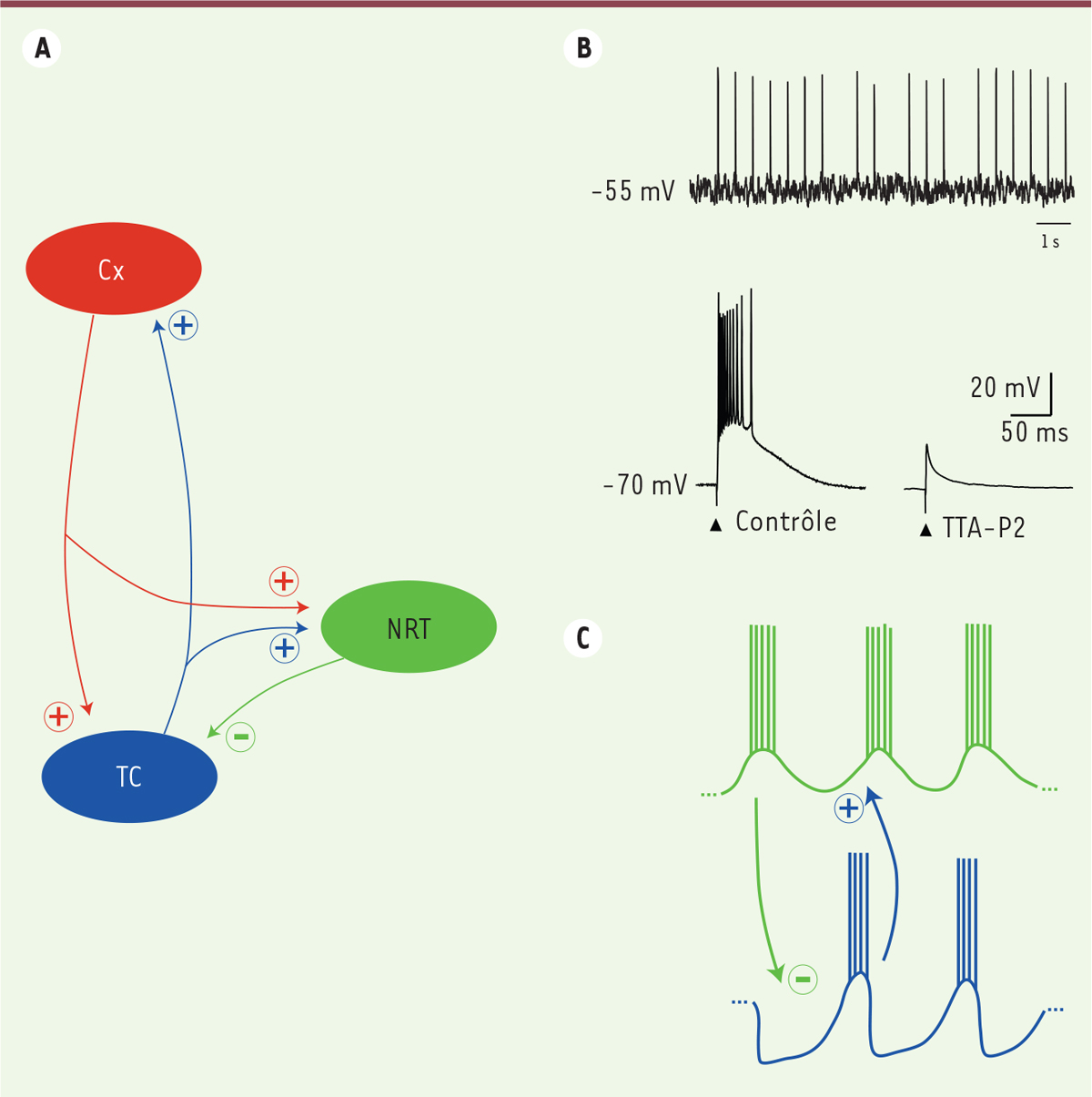
| Figure 1.
Interaction dynamique des structures de la boucle thalamocorticale. A. Schéma de la boucle thalamocorticale. Cx : cortex, TC : noyaux thalamocorticaux, NRT : noyau réticulé thalamique. (+) connexions excitatrices glutamatergiques, (-) connexions inhibitrices GABAergiques. B. Les deux modes de décharges des neurones thalamiques en fonction du potentiel de membrane. À -55 mV, le neurone émet des potentiels d’action de manière tonique en réponse au bombardement synaptique. Au potentiel de -70 mV, il répond à une stimulation synaptique par une bouffée à haute fréquence de potentiels d’action. Cette bouffée est sous-tendue par une dépolarisation due à l’activation de canaux calciques de type T qui est totalement abolie par un bloquant spécifique, le TTA-P2. C. Représentation schématique du mécanisme de génération des fuseaux de sommeil. Les neurones du NRT (en vert) émettent des bouffées de potentiels d’action générant des potentiels synaptiques inhibiteurs GABAergiques dans les neurones TC (en bleu). Ces hyperpolarisations déclenchent en rebond des bouffées de potentiels d’action dans les neurones TC qui excitent en retour les neurones du NRT et permettent l’activation d’un nouveau cycle d’oscillation. Dans les deux types neuronaux, les bouffées de potentiels d’action sont dues à l’activation des canaux de type T. |
L’activité de la boucle thalamocorticale est fortement conditionnée par les propriétés intrinsèques des neurones thalamiques leur conférant une excitabilité bi-modale. Aux potentiels de membrane dépolarisés (> -50 mV), les neurones thalamiques présentent un mode de décharge de potentiels d’action dit « tonique » (Figure 1B), mais un passage à des potentiels plus hyperpolarisés permet de recruter un type de canaux calciques dépendants du potentiel, les canaux calciques à bas-seuil d’activation de type T. L’activation des canaux T génère alors des bouffées à haute fréquence de potentiels d’action (Figure 1B). Le rôle de ces canaux dans la genèse des activités rythmiques de la boucle thalamocorticale a été particulièrement bien étudié en ce qui concerne les fuseaux de sommeil. Ces fuseaux ayant une origine thalamique, des préparations in vitro de tranches de thalamus préservant la connexion entre les neurones thalamocorticaux et ceux du NRT ont pu être utilisées avec succès. Il a ainsi été montré que la mise en jeu des interactions synaptiques mutuelles entre les deux populations de neurones par des bouffées de potentiels d’action sous-tendues par les canaux T est à la base de cette autorythmicité thalamique (Figure 1C) [3].
L’approche in vitro atteint cependant ses limites lorsque l’on veut analyser des oscillations qui nécessitent, pour leur expression, l’intégrité de la boucle thalamocorticale. Néanmoins, sur la base de résultats obtenus sur des préparations de tranches de thalamus réalisées à partir de modèles génétiques ou pharmacologiques d’épilepsie-absence ainsi que d’études in silico, il était traditionnellement admis que, comme dans le cas des fuseaux de sommeil, les neurones thalamocorticaux et ceux du NRT émettaient des bouffées de potentiels d’action, sous-tendues par le recrutement des canaux T, en phase avec chaque cycle des décharges pointe-ondes [4].
Pour dépasser ces limites et évaluer la pertinence des mécanismes suggérés par les précédentes études in vitro [4] ou sur animaux anesthésiés [5, 6], nous avons analysé la dynamique du réseau thalamocortical pendant les décharges pointe-ondes chez des animaux libres de leurs mouvements [7, 8] (→).
(→) Voir la Nouvelle de L.A. Sieu et al., m/s n° 5, mai 2015, page 444
L’activité de neurones corticaux et thalamiques a été enregistrée à l’aide d’électrodes de type « sonde en silicone » dans deux modèles rongeurs d’épilepsie-absence, le modèle génétique des rats GAERS 4 [9] et un modèle pharmacologique de rats auxquels est injecté du gamma-butyrolactone5 (GBL) [10] (Figure 2A). Dans ces modèles rongeurs, les décharges pointe-ondes étant initiées dans la région périorale du cortex somatosensoriel primaire avant d’envahir le noyau ventro-basal thalamique et les autres aires corticales [11], nous avons réalisé ces enregistrements dans le réseau thalamocortical somatosensoriel.
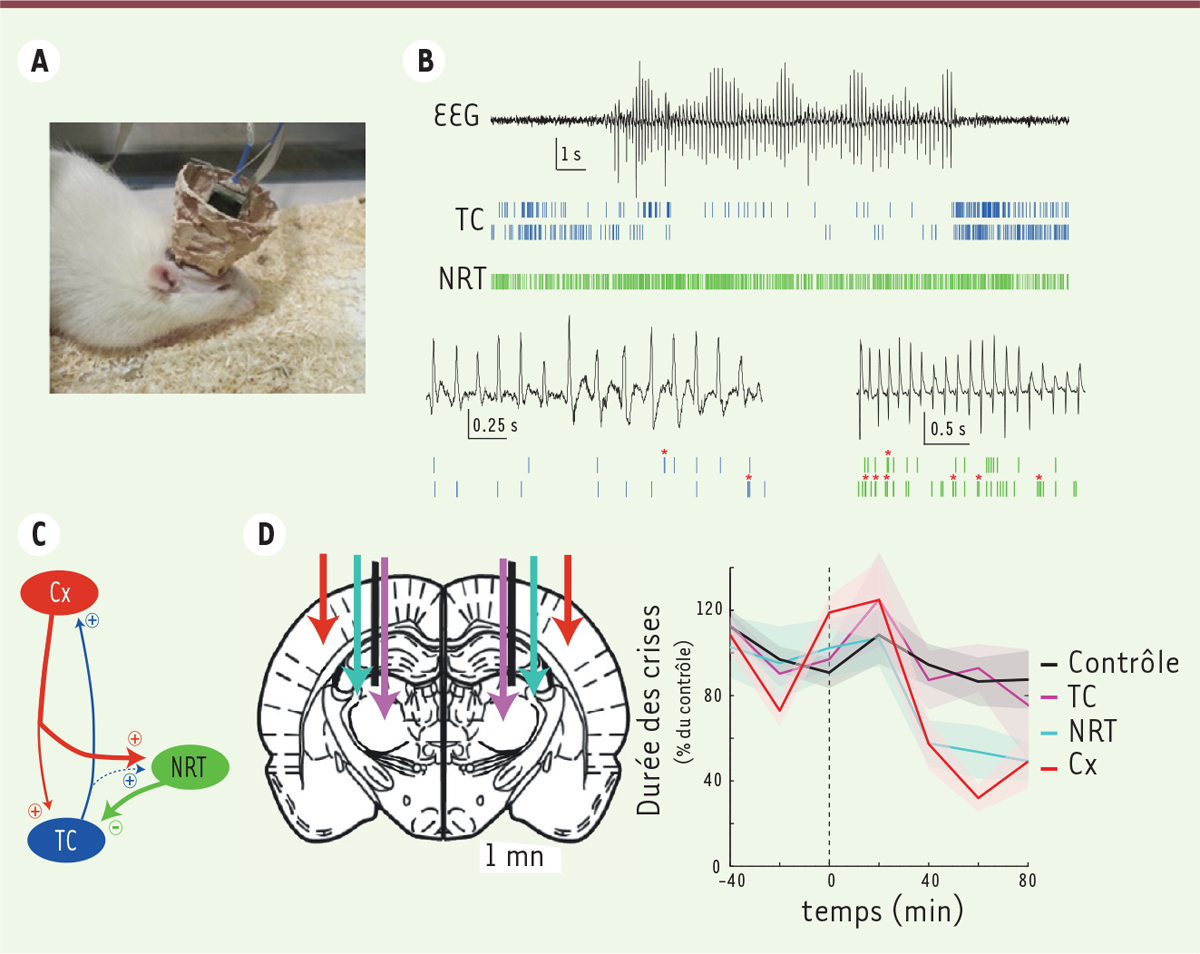
| Figure 2.
Dynamique du réseau thalamocortical pendant les décharges pointe-ondes chez des animaux libres de leurs mouvements. A..Dispositif expérimental combinant l’application locale de drogues par microdialyse et l’enregistrement des activités neuronales par « sonde en silicone » chez un rat GAERS (Genetic absence epilepsy rats from Strasbourg) vigile. B. En haut : enregistrements simultanés de l’activité électrique de deux neurones thalamocorticaux (TC) et d’un neurone du noyau réticulé thalamique (NRT) pendant les décharges pointe-ondes de l’électroencéphalographie (EEG). En bas : détails de l’activité électrique de deux neurones thalamocorticaux (à gauche) et de deux neurones du NRT (à droite) pendant les décharges pointe-ondes. Les étoiles indiquent la présence de bouffées à haute fréquence de potentiels d’action. Calibration EEG : 20 µV. C. Dynamique de l’excitabilité thalamocorticale pendant les décharges pointe-ondes. L’épaisseur des traits symbolise l’importance des différentes connections synaptiques dans la genèse des activités rythmiques. D. À gauche : schéma d’une coupe d’un cerveau de rat montrant l’emplacement des sondes d’enregistrement et d’applications locales d’un bloquant spécifique des canaux T, le TTA-P2 (code couleur indiqué sur le graphe de droite). À droite : la modification de l’excitabilité des neurones du cortex et du NRT par l’application locale de TTA-P2 diminue les crises. Ce même bloquant n’a pas d’effet dans les noyaux thalamocorticaux (ces données sont adaptées de l’article de McCafferty et al. [7]). |
L’analyse de leur dynamique de décharge montre que les neurones thalamocorticaux sont nettement moins actifs durant les périodes ictales6, qu’au cours des périodes inter-ictales (Figure 2B). La réduction d’activité intervient deux secondes avant l’apparition de la décharge pointe-onde sur l’EEG. Ainsi, 45 % des neurones thalamocorticaux sont silencieux lors de plus de la moitié des complexes pointe-ondes d’une décharge. Par ailleurs, les neurones thalamocorticaux n’émettent une bouffée de potentiels d’action à haute fréquence que tous les sept complexes pointe-onde. Il est cependant essentiel de noter que si les neurones thalamocorticaux pris individuellement ont un faible niveau de décharge pendant les périodes ictales, la synchronisation de cette activité au niveau de la population neuronale génère une forte sortie excitatrice du thalamus comme l’atteste l’analyse par cross-corrélogramme7 de l’activité de neurones enregistrée simultanément.
Parmi la population de neurones du NRT, 50 % d’entre eux ont une fréquence de décharge très faible pendant les périodes inter-ictales comme pendant les périodes ictales. Les neurones du NRT actifs en périodes inter-ictales montrent, quant à eux, une diminution de leur taux de décharge 3 secondes avant la survenue des décharges pointe-ondes, tout comme les neurones thalamocorticaux. Cependant, contrairement aux neurones thalamocorticaux, ils augmentent ensuite leur taux de décharge qui reste à un niveau élevé durant toute la période ictale. Cette augmentation est essentiellement due à la présence de bouffées de potentiels d’action à haute fréquence lors des complexes pointe-ondes (Figure 2B).
L’analyse de l’activité de neurones enregistrée simultanément dans les différentes régions de la boucle thalamocorticale indique que, lors de la décharge pointe-onde, les neurones corticaux excitent les neurones thalamocorticaux — qui déchargent alors préférentiellement de manière tonique et non par bouffées de potentiels d’action — et les neurones du NRT qui déchargent par bouffées de potentiels d’action à haute fréquence. Ces bouffées de potentiels d’action vont alors sculpter et synchroniser la décharge tonique des neurones TC par un mécanisme d’inhibition de type « feed-forward » (Figure 2C).
Enfin, pour évaluer le rôle des bouffées de potentiels d’action sous-tendues par les canaux calciques à bas seuil dans la survenue des décharges pointe-ondes, nous avons appliqué pendant les enregistrements, par microdialyse inverse, un bloquant pharmacologique spécifique des canaux T, le TTA-P28. L’application de TTA-P2 dans le noyau ventro-basal thalamique ne modifie pas la survenue des crises d’absence. En revanche, lorsque ce blocage est étendu au NRT, l’occurrence des crises diminue fortement (Figure 2D). Il est important de noter que l’application de TTA-P2 au niveau de la région périorale du cortex somatosensoriel primaire diminue également fortement les décharges pointe-onde indiquant que les canaux T des neurones corticaux jouent un rôle essentiel dans l’excitabilité de la boucle thalamocorticale pendant les crises.