Le glutamate est le principal neurotransmetteur excitateur dans le cerveau des vertébrés. Il se lie à deux types de récepteurs membranaires : les récepteurs ionotropes1, (iGlu), qui sont des récepteurs-canaux, dont l’effet dure quelques dizaines de millisecondes, et les récepteurs métabotropes2, (mGlu), qui régulent des cascades de signalisation intracellulaires et dont la cinétique d’action est de l’ordre de la centaine de millisecondes à la dizaine de secondes. Le sous-type des iGlu comprend les récepteurs AMPA (activés par l’α-amino-3-hydroxy-5-méthylisoazol-4-propionate), NMDA (N-méthyl-D-aspartate), kainate3 et la famille delta. Bien que structurellement très similaires aux autres iGlu, notamment au niveau du domaine de liaison du glutamate, les deux membres de la famille delta, GluD1 et GluD2, ne lient pas le glutamate. Les GluD ont longtemps été considérés comme des récepteurs « orphelins », car aucun agoniste endogène de la fonction canal n’avait été identifié. L’essentiel des données sur les GluD a été obtenu en étudiant le rôle de GluD2 [1]. En effet, ce dernier est fortement exprimé dans le cervelet et son absence conduit à d’importants troubles de la coordination motrice et d’apprentissage moteur. Les propriétés du canal des GluD ont été inférées à partir du mutant A654T (Ala 654 mutée en Thr) de GluD2, ou mutant « lurcher », qui possède un canal constitutivement ouvert. Deux ligands extracellulaires endogènes de GluD2 ont été identifiés : la D-sérine et la pré-cérébelline (Cbln1), précurseur de la cérébelline4,. Dans le cervelet, la D-sérine est libérée par les cellules gliales de Bergman, et Cbln1 est sécrétée par les cellules granulaires présynaptiques. Aucune de ces deux molécules ne déclenche l’ouverture du canal ionique de GluD2. Cependant, leur interaction avec GluD2 joue un rôle primordial dans la différenciation et la plasticité synaptique au niveau des cellules de Purkinje dans le cervelet. Il faut noter que la D-sérine se fixe au domaine extracellulaire homologue à celui qui lie le glutamate dans les autres iGlu (Figure 1), et inhibe le courant ionique chez les souris mutantes GluD2 lurcher. La Cbln1 se fixe au domaine amino-terminal de GluD2 et interagit avec les neurexines présynaptiques5 pour former un pont transsynaptique (Figure 1). GluD1 lie également la D-sérine et Cbln1 mais, bien qu’exprimé dans de nombreuses régions du cerveau [2], son rôle dans la transmission synaptique glutamatergique reste incertain. Cependant, des mutations dans le gène Grid1 codant GluD1 sont associées à des troubles cognitifs comme la schizophrénie et l’autisme, et les souris dépourvues de GluD1 présentent une hyperactivité, un déficit d’interactions sociales et des troubles de l’apprentissage [3, 4] (→).
(→) Voir la Nouvelle de S. Baudouin, m/s n° 2, février 2013, page 121
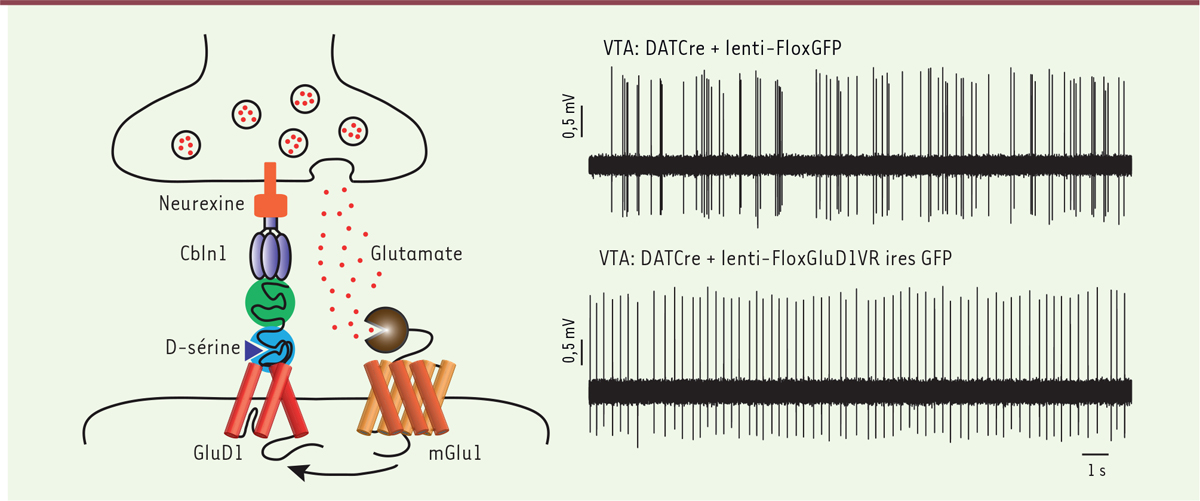
| Figure 1.
Couplage fonctionnel du canal GluD1 avec le récepteur mGlu1. À gauche. Échafaudage transsynaptique impliquant le canal GluD1 et couplage fonctionnel avec le récepteur mGlu1. En bleu, le domaine liant la D-sérine. En vert, le domaine amino-terminal interagissant avec la pré-cérébelline Cbln1. À droite. Enregistrement in vivo de neurones dopaminergique (DA) de l’aire tegmentale ventrale (VTA) après expression sélective dans ces neurones DA soit uniquement de la GFP (green fluorescent protein) (en haut) soit simultanément de la GFP et du mutant du canal GluD1-V617R (en bas). Les vecteurs lentiviraux utilisés ne permettent d’exprimer le transgène qu’en présence de la recombinase Cre. Ces vecteurs ont été injectés chez des souris DATCre exprimant la recombinase Cre sélectivement dans les neurones DA (DAT : transporteur de la dopamine) (figure adaptée de [5]). |
La question de l’existence d’un canal ionique des GluD activable en condition physiologique n’a été résolue que très récemment. Dans le cadre d’une collaboration avec Carole Levenes (Université Paris Descartes) et Julie Perroy (Institut de génomique fonctionnelle, Montpellier) [5], nous avons montré, en système d’expression hétérologue, mais également dans les cellules de Purkinje de tranches de cervelet, que l’ouverture du canal de GluD2 est induite par l’activation du récepteur mGlu1. Dans ces deux préparations, l’ouverture du canal GluD2 peut être obtenue de manière pharmacologique par application du DHPG (3,5-dihydroxyphénylglycine), un agoniste des mGlu de groupe 1 (mGlu1 et mGlu5). Dans les cellules de Purkinje, la stimulation électrique à haute fréquence des afférences glutamatergiques induit un courant ionique excitateur postsynaptique qui dure plusieurs centaines de millisecondes (sEPSC) et est déclenché par l’activation de mGlu1. Grâce à des approches pharmacologiques et génétiques, nous avons montré que ce courant était le résultat de l’ouverture des canaux GluD2. Notamment, l’expression d’un GluD2 dominant négatif portant la mutation V617R (Val 617 mutée en Arg), connu pour inactiver la conduction ionique du canal des iGlu, abolit quasi totalement ce courant.
Dans une étude publiée dans la revue Molecular Psychiatry [6], nous avons examiné l’activation de GluD1 par mGlu1/5 et son rôle dans la transmission synaptique glutamatergique lente des neurones dopaminergique (DA) du mésencéphale. Nous avons observé en système d’expression hétérologue que l’activation de mGlu1 par le DHPG induit un courant ionique porté par le canal GluD1. Ce courant est supprimé quand le canal est muté (GluD1-V617R), inhibé par le NASPM (1-naphthyl acétyl spermine, un composé bloquant le canal GluD2), et modulé par la D-sérine. À l’instar des cellules de Purkinje du cervelet, les neurones DA peuvent être excités par activation des récepteurs mGlu1/5, soit de manière pharmacologique par le DHPG, soit par stimulation électrique des afférences glutamatergiques. Nous avons donc examiné le rôle de GluD1 dans cette excitation lente. Des analyses par RT-PCR (transcription inverse suivie d’une amplification) sur cellule unique et par immunohistochimie grâce à un anticorps développé au laboratoire [2] ont confirmé l’expression de GluD1 et mGlu1/5 dans les neurones DA. Le sEPSC et le courant induit par l’application de DHPG sont inhibés par le NASPM. Ces courants sont absents chez la souris dont le gène GluD1 a été invalidé et sont également supprimés par l’expression ciblée, grâce à une approche Cre-Lox6, du mutant GluD1-V617R dans les neurones DA.
L’activité électrique des neurones DA in vivo présente deux profils distincts : soit une activité régulière à basse fréquence, soit des bouffées d’activité à haute fréquence. Ce second mode de fonctionnement est associé à un pic de libération de dopamine dans le cerveau. Les mGlu jouent un rôle majeur dans l’activité rythmique des neurones DA. Nous avons donc réalisé, en collaboration avec l’équipe de Philippe Faure (UMR8246, Paris), des enregistrements électrophysiologiques de neurones DA in vivo. Ces expériences révèlent que quand le récepteur GluD1 est muté (V617R) ou invalidé (KO), les souris ne présentent plus d’activité haute fréquence, démontrant ainsi la relation entre GluD1 et l’activité physiologique des neurones DA (Figure 1).
De nombreuses études ont montré une association entre la présence de mutations dans les gènes codant GluD1/2 et des troubles psychiatriques. Des mutations du gène Grid1, codant GluD1, sont notamment associées à des cas de schizophrénie et de troubles bipolaires. La schizophrénie est une maladie psychiatrique caractérisée par plusieurs symptômes : des délires et hallucinations, et/ou un retrait social et des difficultés cognitives. Deux hypothèses s’affrontent pour en expliquer l’origine, impliquant deux neurotransmetteurs majeurs du cerveau, le glutamate et la dopamine [7, 8] (→).
(→) Voir les Synthèses de E. Le Guen et al., m/s n° 1, janvier 2015 page 60 et de M. Millan, m/s n° 4, avril 2005, page 434
L’hypothèse dopaminergique postule qu’un dysfonctionnement des neurones qui libèrent la dopamine est en cause, tandis que l’hypothèse glutamatergique est fondée sur l’observation qu’un blocage des récepteurs du glutamate mime certains symptômes de la maladie. Nos travaux fournissent des éléments permettant de réconcilier ces deux hypothèses en révélant une interconnexion entre les deux types de neurotransmissions au sein même des neurones DA. En montrant que l’inactivation génétique de GluD1 abolit l’activité haute fréquence des neurones DA, ces travaux révèlent comment une altération du gène Grid1 impliqué dans la transmission glutamatergique peut mener à un dysfonctionnement du système dopaminergique. Un autre résultat important découle de cette étude : l’identification d’un mode d’activation physiologique de GluD1 qui lève l’état « orphelin » de ce récepteur et ouvre la voie au décryptage de la fonction canal des GluD.