Un phénomène qui a depuis des millénaires fasciné les humains est l’immobilité qui donne au corps cette apparence de « petite mort » à notre vie nocturne endormie. La science n’a que récemment apporté une explication à ce phénomène qui est spécifique du sommeil paradoxal (SP), l’état d’inconscience pendant lequel se joue la majorité des rêves et qui se caractérise par une très importante activité cérébrale étonnamment associée à une atonie musculaire généralisée. Ce dernier signe distinctif est loin d’être anecdotique, puisqu’il nous protège de mouvements inconscients issus de l’activité onirique potentiellement dangereux pour le dormeur, comme en témoigne le syndrome neurologique du RBD (rapid eye movement sleep behavior disorder). Les patients souffrant de RBD perdent en effet l’atonie musculaire du SP, et, n’étant plus paralysés, deviennent alors capables de mouvements complexes, violents, agressifs et de vocalisations [1, 2]. Au-delà de la parasomnie délétère sur la qualité de vie des patients qu’il faut comprendre pour la traiter, le RBD s’avère également être étroitement lié à des maladies neurodégénératives sévères de type α-synucléinopathique (une accumulation intraneuronale de corps de Lewy formés d’agrégats toxiques de la protéine α-synucléine mal conformée), comme la maladie de Parkinson (MP) [3] (→).
(→) Voir la nouvelle de P. Fort et S. Valencia Garcia, m/s n° 10, novembre 2017, page 828
Plusieurs études longitudinales ont établi que le RBD est le meilleur marqueur diagnostic précoce de la MP, avec une fenêtre temporelle d’une dizaine d’années [4]. Mais comment expliquer le lien entre ces deux maladies, a priori si distinctes ? Une théorie actuelle propose que les aires cérébrales responsables de l’atonie seraient atteintes par une α-synucléinopathie, provoquant le RBD et qui se propagerait au cours des années à l’ensemble du cerveau, provoquant la MP [5]. Placées dans ce contexte, nos études récentes ont visé à décrypter le réseau neuronal responsable de l’atonie musculaire du SP et à démontrer que son dysfonctionnement provoquerait un RBD.
Il est admis que le mécanisme sous-jacent de l’atonie musculaire est une inhibition spécifique durant le SP des motoneurones spinaux, les unités fonctionnelles contrôlant l’activité des muscles somatiques. Pendant le SP, ces motoneurones sont soumis à un intense bombardement synaptique par l’intermédiaire de la glycine, un puissant neurotransmetteur inhibiteur, provoquant l’hyperpolarisation de leur potentiel de membrane [6]. Nous avons récemment démontré qu’une petite région du pont dorsal, le noyau sublatérodorsal (SLD) formé de neurones glutamate excitateurs, est le générateur de l’atonie [7]. Dès lors, l’objectif de la présente étude publiée dans Nature Communications [8] a été de circonscrire la population de neurones GABA/glycine placée sous le contrôle de ce générateur et capable dès lors de promouvoir l’inhibition des motoneurones somatiques spécifiquement pendant le SP. Il existe, depuis plus de 30 ans, un débat scientifique acharné sur la localisation de ces neurones inhibiteurs : dans le bulbe rachidien à l’arrière du cerveau, ou directement dans la moelle épinière à proximité des pools motoneuronaux [9]. Pour faire progresser cette question, nous avons réalisé une série d’expériences anatomo-fonctionnelles couplant l’utilisation de marqueurs moléculaires, de traceurs rétrogrades, et des tâches comportementales chez le rat [8]. Nos résultats montrent clairement que seule la partie ventro-médiane du bulbe rachidien (vmM) contient des neurones glycine qui sont recrutés pendant le SP et sont connectés aux motoneurones lombaires. D’autres neurones glycine se distribuent effectivement dans les couches VII et VIII de la moelle épinière, mais pratiquement aucun n’est activé pendant le SP, une condition sine-qua-non pour contribuer à l’expression de la paralysie du SP. Ces données anatomiques originales suggéraient fortement que les neurones glycine responsables de l’inhibition des motoneurones pendant le SP se trouvaient dans la vmM. Encore fallait-il apporter la preuve fonctionnelle de leur contribution physiologique supposée. Pour cela, nous avons utilisé des virus adéno-associés (AAV) véhiculant un ARNsh (short-hairpin RNA) bloquant spécifiquement les ARN messagers codant le vGAT (vesicular GABA transporter), le transporteur vésiculaire du GABA (acide gamma-aminobutyrique) et de la glycine, pour induire génétiquement la suppression de la transmission inhibitrice issue de la vmM. Une fois injectés in situ, ces vGAT-ARNsh bloquent de façon irréversible les ARN messagers codant le vGAT. Les neurones transfectés demeurent fonctionnels, mais incapables de libérer leurs neurotransmetteurs inhibiteurs (GABA/glycine) au niveau de leurs cibles post-synaptiques, c’est-à-dire les motoneurones spinaux. Après avoir injecté bilatéralement ces vGAT-ARNsh dans la vmM de rats préparés pour la polysomnographie1,, nous avons étudié longitudinalement l’impact sur leur cycle veille-sommeil et l’expression du SP [8]. Un mois après le traitement, les animaux ont un comportement normal pendant l’éveil, y compris sur le plan locomoteur. Les rythmes circadien et ultradien des états de vigilance ne sont pas sensiblement modifiés, à l’exception de la durée raccourcie des épisodes de SP (de 25 %) en raison de réveils abrupts. L’analyse des enregistrements électromyographiques couplés à la vidéo met en évidence que, dès leur entrée en SP, les rats subissent une augmentation du tonus musculaire en lieu et place de l’atonie caractéristique. Ce tonus musculaire maintenu facilite alors l’exécution de mouvements et comportements oniriques2 souvent complexes, mimant la recherche de nourriture, ou celle de mouvements exploratoires et saltatoires très brusques précipitant le réveil. Hormis ces comportements anormaux, tout indique par ailleurs (avec un électroencéphalogramme [EEG] normal) que les rats sont bien endormis en SP, les yeux clos et déconnectés du monde extérieur.
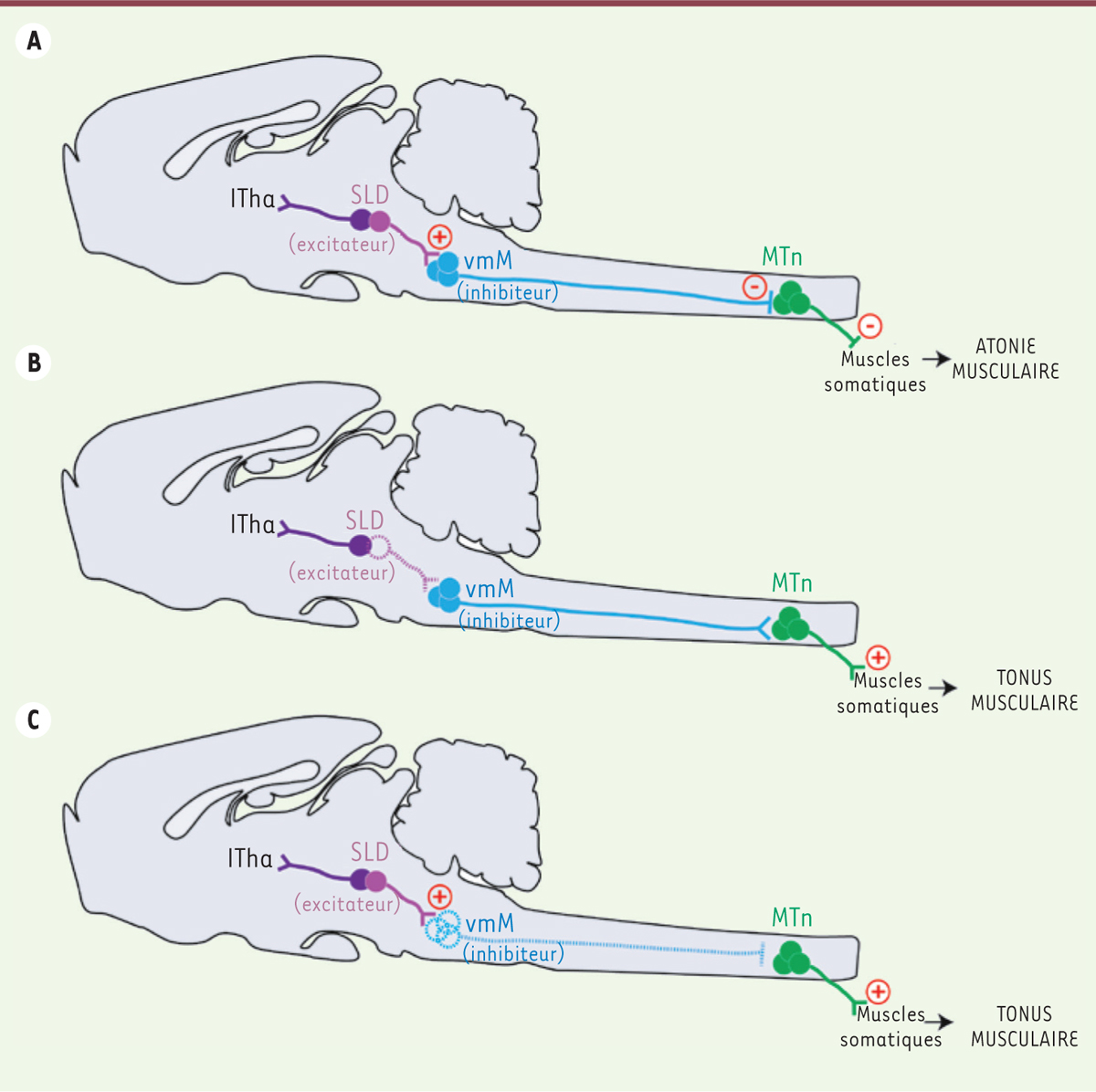
Nos données anatomiques et fonctionnelles convergent donc pour indiquer que les neurones inhibiteurs de la vmM jouent un rôle crucial dans l’expression de l’atonie du SP, car la perte de fonction obtenue génétiquement est suffisante pour maintenir un tonus musculaire pendant le SP et faciliter des comportements oniriques, un ensemble de symptômes rappelant ceux décrits chez les patients RBD [1, 2]. Fondé sur cette étude, nous proposons un modèle complet du réseau neuronal mis en jeu pendant le SP pour nous maintenir paralysés pendant que nous rêvons [7, 8]. Les neurones glutamate du SLD s’activeraient ainsi dès l’entrée en SP. Par leurs projections descendantes, ils exciteraient les neurones glycine inhibiteurs de la vmM. Ces derniers, via leurs axones voyageant tout le long de la moelle épinière, inhiberaient les pools de motoneurones somatiques, la musculature squelettique devenant atone et donc incapable de produire des contractions volontaires (Figure 1A).
| Figure 1. Le réseau neuronal contrôlant l’atonie musculaire pendant le SP fonctionnellement décrypté. A. Le noyau sublatérodorsal (SLD) contient deux populations neuronales : une ascendante vers le thalamus intralaminaire (ITha) corticofuge et une de nature glutamate descendante vers la partie ventro-médiane du bulbe rachidien (vmM). De son coté, la vmM contient des neurones GABA (acide γ-amino-butyrique)/glycine activés pendant le sommeil paradoxal (SP) par le SLD, qui envoient leurs axones inhibiteurs vers les motoneurones spinaux (MTn). L’atonie musculaire résulte de cette cascade d’événements synaptiques spécifique au SP. Le dysfonctionnement expérimental du SLD excitateur (B) ou de la vmM inhibitrice (C) conduit dans les deux cas à une suppression de l’hyperpolarisation des motoneurones, puisque l’atonie musculaire caractéristique du SP est perdue, permettant l’apparition de comportements moteurs anormaux. |
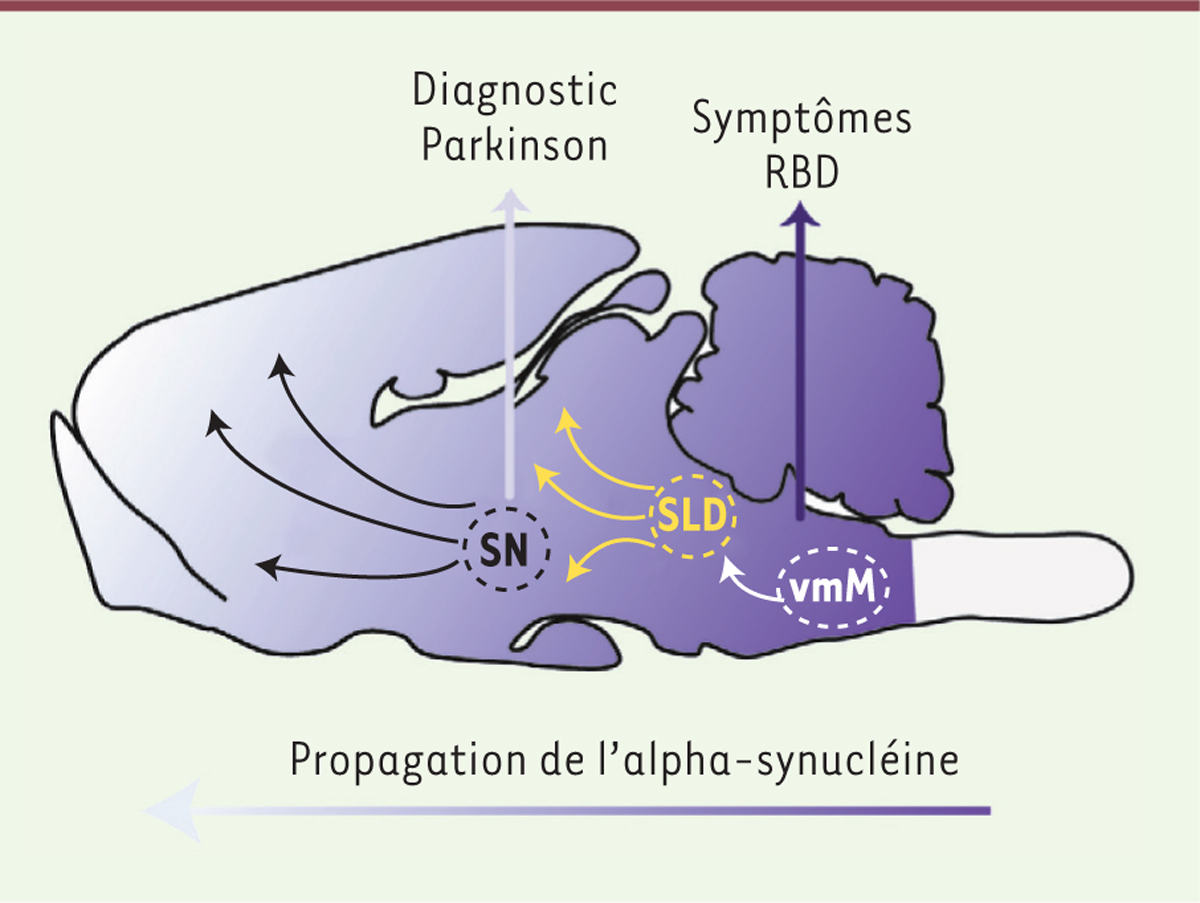
Un aspect important de nos travaux est leur contribution à une meilleure compréhension du RBD humain [7, 8]. Ils suggèrent en effet que la dégénérescence ou le dysfonctionnement d’une partie de ce réseau (Figure 1B et 1C) pourraient être sous-jacents aux symptômes neurologiques le définissant et fidèlement reproduits chez le rat. Soutenant nos conclusions, quelques études anatomo-pathologiques ont identifié chez des patients RBD des processus inflammatoires ou lésionnels dans des aires cérébrales correspondant au SLD et à la vmM des rongeurs [2, 4, 10]. D’ores et déjà, l’inactivation génétique du SLD ou de la vmM constitue des modèles animaux pertinents et simples du RBD pour élaborer des traitements spécifiques et efficaces. L’identification précise des régions cérébrales générant l’atonie, et potentiellement endommagées chez les patients RBD, donne par ailleurs quelques pistes sur les mécanismes potentiels sous-jacents à la haute prévalence de la phénoconversion du RBD en MP. Ainsi, notre hypothèse est que le réseau de l’atonie musculaire restreint au tronc cérébral inférieur serait ciblé précocement par une attaque α-synucléinopathique, concourant à l’étiologie du RBD. Elle se propagerait lentement au cours des années jusqu’à atteindre les neurones dopaminergiques de la substance noire, provoquant les symptômes moteurs cardinaux de la MP pour finalement envahir la majeure partie du système nerveux central (Figure 2). Cette propagation intracérébrale serait le résultat d’une transmission de cellule à cellule, via les voies d’interconnections cérébrales, selon un modèle de trans-conformation3, corruptive4, de l’α-synucléine, comme déjà suggéré pour la protéine prion [5, 11]. Grâce à nos connaissances maintenant complètes du réseau neuronal potentiellement ciblé, nous avons récemment entrepris de tester expérimentalement cette hypothèse en créant un modèle animal reproduisant finement les mécanismes physiopathologiques dépendants de l’α-synucléine et mis en jeu lors de la phénoconversion du RBD en MP.
| Figure 2. Hypothèse sur les mécanismes physiopathologiques sous-jacents à la phénoconversion du RBD en maladie de Parkinson. L’α-synucléinopathie affecterait d’abord les aires du tronc cérébral inférieur responsables de l’atonie musculaire pendant le sommeil paradoxal (SP), déclenchant le Rapid eye movement sleep behavior disorder (RBD). La pathologie se propagerait ensuite lentement vers l’avant du cerveau, causant les symptômes moteurs caractéristiques de la maladie de Parkinson (MP) quand les neurones dopaminergiques de la substance noire (SN) seraient atteints. |