Chaque année, en France, près de 11 000 nouveaux cas de mélanome sont diagnostiqués et 25 % des patients évoluent vers un stade métastatique. Le mélanome métastatique est un cancer cutané de mauvais pronostic. Des mutations oncogéniques touchant le gène codant la sérine/thréonine protéine kinase B-Raf (notamment la substitution en position 600 de la protéine d’une valine en acide glutamique, notée BRAFV600E) sont identifiées chez près de la moitié des patients. Ces patients dont les tumeurs expriment cette mutation sont éligibles à des thérapies ciblées reposant sur la combinaison d’inhibiteurs des activités kinases de B-Raf et de MEK (MAPK [mitogen-activated protein kinase]/ERK [extracellular signal-regulated kinase] kinase). La plupart des patients répondent à court terme à ces traitements, mais les effets thérapeutiques à long terme restent très insuffisants. En effet, la survie sans progression de la maladie à 3 ans n’est que de 22 % chez les patients traités par la combinaison de dabrafenib (un inhibiteur de B-Raf) et de trametinib (un inhibiteur de MEK) [1]. Les patients résistants aux thérapies ciblées et ceux qui ne sont pas éligibles à ces thérapies peuvent cependant recevoir des immunothérapies qui visent à réactiver les réponses du système immunitaire contre les cellules de mélanome. Les immunothérapies, fondées notamment sur l’administration d’anticorps monoclonaux anti-CTLA-4 (cytotoxic T-lymphocyte–associated antigen 4), comme l’ipilimumab, et anti-PD-1 (programmed cell death 1), comme le nivolumab ou le pembrolizumab, qui neutralisent ces points de contrôle du système immunitaire, s’accompagnent d’un taux initial de réponse moins important que celles obtenues avec les thérapies ciblées. Toutefois, les réponses sont plus soutenues dans le temps : la survie sans progression à 3 ans atteint 39 % chez les patients traités par la combinaison d’ipilimumab et de nivolumab [2].
Bien qu’immunogènes, les cellules de mélanome résistent à l’action du système immunitaire par des mécanismes de résistance primaire, adaptative ou secondaire [3]. En ce qui concerne la résistance adaptative, l’expression de points de contrôle, comme CTLA-4 et PD-1, à la surface des lymphocytes T spécifiques des cellules de mélanome, constitue un véritable frein moléculaire. Celui-ci contribue en effet à l’épuisement lymphocytaire et à l’échappement des cellules tumorales au système immunitaire. Ainsi, l’utilisation thérapeutique des anticorps ciblant CTLA-4 et PD-1 a révolutionné le pronostic du mélanome métastatique. Toutefois, près de 40 % des patients ne répondent pas à ces immunothérapies et la majorité d’entre eux développent des effets indésirables liés à des réactions auto-inflammatoires, voire auto-immunes [2]. La plupart des effets indésirables sont réversibles et/ou peuvent être traités par corticothérapie. Néanmoins, des effets indésirables sévères, comme la colite réfractaire à la corticothérapie, imposent l’arrêt du traitement et l’introduction d’un anti-inflammatoire puissant, l’infliximab, un anticorps dirigé contre le TNFα (tumor necrosis factor ±), dont les conséquences sur la réponse immunitaire anti-tumorale restent pourtant en grande partie inconnues [4].
Le TNFα a été initialement décrit pour ses propriétés anti-cancéreuses : de fortes doses de cette cytokine conduisent en effet in vitro à la mort de cellules de fibrosarcomes murins et à la nécrose tumorale chez la souris [5]. Il a été montré que le TNFα induisait une mort cellulaire apoptotique, dépendante de l’activation des caspases, ou, alternativement, une nécroptose, qui repose sur la kinase RIP (receptor-interacting protein kinase). La plupart des cellules cancéreuses, y compris les cellules de mélanome, résistent à la mort induite par le TNFα en raison de leur forte expression de protéines anti-apoptotiques (comme cFLIP [cellular FLICE-inhibitory protein], Bcl-2 [B-cell lymphoma-2], Mcl-1 [myeloid cell leukemia-1], et les IAP [inhibitor of apoptosis]) et de leur faible expression de RIPK3 (receptor-interacting protein kinase 3), essentielle à la nécroptose. Les essais cliniques réalisés chez l’homme, fondés sur l’administration systémique de TNFα chez des patients atteints de cancer avancé ont par ailleurs montré une faible efficacité thérapeutique, ainsi que des intolérances majeures se traduisant par une auto-inflammation, une cardiotoxicité et une hépatotoxicité. L’administration de TNFα recombinant, en association avec des agents alkylants (comme le Melphalan) dans des protocoles de perfusion de membres isolés1, permet toutefois le traitement loco-régional de mélanome et de sarcome chez les patients [6].
Le TNFα produit par les lymphocytes T CD8 ne joue qu’un rôle secondaire dans la cytotoxicité à médiation cellulaire [7]. Sa production facilite par contre une dédifférenciation des cellules de mélanome, associée à la perte de l’expression des antigènes mélanocytaires, perte contribuant à l’échappement des tumeurs au contrôle par le système immunitaire [8]. Dans le microenvironnement tumoral, le TNFα participe à une inflammation chronique. Il facilite également l’angiogenèse tumorale ainsi que le développement d’un environnement immunosuppresseur pro-tumoral. Il stimule par exemple l’infiltration dans les tumeurs de cellules immunosuppressives, comme les MDSC (myeloid-derived suppressor cells) [9], ainsi que l’expression à la surface des cellules cancéreuses de PD-L1 (programmed cell death-ligand 1), le ligand de PD-1 [10].
Afin de comprendre le rôle du TNFα et de son récepteur, le TNFR1, dans la progression du mélanome, nous avons examiné au Centre de recherches en cancérologie de Toulouse (CRCT) si le TNFα pouvait exercer un effet inhibiteur sur les lymphocytes T CD8+ spécifiques des cellules de mélanomes. Les lymphocytes T CD8 activés expriment en effet le TNFR1 et la signalisation qui résulte de la liaison du TNFα à ce récepteur induit un processus d’apoptose des cellules, appelé activation-induced cell death (AICD). La signalisation TNFα-TNFR1 constituerait donc un point de contrôle supplémentaire au cours de la réponse anti-mélanome (Figure 1). Un déficit génétique de TNFα (ou de son récepteur) ou son inhibition pharmacologique dans un modèle de mélanome murin s’accompagne d’une augmentation de l’infiltration tumorale de lymphocytes T CD8+ et d’une diminution de la croissance tumorale [11].
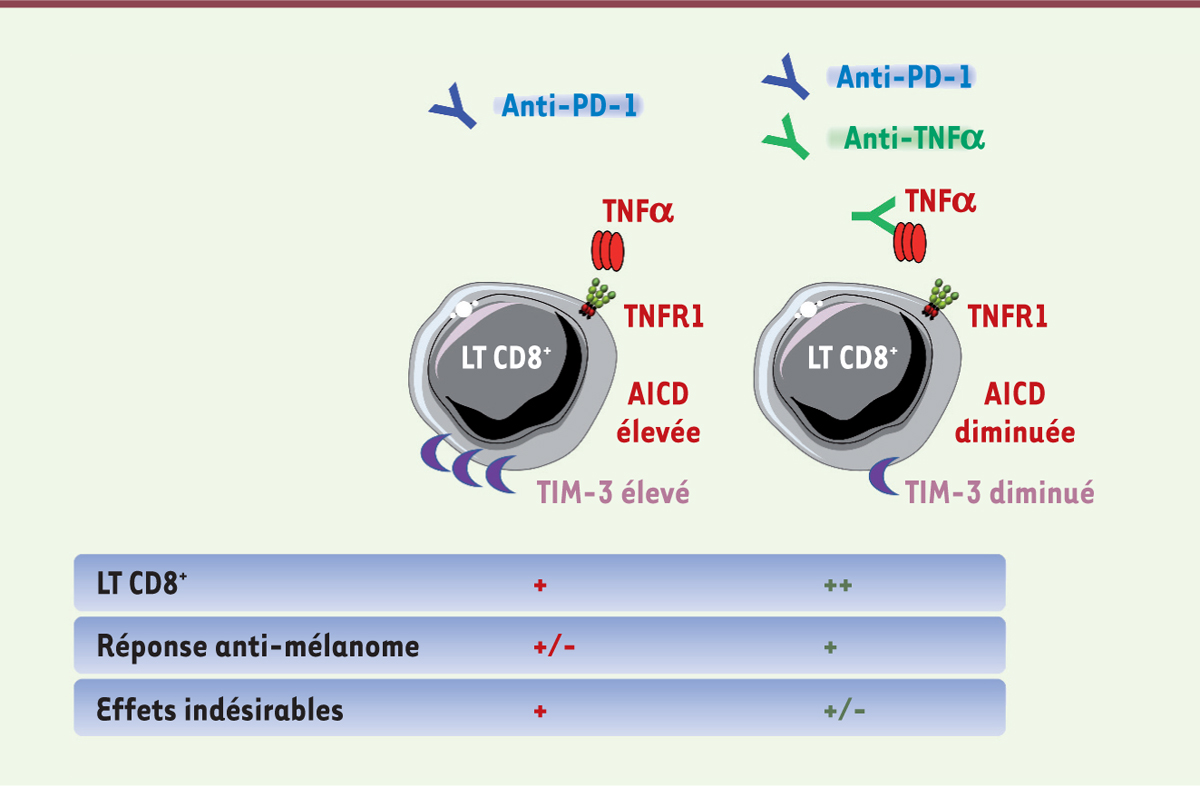
| Figure 1. Les anti-TNFα augmentent la réponse des anti-PD-1 contre le mélanome. Le TNFα (tumor necrosis factor ±) est produit par les lymphocytes T CD8+ (LT CD8+) qui infiltrent les tumeurs de mélanome. La signalisation initiée par la liaison du TNFα à son récepteur (TNFR1) freine l’accumulation de ces lymphocytes, facilitant l’échappement immunitaire des cellules de mélanome. Le traitement par un anticorps anti-PD-1 (clone RMP1–14 ; 10 mg/kg) s’accompagne d’une activation lymphocytaire associée, entre autres, à la production de TNFα dans le microenvironnement tumoral. Le TNFα conduit à l’augmentation de l’expression à la surface des LT CD8+ de TIM-3 (T-cell immunoglobulin and mucin-domain containing-3), un point de contrôle immunitaire secondaire et à la mort cellulaire de ces lymphocytes induite par leur propre activation (activation-induced cell death, AICD), ce qui limite la réponse thérapeutique des anti-PD-1 contre les mélanomes. L’anti-TNFα neutralisant (clone XT3.11; 10 mg/kg) permet une accumulation des LT CD8+ au sein des tumeurs, prévient l’expression de TIM-3 et bloque l’AICD en réponse aux anti-PD-1, induisant ainsi des rejets tumoraux fréquents dans des modèles précliniques de cancer. |
Dans des modèles précliniques de mélanome, de cancer du poumon et de cancer du sein, nous avons montré que la neutralisation du TNFα ou du TNFR1 potentialise la réponse aux traitements anti-PD-1 [12]. L’expression de PD-L1 est en effet augmentée à la surface des lymphocytes T CD8+ et des cellules dendritiques infiltrant les tumeurs par un mécanisme qui implique le TNFα. Cette observation est en accord avec le rôle décrit du TNFα dans la stabilisation de PD-L1 par un processus de déubiquitination qui dépend de CSN5 (COP9 signalosome subunit 5 ou Jun activation domain-binding protein 1) [10]. Nous avons également observé une légère diminution de la proportion des lymphocytes T CD8+ producteurs d’IFN-g (interféron gamma) chez les souris déficientes en TNFα, ce qui pourrait contribuer à limiter l’expression de PD-L1 à la surface des leucocytes infiltrant la tumeur. Il est à noter que le déficit en TNFα s’accompagne d’une augmentation de la proportion des lymphocytes T CD8+ producteurs de granzyme B, suggérant que, malgré l’absence de TNFα et la légère baisse de production d’IFN-g, les lymphocytes T CD8+ infiltrant la tumeur conservent un potentiel cytotoxique. Des anticorps anti-TNFα peuvent prévenir l’AICD des lymphocytes T CD8+ en réponse aux anti-PD-1, ainsi que l’expression de TIM-3 (T-cell immunoglobulin and mucin-domain containing-3), un point de contrôle secondaire impliqué dans la résistance aux anti-PD-1 (Figure 1) [13] (→).
(→) Voir la Synthèse de C. Granier et al., m/s n° 3, mars 2018, page 231
Des analyses de bio-statistique et de bio-informatique indiquent également que l’expression de TNFα dans les biopsies de mélanomes humains (données TCGA, the cancer genome atlas du mélanome) est associée à une signature génique d’immuno-échappement qui est corrélée, notamment à l’expression de TIM-3 et de PD-L1 [12].
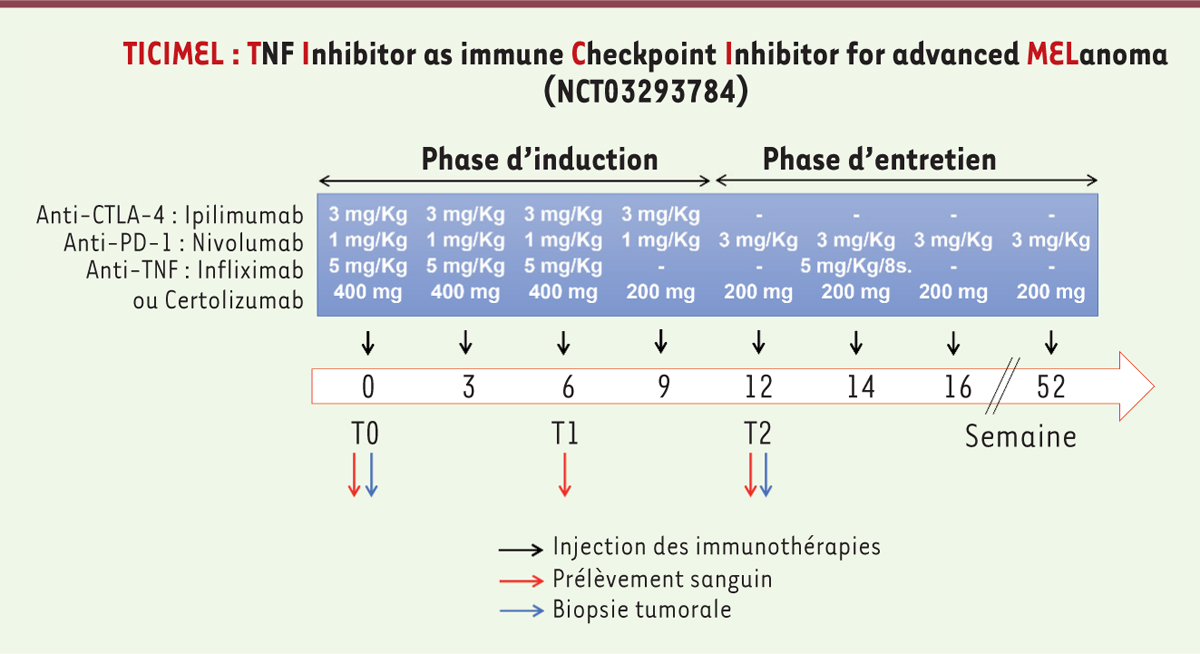
Toutes ces données constituent le rationnel scientifique de l’essai clinique d’immunothérapie TICIMEL (NCT03293784)2,. TICIMEL cherche à évaluer, chez 30 patients atteints de mélanome avancé, la tolérance de la combinaison d’une immunothérapie fondée sur l’injection d’anticorps anti-points de contrôle de la réponse immune et d’un anticorps anti-TNFα (Figure 2). Ce protocole consistera en la co-administration de l’ipilimumab et du nivolumab, qui ciblent respectivement CTLA-4 et PD-1, toutes les 3 semaines pendant une phase d’induction de 3 mois. La phase d’entretien reposera sur l’administration de nivolumab pendant 12 mois. Les anticorps anti-TNFα seront co-administrés au cours des deux phases de ce traitement (Figure 2). Deux groupes initiaux de 6 patients, tous traités par ipilimumab et nivolumab et recevant un anti-TNFα, le certolizumab-pegol3, ou l’infliximab4, de puissants anticorps à activité anti-inflammatoire habituellement prescrits pour le traitement de maladies auto-immunes, ont déjà été constitués. Ces deux traitements anti-TNFα diffèrent par leurs natures moléculaires et leurs voies d’administration. Les patients du premier groupe sont traités par le certolizumab-pegol, un fragment d’anticorps (Fab’, antigen-binding fragment) anti-TNFα humanisé couplé au polyéthylène glycol pour accroître sa demi-vie, administré par voie sous-cutanée. L’absence de région Fc dans cette molécule permet d’éviter l’activation du complément et l’induction d’une ADCC (antibody-dependent cell-mediated cytotoxicity), susceptible de conduire à l’élimination de populations lymphocytaires T effectrices comme les lymphocytes T effecteurs mémoires CD45RA+ (TEMRA), qui peuvent exprimer du TNFα à leur membrane. Les patients du deuxième groupe sont traités par l’infliximab, un anti-TNFα chimérique (dont la région Fc est de type IgG1 [immunoglobuline d’isotype G1] humaine) de première génération, injecté par voie intraveineuse. Le choix de l’infliximab repose sur son utilisation consensuelle pour la gestion des colites réfractaires aux corticothérapies induites par les immunothérapies du mélanome, sans que l’on connaisse précisément les conséquences sur la réponse immunitaire anti-cancéreuse. Dans cet essai, l’impact de ces combinaisons sur la réponse thérapeutique, les effets indésirables et la réponse immunitaire seront évalués. En fonction des résultats cliniques et biologiques obtenus et notamment de la sécurité d’emploi de cette triple association, de nouveaux essais seront conduits intégrant une cohorte plus importante constituée de 18 patients traités par ipilimumab et nivolumab en combinaison avec le traitement anti-TNFα ayant montré la meilleure efficacité clinique, tant au niveau de la réponse anti-tumorale que de la diminution des effets indésirables induits par l’injection des anticorps anti-points de contrôle de la réponse immune.
| Figure 2. Essai clinique TICIMEL chez les patients atteints de mélanome avancé. L’essai clinique repose sur (1) une phase d’induction avec co-administration toutes les 3 semaines des anticorps anti-points de contrôle de la réponse immune (3 mg/kg d’ipilimumab et 1 mg/kg de nivolumab) et de l’un des deux anti-TNFα (5 mg/kg d’infliximab ou 200 ou 400 mg de certolizumab-pegol) ; (2) une phase d’entretien avec co-administration toutes les 2 semaines de nivolumab (3 mg/kg) et de l’un des deux anti-TNFα (5 mg/kg d’infliximab toutes les 8 semaines ou 200 mg de certolizumab-pegol toutes les 2 semaines). Il est à noter que le schéma d’administration de l’ipilimumab et du nivolumab est conforme à l’autorisation de mise sur le marché. Avant induction (T0), 6 semaines (T1) et 12 semaines (T2) après induction, un prélèvement sanguin et/ou une biopsie tumorale sont effectués pour permettre l’analyse de l’évolution de la réponse immunitaire chez les patients. |
Nos résultats précliniques suggèrent que les traitements anti-TNFα pourraient exercer une double action chez les patients atteints de mélanome avancé : d’une part, en augmentant la réponse immunitaire contre les cellules de mélanome et, d’autre part, en diminuant les effets indésirables d’auto-inflammation induits par les immunothérapies.
Ce projet est une parfaite illustration de l’intérêt de la structuration transversale de la recherche clinico-biologique, réalisée à l’Oncopôle de Toulouse, permettant une vision multidisciplinaire de la maladie cancéreuse et un transfert rapide des données fondamentales vers la clinique.