| |
| Med Sci (Paris). 34(10): 842–848. doi: 10.1051/medsci/2018210.Progrès de la thérapie génique Espoirs pour le syndrome d’Usher Charlotte Calvet,1,2,3 Ghizlene Lahlou,1,2,3 and Saaid Safieddine1,2,3,4* 1Institut Pasteur, Unité de génétique et physiologie de l’audition, 25, rue du Docteur Roux, 75724Paris, Cedex 15, France 2Inserm UMRS 1120, 75015Paris, France 3Sorbonne Universités, 75005Paris, France 4CNRS, UMRS 1120, 75015Paris, France |

La surdité, parfois associée à des troubles de l’équilibre, est le déficit sensoriel le plus fréquent chez l’homme. Il peut s’agir d’une surdité de transmission due à une atteinte de l’oreille externe ou moyenne, ou d’une surdité de perception (ou surdité neurosensorielle) due à un dysfonctionnement de l’oreille interne ou des voies auditives centrales. L’atteinte de la cochlée, organe sensoriel de l’audition, et plus particulièrement des cellules sensorielles auditives, représente la cause la plus fréquente de surdité d’origine génétique, et on estime qu’environ 80 % des cas de surdité congénitale sont d’origine génétique. À ce jour, une centaine de gènes ont été identifiés comme responsables de surdité isolée, et plusieurs centaines ont été impliqués dans les surdités syndromiques (i.e., où la surdité est associée à d’autres anomalies en dehors du système auditif). Cependant, de nombreux gènes impliqués dans des formes rares de surdité restent à identifier1. Aucun traitement curatif des surdités neurosensorielles d’origine génétique n’existe à ce jour, soulignant ainsi le potentiel d’une approche de thérapie génique dans ce domaine. La thérapie génique consiste à introduire, à l’aide d’un vecteur, un gène correctif dans des cellules d’un patient ou à modifier directement le génome de ces cellules dans un but thérapeutique. Grâce à une meilleure connaissance de la génétique humaine et à la découverte de nouveaux vecteurs de transfert de gènes, une thérapie génique curative est désormais sérieusement envisageable pour diverses maladies. Plusieurs essais cliniques de thérapie génique sont actuellement en cours chez l’homme pour le traitement de maladies cardiovasculaires, métaboliques, neurodégénératives, ou cancéreuses2, mais un seul essai de phase I/II a été entrepris pour le traitement des surdités neurosensorielles acquises. L’approche de thérapie génique des surdités la plus activement étudiée est celle qui vise à remplacer le gène défectueux ou à augmenter son expression afin de rétablir un fonctionnement cochléaire et/ou vestibulaire normal. |
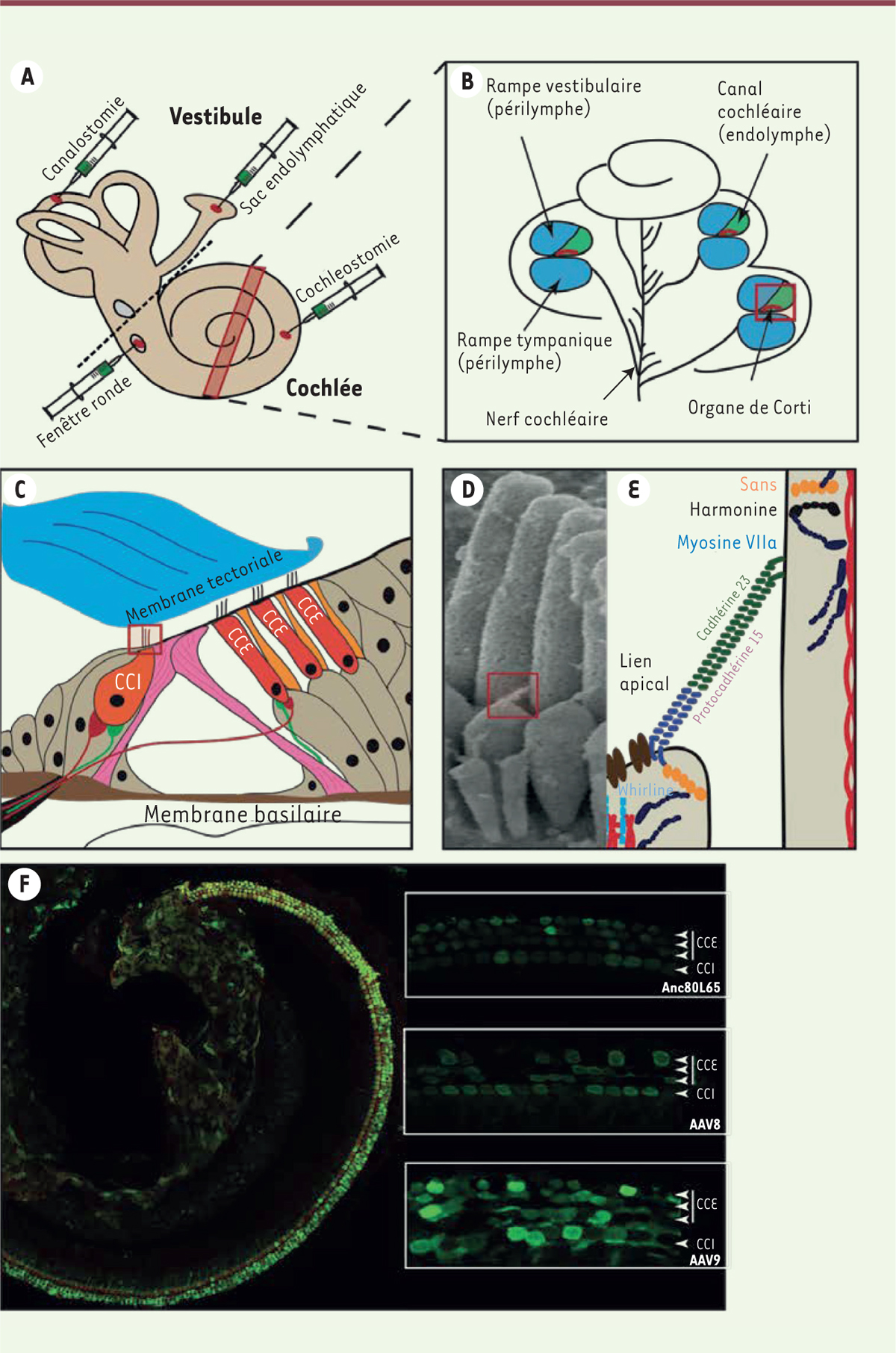
Les voies possibles d’administration La présence d’une barrière hémato-cochléaire (barrière hémato-périlymphatique) empêche la diffusion de nombreux agents thérapeutiques ou molécules vers les cellules cibles de l’oreille interne, avec pour conséquence une réduction de l’effet thérapeutique d’une administration de type systémique. Une thérapie locale intra-cochléaire serait ainsi plus efficace. L’oreille interne est facilement accessible. Elle constitue un compartiment liquidien isolé du reste de l’organisme, ce qui limite la diffusion systémique des agents thérapeutiques et, par conséquent, leurs effets secondaires potentiels. Les voies de transfert d’agents thérapeutiques dans l’oreille interne peuvent être divisées en trois catégories principales résumées schématiquement dans la Figure 1.
 | Figure 1. A. Représentation schématique de l’oreille interne (cochlée et vestibule) et des différentes voies d’injection : cochléostomie, fenêtre ronde, sac endolymphatique et canalostomie. B. Coupe transversale de la cochlée, où on distingue les rampes vestibulaire et tympanique contenant la périlymphe (bleu) ; le canal cochléaire rempli d’endolymphe (vert) et où se loge l’organe de Corti (rouge). C. Fort grossissement du canal cochléaire montrant l’organe de Corti entre les membranes tectoriale (en haut) et basilaire (en bas), et contenant les cellules sensorielles auditives : cellules ciliées internes (CCI) et cellules ciliées externes (CCE). D. Image obtenue au microscope électronique à balayage montrant l’organisation de la touffe ciliaire des CCI encadrée dans (C). E. Illustration schématique des composants moléculaires du lien apical encadré en (D). F. Images obtenues en microscopie confocale d’un organe de Corti doublement marqué pour la myosine VI (en rouge) et pour la green fluorescent protein (GFP, en vert) après injection intra-cochléaire d’un vecteur viral AAV recombinant permettant l’expression de la GFP (gène rapporteur) dans les cellules transduites. Les encarts sont des forts grossissements montrant le profil de transduction des cellules sensorielles auditives par l’AAV8, l’AAV9 et l’Anc80L65. |
L’approche périlymphatique peut être réalisée soit par diffusion, soit par injection directe à travers la membrane de la fenêtre ronde. Dans le premier cas, l’agent thérapeutique est déposé dans l’oreille moyenne après une injection trans-tympanique. Il diffuse ensuite de façon passive à travers la membrane de la fenêtre ronde. Dans le deuxième cas, l’agent thérapeutique est directement injecté dans l’oreille interne, après un abord chirurgical de l’oreille moyenne [1 2 3]. Il diffuse alors dans l’espace périlymphatique, au-delà du site d’injection. La deuxième voie de transfert possible est l’approche endolymphatique. Elle permet d’atteindre directement le compartiment abritant l’organe de Corti, l’organe sensoriel de l’audition, soit par injection dans le sac endolymphatique, soit par cochléostomie [4], c’est-à-dire directement dans le canal cochléaire. L’injection à travers un canal semi-circulaire (canalostomie) permet une approche à la fois périlymphatique et endolymphatique [5]. L’association de deux approches est également envisageable, notamment la combinaison d’une canalostomie et d’une injection à travers la membrane de la fenêtre ronde [6]. |
Les vecteurs de transfert En thérapie génique, le transfert du matériel génétique nécessite un vecteur qui cible les cellules d’intérêt. L’efficacité de plusieurs vecteurs de transfert a été testée dans l’oreille interne. Les vecteurs non viraux, comme les nanoparticules (liposomes), sont facilement manipulables. Ils présentent l’avantage de protéger et de libérer de façon contrôlée l’agent thérapeutique, mais ces vecteurs ne permettent qu’une expression transitoire du gène thérapeutique. Ils ne peuvent à eux seuls cibler spécifiquement certaines cellules de l’oreille interne [7]. Bien que des études in vitro et in vivo aient montré l’utilité de ces nanoparticules comme vecteur de transfert de gènes, seul un nombre relativement faible d’essais cliniques de thérapie génique les utilisant sont en cours de développement [8]. Le nombre d’essais cliniques dans lesquels des vecteurs viraux ont été utilisés comme moyen de transfert de gènes in vivo ne cesse d’augmenter depuis les quinze dernières années3 [17] (→). (→) Voir la Synthèse de H. Khabou et D. Dalkara, m/s n° 5, mai 2015, page 529 Les vecteurs viraux utilisés en thérapie génique sont des virus dont les séquences de réplication et de virulence ont été remplacées par le gène d’intérêt. Ils ont l’avantage d’infecter efficacement aussi bien les cellules mitotiques que post-mitotiques, et leur capside confère au matériel génétique qu’ils hébergent une protection, ce qui permet d’augmenter l’efficacité du transfert de l’agent thérapeutique. Différents vecteurs viraux ont été testés dans l’oreille interne, notamment les lentivirus, les adénovirus, et les virus adéno-associés (AAV) [9]. Malgré une capacité de transfert limitée aux transgènes thérapeutiques qui ne dépassent guère la taille de 4,5 kilobases, les AAV semblent être les vecteurs viraux les plus prometteurs pour une telle thérapie. Les AAV sont en effet caractérisés par une grande stabilité. Ils sont capables de résister à de larges variations de température et de pH, avec peu ou pas de perte d’activité. Ils présentent également un large tropisme pour de nombreux types de cellules et de tissus, faisant d’eux des outils idéaux pour la plupart des applications, y compris la thérapie génique des surdités. D’autres caractéristiques ont contribué à encourager l’utilisation des AAV, en particulier la découverte de nouveaux sérotypes dont la spécificité cellulaire permet d’améliorer grandement l’efficacité de la thérapie [9]. La diversité des sérotypes d’AAV permet ainsi d’élargir le champ de cellules à cibler selon la maladie à traiter. Un effort d’ingénierie a d’ores et déjà conduit à une amélioration significative de l’efficacité de transduction des AAV, soit en utilisant des promoteurs spécifiques des cellules ciblées, soit en modifiant génétiquement la capside virale, soit en ajoutant des séquences régulatrices, comme la séquence WPRE (woodchuck hepatitis virus post-transcriptional regulatory element), qui permettent une meilleure stabilisation des transcrits [10]. Ces recherches ont récemment abouti à la production d’une nouvelle génération d’AAV synthétiques, comme l’Anc80L65 [11], vecteur ayant montré des taux de transduction des cellules ciliées de l’oreille interne inégalés à ce jour [12]. |
Thérapie génique du syndrome d’Usher Le syndrome d’Usher (USH) représente la principale cause génétique de surdité associée à une cécité dans le monde, avec une incidence estimée à 1/6 000 naissances [13]. Il en existe trois types cliniques (USH1, USH2 et USH3) classés selon la sévérité et la précocité de l’atteinte auditive, la présence ou non d’une atteinte de l’équilibration, et l’âge d’apparition de l’atteinte rétinienne4 [18] (→). (→) Voir la Synthèse de A. El-Amraoui et al., m/s, n° 8-9, août-septembre 2005, page 737 Actuellement, 10 gènes responsables ont été identifiés (Tableau I et Figure 1) et les récentes avancées réalisées dans le cadre de la thérapie génique permettent désormais d’envisager la possibilité de développer un traitement curatif de ce syndrome [2, 3, 14]. Tableau I
|
Surdité |
Phénotype Atteinte vestibulaire |
Rétinite pigmentaire |
Locus |
Gène |
Protéine |
Fonction |
Localisation |
| Usher de type 1 |
Congénitale profonde |
Aréflexie vestibulaire bilatérale congénitale |
Début prépubertaire |
USH1B |
MYO7A |
myosine VIIa |
Protéine motrice : transport des autres protéines USH le long des filaments d’actine du stéréocil |
Autour de l’extrémité intracellulaire du lien apical Plaque cuticulaire |
|
|
|
USH1C |
USH1C |
harmonine |
Protéine d’échafaudage : lien entre les protéines du lien apical et le cytosquelette d’actine |
Autour de l’extrémité intracellulaire du lien apical |
|
|
|
USH1D |
CDH23 |
cadhérine 23 |
Protéine d’adhérence intercellulaire constitutive du lien apical |
Partie supérieure du lien apical |
|
|
|
USH1F |
PCDH15 |
protocadhérine 15 |
Protéine d’adhérence intercellulaire constitutive du lien apical |
Partie inférieure du lien apical |
|
|
|
USH1G |
USH1G |
Sans |
Protéine d’échafaudage : lien entre les protéines du lien apical et le cytosquelette d’actine |
Autour de l’extrémité intracellulaire du lien apical |
|
|
|
USH1J |
CIB2 |
CIB2 |
Protéine de liaison au Ca2+ et à l’intégrine |
Autour de l’extrémité intracellulaire du lien apical |
|
| Usher de type 2 |
Congénitale moyenne à sévère, d’évolution progressive |
Normal |
Début postpubertaire |
USH2A |
USH2A |
ushérine |
Protéine d’adhérence intercellulaire impliquée dans le lien basal des stéréocils |
Expression transitoire à la base du stéréocil durant le développement embryonnaire |
| USH2C |
GPR98 |
VGLR1 |
Protéine G couplée au récepteur impliquée dans le lien basal |
|
|
|
USH2D |
WHRN |
whirline |
Élongation du stéréocil |
Extrémité supérieure du stéréocil |
|
| Usher de type 3 |
Postlinguale, moyenne d’évolution progressive |
Variable |
Variable |
USH3A |
CLRN1 |
clarine-1 |
Protéine transmembranaire d’interaction impliquée dans l’activité de mécano-transduction et la localisation des composants synaptiques |
Apex des stéréocils Base des cellules ciliées (synapse) |
Les syndromes d’Usher : phénotypes, gènes et protéines associés. Comparaison des phénotypes liés à l’atteinte cochléaire, à l’atteinte vestibulaire, et à la rétinite pigmentaire dans chaque type clinique du syndrome d’Usher (types 1, 2 et 3). Les gènes et protéines impliqués sont listés, et la fonction et la localisation de ces protéines sont détaillées. |
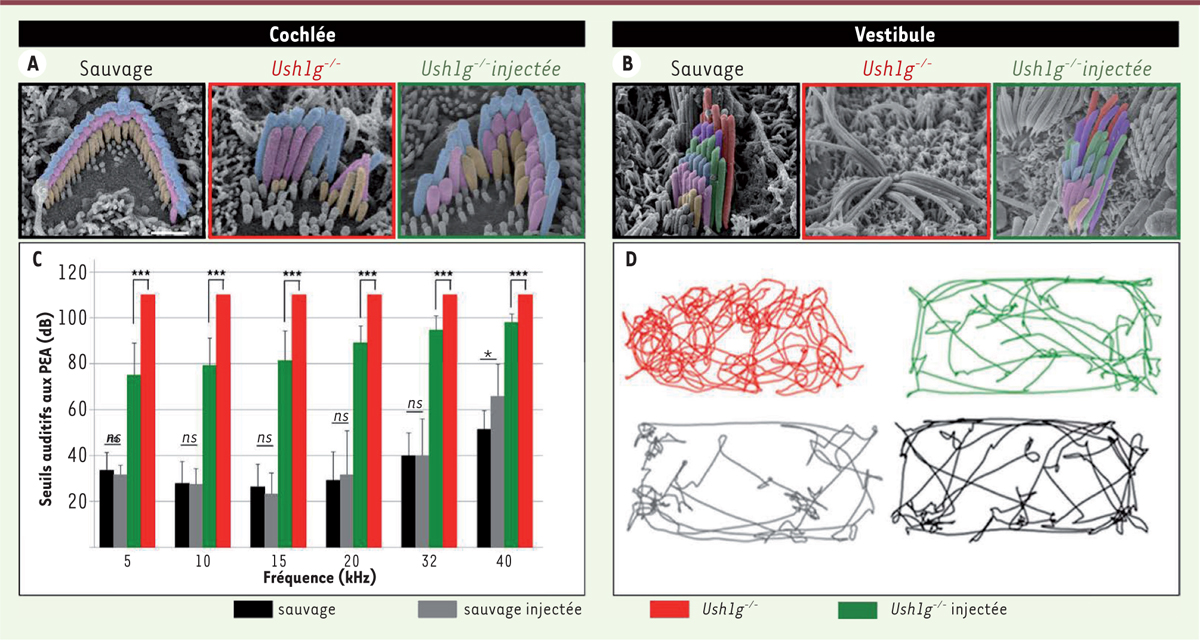
Des modèles murins des différentes formes génétiques de ce syndrome ont été produits, et des essais de thérapie génique in vivo dans certains de ces modèles ont montré des résultats encourageants pour le développement d’un traitement de la surdité et des troubles de l’équilibration. Une de ces études concerne le syndrome d’Usher de type 2D (USH2D), caractérisé par une surdité progressive moyenne à sévère sans déficit vestibulaire. Il est lié à des mutations du gène WHRN codant la protéine whirline [14]. Les souris dont le gène Whrn a été invalidé (souris Whrn-/-), considérées comme un modèle du syndrome d’USH2D, présentent à la fois une surdité profonde et une atteinte vestibulaire sévère contrairement aux patients. Ce modèle présente donc des caractéristiques différentes de ce qui est observé chez l’homme. Néanmoins, cette étude a permis de montrer que l’administration néo-natale par canalostomie de l’ADN codant la whirline chez ces souris restaure complètement la fonction vestibulaire mais seulement partiellement l’audition. Cette différence d’efficacité pourrait s’expliquer par un faible taux de transduction des cellules sensorielles auditives [14]. Le syndrome d’Usher de type 1G (USH1G) est lié à des mutations dans le gène SANS, codant la protéine du même nom (Sans, scaffold ankyrin and sterile alpha motif-containing protein) [15]. Cette forme clinique est l’une des plus sévères du syndrome d’Usher. Les patients USH1G naissent avec une surdité profonde associée à des troubles sévères de l’équilibration qui sont suivis d’une atteinte rétinienne progressive évoluant vers la cécité. Cette perte visuelle entrave la lecture labiale et limite la compensation des troubles vestibulaires, aggravant ainsi le handicap de ces patients. Comme chez l’homme, les souris invalidées pour le gène SANS (souris Ush1g-/-
) présentent une surdité profonde et un déficit vestibulaire [15]. Ces anomalies sont dues à la dégénérescence précoce de la touffe ciliaire des cellules sensorielles cochléaires et vestibulaires. Le transfert viral de l’ADNc (ADN complémentaire) codant la protéine Sans aux cellules sensorielles de l’oreille interne à travers la fenêtre ronde chez des souris Ush1g-/-
à la naissance restaure la structure des cellules sensorielles auditives et vestibulaires et rétablit durablement la fonction d’équilibration de ces souris, alors qu’il n’améliore que partiellement leurs seuils auditifs (Figure 2). La différence de récupération des fonctions cochléaire et vestibulaire constatée est probablement due à un taux de transduction des cellules cochléaires plus faible que celui des cellules vestibulaires. Un résultat important de cette étude est la démonstration que la fenêtre temporelle pour un traitement efficace de cette forme de surdité est plus large que ce que l’on présupposait, puisque les souris mutantes ont déjà à la naissance de sévères anomalies structurales des cellules sensorielles de l’oreille interne que la thérapie génique a permis de corriger. Ces résultats ouvrent ainsi de nouvelles perspectives pour une thérapie génique des troubles cochléaires et vestibulaires liés à une anomalie de la morphogénèse de l’appareil de transduction mécano-électrique des cellules sensorielles, i.e. leur touffe ciliaire.
 | Figure 2. Le transfert viral de l’ADNc codant la protéine Sans restaure la structure et la fonction des cellules sensorielles de l’oreille interne. Images obtenues au microscope électronique à balayage montrant l’organisation de la touffe ciliaire des cellules ciliées externes cochléaires (A) et des cellules ciliées vestibulaires (B) d’une souris sauvage comparée à celle d’une souris Ush1g-/- non traitée et d’une souris Ush1g-/- traitée. C. Histogramme des potentiels évoqués auditifs des souris sauvages non injectées, sauvages injectées, Ush1g-/- non injectées, et Ush1g-/- injectées, montrant une amélioration significative des seuils auditifs sur toutes les fréquences testées. D. Suivi vidéo des souris sauvages, sauvages injectées, Ush1g-/- non injectées, et Ush1g-/- injectées, montrant le rétablissement d’un comportement normal chez les souris Ush1g-/- injectées, similaire à celui des souris sauvages. Les souris Ush1g-/- présentent quant à elles un comportement de rotation permanente (circling behavior) dû à l’atteinte vestibulaire. |
Un modèle murin du syndrome d’Usher de type USH1C a récemment fait l’objet d’une étude de thérapie génique dans un but curatif. Le syndrome de type USH1C est dû à des mutations du gène codant l’harmonine, une protéine essentielle à la cohésion de la touffe ciliaire des cellules sensorielles auditives et vestibulaires au cours du développement [19] (→). (→) Voir la Nouvelle de N. Grillet, m/s n° 11, novembre 2009, page 903 Comme Sans, l’harmonine fait partie intégrante de la machinerie de transduction mécano-électrique. Les souris modèles d’USH1C sont caractérisées comme chez l’homme par une surdité profonde et une atteinte sévère de l’équilibration. L’injection intra-cochléaire d’un nouvel AAV synthétique, Anc80L65, comme vecteur de transfert du gène de l’harmonine restaure l’expression et la localisation subcellulaire de la protéine et rétablit l’audition et l’équilibration à un niveau quasi normal [3]. Nul doute que ce résultat très prometteur contribuera à accélérer la recherche translationnelle en thérapie génique dans le domaine de la surdité associée ou non à des troubles de l’équilibration. |
Les défis des futures applications cliniques Malgré de nombreux revers durant les dernières décennies, la thérapie génique reste un domaine en constante évolution. Les résultats obtenus au cours de ces dix dernières années permettent d’envisager, dans un futur plus ou moins proche, une application de la thérapie génique pour le traitement curatif de certaines formes de surdité chez l’homme. Bien que la thérapie génique virale apparaisse prometteuse, certaines étapes préalables à son utilisation clinique restent à franchir. Il s’agit notamment de la validation des résultats obtenus dans les modèles murins sur un modèle animal plus proche de l’homme, de la maîtrise de voies d’injection non délétères pour le fonctionnement de la cochlée, et du choix du vecteur de transfert. Il est en effet nécessaire de développer des vecteurs qui soient plus efficaces pour la transduction et des promoteurs spécifiques des cellules cibles afin d’obtenir de meilleurs taux d’expression protéique et ainsi un effet thérapeutique optimal. L’Anc80L65, vecteur AAV de nouvelle génération, semble très prometteur pour la thérapie génique des surdités, mais contrairement aux AAV conventionnels son innocuité reste à évaluer. Concernant les nanoparticules, des améliorations sont également nécessaires afin d’augmenter leur stabilité et accroître leur efficacité de transfection. Les rongeurs en général, et la souris en particulier, restent des modèles incontournables en recherche translationnelle. Mais de tels modèles sont loin d’être parfaits : la taille et le développement de l’oreille interne ainsi que la fonction de certains gènes diffèrent entre les rongeurs et l’homme. Contrairement à l’homme, les rongeurs présentent un système auditif dont la maturation est tardive, et ces animaux naissent sans ouïe (l’audition n’apparaît qu’à environ 12 jours de vie chez la souris). Le développement d’un modèle animal alternatif mimant plus fidèlement la maladie humaine est donc essentiel pour valider l’efficacité des traitements potentiels des surdités génétiques chez l’homme et s’assurer de leur tolérance à long terme. Il est également primordial d’adopter une approche chirurgicale facilement transposable à l’homme. La canalostomie ou l’abord du sac endolymphatique nécessitent une chirurgie invasive et potentiellement à risque pour la préservation de l’intégrité des structures de l’oreille interne humaine. En revanche, une injection à travers la fenêtre ronde ou la fenêtre ovale cochléaires semble être plus appropriée [16]. L’abord chirurgical correspondant, de moins en moins invasif, est déjà pratiqué en routine par les otorhinolaryngologistes pour le traitement de l’otospongiose ou la pose d’un implant cochléaire. Enfin, au-delà de la démonstration expérimentale de l’efficacité de la thérapie génique, de sa sécurité, et de la durée de son effet curatif potentiel, d’autres obstacles incluant un cadre réglementaire strict, la difficulté du recrutement de patients volontaires, et des questions éthiques devront être surmontés avant d’entreprendre des essais cliniques. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données pubiées dans cet article. |
Les auteurs remercient chaleureusement le Pr Christine Petit et le Dr Jean-Pierre Hardelin pour la relecture de cette synthèse et la pertinence de leurs remarques.
|
Footnotes |
1. Iizuka T, Kanzaki S, Mochizuki H, et al. Noninvasive In vivo delivery of transgene via adeno-associated virus into supporting cells of the neonatal mouse cochlea . Hum Gene Ther. 2008; ; 19 : :384.–390. 2. Emptoz A, Michel V, Lelli A, et al. Local gene therapy durably restores vestibular function in a mouse model of Usher syndrome type 1G . Proc Natl Acad Sci USA. 2017; ; 114 : :9695.–9700. 3. Pan B, Askew C, Galvin A, et al. Gene therapy restores auditory and vestibular function in a mouse model of Usher syndrome type 1c . Nat Biotechnol. 2017; ; 35 : :264.–272. 4. György B, Sage C, Indzhykulian AA, et al. Rescue of hearing by gene delivery to inner-ear hair cells using exosome-associated AAV . Mol Ther. 2017; ; 25 : :379.–391. 5. Guo J, Liu Y, Qu T, et al. Cochleovestibular gene transfer in neonatal mice by canalostomy . Neuroreport. 2017; ; 28 : :682.–688. 6. Yoshimura H, Shibata SB, Ranum PT, et al. Enhanced viral-mediated cochlear gene delivery in adult mice by combining canal fenestration with round window membrane inoculation . Sci Rep. 2018; ; 8 : :2980.. 7. Pyykkö I, Zou J, Zhang W, et al. Nanoparticle-based delivery for the treatment of inner ear disorders . Curr Opin Otolaryngol Head Neck Surg. 2011; ; 19 : :388.–396. 8. Schlenk F, Grund S, Fischer D. Recent developments and perspectives on gene therapy using synthetic vectors . Ther Deliv. 2013; ; 4 : :95.–113. 9. Sacheli R, Delacroix L, Vandenackerveken P, et al. Gene transfer in inner ear cells: a challenging race . Gene Ther. 2013; ; 20 : :237.–247. 10. Choi JH, Yu NK, Baek GC, et al. Optimization of AAV expression cassettes to improve packaging capacity and transgene expression in neurons . Mol Brain. 2014; :7.. 11. Zinn E, Pacouret S, Khaychuk V, et al. In silico reconstruction of the viral evolutionary lineage yields a potent gene therapy vector . Cell Rep. 2015; ; 12 : :1056.–1068. 12. Landegger LD, Pan B, Askew C, et al. A synthetic AAV vector enables safe and efficient gene transfer to the mammalian inner ear . Nat Biotechnol. 2017; ; 35 : :280.–284. 13. Kimberling WJ, Hildebrand MS, Shearer AE, et al. Frequency of Usher syndrome in two pediatric populations: Implications for genetic screening of deaf and hard of hearing children . Genet Med. 2010; ; 12 : :512.–516. 14. Isgrig K, Shteamer JW. , Belyantseva IA, et al. Gene therapy restores balance and auditory functions in a mouse model of Usher syndrome . Mol Ther. 2017; ; 25 : :780.–791. 15. Caberlotto E, Michel V, Foucher I, et al. Usher type 1G protein sans is a critical component of the tip-link complex, a structure controlling actin polymerization in stereocilia . Proc Natl Acad Sci USA. 2011; ; 108 : :5825.–5830. 16. Kang WS, Nguyen K, McKenna CE, et al. Intracochlear drug delivery through the oval window in fresh cadaveric human temporal bones . Otol Neurotol. 2016; ; 37 : :218.–222. 17. Hanen Khabou H, Dalkara D. La conception de vecteurs adaptés à la thérapie génique oculaire . Med Sci (Paris). 2015;; 31 : :529.–37. 18. El-Amraoui A, Lefèvre G, Hardelin JP, Petit C. Syndrome de Usher de type 1 et développement de la touffe ciliaire des cellules sensorielles de l’oreille interne . Med Sci (Paris). 2005; ; 21 : :737.–740. 19. Grillet N. Harmonine est un composant de la machinerie de mécanotransduction auditive . Med Sci (Paris). 2009; ; 25 : :903.–906. |