| |
| Med Sci (Paris). 34(10): 875–878. doi: 10.1051/medsci/2018219.Mélanome métastatique Contribution des lymphocytes B à l’acquisition d’une résistance aux thérapies ciblées Camille Fourneaux1 and Bertrand Dubois2 1Master 1 Cancer, module d’immunologie-virologie, université de Lyon, université Claude Bernard Lyon 1, Lyon, France 2UMR Inserm 1052 CNRS 5286, centre Léon Bérard, centre de recherche en cancérologie de Lyon, 28, rue Laennec69373Lyon Cedex 08, France MeSH keywords: Lymphocytes B, Résistance aux médicaments antinéoplasiques, Humains, Immunothérapie, Mélanome, Thérapie moléculaire ciblée, Métastase tumorale, Tumeurs cutanées, Échec thérapeutique, physiologie, immunologie, effets indésirables, anatomopathologie, thérapie |
Le mélanome est une pathologie cancéreuse cutanée due à la transformation maligne des mélanocytes. Cette transformation est particulièrement favorisée par une forte exposition au soleil (rayons UV) sans protection. Il s’agit du cancer de la peau le plus agressif et son incidence augmente chaque année. Le pronostic des patients en termes de survie est particulièrement dépendant du stade de développement de la maladie au moment du diagnostic. En effet, si le taux de survie à 5 ans pour les mélanomes de stade précoce est de 85 %, ce taux chute à 18 % pour les mélanomes de stade IV (métastatiques). |
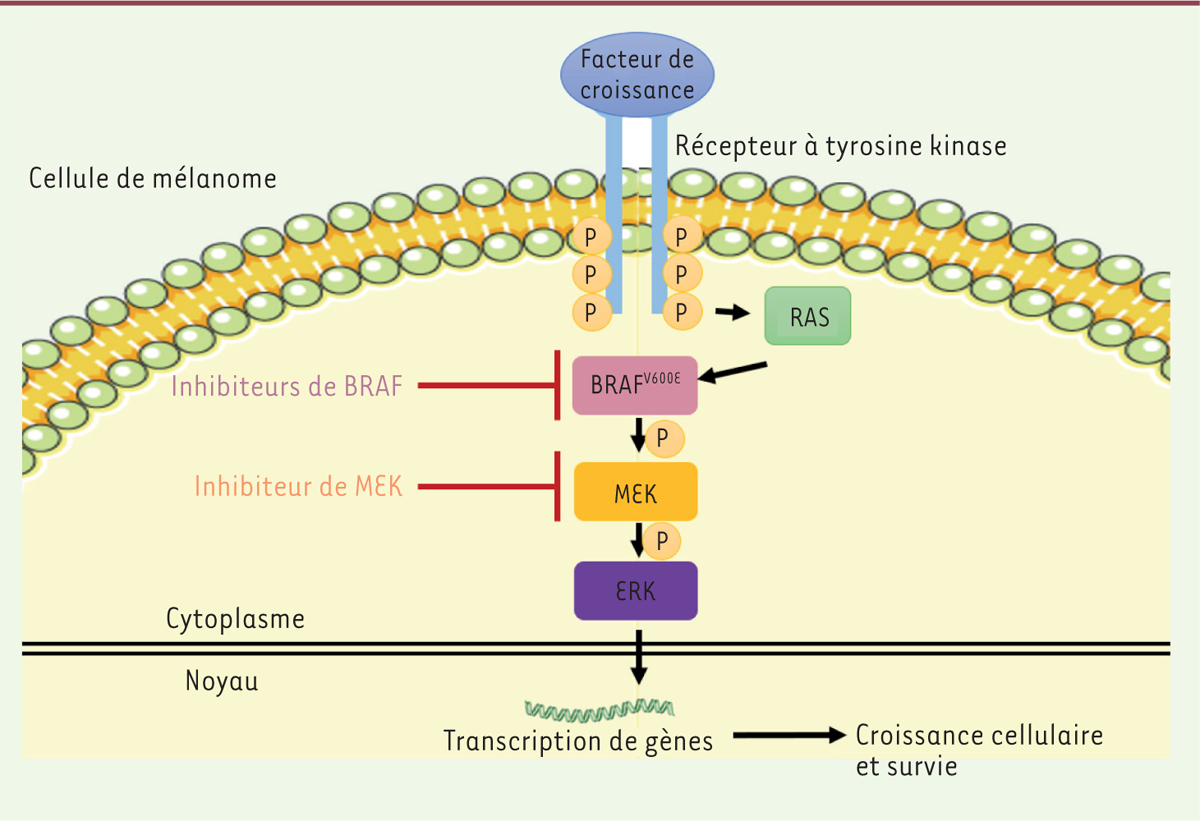
Approches thérapeutiques dans le mélanome Les différentes options thérapeutiques pour traiter le mélanome vont de la simple exérèse pour les stades précoces localisés, à des stratégies plus lourdes et agressives pour les stades métastatiques comme la chimiothérapie, la radiothérapie, les traitements ciblés et l’immunothérapie. L’objectif de celle-ci est de stimuler le système immunitaire du patient pour induire ou restaurer une réponse antitumorale efficace et durable. Une des stratégies consiste à bloquer les points de contrôle immunitaires inhibiteurs exprimés par les lymphocytes T à l’aide d’anticorps afin de lever la suppression de la réponse immunitaire et restaurer la fonction antitumorale des lymphocytes T. Le blocage de PD1 (programmed cell death protein 1) par les anticorps Nivolumab ou Pembrolizumab, et/ou de CTLA-4 (cytotoxic T lymphocyte antigen 4 protein) par l’Ipilimumab donne ainsi des résultats remarquables avec des réponses cliniques durables chez 30 à 40 % des patients et ce type d’immunothérapie est aujourd’hui proposé en première ligne aux patients atteints de mélanome de stade IV [1]. Les thérapies ciblées, quant à elles, découlent de la caractérisation des mutations induisant la transformation maligne, et visent à inhiber spécifiquement l’action de protéines mutées afin de supprimer la prolifération des cellules cancéreuses (→). (→) Voir la Nouvelle de N. Andrieu et N. Bendriss-Vermare, page 872 de ce numéro Chez plus de la moitié des patients atteints d’un mélanome, le gène BRAF (B-Raf kinase proto-oncogène) est muté dans les cellules tumorales, et, dans 90 % des cas, cette mutation conduit à une substitution de la valine par un acide glutamique en position 600 de la protéine (V600E). Un autre gène est fréquemment muté, il s’agit de MEK (mitogen-activated protein kinase kinase). Les produits de ces deux gènes sont impliqués dans la voie MAPKinase, voie majeure de la prolifération cellulaire. Ces deux kinases sont situées en aval de récepteurs des facteurs de croissance possédant des domaines à tyrosine kinase (Figure 1), tels que les récepteurs IGFR (insulin-like growth factor receptor) ou encore FGFR (fibroblast growth factor receptor). Suite à l’activation du récepteur par fixation de son ligand, ces kinases vont phosphoryler des protéines en aval afin de transduire un signal au sein de la cellule et conduire à l’activation de gènes induisant la prolifération cellulaire. Lorsque l’une de ces deux kinases est mutée, la voie en aval est activée de manière constitutive, c’est-à-dire sans nécessiter l’engagement du récepteur par son ligand. Les thérapies ciblant BRAF ou MEK permettent d’inhiber spécifiquement l’activité enzymatique de ces protéines, ce qui limite la transduction du signal de prolifération au sein de la cellule. L’inhibition de BRAF par administration de Vemurafenib conduit ainsi à une régression tumorale (réponse partielle ou complète) et à une augmentation de la survie chez plus de 80 % des patients atteints d’un mélanome présentant la mutation BRAFV600E.
 | Figure 1. Schéma de la voie MAPkinase et ses inhibiteurs dans une cellule de mélanome porteuse de la mutation de BRAFV600E. |
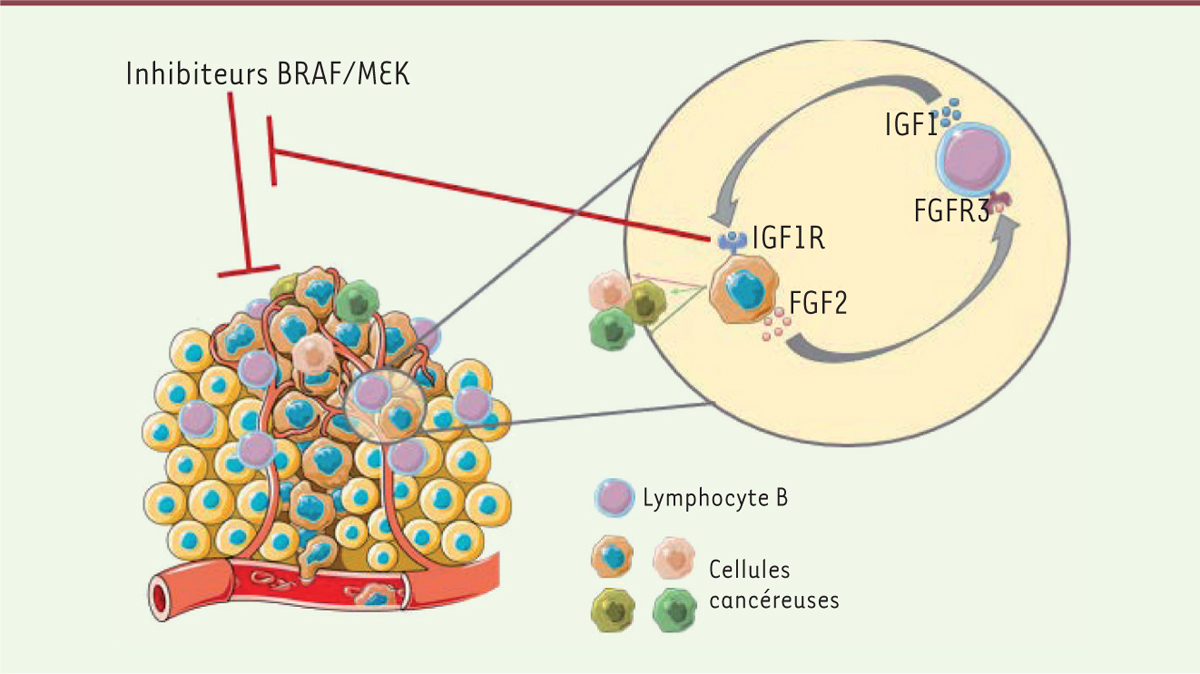
 | Figure 2. Mécanisme de résistance des cellules de mélanome aux thérapies ciblées relayé par les lymphocytes B. Les cellules tumorales, via la production de FGF2, conditionnent les LB à produire le facteur de croissance IGF1 qui, d’une part, augmente l’hétérogénéité tumorale et, d’autre part, diminue la sensibilité des cellules tumorales aux inhibiteurs de BRAF et MEK. |
Même si, chez certains patients, la réponse au traitement excède 18 mois, des résistances à ces thérapies ciblées apparaissent dans plus de 40 % des cas après quelques mois de traitement. Les mécanismes impliqués dans l’acquisition de cette résistance sont variés et incluent l’apparition d’un nouvel oncogène tel que NRAS, des mutations génétiques induisant l’activation de protéines en aval de BRAF ou MEK dans la voie MAPKinase [2] et le recrutement et la coopération des cellules de l’environnement stromal et des cellules immunitaires [3]. Parmi ces dernières, les lymphocytes B (LB) sont désormais reconnus comme des cellules clés de l’environnement tumoral. Récemment, ils ont été impliqués dans l’acquisition de résistances aux thérapies ciblées via leur capacité à produire de l’IGF1 (insulin growth factor 1), un facteur de croissance fréquemment impliqué dans le développement tumoral [4]. |
Les lymphocytes B : des acteurs longtemps négligés dans le cancer Le double rôle pro- ou anti-tumoral des lymphocytes B Les lymphocytes B sont des cellules du système immunitaire qui interviennent dans la réponse immunitaire adaptative. Ils infiltrent la plupart des tumeurs au même titre que les lymphocytes T, et leur densité dans la tumeur corrèle souvent positivement avec une meilleure survie globale et une meilleure survie sans rechute. Néanmoins, dans certaines situations, les lymphocytes B peuvent exercer un rôle délétère dans l’environnement tumoral, mais les mécanismes responsables de cette dichotomie fonctionnelle restent encore largement méconnus. Trois fonctions des lymphocytes B pourraient expliquer leur rôle pro- versus anti-tumoral. Premièrement, après leur différenciation en plasmocytes, les lymphocytes B sont capables de produire des anticorps qui pourraient moduler/neutraliser les antigènes tumoraux et/ou induire la mort des cellules tumorales par activation du complément ou de cellules accessoires par ADCC ( antibody-dependent cellular cytotoxicity). Cette activité cytotoxique est essentiellement due aux IgG1 et IgG3. À l’inverse, les IgA et les IgG4 pourraient inhiber la réponse immunitaire et promouvoir la croissance tumorale. Deuxièmement, les lymphocytes B sont capables de produire des cytokines pouvant agir sur les cellules tumorales et/ou moduler la réponse immunitaire. Ainsi, des lymphocytes B qui sécrètent de l’interféron gamma sont associés à un pronostic favorable en permettant le recrutement et l’activation d’autres cellules immunitaires sur le site de la tumeur. À l’inverse, des lymphocytes B dits régulateurs et sécrétant de l’interleukine 10 et/ou 35, sont associés à un plus mauvais pronostic via leur capacité à réguler négativement d’autres acteurs du système immunitaire et à réduire l’efficacité de la réponse antitumorale. Enfin, les lymphocytes B, par leur fonction de cellules présentatrices d’antigènes, peuvent moduler l’activation et la fonction des lymphocytes T CD8 + et CD4 + qui participent à la réponse immunitaire antitumorale [ 5]. L’importance de l’isotype des immunoglobulines sécrétées par les lymphocytes B intratumoraux Dans les mélanomes comme dans la plupart des cancers, l’infiltrat de lymphocytes B est souvent un facteur de bon pronostic. Il a été démontré que le terrain inflammatoire provoqué par le développement de la tumeur peut s’accompagner de la formation de structures lymphoïdes dites tertiaires (TLS), qui sont constituées d’agrégats de lymphocytes B et T distincts mais contigus, et dont la fonction mime celle des organes lymphoïdes secondaires, c’est-à-dire l’activation et la différenciation des lymphocytes T et B [ 6]. Il semblerait cependant que la proportion de lymphocytes B infiltrants ainsi que la nature des anticorps produits conditionnent la fonction de ces lymphocytes. Des études ont ainsi montré, chez des patients atteints de mélanome, qu’un infiltrat immunitaire contenant plus de 15 % de lymphocytes B était corrélé à une progression de la maladie. Il est intéressant de noter que l’isotype d’immunoglobuline produit par les lymphocytes B est déterminant quant à son rôle pro- ou antitumoral. Ainsi, dans le mélanome, une partie des plasmocytes infiltrant la tumeur sécrètent des IgA, un isotype d’immunoglobuline normalement principalement retrouvé dans les muqueuses et dont la capacité de lyse des cellules tumorales via l’activité du complément est faible. Par ailleurs, la production de taux élevés d’IgG4, une Ig également associée à la tolérance immunitaire, s’accompagne d’un mauvais pronostic et favorise la progression tumorale en inhibant la lyse des cellules tumorales par ADCC induite par les IgG1 [ 7]. Une étude récente vient de démontrer une nouvelle facette du rôle protumoral des lymphocytes B dans le mélanome, à savoir leur implication dans l’acquisition d’une résistance aux thérapies ciblées [ 8]. |
Les cellules cancéreuses induisent la production d’IGF1 par les lymphocytes B Chez des patients atteints de mélanome métastatique, il existe une corrélation forte entre l’infiltrat en lymphocytes B et la production élevée du facteur de croissance IGF1. Ce dernier permet, après s’être fixé sur son récepteur à domaine tyrosine kinase, l’activation des voies PI3K/AKT/mTOR et MAPKinase, qui sont impliquées et dérégulées dans de nombreux cancers, et associées à l’acquisition de résistances aux thérapies ciblées notamment dans le mélanome [8]. En analysant les données d’une cohorte de patients atteints de mélanome de stade IV, les auteurs de l’étude ont montré (1) une augmentation de l’infiltrat lymphocytaire B après un traitement des patients par un inhibiteur de BRAF, (2) une colocalisation de ces lymphocytes avec IGF1, et (3) une corrélation négative entre une production élevée d’IGF1 dans la tumeur et la survie des patients. De manière intéressante, seuls les lymphocytes B intra-tumoraux produisent de l’IGF1, et cette capacité peut être acquise par des cellules B de donneurs sains si elles sont cultivées avec des cellules cancéreuses. L’utilisation d’anticorps bloquants a révélé que ce conditionnement nécessite la production constitutive par les cellules tumorales d’un autre facteur de croissance, FGF2 (fibroblast growth factor 2), qui agit sur les lymphocytes B via son récepteur FGFR3. L’IGF1 sécrété par les lymphocytes B permettra en retour aux cellules cancéreuses de produire de plus grandes quantités de FGF2 et d’activer FGFR3, et ainsi d’enclencher une boucle FGF2/FGFR3. Cette production d’IGF1 induite par les cellules tumorales dans les lymphocytes B est responsable de la mise en place d’une résistance aux inhibiteurs de BRAF et MEK. |
L’IGF1 produit par les lymphocytes B induit dans les cellules de mélanome une résistance aux thérapies ciblées Afin de mesurer l’effet des lymphocytes B sur l’efficacité des thérapies ciblées dans le mélanome, les auteurs ont comparé l’effet d’inhibiteurs de BRAF ou MEK sur la viabilité in vitro de lignées de cellules tumorales cultivées seules ou en présence de lymphocytes B. Tandis que les lymphocytes B d’individus sains ne modifient pas la sensibilité des cellules tumorales aux inhibiteurs – évaluée par le taux de viabilité cellulaire, qui diminue graduellement quand la concentration d’inhibiteurs augmente - l’ajout de lymphocytes B isolés de tumeurs de mélanome ou l’ajout d’IGF-1 recombinante induisent une résistance à ces inhibiteurs. Il faut ainsi des concentrations d’inhibiteurs de BRAF ou MEK 100 à 1000 fois plus élevées pour induire la mort des cellules tumorales. De manière intéressante, des effets similaires sont observés avec des lymphocytes B normaux préalablement conditionnés par les cellules tumorales. De plus, dans ces expériences de coculture, l’addition d’un anticorps anti-IGF1 abroge l’effet délétère des lymphocytes B et restaure la sensibilité des cellules tumorales aux inhibiteurs. Enfin, des résultats similaires sont observés en cas d’inhibition de l’expression du récepteur FGFR3 par shARN dans les cellules de mélanome. Ces résultats montrent que les lymphocytes B présents dans l’environnement tumoral induisent, via leur production d’IGF1, une résistance des cellules tumorales aux thérapies ciblées, et que la boucle FGF2/FGFR3 établie dans les cellules cancéreuses joue un rôle essentiel dans le développement de ces résistances. De plus, les auteurs démontrent que les lymphocytes B, via leur production d’IGF1, augmentent l’hétérogénéité tumorale en induisant l’apparition de différentes sous-populations exprimant des caractéristiques de cellules souches. Ainsi, les marqueurs CD133 et CD271, normalement exprimés respectivement par les cellules souches hématopoïétiques et les cellules souches mésenchymateuses, sont détectés en cytométrie de flux sur les cellules tumorales de mélanome cultivées plusieurs jours avec des lymphocytes B associés aux tumeurs. L’induction des populations exprimant ces marqueurs a été observée avec différentes lignées de mélanomes, mais elles sont absentes lorsque l’IGF-1 est neutralisé. La réapparition de caractéristiques souches au sein des tumeurs étant fréquemment associée à un mauvais pronostic, ce changement phénotypique des cellules de mélanome pourrait donc constituer un élément essentiel du mécanisme à l’origine de l’acquisition de résistances aux thérapies ciblant BRAF et MEK. |
Les lymphocytes B, une nouvelle cible thérapeutique pour traiter les mélanomes métastatiques L’identification de ce nouveau mécanisme de résistance aux thérapies ciblées suggère que la déplétion des lymphocytes B, ou leur inhibition, pourrait réduire la progression du mélanome et constituer une piste thérapeutique d’avenir pour maintenir la sensibilité des cellules tumorales aux inhibiteurs de BRAF et MEK. Pour valider cette hypothèse, les auteurs ont testé dans un essai clinique l’effet de l’administration d’Ofatumumab, un anticorps anti-CD20 qui induit la mort des lymphocytes B exprimant CD20 suite à l’activation de la voie classique du complément et de celle des cellules NK. Il en résulte une disparition des lymphocytes B immatures et matures, sans que les plasmocytes ne soient affectés. Cet anticorps anti-CD20 est déjà utilisé en clinique pour traiter les lymphomes non Hodgkiniens et les leucémies lymphoïdes chroniques. Dans leur essai pilote, les auteurs ont constaté une amélioration chez 6 des 10 patients traités, allant d’une diminution significative de la taille des lésions tumorales cibles à une stabilisation de leur progression. Malgré ces résultats très encourageants, cette approche présente néanmoins des limites dans la mesure où elle ne cible pas spécifiquement les lymphocytes B intra-tumoraux, et conduit donc à l’élimination de tous les lymphocytes B sauf les plasmocytes. Ceci pourrait conduire à un affaiblissement du système immunitaire et l’élimination des lymphocytes B dotés d’un rôle antitumoral. |
Rajasekharan Somasundaram et al. [8] exposent une nouvelle facette du potentiel pro-tumoral des lymphocytes B, à savoir leur participation active aux mécanismes de résistance des cellules de mélanome aux thérapies à base d’inhibiteurs de BRAF et MEK. La sécrétion de FGF2 par les cellules tumorales induit la production d’IGF1 par les lymphocytes B infiltrants. Il en résulte une augmentation de l’hétérogénéité tumorale avec l’émergence de cellules cancéreuses possédant des marqueurs de cellules souches et l’apparition de résistances aux traitements par les inhibiteurs de BRAF et MEK. Cet article démontre une fois de plus la nécessité de mieux appréhender les interactions complexes entre les différents acteurs du système immunitaire et les cellules cancéreuses afin de pouvoir développer de nouvelles thérapies plus efficaces tenant compte des spécificités fonctionnelles des cellules immunitaires infiltrantes. Il suggère également une nouvelle piste thérapeutique qui consisterait à éliminer spécifiquement les lymphocytes B pro-tumoraux. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. |
1. Rotte A, Bhandaru M, Zhou Y, et al. Immunotherapy of melanoma: Present options and future promises . Cancer Metastasis Rev. 2015; ; 34 : :115.–128. 2. Shi H, Hugo W, Kong X, et al. Acquired resistance and conal evolution in melanoma during BRAF inhibitor therapy . Cancer Discovery. 2014; ; 4 : :80.–93. 3. Rizos H, Menzies AM, Pupo GM, et al. BRAF inhibitor resistance mechanisms in metastatic melanoma: spectrum and cinical impact . Clin Cancer Res. 2014; ; 20 : :1965.–1977. 4. Villanueva J, Vultur A, Lee JT, et al. Acquired resistance to BRAF inhibitors mediated by a RAF kinase switch in melanoma can be overcome by cotargeting MEK and IGF-1R/PI3K . Cancer Cell. 2010; ; 18 : :683.–695. 5. Shen M, Sun Q, Wang J, et al. Positive and negative functions of B lymphocytes in tumors . Oncotarget. 2016; ; 7 : :55828.–55839. 6. Cipponi A, Mercier M, Seremet T, et al. Neogenesis of lymphoid structures and antibody responses occur in human melanoma metastases . Cancer Res. 2012; ; 72 : :3997.–4007. 7. Gilbert AE, Karagiannis P, Dodev T, et al. Monitoring the systemic human memory B cell compartment of melanoma patients for anti-tumor IgG antibodies . PLoS One. 2011; ; 6 : :e19330.. 8. Somasundaram R, Zhang G, , Fukunaga-Kalabis M, et al. Tumor-associated B-cells induce tumor heterogeneity and therapy resistance . Nat Commun. 2018; ; 8 : :607.. |