| |
| Med Sci (Paris). 34(10): 879–881. doi: 10.1051/medsci/2018218.Voie de signalisation Hippo, microenvironnement protumoral et carcinome hépato-cellulaire Maud Guy1* and Eve-Isabelle Pécheur2* 1Master 1 cancer, module d’immunologie-virologie, université de Lyon, université Claude Bernard Lyon 1, Lyon, France 2Université de Lyon, Université Claude Bernard Lyon 1, CNRS 5286, Inserm U 1052, Centre de recherche en cancérologie de Lyon, 151, cours Albert Thomas, 69003Lyon, France MeSH keywords: Animaux, Carcinome hépatocellulaire, Chimiokine CCL2, Régulation négative, Humains, Foie, Tumeurs du foie, Souris, Protein-Serine-Threonine Kinases, Transduction du signal, Microenvironnement tumoral, génétique, métabolisme, anatomopathologie, physiologie |
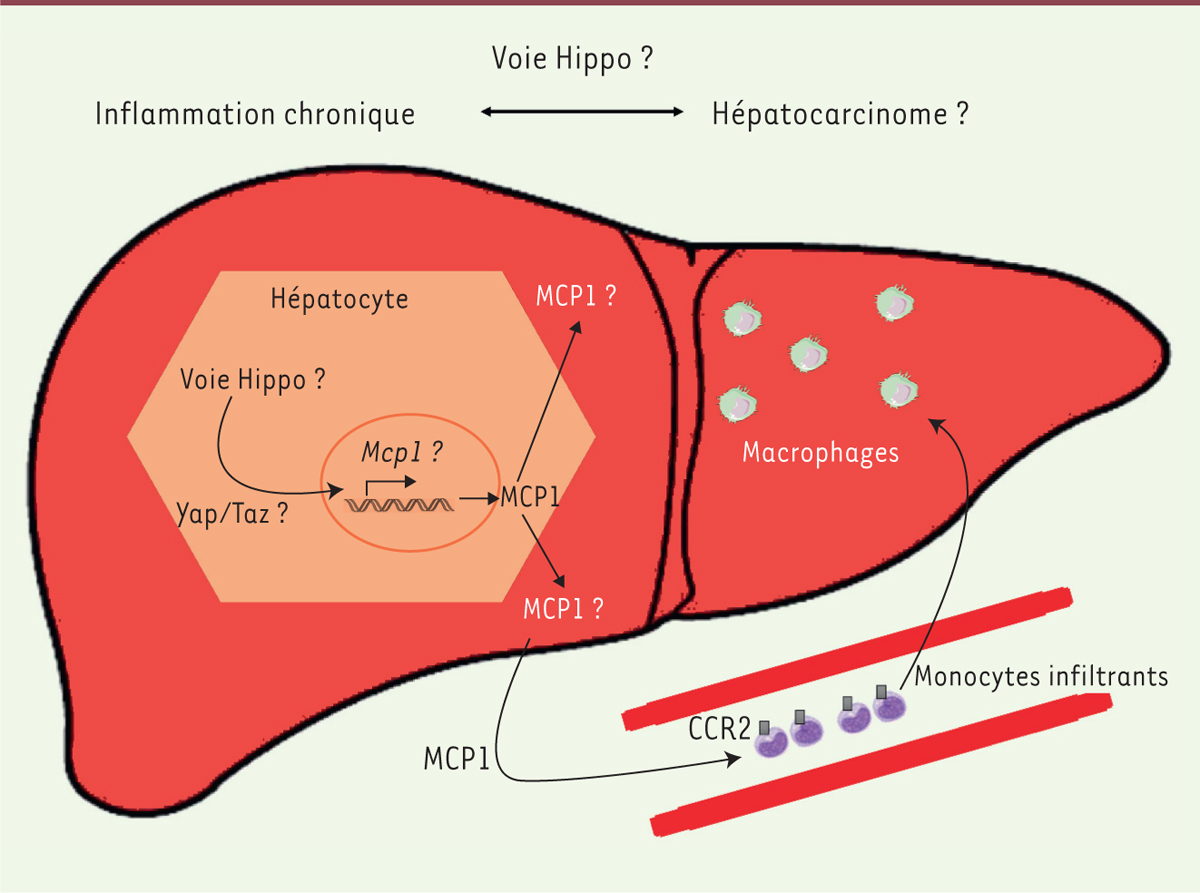
Microenvironnement, inflammation et carcinome hépatocellulaire Le carcinome hépatocellulaire (CHC) est le cinquième cancer le plus fréquent et la deuxième cause mondiale de décès par cancer. Ses principales causes sont la consommation d’alcool et les infections virales (virus des hépatites B, C ou delta). Le développement tumoral survient généralement dans un contexte d’inflammation hépatique chronique, et succéde à des stades de fibrose et de cirrhose. Les cytokines pro-inflammatoires interleukine 6 (IL-6) et TNF-α (tumor necrosis factor ±), activant respectivement Stat3 et NFkB, jouent un rôle clé dans sa progression [1]. Les voies de signalisation fréquemment altérées dans cette pathologie sont WNT/β-caténine, PI3K ⁄AKT⁄ mTOR (mammalian target of rapamycin), RAS⁄MAPK, IGF (insulin growth factor), HGF (hepatocyte growth factor) ⁄MET, VEGF (vascular endothelial growth factor), EGFR (epithelial growth factor receptor), PDGFR (platelet-derived growth factor receptor) ou c-Myc [2]. Le microenvironnement tumoral et l’inflammation sont des acteurs majeurs du développement du CHC. Ils peuvent être modulés par la voie Hippo, ce qui suggère un lien entre signalisation Hippo, inflammation et développement du CHC (Figure 1). C’est ce lien qu’explore et confirme une équipe américaine [3].
 | Figure 1. La cytokine MCP1 à l’origine de l’infiltration de monocytes dans le foie. Les différents acteurs cellulaires et moléculaires impliqués dans le développement du CHC. MCP1 : monocyte chemoattractant protein 1 ; CCR2 : C-C chemokine receptor type 2. |
La voie Hippo met en jeu les protéines kinases MST1 et MST2 qui activent la kinase Lats (large tumor suppressor kinase 1). Celle-ci phosphoryle puis inhibe Yap/Taz, provoquant sa rétention cytosolique et sa dégradation. Activée, la voie Hippo est antitumorale car elle bloque l’entrée nucléaire de Yap/Taz. Les gènes impliqués dans la survie et la prolifération n’étant alors pas activés, le développement tumoral est bloqué. Or, la voie Hippo est dérégulée chez environ 5 à 10 % des patients atteints de CHC, avec une amplification du locus contenant le gène YAP et, chez la majorité des patients, il y a une perte d’activité de MST1 et MST2 [4]. La monocyte chemoattractant protein-1 (MCP1), aussi connue sous le nom de CCL2, est une chimiokine sécrétée par les hépatocytes, les cellules endothéliales, les macrophages et les fibroblastes. Les monocytes, les lymphocytes et les polynucléaires basophiles, qui expriment le récepteur CCR2 à leur surface, y sont sensibles. La fixation de MCP1 sur CCR2 active notamment les intégrines α4β1 et α5β1 des monocytes, induisant la migration de ces cellules vers la source de production de la chimiokine (chimiotactisme). Les monocytes « roulent », puis s’arrêtent et adhèrent à la surface de l’endothélium vasculaire via la E-sélectine et VCAM-1 (vascular cell adhesion molecule-1) [5]. Puis, par extravasation à travers les cellules pavimenteuses de la barrière endothéliale, ils rejoignent le tissu où ils se différencient en macrophages. Ces derniers sécrètent MCP1, ce qui a pour effet de recruter d’autres cellules immunitaires, aggravant l’inflammation. |
L’inhibition de la voie Hippo induit l’expression de MCP1 et de Yap/Taz Les auteurs ont généré un modèle murin de CHC, par délétion de Mst1 et Mst2 dans les hépatocytes (double knock-out KO). Dans ce modèle, Hippo est inhibée, la kinase Lats1 n’est pas activée, conduisant à la surexpression de Yap/Taz qui va alors transiter dans le noyau. Chez ces souris double KO, la transcription et l’expression de MCP1 par les hépatocytes sont augmentées, témoignant de la réponse inflammatoire. De plus, les taux sériques de MCP1 sont corrélés au développement de nodules hépatiques tumoraux. |
MCP1 induit l’infiltration massive de monocytes favorisant le développement tumoral Chez les souris double KO, on observe une augmentation de l’infiltration intrahépatique par des monocytes exprimant CCR2, qui se différencient alors en macrophages. Cela s’accompagne d’une surexpression de cytokines pro-inflammatoires dont les IL-1β et IL-6, et d’une inflammation hépatique. La déplétion pharmacologique des macrophages hépatiques par le clodronate aboutit à la réduction du poids du foie, de la sécrétion d’IL-1β et IL-6, suggérant une inflammation réduite, et du nombre de nodules hépatiques. Un modèle murin triple KO, généré par délétion de Mst1, Mst2 et Mcp1, présente le même phénotype que les double KO traitées par clodronate, ce qui confirme la responsabilité de MCP1 dans l’infiltration hépatique des macrophages et la mise en place d’un microenvironnement inflammatoire propice au développement tumoral. Chez ces souris triple KO, l’infiltration de monocytes est moindre que celle observée chez les souris double KO, de même que le degré de fibrose, la prolifération et la formation de tumeurs. Ces modèles confirment que la sécrétion de MCP1 par les hépatocytes porteurs d’une mutation sur les composants de la voie Hippo stimule l’infiltration des monocytes qui se différencient en macrophages, ce qui induit une inflammation, une fibrose faisant le lit du CHC. |
Différentes sous-populations de macrophages dans le microenvironnement tumoral Les auteurs ont caractérisé par immunohistochimie les sous-populations de monocytes infiltrés dans le foie chez les souris double KO. Deux phénotypes sont retrouvés : les macrophages M1 pro-inflammatoires et les macrophages M2 associés à la résolution de l’inflammation. Les premiers sont repérés par leur marqueur spécifique iNOS (inducible nitric oxide synthase) et sécrètent les IL-1β et IL-6, impliquées dans le développement de divers cancers, tandis que les seconds exprimant CD206, sécrètent de l’IL-10, de l’IL-13 et du TGF-β (transforming growth factor-β), plutôt anti-inflammatoires. Le TGF-β est capable d’inhiber l’activité des cellules natural killer (NK) et induit la synthèse d’interféron-g (IFN-g). L’IL-10 contribue à limiter l’inflammation en réduisant la synthèse de cytokines comme le TNF-α, les IL-6 et -12 [6]. |
L’inhibition de la voie Hippo altère des voies moléculaires favorisant le développement tumoral La délétion de Mst1 et Mst2 favorise l’activation de JNK, Erk, Stat3 et Smad2, voies impliquées dans la prolifération, la survie et la différenciation cellulaires, ainsi que celle d’IκB et NF-κB, régulateurs de l’inflammation. Toutefois, indépendamment de Hippo, les macrophages sont capables de stimuler la survie et la prolifération des hépatocytes via la sécrétion de TNF-α, d’IL-6 phosphorylant Stat3, d’IL-1β, de VEGF, HGF et TGF-β activant Smad2. La délétion de Mst1, Mst2 et Mcp1 induit une baisse de la phosphorylation de Stat3, Smad2 et JNK, réduisant leur activité, ce qui limite la prolifération des hépatocytes et le développement tumoral. |
MCP-1 : cible transcriptionnelle directe de Yap/Taz Outre la délétion de Mst1 et Mst2 dans le modèle de souris double KO, les auteurs ont induit génétiquement une sous-expression de Yap dans le foie pour caractériser son rôle. Ceci abolit le phénotype tumoral en restaurant une croissance hépatique quasiment normale, et réduit la transcription et l’expression de MCP1. Yap serait ainsi impliquée, directement ou indirectement, dans le contrôle de cette chimiokine. Yap est connue pour se fixer sur les facteurs de transcription TEAD, qui reconnaissent une séquence consensus dans les gènes cibles dont ils activent la transcription [7]. La présence d’un motif conservé GGAAT de fixation des facteurs TEAD a été identifiée par analyse bio-informatique environ 400 pb en amont du site d’initiation de la transcription de Mcp1. L’analyse par immunoprécipitation de la chromatine et qPCR (CHIP-qPCR) a confirmé la fixation de Yap sur ce motif. Donc, MCP1 est une cible transcriptionnelle directe de Yap/Taz. Ceci explique la corrélation entre l’expression de MCP1 et celle des cibles transcriptionnelles de Yap/Taz chez les patients atteints de CHC. La surexpression de Yap et MCP1 est observée dans les zones tumorales d’échantillons de patients, mais pas dans les tissus adjacents non tumoraux. Ce résultat est donc cohérent avec ceux obtenus chez les souris double KO. |
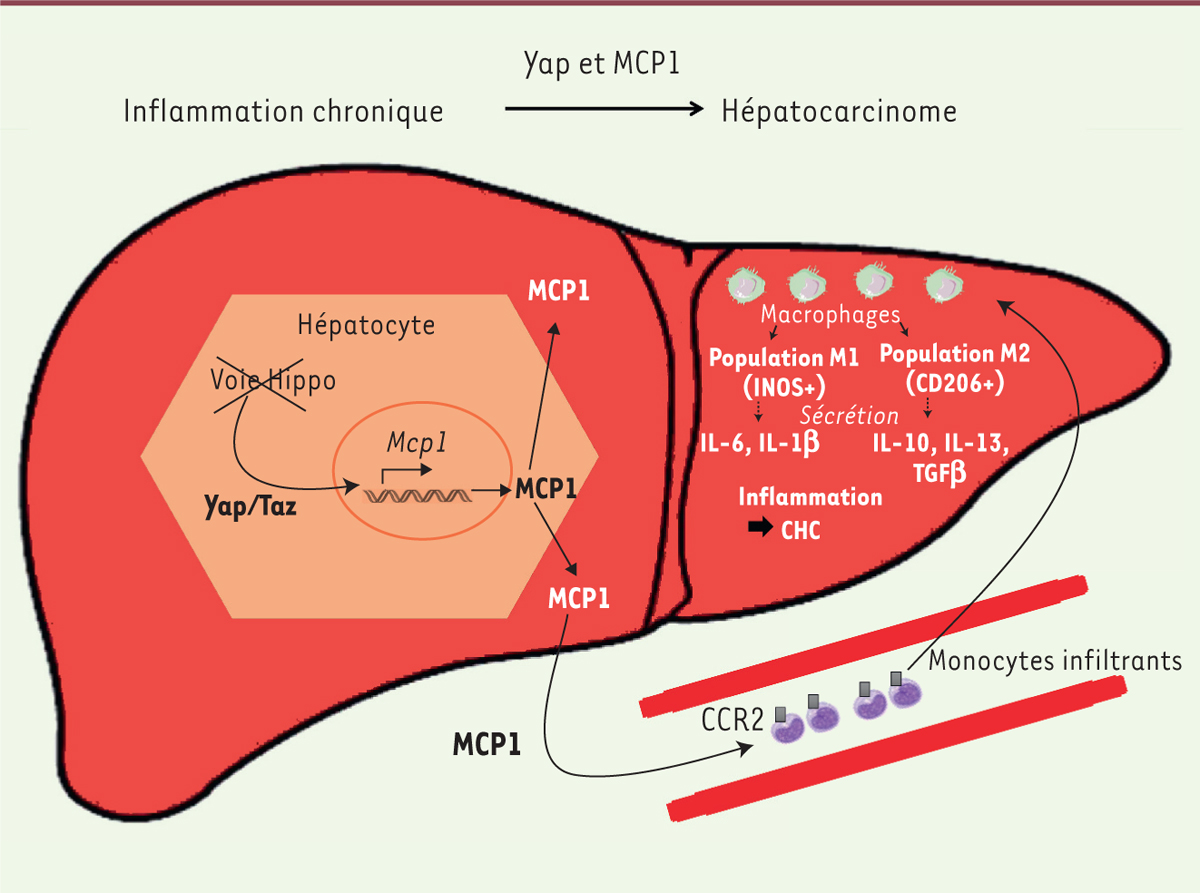
La voie Hippo activée réprime l’expression de Mcp1, et donc la biosynthèse de la chimiokine MCP1. Ceci empêche l’infiltration hépatique des monocytes et l’installation d’une inflammation hépatique via les cytokines sécrétées, ainsi que la prolifération excessive des hépatocytes et l’émergence du CHC qui en résultent (Figure 2).
 | Figure 2. La délétion de Mst1 et Mst2 permet à Yap d’activer la transcription de Mcp1, déclenchant l’inflammation hépatique et le développement d’un CHC. Les monocytes attirés dans le foie par MCP1 se différencient en deux sous-populations de macrophages : M1 sécrétant les cytokines IL-6 et IL-1β, et M2 sécrétant l’IL-10, l’IL-13 et le TGF-β. Ce microenvironnement favorise l’inflammation propice au développement de CHC. IL-6/1β/10/13 : interleukines 6/1β/10/13 ; TGFβ : transforming growth factor β ; CHC : carcinome hépatocellulaire ; MCP1 : monocyte chemoattractant protein-1 ; iNOS : inducible nitric oxide synthase. |
La chimiokine MCP1, souvent surexprimée chez les patients atteints d’hépatocarcinome et responsable d’une inflammation hépatique, constitue une cible thérapeutique intéressante. L’équipe de Kun-Yu Teng a testé un anticorps neutralisant MCP1 dans un modèle murin KO pour le microARN-122 dans le foie. Cette immunothérapie ciblant l’axe MCP1-CCR2 chez la souris a permis de réduire l’infiltration du foie par des cellules immunitaires myéloïdes, d’augmenter la cytotoxicité des cellules NK, et donc de limiter le développement du CHC [8]. Toutefois, la seule neutralisation de MCP1 ne serait pas suffisante et il faudrait combiner cet anticorps avec d’autres traitements du CHC. Parmi ceux-ci, le Sorafenib, un inhibiteur de multiples récepteurs à activité tyrosine kinase dérégulés dans le CHC, dont les VEGFR1 et 3, le PDGFR, KIT et RET, est administré en première ligne de traitement [9]. Certains des inhibiteurs des points de contrôle immunitaires sont également en cours d’évaluation dans des essais cliniques de phase 3. Ainsi, le projet HIMALAYA compare l’administration de Durvalumab, un anticorps monoclonal ciblant PD-L1 (programmed death 1 ligand), seul ou en combinaison avec le Tremelimumab qui, lui, cible CTLA-4 (cytotoxic-T-lymphocyte-associated 4 protein), à l’administration de Sorafenib, et montre donc l’importance de cibler le système immunitaire dans le CHC. L’idée de combiner des thérapies ciblant des voies de signalisation dérégulées avec d’autres limitant l’inflammation, telles que l’anticorps dirigé contre l’axe MCP1-CCR2, pourrait faire l’objet d’un essai clinique à l’avenir pour combattre plus efficacement l’hépatocarcinome. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. |
1. Ringelhan M, Pfister D, , O’Connor T, et al. The immunology of hepatocellular carcinoma . Nat Immunol. 2018; ; 19 : :222.–232. 2. Cornella H, Alsinet C, Villanueva A. Molecular pathogenesis of hepatocellular carcinoma, alcoholism . Clin Exp Res. 2011;; 35 : :821.–5. 3. Kim W, Khan SK, Liu Y, et al. Hepatic Hippo signaling inhibits protumoural microenvironment to suppress hepatocellular carcinoma . Gut. 2018; ; 67 : :1692.–1703. 4. Yimlamai D, Fowl BH, Camargo FD. Emerging evidence on the role of the Hippo/YAP pathway in liver physiology and cancer . J Hepatol. 2015; ; 63 : :1491.–1501. 5. Gerszten RE, Garcia-Zepeda EA, Lim YC. MCP-1 and IL-8 trigger firm adhesion of monocytes to vascular endothelium under flow conditions . Nature. 1999; ; 398 : :718.–723. 6. Qu X, Tang Y, Hua S. Immunological approaches towards cancer and inflammation: a cross talk . Frontiers Immunol. 2018; ; 9 : :1.–19. 7. Zhao B, Ye X, Yu J, et al. TEAD mediates YAP-dependent gene induction and growth control . Genes Dev. 2008;; 22 : :1962.–71. 8. Teng KY, Han J, Zhang X, et al. Blocking the CCL2-CCR2 axis using CCL2 neutralizing antibody is an effective therapy for hepatocellular cancer in a mouse model . Mol Cancer Therap. 2017;; 16 : :312.–22. 9. Raoul JL, Kudo M, Finn RS, et al. Systemic therapy for intermediate and advanced hepatocellular carcinoma: Sorafenib and beyond . Cancer Treat Rev. 2018;; 68 : :16.–24 (en complément du projet HIMALAYA, ClinicalTrials.gov NCT03298451).. |