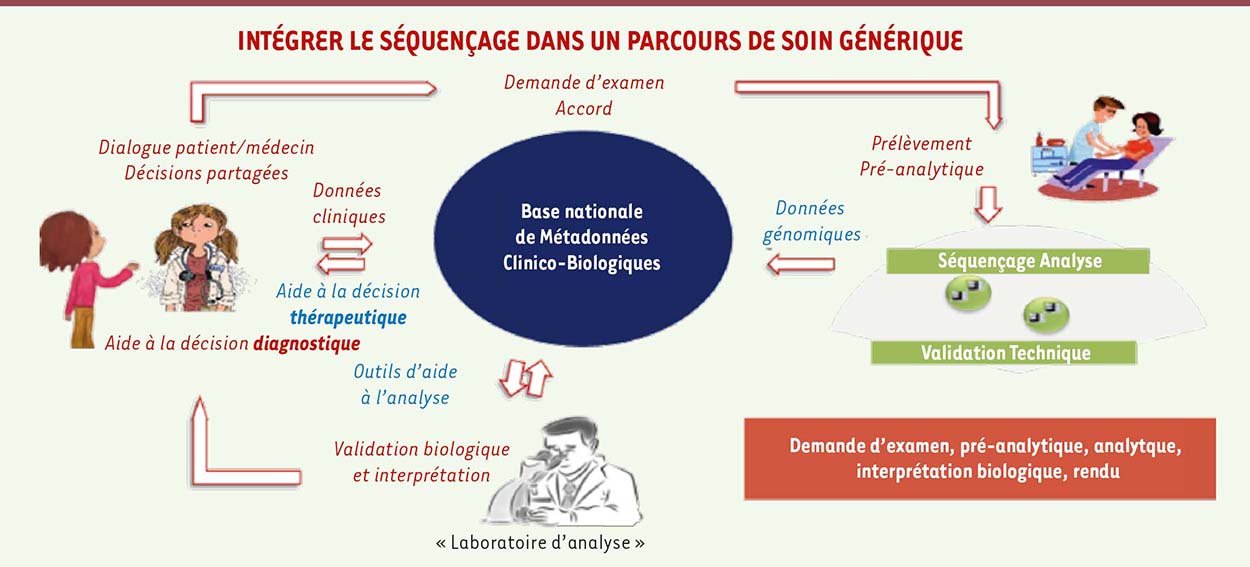
Le plan vise à intégrer le séquençage du génome en routine dans la pratique clinique, et à développer une filière nationale de médecine génomique en partenariat avec la recherche et les industriels (Figure 1). La France veut en effet redevenir leader dans ce domaine.
 | Figure 1 Intégrer le séquençage du génome dans la pratique clinique. |
Le plan est organisé autour de trois objectifs et 14 mesures. Il s’adresse à toutes les maladies. Certains objectifs sont génériques et seront utilisables dans le domaine du cancer comme celui des maladies rares.
Tout d’abord, il a été décidé, pour structurer le séquençage haut débit, de mettre en place des plateformes au niveau du territoire dans les prochaines années. Ces plateformes sont supposées couvrir l’ensemble des pathologies susceptibles d’avoir besoin de séquençage haut débit. En décembre 2016, un appel à projets a été lancé à l’attention des plateformes. Deux plateformes de séquençage ont été sélectionnées : SEQOiA et AURAGEN. Sera également créé un collecteur analyseur de données, afin de traiter et d’exploiter les données. Une autre structure commune permettra de suivre l’innovation technologique et les progrès autour du séquençage. Il s’agira d’un centre de référence en matière d’innovation et d’expertise de transfert.
Une mesure consiste à évaluer les indications et à déterminer ce qui se passe sur le terrain lors de la mise en oeuvre des différentes mesures du plan, notamment en termes de prise en charge financière par l’assurance maladie et se trouve actuellement traitée avec la HAS.
Une mesure porte sur les nouveaux métiers dont il faudra disposer sur le terrain clinique, comme celui de conseiller génétique spécialisé en génomique.
L’évaluation médico-économique de l’ensemble du dispositif et sa position au niveau international constitue une autre priorité.
Avant toute chose, ce plan vise à améliorer le parcours de soins et a été conçu autour de ce dernier. Le prélèvement sera acheminé vers une plateforme de séquençage. Les séquences seront alignées, annotées, voire comparées dans certaines circonstances. Les laboratoires hospitaliers valideront et interpréteront avec le clinicien, dans la perspective d’un rendu au patient.
Je m’étendrai davantage sur la mesure n° 5, qui a comme objectif de lever les verrous technologiques, cliniques et réglementaires sur le parcours de soin. Dès septembre 2016, les quatre projets pilotes ont été lancés, portant respectivement sur la variabilité de la population générale, le diabète, le cancer et les maladies rares.
Le projet DEFIDIAG est le projet Maladies rares du plan France Médecine Génomique, qui porte sur la déficience intellectuelle. L’Inserm est promoteur de ce projet pilote comme des trois autres et à ce titre le pôle de recherche clinique de l’Inserm est très impliqué dans l’élaboration de ce projet pilote, qui a vocation à être un démonstrateur de l’efficacité du plan tel qu’il été conçu.
Nous avons beaucoup de chance, car notre comité de pilotage est extrêmement actif. Des groupes de travail ont été mis en place. Le groupe « méthodologie, data et évaluation médico-économique » est porté avec brio par les différentes équipes du CHU et de l’université de Dijon. D’autres groupes travaillent sur le circuit du patient, les laboratoires et la bio-informatique, le budget, l’éthique et le réglementaire.