Maladie d’Alzheimer
Enjeux scientifiques, médicaux et sociétaux
2007
→ Aller vers ANALYSE
La maladie d'Alzheimer a été décrite il y a aujourd'hui cent ans. Avec l'allongement de la durée de vie, principalement dans les pays développés, son incidence augmente de façon vertigineuse. Les projections actuelles avoisinent un doublement du nombre de personnes atteintes par période de 20 ans.
La maladie d'Alzheimer est la forme de démence la plus fréquemment rencontrée (environ 70 % des cas de démence). Les perturbations les plus précoces et les plus fréquentes sont des troubles bénins de la mémoire portant sur les faits récents et le plus souvent sur des détails de la vie quotidienne. Il s'ensuit une lente évolution des symptômes qui vont progressivement s'étendre à des troubles de l'organisation et de la programmation (fonctions exécutives), du langage (aphasie), une maladresse gestuelle (apraxie), un défaut de reconnaissance des objets, des lieux, des personnes (agnosie). La maladie s'accompagne également de divers troubles du comportement qui viennent aggraver les troubles cognitifs et peuvent diminuer la tolérance de l'entourage du patient : repli sur soi, apathie, symptômes dépressifs, troubles du sommeil, de l'appétit, agitation, hallucinations... Enfin, des signes neurologiques somatiques apparaissent le plus souvent, entraînant des troubles de l'équilibre, de la marche, et augmentent le risque de chutes. La maladie d'Alzheimer, perçue comme une lente et inexorable dégradation intellectuelle et physique des patients, renvoie une image très négative à la société.
Un objectif poursuivi par les cliniciens est de repérer des patients atteints de troubles cognitifs n'ayant pas encore de retentissement sur les activités ou l'autonomie. Ces troubles peuvent être considérés comme une première phase symptomatique de la maladie d'Alzheimer. Le terme le plus couramment utilisé pour définir l'atteinte de ces patients est actuellement celui de Mild Cognitive Impairment (MCI), soit déclin cognitif léger. Ces patients présentent un risque plus élevé de développer un syndrome démentiel après une ou plusieurs année(s) de suivi.
Il existe une minorité de cas de transmission familiale monogénique (environ 1 % des malades) qui surviennent de façon beaucoup plus précoce, parfois avant même l'âge de 40 ans. Dans la majorité des cas, la maladie d'Alzheimer apparaît comme une pathologie multifactorielle résultant de l'interaction de divers facteurs environnementaux, épigénétiques et de facteurs génétiques qui pourraient favoriser son apparition. Différentes études ont identifié des « facteurs de risque » et des « facteurs de protection ». Des facteurs cardiovasculaires comme l'hypertension artérielle seraient des facteurs de risque. À l'inverse, une bonne hygiène de vie (activités physique et intellectuelle, consommation de poisson...) semble exercer des effets protecteurs.
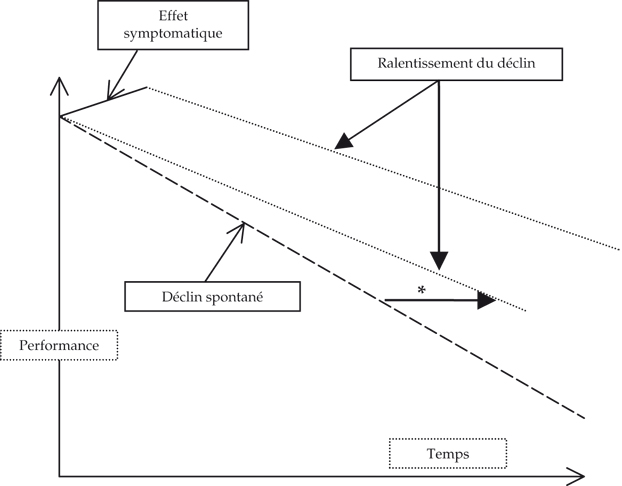
Aujourd'hui, en France, le diagnostic de la maladie d'Alzheimer est porté tardivement et la prise en charge des patients est hétérogène. Les médicaments symptomatiques actuellement disponibles ont une efficacité modeste (parfois contestée) sur l'évolution de la maladie. D'autres ressources existent ; elles visent à stimuler, consolider les fonctions du patient, améliorer son bien-être et ses capacités d'autonomie et à soutenir sa famille.
Enfin, outre le poids douloureux de la maladie, celui du coût financier – pour les familles et pour la société – est loin d'être négligeable, et des projections économiques selon les différents scénarios qui peuvent être aujourd'hui envisagés s'avèrent indispensables.
La maladie d'Alzheimer se caractérise par des lésions cérébrales
Le diagnostic certain de maladie d'Alzheimer repose sur l'observation de lésions cérébrales caractéristiques (généralement constatées à l'occasion d'un examen post mortem) : les plaques séniles et les dégénérescences neurofibrillaires. Ces altérations microscopiques sont associées à des modifications macroscopiques. Le poids et le volume du cerveau sont en moyenne diminués. Des aires corticales qui jouent un rôle dans les fonctions mnésiques et sont situées à la face interne des hémisphères – le cortex entorhinal et l'hippocampe – sont les premières à perdre du volume, suivies par les régions du cortex impliquées dans des fonctions telles que le langage, l'analyse complexe des influx visuels ou auditifs ou la programmation des mouvements volontaires.
L'examen microscopique met en évidence deux types de lésions – neurofibrillaires et amyloïdes – l'une et l'autre localisées dans des régions spécifiques du cerveau.
La pathologie neurofibrillaire est due à l'accumulation pathologique dans le neurone d'une protéine naturellement présente, la protéine Tau. Cette protéine joue un rôle dans la polymérisation des microtubules. La pathologie amyloïde est quant à elle caractérisée par l'accumulation extracellulaire d'un peptide normalement présent à faible concentration, le peptide β-amyloïde ou Aβ. La fonction normale de ce peptide et de son précurseur demeure méconnue.
Les accumulations de peptide Aβ et de protéine Tau prennent différents aspects morphologiques. Le peptide Aβ extracellulaire peut former des dépôts volumineux, faiblement concentrés, en « carte de géographie » : les dépôts diffus. Les dépôts focaux de peptide Aβ sont, au contraire, denses et de forme sphérique. Ils ont des caractéristiques physico-chimiques propres aux substances amyloïdes : insolubilité dans les solvants habituels, structure fibrillaire en microscopie électronique et affinité pour certains colorants comme le rouge Congo ou la thioflavine. Le peptide Aβ se dépose également dans la paroi des vaisseaux (angiopathie amyloïde). La dégénérescence neurofibrillaire est l'agrégation de protéine Tau dans le corps cellulaire du neurone. Les « fibres tortueuses » (neuropil threads) sont des prolongements nerveux, principalement dendritiques, chargés de protéine Tau. Cette protéine s'accumule également dans les axones qui entourent les dépôts focaux de peptide Aβ, formant la couronne de la plaque sénile. La plaque sénile est donc constituée d'un dépôt focal de peptide Aβ entouré d'une couronne d'axones enrichis en protéine Tau.
Concernant la topographie des lésions, la pathologie neurofibrillaire affecte préférentiellement le cortex entorhinal, l'hippocampe et les aires associatives. Elle touche aussi des structures sous-corticales : les noyaux limbiques du thalamus, le noyau basal de Meynert qui assure l'innervation cholinergique du cortex, le locus cœ ruleus (innervation noradrénergique) ou les noyaux du raphé (innervation sérotoninergique). Les dépôts diffus et focaux de peptide Aβ sont observés dans le cortex cérébral. Des dépôts uniquement de type diffus sont observés dans les noyaux gris centraux et le cervelet.
L'analyse d'un grand nombre de cas, d'âge et de gravité variables, a permis de retracer l'évolution spatiale et temporelle des lésions et d'en décrire les stades. Les lésions neurofibrillaires intéressent successivement la région entorhinale (stades I et II de Braak), hippocampique (stades III et IV), et néocorticale (stades V et VI). Chaque stade ajoute une nouvelle structure touchée à celles qui l'étaient au stade précédent. Il en est de même pour les 5 « phases » de Thal qui décrivent l'évolution des dépôts de peptide Aβ, qui surviennent de façon successive et additive, dans le néocortex, dans l'aire entorhinale et l'hippocampe, dans les noyaux sous-corticaux, dans le tronc cérébral et finalement dans le cervelet.
La progression des lésions neurofibrillaires dans le cortex (cortex entorhinal puis hippocampe, et enfin néocortex) correspond à la progression des symptômes. En revanche, les dépôts de peptide Aβ sont moins bien corrélés aux symptômes. Il est fréquent de trouver, chez un sujet âgé considéré comme intellectuellement normal, des dépôts diffus de peptide Aβ dans le cortex cérébral associés à des dégénérescences neurofibrillaires dans l'hippocampe et le cortex entorhinal. Ces lésions paraissent constantes dans le cerveau de centenaires ayant fait l'objet d'un examen post mortem. Elles peuvent être rencontrées chez des sujets jeunes considérés comme asymptomatiques. Leur signification est discutée. Leur fréquence a laissé penser qu'elles pouvaient rester stables et n'être le témoin que du vieillissement cérébral physiologique, un concept aux limites peu précises. Selon une autre hypothèse, ces lésions, même sans conséquence clinique, pourraient signer la présence d'une maladie d'Alzheimer encore asymptomatique.
De nombreuses inconnues demeurent dans la neuropathologie de la maladie d'Alzheimer et dans ses corrélations cliniques, notamment du fait de la rareté des études post mortem systématiques de patients atteints de maladie d'Alzheimer et de sujets âgés normaux (particulièrement en France). L'hypothèse la plus communément admise aujourd'hui de la « cascade amyloïde » suppose que les dépôts de peptide Aβ sont à l'origine de la pathologie neurofibrillaire. Pourquoi, dans cette hypothèse, observe-t-on, dans les stades précoces, des lésions neurofibrillaires sans dépôts amyloïdes ? Le peptide Aβ peut-il s'accumuler dans le parenchyme avant la constitution des plaques séniles ? Quelle est la relation entre la pathologie liée au peptide Aβ et celle associée à la protéine Tau ?
Les souris transgéniques exprimant un ou différents gènes portant une ou plusieurs mutations responsables de maladie d'Alzheimer familiale permettent d'appréhender expérimentalement certains des stades de la pathologie ; les dépôts amyloïdes n'ont encore jamais été à l'origine d'une accumulation intracellulaire de protéine Tau chez la souris, et inversement. Il est donc indispensable de confronter la complexité de la neuropathologie humaine à ses modèles animaux.
Par ailleurs, les corrélats pathologiques du MCI et des symptômes tels que les troubles du comportement, le syndrome extrapyramidal, les troubles du sommeil, l'amaigrissement, ont été très peu étudiés sur de larges cohortes de patients autopsiés. L'épidémiologie des lésions de la maladie d'Alzheimer est encore mal connue ; la plupart des études provient de patients hospitalisés. Qu'en est-il dans la population générale ? Quelle est la fréquence, probablement sous-estimée, des lésions elles-mêmes et des pathologies associées, vasculaires ou neurodégénératives (en particulier des corps de Lewy, trouvés dans la maladie de Parkinson et la démence à corps de Lewy) ? De nombreuses questions restent donc à explorer et supposent le recueil systématique de données obtenues par l'examen de cerveaux post mortem.
Les lésions cérébrales s'accompagnent d'une accumulation de peptide β-amyloïde
Comme il a été décrit précédemment grâce aux examens post mortem, la maladie d'Alzheimer est caractérisée par des dépôts de morphologies diverses, de topologie et de cinétique d'apparition spécifiques, appelés dépôts diffus, dépôts focaux et dépôts vasculaires. Toutes ces lésions cérébrales sont constituées de peptides hydrophobes de nature variée, regroupés sous le terme générique de peptides amyloïdes (Aβ), et qui sont tous dérivés d'un précurseur appelé βAPP (β-Amyloid Precursor Protein) ou APP. La purification du peptide Aβ en 1984 et le clonage de son précurseur en 1987 ont permis de faire un bond significatif dans la compréhension de la genèse de ce peptide. Il a notamment été démontré que le peptide Aβ est un catabolite « normal » de la maturation physiologique de la protéine βAPP. Ce sont des altérations post-traductionnelles qui se répercutent sur les taux de peptide Aβ dans la cellule. Quand le peptide Aβ augmente, ce peptide hydrophobe s'agrège et le processus de dépôts peptidiques est sans doute initié. Certaines mutations responsables de formes génétiques, agressives et précoces de maladie d'Alzheimer, ont été identifiées sur la protéine βAPP elle-même. De manière intéressante, ces mutations se traduisent toujours par une altération des taux ou de la nature même des peptides Aβ. Cette observation indique l'importance du peptide Aβ dans l'étiologie de la maladie d'Alzheimer et souligne l'intérêt de l'étude des enzymes responsables de la formation du peptide amyloïde. Le peptide Aβ résulte de l'action combinée de deux activités protéolytiques distinctes, la β-sécrétase et la γ-sécrétase qui libèrent respectivement les extrémités N- et C-terminales du peptide ; c'est la voie amyloïdogénique.
L'activité de la β-sécrétase est maintenant bien caractérisée. Il s'agit d'une protéase acide purifiée et caractérisée simultanément par plusieurs équipes de recherche, et appelée BACE1 (β-site-APP Cleaving Enzyme 1) ou memapsin 2. La protéase BACE1 possède un homologue appelé BACE2 qui semble peu présent au niveau cérébral et qui contribue peu ou pas à la production de peptide Aβ. L'invalidation du gène codant pour BACE1 seul suffit à bloquer pratiquement totalement la production de peptide Aβ. Les souris invalidées pour BACE1 sont viables et fertiles.
La γ-sécrétase est l'enzyme qui libère l'extrémité C-terminale des peptides amyloïdes, engendrant les couples Aβ 40/AICDC59 (Amyloid IntraCellular Domain) et Aβ 42/AICDC57. Il existe un autre clivage (coupure ɛ) intervenant en aval du site γ-sécrétase, proche du feuillet interne de la membrane, qui libère l'AICDC50. De nombreuses études suggèrent que les présénilines 1 et 2 (PS1 et PS2), protéines responsables de la majorité des formes familiales de la maladie d'Alzheimer, sont elles-mêmes porteuses de l'activité γsécrétase. Les premiers éléments le laissant supposer concernent l'observation empirique que les mutations portées par les présénilines se traduisent toujours par une modulation des taux et de la nature même du peptide Aβ formé, avec une incidence particulière sur la production exacerbée de Aβ x42 pathogène. D'autre part, l'invalidation du gène codant pour la PS1 diminue drastiquement la production de peptides Aβ et celle-ci est virtuellement abolie quand les deux PS1 et PS2 sont réduites. L'activité γ-sécrétase dépendante des présénilines apparaît portée par un complexe multiprotéique de haut poids moléculaire impliquant au moins trois autres protéines, la nicastrine (NCT), Aph-1 (Anterior pharynx defective 1 homolog) et Pen-2 (Presenilin enhancer 2 homolog). Il existe deux présénilines, trois homologues de Aph-1 (Aph-1a, Aph-1b et Aph-1c) et deux isoformes de Aph-1a (Aph1aL et Aph-1aS). L'existence de complexes γ-sécrétase distincts reflète sans doute le fait que chacun d'entre eux pourrait avoir une fonction différente liée à la capacité d'hydrolyse de substrats spécifiques.
Les taux endogènes de peptides Aβ sont régis par la balance entre les processus de formation du peptide et ceux de sa dégradation. Il n'y a aucune étude montrant que les processus de formation des peptides amyloïdes sont altérés dans les formes sporadiques de maladie d'Alzheimer et, notamment, aucun travail n'a établi que l'activité des β- et γ-sécrétases était augmentée. On admet que les modifications se traduisant par l'augmentation des niveaux de peptide Aβ sont généralement post-traductionnelles. Les processus de dégradation du peptide sont donc particulièrement importants. Les études concernant les enzymes de dégradation du peptide Aβ ont identifié la néprilysine (NEP), l'enzyme de conversion de l'endothéline (ECE) et l'enzyme de dégradation de l'insuline (IDE) qui pourraient toutes les deux constituer des cibles thérapeutiques.
Les dégénérescences neurofibrillaires résultent de l'agrégation de la protéine Tau
Dans la maladie d'Alzheimer, les dégénérescences neurofibrillaires résultent de l'agrégation intraneuronale de protéines Tau, sous la forme de paires de filaments en hélice. La présence de ces lésions neuropathologiques est très bien corrélée au déficit cognitif.
Les protéines Tau sont des protéines associées aux microtubules. Elles sont principalement exprimées dans les neurones. Il existe six isoformes de protéines Tau dans le cerveau humain adulte générées par épissage alternatif à partir d'un gène unique situé sur le chromosome 17. Ces protéines jouent un rôle dans la polymérisation et la stabilité des microtubules. Cette fonction est régulée par l'état de phosphorylation des protéines Tau.
Dans de nombreuses maladies neurodégénératives regroupées sous le terme de « tauopathies », des formes anormalement phosphorylées d'isoformes de protéines Tau s'agrègent en filaments. Dans la maladie d'Alzheimer, les dégénérescences neurofibrillaires sont trouvées initialement dans le cortex entorhinal et la formation hippocampique, et affectent de façon séquentielle des sous-populations neuronales de l'isocortex. Elles apparaissent ensuite dans les régions polymodales associatives, puis unimodales associatives et finalement sensori-motrices (primaires et secondaires). Dans les autres maladies neurodégénératives, il existe une agrégation des protéines Tau non seulement dans les neurones mais aussi dans les cellules gliales.
L'hyperphosphorylation et la modification du rapport entre les différentes isoformes de protéines Tau sont primordiales dans la formation des dégénérescences neurofibrillaires. D'un point de vue étiologique, l'épissage de Tau peut être modulé de façon directe (mutations sur le gène de Tau dans certaines formes familiales de démence frontotemporale associées à un syndrome parkinsonien) ou indirecte (répétitions de triplets CUG dans la dystrophie myotonique de Steinert). Concernant la phosphorylation anormale de Tau, elle peut résulter de l'augmentation de l'activité de certaines kinases (kinases dépendantes de la diminution d'activité de phosphatases) et de la modulation de régulateurs (peptidyl prolyl cis/trans-isomérases, protéines 14.3.3...). Les modifications qui conduisent à l'agrégation des protéines Tau sont donc la phosphorylation et des variations d'épissage, et seraient responsables d'un changement de conformation des protéines.
Par ailleurs, il existe des co-facteurs d'agrégation des protéines Tau comme les glycosaminoglycanes et les acides gras qui pourraient favoriser la formation de fibrilles. D'autres pistes sont également explorées pour comprendre les conditions qui conduisent aux dégénérescences neurofibrillaires. Parmi celles-ci, on peut citer le stress oxydant, la réactivation du cycle cellulaire et la vulnérabilité de certaines sous-populations neuronales. Les stratégies thérapeutiques potentielles sont fondées sur ces hypothèses étiologiques.
L'agrégation des protéines Tau perturbe le fonctionnement neuronal. Si l'altération du transport axonal constitue la principale perturbation, d'autres conséquences restent encore mal comprises comme le déficit en agents neurotrophiques et neurotransmetteurs.
Connaître les différents facteurs génétiques peut permettre de mieux appréhender les causes de la maladie
Même si les mécanismes susceptibles de conduire aux lésions caractéristiques de la maladie d'Alzheimer commencent à être mieux connus, ceux-ci sont toutefois très loin d'être complètement compris. De fait, caractériser des facteurs capables de favoriser le développement d'une pathologie complexe telle que la maladie d'Alzheimer est un enjeu majeur. Ces facteurs peuvent être de plusieurs ordres : génétiques, épigénétiques et environnementaux. De leurs interactions dépendra la prédisposition à développer l'affection. Cependant, la maladie d'Alzheimer apparaissant comme une maladie à prédisposition génétique non négligeable, des efforts considérables ont été déployés au cours des vingt dernières années pour caractériser ses déterminants génétiques.
Il est estimé que moins de 1 % des cas présentent un mode de transmission autosomique dominant, ces formes étant précoces (<60 ans) voire très précoces (<40 ans). Au-delà de ces formes familiales monogéniques, il peut exister une agrégation familiale évidente pour environ 5 à 8 % des cas. L'existence d'antécédents familiaux pour ces formes est alors associée à une augmentation de 2 à 5 fois du risque de développer la maladie d'Alzheimer. En revanche, pour plus de 90 % des cas de maladie d'Alzheimer, essentiellement à début tardif (au-delà de 65 ans), aucune agrégation familiale n'est connue. Ces formes sont alors définies comme « sporadiques ». Ce constat pourrait sous-entendre l'absence de déterminisme génétique. Or, il est maintenant clairement établi que des facteurs génétiques peuvent être impliqués dans ces formes sporadiques. Ainsi, que ce soit pour les formes présentant une agrégation familiale ou pour les formes sporadiques, la maladie d'Alzheimer apparaît comme une pathologie multifactorielle résultant de l'interaction de facteurs génétiques et de facteurs environnementaux. L'ensemble des formes non monogéniques de la maladie d'Alzheimer est finalement défini comme ne présentant pas de transmission mendélienne classique.
La découverte de mutations responsables des formes autosomiques dominantes, et donc monogéniques, de la maladie d'Alzheimer a profondément influencé notre compréhension du processus pathologique de l'affection. En 1991, la première mutation sur le gène du précurseur du peptide amyloïde (APP) était mise en évidence, protéine dont le métabolisme produit les peptides amyloïdes qui sont les principaux composants des dépôts amyloïdes. Puis en 1995 ont été mises en évidence des mutations sur les gènes des présénilines 1 et 2 (respectivement, PS1 et PS2). Ces mutations, en particulier celles de PS1, ont très rapidement été associées à une augmentation de la production des peptides amyloïdes, plus particulièrement en favorisant les formes Aβ x-42. La caractérisation de ces gènes mutés a fortement contribué à placer le métabolisme de l'APP au centre du processus pathologique de la maladie d'Alzheimer et à proposer l'hypothèse de la cascade amyloïde.
Cependant, même si l'importance des mutations des gènes APP, PS1 et PS2 est incontestable, ces mutations n'expliquent pas toutes les formes monogéniques de la maladie d'Alzheimer et, surtout, elles ne sont responsables que de formes très rares de la pathologie.
Concernant les formes sans transmission mendélienne classique, il a été mis en évidence dès 1993, l'impact majeur de l'allèle ɛ4 du gène de l'apolipoprotéine E (APOE4) sur le risque de développer la maladie d'Alzheimer. Les individus porteurs d'au moins une copie de cet allèle ont un risque 3 à 4 fois plus élevé de développer l'affection, avec un début plus précoce. Le gène de l'APOE4 serait associé à près de 20 % des cas de maladie d'Alzheimer. Néanmoins, l'implication de la protéine APOE dans le processus physiopathologique n'est toujours pas élucidée.
Cette première découverte essentielle a pu laisser croire que l'étude de la génétique des formes sans transmission mendélienne classique de la maladie d'Alzheimer serait rapide. Depuis la mise en évidence du gène de l'APOE4, et malgré la multiplication des analyses, avec près de 200 gènes candidats étudiés et plus de 800 publications qui leur sont consacrées, aucun consensus n'a pu être obtenu quant à la caractérisation de nouveaux déterminants génétiques de la maladie. Il a toutefois été estimé qu'au moins 4 gènes majeurs présentant un effet similaire à celui de l'APOE, existeraient. De plus, par analyse de liaisons génétiques sur les formes présentant une agrégation familiale, plus de 20 loci ont été caractérisés, susceptibles de contenir un déterminant génétique de la maladie d'Alzheimer. Un consensus s'est dégagé pour 4 régions chromosomiques en 9p21, 9q22, 10q21-25 et 12p11-12. Il est donc probable que plusieurs dizaines de gènes présentant un effet plus modeste, interviennent aussi.
La très grande majorité de la part génétique de la maladie d'Alzheimer reste donc encore à caractériser. Des perspectives se sont ouvertes grâce au développement des nouvelles approches à haut-débit permettant l'analyse de milliers de polymorphismes en un temps court et pour un coût par génotypage faible. Par ailleurs, l'établissement de convergences biologiques pour sélectionner les gènes candidats les plus pertinents devrait permettre de nouvelles avancées majeures.
La caractérisation de ces gènes devrait aider à la compréhension du (ou des) processus physiopathologique(s) impliqué(s) dans le développement de la maladie d'Alzheimer. Cette compréhension contribuera au développement de nouvelles thérapies en ciblant des protéines clés du processus physiopathologique. Des profils génétiques individuels pourront potentiellement être établis afin de définir la prise en charge thérapeutique la plus efficace. À cet égard, il a été rapporté que l'efficacité d'inhibiteurs d'acétylcholinestérase dépendrait du génotype de l'APOE, les individus porteurs de l'allèle ɛ4 répondant moins bien au traitement. Enfin, c'est seulement avec une connaissance exhaustive des acteurs de la maladie d'Alzheimer qu'un outil génétique d'aide au diagnostic pourra être éventuellement proposé.
Les avancées de la recherche permettent d'envisager de nouvelles pistes thérapeutiques et de nouveaux biomarqueurs
Les thérapeutiques utilisées actuellement sont fondées sur des observations anciennes : la maladie d'Alzheimer s'accompagne d'une baisse du taux d'acétylcholine dans le cerveau d'où l'idée d'agir sur l'enzyme de dégradation de ce neurotransmetteur (stratégie anti-acétylcholinestérasique) ou, plus récemment, avec un autre médicament agissant sur le glutamate, un neurotransmetteur ayant un effet neurotoxique à concentration élevée (stratégie anti-glutamatergique).
Les progrès réalisés dans la compréhension de la maladie d'Alzheimer permettent aujourd'hui d'envisager de nouvelles approches thérapeutiques. Pour beaucoup, ces stratégies visent à prévenir l'accumulation de peptide βamyloïde (Aβ) ou de ses fragments.
Des immunothérapies ont été réalisées chez les souris transgéniques, modèles permettant de mimer les conséquences de la pathologie humaine. Deux types d'immunothérapie, active et passive, ont été testés chez l'animal. Dans le cas de l'immunothérapie active, l'injection du peptide Aβ 1-42 agrégé ou de fragments induit une réponse immunitaire qui prévient l'apparition des dépôts amyloïdes ou diminue leur quantité. L'efficacité du traitement varie en fonction du type de peptide utilisé, de son mode d'administration, de la pathologie amyloïde et du modèle utilisé. L'immunothérapie passive, qui consiste à administrer des anticorps monoclonaux dirigés contre le peptide Aβ, a des conséquences similaires.
Les mécanismes sous-jacents à la clairance des dépôts amyloïdes dans le cerveau des animaux transgéniques suite à l'immunothérapie sont encore mal compris. Après immunisation active, la disparition des dépôts amyloïdes chez les souris était associée à une amélioration de leurs performances dans des tâches de mémoire spatiale. De même, l'immunothérapie passive chez des animaux transgéniques âgés, bien qu'ayant un faible effet sur la diminution de la charge amyloïde, a permis une amélioration significative des fonctions cognitives. D'autres paramètres biologiques liés à la cognition, comme l'intégrité synaptique, sont également améliorés par l'immunothérapie.
Ces approches ont permis d'envisager des stratégies thérapeutiques chez l'homme. Les premières tentatives ont été réalisées en 2001, puis abandonnées après que 6 % des patients aient développé une méningo-encéphalite.
Entre temps, les essais pré-cliniques chez l'animal ont repris, recherchant une immunothérapie présentant moins d'effets secondaires et une approche plus ciblée vers des formes pathologiques du peptide amyloïde. La plupart de ces approches est encore en essai pré-clinique mais certaines sont en phase I ou II et l'une d'elles est d'ores et déjà en phase III. L'immunothérapie est sans doute l'innovation thérapeutique qui porte le plus d'espoir dans le traitement de la maladie d'Alzheimer.
Parallèlement, des études d'invalidation génique de la β-sécrétase (ou BACE1) qui libère l'extrémité N-terminale du peptide Aβ ont montré que les animaux dépourvus de BACE1 sont viables, fertiles et ne présentent pas d'altérations phénotypiques majeures. Toutefois, la cristallisation de BACE1 associée à son substrat a révélé que le site de liaison du substrat à l'enzyme était très étendu, rendant difficile la conception d'inhibiteurs non peptidiques, biodisponibles et métaboliquement stables. Ainsi, il n'y a pas actuellement d'inhibiteurs de β-sécrétase ayant atteint le stade de l'essai clinique. Deux autres approches consistent soit à réduire les taux de BACE1 par une approche ARN antisens, soit à bloquer l'accessibilité de l'enzyme pour la protéine précurseur du peptide Aβ (βAPP) à l'aide d'anticorps spécifiques. Cette dernière approche, encore expérimentale, permet de s'affranchir du fait que BACE1 puisse couper d'autres substrats que la βAPP et de garder fonctionnelle l'enzyme pour ses autres fonctions.
La γ-sécrétase libérant l'extrémité C-terminale du peptide Aβ est une cible théorique primordiale si l'on veut bloquer la surproduction de ce peptide. L'activité γ-sécrétase englobe deux types de complexes enzymatiques, dépendants ou indépendants des présénilines (PS). La stratégie visant à bloquer le complexe PS-dépendant s'est rapidement avérée problématique, l'inactivation génique des PS étant létale in utero. Toutefois, il a été récemment décrit un inhibiteur (LY450139) pour lequel les auteurs ne rapportent pas de toxicité marquée dans un essai clinique de courte durée. Mais aucune baisse significative des taux de peptide Aβ n'a été mesurée dans le liquide céphalo-rachidien.
L'α-sécrétase coupe la βAPP au milieu de la séquence Aβ et, théoriquement, diminue la production du peptide Aβ. Il a été établi que des activateurs de la protéine kinase C augmentaient la coupure α-sécrétase, et que cela se répercutait par une diminution de peptide Aβ in vivo. Le challenge est donc de développer des agents stimulant l'α-sécrétase. Quelques résultats prometteurs ont été obtenus. Ainsi, la bryostatine réduit l'accumulation de peptide Aβ dans le cerveau de souris transgéniques sans effets secondaires immédiats.
La dégradation du peptide Aβ constitue également une cible intéressante. Les enzymes majeures participant au catabolisme du peptide sont la néprilysine (NEP), l'enzyme de dégradation de l'insuline (IDE) et l'enzyme de conversion de l'endothéline (ECE). Diverses options peuvent être envisagées pour leur activation pharmacologique.
Il existe plusieurs stratégies visant à bloquer la polymérisation du peptide Aβ et donc son agrégation. Deux molécules candidates, Alzhemed™ (ou tramiprosate) et Clioquinol, sont en cours d'essai clinique. Les processus d'agrégation sont amplifiés par les ions métalliques lourds et, en conséquence, les chélateurs de ces ions peuvent retarder la polymérisation.
Il a été montré que les glycosaminoglycanes (GAG) favorisaient l'agrégation du peptide Aβ. C'est cet effet qu'inhibe Alzhemed™ et des études ont montré que le médicament bloque la fibrillation du peptide Aβ in vitro et dans le cerveau de souris transgéniques. Cette substance administrable par voie orale est bien tolérée, non toxique et possède une bonne biodisponibilité dans le cerveau. Les niveaux plasmatiques de Aβ 42 baissent de manière dose dépendante au cours d'un traitement de trois mois et l'état cognitif est stabilisé quand on s'adresse à des patients ayant une forme modérée de maladie d'Alzheimer. Parmi les stratégies « anti-amyloïdes » actuelles, Alzhemed™ est un des candidats les plus avancés puisqu'il est actuellement en phase III.
Tableau État d'avancement actuel concernant différentes stratégies thérapeutiques
|
Stade
|
Stratégie thérapeutique
|
Mécanisme ciblé
|
|
Abandonné
|
Immunothérapie active : AN-1792
|
Vaccin anti-Aβ intact
|
|
Préclinique
|
Inhibition/blocage de la β-sécrétase et γ-sécrétase
|
Réduction de la production de Aβ
|
| |
Activation de l'α-sécrétase :
Bryostatine 1
|
Activation de la protéine kinase C
|
| |
Inhibiteur de kinases
|
Neuroprotection/Réduire la dégénérescence neurofibrillaire
|
|
Phase I
|
Inhibition/blocage de la γ-sécrétase
|
Réduction de la production de Aβ
|
|
Phases I, II et III
|
Immunothérapie passive
|
Anticorps monoclonal contre Aβ
|
|
Phases I et II
|
Immunothérapie active
|
Vaccin anti-fragments Aβ couplés à un haptène
|
| |
Inhibiteur de kinases
|
Neuroprotection/Réduire la dégénérescence neurofibrillaire
|
|
Phase II
|
Chélation des métaux lourds : Dérivé Clioquinol
|
Chélation du cuivre et du zinc pour réduire l’agrégation de Aβ
|
|
Phase III
|
Anti-polymérisation :
Tramiprosate (Alzhemed™)
|
Mimétique de glycosaminoglycan
Réduction de Aβ
|
| |
Modulateurs de γ-sécrétase :
R-Flurbiprofène anti-inflammatoire non stéroïdien
|
Réduction de la production de Aβ42
|
| |
Œstrogènes, anti-inflammatoire non stéroïdien, antioxydants, statines
|
Neuroprotection
|
De nombreux travaux suggèrent que des processus de stress oxydant interviennent avant le début des symptômes de la maladie d'Alzheimer. Ainsi, diverses stratégies antioxydantes ont été développées. Toutefois, les études ont donné lieu à des résultats parfois contradictoires et ne font pas actuellement l'objet d'essais cliniques.
Il a été montré que la maladie d'Alzheimer s'accompagne d'une perte neuronale et d'une altération de l'architecture synaptique et il est notoire que les facteurs neurotrophiques protègent de la mort neuronale et de la toxicité amyloïde. Le NGF (Nerve Growth Factor) cible plus particulièrement la transmission cholinergique. La première étude d'application ex vivo de NGF chez 8 patients présentant une maladie d'Alzheimer modérée a établi une absence de toxicité à 22 mois, ainsi qu'une amélioration dans l'évolution du déclin cognitif. Ces premiers résultats concernant une approche de thérapie génique sont encourageants mais attendent confirmation sur des cohortes plus importantes. Il est peu probable qu'une stratégie visant uniquement la transmission cholinergique puisse « guérir » la maladie d'Alzheimer mais elle pourrait s'avérer complémentaire aux approches anti-amyloïdergiques, particulièrement aux stades précoces ou modérés de la maladie.
Les œ strogènes sont des hormones pléïotropes qui pourraient être impliquées dans les processus de neuroprotection. Cependant, à l'heure actuelle, les études réalisées ne permettent pas de conclure à un effet significatif des œ strogènes sur la formation du peptide Aβ.
Les mécanismes par lesquels le cholestérol augmente les taux de peptide Aβ sont encore mal compris. Des études indiquent qu'il régulerait négativement l'activité α-sécrétase et potentialiserait l'activité des β- et γ-sécrétases. Cependant, le rôle bénéfique des statines a été récemment mis en doute : aucun effet significatif sur les fonctions cognitives n'a pu être établi.
Dans des cellules transfectées ou chez l'animal transgénique « Alzheimerisé », certains anti-inflammatoires non stéroïdiens (ibuprofène, indométhacine) peuvent réduire la production de Aβ 42. Plusieurs essais thérapeutiques contrôlés ont été réalisés mais n'ont pas donné lieu à des conclusions consensuelles.
La recherche sur la maladie d'Alzheimer bénéficie aujourd'hui de modèles animaux où la pathologie affecte principalement l'hippocampe et les fonctions cognitives, comme dans la pathologie humaine, et de tels modèles concourent à mieux comprendre les mécanismes d'agrégation des protéines Tau et envisager une stratégie thérapeutique.
Les conséquences de la phosphorylation anormale des protéines Tau sont une perturbation de la stabilité des microtubules et une perte de transport axonal. Des molécules permettant de stabiliser les microtubules (des dérivés du taxol) ont donc été proposées dans le traitement des tauopathies. Leur utilisation en clinique est néanmoins fort peu probable puisque ces substances ne sont pas spécifiques aux neurones. De plus, certaines tauopathies présentent une surexpression de protéines Tau 4R favorisant la stabilité des microtubules et il est probable que le taxol va montrer les mêmes effets indésirables.
La phosphorylation anormale des protéines Tau favoriserait leur agrégation en filaments. L'utilisation d'inhibiteurs de kinases est donc une voie prometteuse avec l'utilisation du lithium ou d'inhibiteurs de GSK3β pour ralentir la progression de la dégénérescence neurofibrillaire. Des essais thérapeutiques en cours testent cette approche. Des résultats similaires ont été obtenus pour des inhibiteurs de MAP kinases. De même, la compréhension du rôle des phosphatases et des prolyl-isomérases est également cruciale pour réguler les mécanismes de déphosphorylation.
Si la phosphorylation est considérée comme un événement majeur de l'agrégation des protéines Tau, d'autres modifications post-traductionnelles ou conformationnelles sont aussi suspectées. En outre, les interactions entre protéines Tau peuvent permettre d'envisager le développement d'agents intercalants inhibant leur agrégation. Depuis peu, il est possible de suivre l'agrégation des protéines directement en spectroscopie par résonance magnétique nucléaire (RMN) et d'identifier les séquences peptidiques impliquées. Ces travaux permettent de mettre en évidence des agents intercalants et ouvrent de nouvelles perspectives thérapeutiques pour les tauopathies.
Les progrès réalisés dans la compréhension des mécanismes biologiques avec la mise en évidence de facteurs impliqués dans l'étiopathogenèse de la maladie d'Alzheimer ont permis d'identifier des marqueurs biologiques de la pathologie : les protéines Tau totales, les protéines Tau hyperphosphorylées (phospho-Tau) et le peptide Aβ 1-42. Ces marqueurs, dosés dans le liquide céphalo-rachidien (LCR), sont explorés dans le cadre de la recherche dans certains centres experts ou réseaux de spécialistes. Des techniques de dosage simultané sont en cours de développement. D’après une étude réalisée en 2006, l’altération combinée des trois marqueurs permettrait de repérer les patients susceptibles d’évoluer d’un MCI vers une maladie d’Alzheimer.À l'heure actuelle, d'autres candidats biologiques sont en train d'émerger tels que des formes tronquées de peptides Aβ, des enzymes impliquées dans le métabolisme du précurseur APP ou du métabolisme de la proteine Tau, et des protéines associées aux lésions de la maladie d'Alzheimer. La possibilité d'effectuer des dosages sanguins de biomarqueurs constituerait une avancée importante et mettrait à l’ordre du jour l’étude de leur application en pratique clinique courante en complément des examens cliniques.
L'approche neuropsychologique est fondamentale pour l'évaluation des troubles cognitifs
Depuis une vingtaine d'années, grâce au développement de la neuropsychologie cognitive et de la recherche clinique, à la prise de conscience du problème de santé publique que représente la maladie d'Alzheimer et aussi du fait de l'établissement de critères diagnostiques, des progrès considérables ont été réalisés dans la description des perturbations cognitives relatives à cette pathologie. La précocité et l'importance de ces perturbations font de l'examen neuropsychologique
1
Les différents outils mentionnés sont couramment utilisés par des psychologues cliniciens formés à la neuropsychologie dans le cadre de l'examen d'un patient qui consulte pour une suspicion de maladie d'Alzheimer ou pour évaluer l'évolution des déficits cognitifs en cas de maladie légère à modérée. D'autres outils sont à la disposition des médecins, pour évaluer la sévérité d'une démence diagnostiquée ou pour faire le diagnostic chez un patient qui présente des troubles cognitifs manifestes (voir démarche diagnostique).
une priorité dans l'établissement du diagnostic de maladie d'Alzheimer. Cet examen permet de mettre en évidence les troubles, de les caractériser, de les différencier de ceux qui surviennent dans les autres maladies neurodégénératives, ou dans le syndrome dépressif, ainsi que du déclin lié à l'âge de certaines capacités cognitives. Enfin, le bilan neuropsychologique joue un rôle important dans la mise en évidence de capacités préservées, sur lesquelles pourra s'appuyer la prise en charge.
Même s'il est établi que plusieurs formes d'entrée dans la maladie sont possibles, les troubles inauguraux touchent généralement la mémoire. Cette fonction regroupe plusieurs composantes – ou systèmes mnésiques – qui ne sont pas affectées de la même façon. La mémoire épisodique permet de se souvenir des événements personnellement vécus, dans leur contexte temporel et spatial. Ses troubles occupent une place centrale dans la maladie d'Alzheimer et se caractérisent par des difficultés à acquérir de nouvelles informations et à restituer des souvenirs, en particulier ceux portant sur des faits récents. Ces troubles se distinguent du déclin de la mémoire lié à l'âge, tant par leur ampleur que par leur nature, puisqu'ils concernent les différentes étapes de la mémorisation, l'encodage, le stockage et la récupération des informations, ces derniers étant moins spécifiques car observés dans de nombreuses affections. Des troubles isolés de la mémoire épisodique sont caractéristiques du MCI amnésique. La plupart des scores des patients est déficitaire : l'apprentissage de listes de mots reliés sémantiquement ou non, l'effet de primauté (rappel des premiers mots de la liste), la reconnaissance des mots et le rappel d'une histoire ou d'une figure géométrique. La mesure qui semble être à la fois la plus sensible et la plus spécifique est le rappel différé d'une liste de mots reliés sémantiquement, ce qui peut s'expliquer par la difficulté des patients à organiser les items à mémoriser par catégorie sémantique.
L'examen de la mémoire épisodique se fait couramment à l'aide d'épreuves d'apprentissage de mots ou de rappel d'histoires. Une épreuve s'est maintenant imposée dans les consultations mémoire, « le rappel libre-trait d’union rappel indicé 16 items » (RL-RI), dérivée de la procédure de Grober et Buschke. Son objectif est de différencier des troubles « authentiques » de la mémoire épisodique de troubles « apparents » liés par exemple à l'utilisation de stratégies inefficaces ou à des troubles attentionnels qui retentissent sur les performances mnésiques. Dans la maladie d'Alzheimer, il existe un déficit du rappel libre des informations, et le rappel indicé (par exemple, « quel était le nom de la fleur ? ») n'améliore guère les performances, ce qui traduit des difficultés de l'encodage et du stockage des informations.
La mémoire sémantique, qui stocke les mots, les concepts, les connaissances sur le monde ainsi que la sémantique personnelle (connaissances générales sur soi-même), peut être perturbée précocement dans la maladie d'Alzheimer, alors qu'elle résiste bien aux effets de l'âge, ce qui fait de son atteinte un argument en faveur d'une maladie dégénérative. Des troubles de la mémoire sémantique ont régulièrement été mis en évidence dans des groupes de patients MCI et seraient parmi les meilleurs indices prédictifs du déclin cognitif ultérieur.
La mise en évidence de troubles de la mémoire sémantique peut se faire à l'aide de questionnaires portant sur les connaissances de concepts ou de personnes célèbres. Les troubles affectent davantage les connaissances spécifiques que les connaissances générales et se manifestent par des erreurs constantes d'un moment à l'autre et d'une épreuve à l'autre, ce qui signe la dégradation des concepts. Ils ne doivent pas être confondus avec des troubles de l'accès à la mémoire sémantique qui se caractérisent par des difficultés à produire le mot correct, sans perte du concept. Il s'agit alors de troubles du langage, très fréquents dans la maladie d'Alzheimer et mis en évidence à l'aide d'épreuves de dénomination d'images ou d'évocation lexicale. Le langage écrit est également perturbé dans la maladie d'Alzheimer, le symptôme le plus évocateur étant une tendance à régulariser l'écriture des mots irréguliers (« fame, onion, otone »).
La mémoire de travail, qui permet de stocker et manipuler de petites quantités d'informations pendant un bref laps de temps, est également perturbée très tôt dans la maladie d'Alzheimer. « L'administrateur central », responsable de la distribution des ressources attentionnelles et de la coordination des autres systèmes de la mémoire de travail, est particulièrement sensible à la pathologie. La mémoire de travail est couramment évaluée à l'aide de tâches d'empan (répétition de séries de chiffres, à l'endroit et à l'envers) ou de paradigmes de doubles tâches. L'atteinte de l'administrateur central doit être considérée comme l'une des perturbations cognitives fondamentales de la maladie d'Alzheimer, qui se répercute sur de multiples tâches.
La maladie d'Alzheimer affecte donc en priorité la mémoire épisodique, la mémoire sémantique et la mémoire de travail, ces trois types de mémoire étant les systèmes de mémoire les plus élaborés. En revanche, les systèmes de plus bas niveau, comme le système de représentations perceptives, qui sous-tend les effets d'amorçage perceptif, et la mémoire procédurale, qui sous-tend les habitudes sont plus résistants, tout du moins aux premiers stades de l'affection. La préservation de ces systèmes de mémoire peut servir de socle à la prise en charge des patients.
D'autres fonctions cognitives que la mémoire et le langage sont perturbées dans la maladie d'Alzheimer, en particulier les fonctions exécutives, ou processus mentaux de haut niveau impliqués dans la réalisation d'une activité dirigée vers un but. Leur perturbation est souvent précoce, et peut se manifester à un stade prédémentiel. La mise en évidence des troubles exécutifs est un enjeu important compte tenu de leurs répercussions dans la vie quotidienne des patients et sur la prise de conscience de leurs déficits cognitifs. L'épreuve de catégorisation de cartes de Wisconsin se révèle sensible, mais elle présente l'inconvénient d'être « multidéterminée », ce qui conduit parfois à lui préférer le recours à des tâches plus simples, impliquant des fonctions exécutives « de base », comme la flexibilité mentale ou la capacité d'inhibition (respectivement le Trail Making test, et le Stroop).
Enfin, d'autres troubles surviennent plus ou moins précocement au cours de l'évolution de la maladie d'Alzheimer, tels une apraxie (difficulté à réaliser des gestes sur ordre), une agnosie (difficulté à identifier des objets) ou encore des troubles visuo-spatiaux qui s'expriment par des difficultés à réaliser des dessins géométriques ou figuratifs, spontanément ou en copie. Le test de copie de la figure géométrique de Rey est l'une des épreuves les plus utilisées.
Ainsi, les travaux réalisés ces dernières années concernant la maladie d'Alzheimer ont permis une description précise des perturbations cognitives et de leurs substrats cérébraux. Ces perturbations sont dominées par les troubles de différents systèmes de mémoire. Les études insistent également sur les capacités qui sont plus longtemps préservées. Les travaux les plus récents visent à mettre en évidence les troubles les plus précoces en étudiant des patients MCI amnésiques « purs ». Même si ces patients sont rares, leur étude, et surtout celle des patients qui par la suite développent la maladie d'Alzheimer (les « converteurs ») a permis de mettre l'accent sur la nécessité de rechercher, chez un patient susceptible de présenter une maladie d'Alzheimer, des troubles « authentiques » de la mémoire épisodique, notamment en rappel différé, une altération de la mémoire sémantique, des fonctions exécutives ou des aptitudes visuo-spatiales. Ces connaissances devraient permettre un diagnostic plus précoce de la maladie et, en conséquence, une meilleure prise en charge des patients.
L'imagerie cérébrale apporte des connaissances sur les anomalies structurales et les altérations fonctionnelles
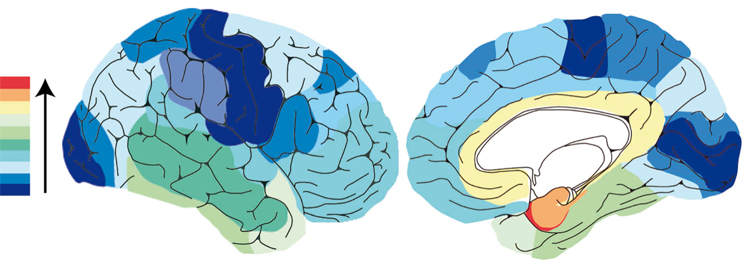
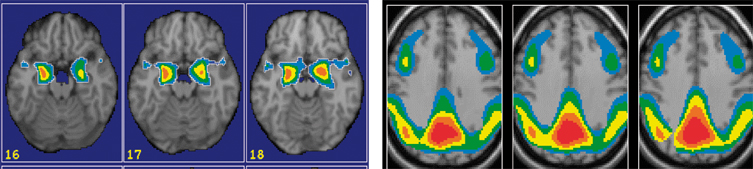
Les études en imagerie par résonance magnétique (IRM) montrent des altérations morphologiques cérébrales associées à la maladie d'Alzheimer qui touchent en premier lieu la région hippocampique, en accord avec la distribution régionale des dégénérescences neurofibrillaires. Ainsi, de nombreux auteurs ont montré une atrophie marquée de la région médiane du lobe temporal en comparaison à des sujets âgés sains, même à un stade pré-démentiel de la maladie. L'atrophie s'étend ensuite à d'autres régions (cortex temporal externe, gyrus cingulaire postérieur, cortex temporo-pariétal), en concordance avec l'expansion des dégénérescences neurofibrillaires.
La maladie d'Alzheimer entraîne une démyélinisation et une perte axonale qui concernent la substance blanche qui connecte les cortex associatifs (corps calleux, substance blanche des lobes temporaux, frontaux et pariétaux) et la substance blanche du système limbique. L'atrophie de la région temporale interne caractéristique de la maladie d'Alzheimer, s'accompagne aussi d'une vulnérabilité des fibres hippocampiques et parahippocampiques. Ces anomalies sont plus faciles à mettre en évidence par l'IRM du tenseur de diffusion que par l'IRM anatomique standard.
Les analyses en imagerie fonctionnelle (tomographie par émission de positons ou TEP) révèlent que la réduction du métabolisme du gyrus cingulaire postérieur constitue l'anomalie la plus précoce, puisqu'elle est également présente chez des patients atteints de MCI ainsi que chez des sujets sains porteurs du gène de l'APOE4, lesquels présentent un risque accru de développer la maladie d'Alzheimer. L'atteinte fonctionnelle précoce de cette région peu marquée par l'atrophie pourrait au moins en partie s'expliquer par l'effet à distance de l'altération morphologique de la région hippocampique. À un stade plus avancé de la pathologie, la baisse du métabolisme s'étend au cortex temporo-pariétal et au cortex frontal, mais le métabolisme du cortex primaire moteur et sensoriel, des noyaux gris centraux et du cervelet demeure relativement préservé. En revanche, de façon inattendue, la région hippocampique n'apparaît pas souvent hypométabolique, y compris dans de larges échantillons de patients. Cette difficulté à mettre en évidence un hypométabolisme significatif au niveau de l'hippocampe dans la maladie d'Alzheimer a parfois été attribuée à des questions méthodologiques, mais même dans les meilleures conditions, la réduction du métabolisme est nettement inférieure à celle observée dans les régions néocorticales postérieures. Ceci suggère l'existence de mécanismes compensatoires (dont la nature exacte reste à déterminer) qui pourraient se mettre en place au niveau de l'hippocampe, avant même que la maladie d'Alzheimer soit manifeste.
Ainsi, les anomalies structurales et fonctionnelles ne se superposent pas parfaitement ; les premières concernent d'abord la région hippocampique et les secondes, le gyrus cingulaire postérieur. Cette discordance est surtout frappante chez les patients MCI dont l'étude a en outre permis de souligner l'importance des anomalies fonctionnelles précoces du cortex temporo-pariétal décelables au cours d'un suivi de plusieurs mois et qui semblent spécifiques des patients qui vont par la suite développer une maladie d'Alzheimer, selon les critères diagnostiques actuels.
La distribution des altérations cérébrales permet de rendre compte des troubles cognitifs, notamment de la mémoire épisodique dans la maladie d'Alzheimer. Ceci a été établi grâce à la méthode des corrélations cognitivo-métaboliques ou cognitivo-morphologiques et à celle des activations. La première, qui consiste à établir des liens entre des troubles cognitifs et des déficits métaboliques ou des atrophies de substance grise, a permis de montrer que les dysfonctionnements de la région hippocampique et du cortex cingulaire postérieur sous-tendent respectivement les troubles de l'encodage et de la récupération. Cette méthode permet également de mettre en évidence les régions impliquées dans les mécanismes compensatoires, à un stade où les structures normalement impliquées dans la mémoire épisodique ne permettent plus de sous-tendre les performances résiduelles des patients.
Les études d'activation en TEP ou en IRM fonctionnelle réalisées dans le cadre de la maladie d'Alzheimer convergent vers une diminution des activations hippocampiques, tant lors de l'encodage que lors de la récupération, et montrent souvent une augmentation des activations situées dans le cortex associatif, notamment frontal. La notion de mécanismes compensatoires est régulièrement avancée pour expliquer ce dernier résultat et cette hypothèse a été récemment confortée par l'existence de corrélations significatives entre les activations frontales et les performances mnésiques. Les mécanismes compensatoires semblent plutôt sous-tendus par l'hippocampe chez les patients MCI. En effet, ces patients présentent des activations hippocampiques plus importantes que les sujets sains.
De nouvelles méthodes d'imagerie se développent actuellement pour visualiser les plaques séniles et les dégénérescences neurofibrillaires, ainsi que pour appréhender les troubles de la connectivité entre les régions et les anomalies de la substance blanche, mais leurs applications cliniques ne sont pas immédiates. De même, dans le cadre de la recherche, l'imagerie cérébrale fonctionnelle est précieuse pour mieux comprendre la physiopathologie de la maladie d'Alzheimer. Elle est puissante en termes de diagnostic précoce et de prédiction du déclin cognitif. Pour différentes raisons (économiques, disponibilité, variabilité inter-individuelle...), cette technique ne peut être utilisée en routine et c'est l'imagerie morphologique en IRM qui s'avère aujourd'hui la plus facile à mettre en œ uvre en pratique clinique. Sa contribution devrait encore s'intensifier avec l'automatisation de techniques de traitement d'image permettant de visualiser l'atrophie cérébrale dans des régions jouant un rôle crucial dans la survenue des troubles cognitifs. En situation de contre-indication (pace maker, claustrophobie...), la réalisation d'un scanner peut s'avérer utile pour les patients qui ne peuvent bénéficier d'une IRM.
Le diagnostic clinique n'est généralement porté qu'au stade de démence avérée
Jusqu'à présent, la maladie d'Alzheimer est définie cliniquement comme une démence dont le diagnostic se fonde sur la présence d'un déclin cognitif avec retentissement sur les activités de la vie quotidienne. Ainsi, le diagnostic repose sur une démarche en deux étapes avec, dans un premier temps, la démonstration d'un syndrome démentiel puis, secondairement, la mise en évidence d'arguments en faveur d'une maladie d'Alzheimer (installation lente et insidieuse de troubles cognitifs).
La maladie a longtemps été considérée comme une affection dégénérative du présenium (avant 65 ans). Les troubles cognitifs et comportementaux observés chez les personnes âgées étaient alors regroupés sous le terme de « démence sénile ». Il a fallu attendre les années 1960 pour reconnaître l'unicité de la maladie d'Alzheimer, cause de démence la plus fréquente, quel que soit l'âge de début. De nombreux critères de diagnostic de la maladie d'Alzheimer ont été proposés. Les principaux sont les critères de la CIM-10 (Organisation Mondiale de la Santé, 1993), du DSM-IV (
American Psychiatric Association, 1994) et du NINCDS-ADRDA (
National Institute of Neurological and Communicative Diseases and Stroke/
Alzheimer's Disease and Related Disorders Association, 1984) (voir tableaux
8.I,
8.II et
8.III). Tous font référence à une altération progressive de la mémoire et des autres fonctions cognitives en absence de toute autre pathologie pouvant rendre compte de l'apparition d'un syndrome démentiel. Ces critères ont une sensibilité globalement satisfaisante (80 % en moyenne sur l'ensemble des études) mais une spécificité moindre (de l'ordre de 70 %) pour le diagnostic de maladie d'Alzheimer probable avec confirmation
post mortem.
L'utilisation des critères diagnostiques de la maladie d'Alzheimer a fait l'objet de recommandations pratiques par l'Agence nationale d'accréditation et d'évaluation en santé (
Anaes, 2000). L'Anaes (devenue la Haute autorité de santé, HAS) recommande en particulier un avis spécialisé avec un bilan neuropsychologique et une imagerie cérébrale. Des
guidelines européens ont été élaborés en 2006 et insistent sur l'importance de l'évaluation des fonctions cognitives, avec une mesure globale des fonctions cognitives, une évaluation de la mémoire, des fonctions exécutives, et des fonctions instrumentales (langage, lecture, écriture, praxies...). Enfin, l'évaluation des activités fonctionnelles de la vie quotidienne est un élément fondamental du syndrome démentiel. D'une façon générale, le diagnostic de maladie d'Alzheimer est rendu plus difficile aux deux extrémités de l'évolution de la maladie. Au début de la maladie, les symptômes sont discrets et peuvent être masqués et confondus avec des difficultés liées au vieillissement normal. À la fin de l'évolution, aux stades ultimes de la dégradation cognitive et comportementale, il est difficile de retrouver à l'examen des stigmates spécifiques d'une affection. C'est souligner l'importance de l'interrogatoire de l'entourage sur le mode d'installation des troubles dans le diagnostic de maladie d'Alzheimer.
La maladie d'Alzheimer demeure sous-diagnostiquée en France. Selon les données épidémiologiques disponibles, la moitié des patients est aujourd'hui identifiée. Cette insuffisance de diagnostic est liée à plusieurs facteurs, en particulier au fait que nombre de médecins ne sont pas encore convaincus de l'intérêt d'une médicalisation de la maladie d'Alzheimer ni de sa prise en charge thérapeutique. Ce sous-diagnostic est principalement observé chez les patients âgés, mais concerne également les sujets les plus jeunes. Quand le diagnostic est porté, il l'est souvent avec retard. C'est ainsi que le diagnostic de maladie d'Alzheimer n'est aujourd'hui porté qu'au stade de démence avérée.
Une fois le diagnostic établi, son annonce au patient est nécessaire car c'est de ce diagnostic que vont dépendre le traitement et le plan de soins, une meilleure attitude de l'entourage, l'anticipation des périodes de crises, le choix des décisions auxquelles le patient peut participer.
Les progrès dans la connaissance de la pathologie ainsi que le développement de nouveaux outils para-cliniques dans le domaine de la neuro-imagerie ou des biomarqueurs conduisent à penser que, dans l'avenir, on fera le diagnostic de la maladie d'Alzheimer à des stades plus précoces, aujourd'hui englobés dans le syndrome du MCI.
Un diagnostic à la phase pré-démentielle de la maladie pourrait devenir possible
Dans la maladie d'Alzheimer, les premières lésions cérébrales sont présentes plusieurs années et même plusieurs décennies avant l'apparition des premiers symptômes. Cette longue phase pré-symptomatique, où les lésions s'installent à bas bruit, précède une phase de transition où des symptômes apparaissent sans atteindre les critères de démence selon les classifications actuelles (CIM-10, DSM-IV, NINCDS-ADRDA). Depuis plusieurs dizaines d'années, différents auteurs ont cherché à repérer cette première phase symptomatique de la maladie d'Alzheimer, en identifiant des patients atteints de troubles mnésiques (ou d'autres troubles cognitifs) non suffisamment sévères pour retentir sur les activités socio-professionnelles ou altérer l'autonomie. Ces études ont montré que ces patients, par rapport à d'autres sujets du même âge sans troubles cognitifs, avaient un risque accru de développer un syndrome démentiel après une ou plusieurs année(s) de suivi.
L'atteinte de ces patients est actuellement définie comme un déclin cognitif léger (MCI). Les critères de MCI ont évolué depuis une quinzaine d'années ; ceux qui ont été proposés, et précisés à plusieurs reprises, associent une plainte mnésique (corroborée par l'entourage du patient), un déficit mnésique avéré, un fonctionnement cognitif globalement normal, une préservation des activités quotidiennes de base et une absence de démence. Plusieurs formes de MCI ont été récemment distinguées : le MCI amnésique pur, le MCI intéressant plusieurs domaines cognitifs incluant la mémoire, le MCI portant sur plusieurs domaines à l'exclusion de la mémoire, le MCI caractérisé par un déficit dans un domaine isolé, en dehors de la mémoire. Le but de cette classification est de prédire au mieux la pathologie sous-jacente aux troubles observés ; après avoir été un syndrome très général, les différentes catégories du MCI sont aujourd'hui mieux définies.
Dans le MCI, la présence d'un syndrome amnésique épisodique est significativement associée à une évolution vers la maladie d'Alzheimer. Certains auteurs reprochent au concept de MCI (en dépit de ses subdivisions ultérieures) son hétérogénéité et considèrent qu'il est temps d'étudier la possibilité d'identifier les patients atteints de maladie d'Alzheimer au stade pré-démentiel, sur la base de troubles mnésiques vérifiés et des données de neuro-imagerie ou de marqueurs biologiques, en court-circuitant l'étape syndromique de MCI. De nouveaux critères sont actuellement étudiés pour établir un diagnostic de maladie d’Alzheimer probable avant le seuil de démence (voir tableau 8.V).
Des symptômes psychologiques et comportementaux accompagnent le déclin cognitif
La maladie d'Alzheimer ne se résume pas à des troubles cognitifs. Au contraire, ce sont probablement les symptômes non cognitifs associés qui vont entraîner le plus de difficultés au cours de l'évolution de la maladie. Il est à noter que la majorité des troubles comportementaux est en lien avec un syndrome confusionnel, une douleur, un effet iatrogène ou un environnement inadapté, encore mal pris en compte du fait d'un manque de formation des aidants familiaux et des professionnels de santé.
Les symptômes neuropsychiatriques ou symptômes psychologiques et comportementaux des démences appartiennent au tableau clinique de la maladie d'Alzheimer. Ils sont définis comme des manifestations primaires d'un dysfonctionnement cérébral. Ils apparaissent spécifiquement à la suite d'une atteinte d'un système ou d'un circuit comme le système limbique ou les circuits cortico-sous-corticaux. Les maladies neurodégénératives comme la maladie d'Alzheimer produisent à la fois des altérations structurales et chimiques, et les symptômes neuropsychiatriques peuvent être influencés soit par l'un soit par l'autre de ces changements.
Il faut cependant souligner que ces modifications biologiques spécifiques sont nécessaires mais non suffisantes pour produire les symptômes neuropsychiatriques, car des facteurs additionnels, en particulier psychologiques et sociaux, contribuent aussi à déterminer quel patient présentera les modifications comportementales.
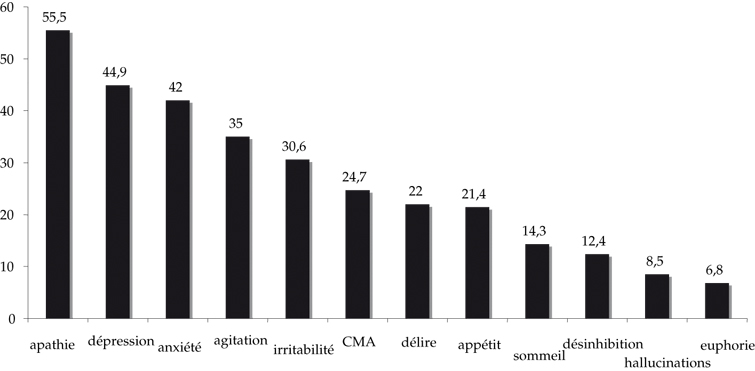
Quelle que soit la sévérité de la maladie, le symptôme le plus fréquemment rencontré est l'apathie suivie des symptômes dépressifs et de l'anxiété. Un regroupement syndromique (symptômes affectifs, apathie, hyperactivité, symptômes psychotiques) est utile pour la compréhension de leur étiologie et pour une meilleure prise en charge.
Selon les données récentes, l'existence d'antécédent de troubles dépressifs serait considérée comme un facteur de risque de maladie d'Alzheimer. En phase pré-démentielle de la maladie, le symptôme d'apathie est le symptôme neuropsychiatrique le plus précoce. Au stade démentiel, de nombreux symptômes sont présents chez plus de 80 % des patients, comme le soulignent les études européennes.
L'évaluation des symptômes neuropsychiatriques ou symptômes psychologiques et comportementaux des démences par des outils spécifiques est indispensable tant au moment du dépistage, du diagnostic qu'au cours de l'évolution.
Cette évaluation doit remplir différentes conditions :
• en complément de l'Inventaire neuropsychiatrique (NPI ou Neuropsychiatric Inventory) qui est l'instrument de référence, il est nécessaire d'utiliser des instruments centrés sur l'évaluation d'une dimension spécifique (apathie, dépression au stade précoce, agitation, hyperactivité, psychose dans les stades modérés à sévères) ;
• même si l'évaluation de l'accompagnant reste la référence, l'évaluation doit aussi prendre en compte le point de vue du patient et du clinicien ;
• l'évaluation du clinicien doit tenir compte des réponses aux questionnaires standardisés mais aussi de l'observation directe des comportements du patient au cours des situations cliniques (consultation, hospitalisation de jour, passation de tests neuropsychologiques) ;
• afin d'effectuer une évaluation qui soit la plus objective possible, le recueil précis de la fréquence des troubles doit être dissocié de l'évaluation de la gravité ;
• elle doit s'accompagner de la recherche de causes somatiques ou d'une iatrogénie pouvant expliquer au moins partiellement l'apparition des troubles ;
• elle doit enfin apprécier le retentissement sur l'autonomie et sur les activités de la vie quotidienne.
Dans la majorité des cas, l'évaluation est effectuée à partir d'un entretien avec un accompagnant informé des comportements du patient. Les auto-évaluations du patient sont moins utilisées.
Les symptômes psychologiques et comportementaux ont des conséquences sur l'évolution et le mode de vie du patient (passage plus fréquent en institution) et également sur l'intensité du fardeau ressenti par l'accompagnant. Ceci conduit à toujours tenir compte de la dynamique entre le patient et l'accompagnant quand on est amené à évaluer ces symptômes.
Une perte de poids, des troubles de l'équilibre et d'autres déficiences sont également associés à la maladie
La perte de poids affecte 20 à 40 % des patients atteints de formes légères à modérées de la maladie d'Alzheimer, indépendamment de leur lieu de vie. Elle s'amplifie avec l'évolution de la maladie et représente un facteur prédictif de mortalité. Certains travaux montrent aussi que l'amaigrissement peut précéder le diagnostic de la maladie. Il pourrait, dans ce cas, représenter une des manifestations précoces du processus pathologique.
La pratique clinique montre que la perte de poids s'accompagne d'un ensemble de complications (altération du système immunitaire, atrophie musculaire, chutes, fractures, dépendance...), responsables d'une aggravation de l'état de santé et d'une augmentation du risque d'institutionnalisation et de mortalité.
La mesure du poids doit donc être un des paramètres de suivi des patients atteints de maladie d'Alzheimer. En effet, l'altération du statut nutritionnel peut, avec une prise en charge adéquate, être réversible et ceci d'autant qu'elle est dépistée tôt.
La maladie peut s'accompagner de la survenue de troubles du comportement alimentaire diminuant les apports énergétiques. Il peut s'agir d'anorexie, d'un refus de s'alimenter ou encore de troubles praxiques. La recherche d'une cause somatique ou iatrogène devrait être systématique. Les troubles de l'odorat (anosmie), fréquents dans la maladie d'Alzheimer, peuvent également avoir un retentissement sur les apports alimentaires. La perte de poids témoigne toujours d'une insuffisance des apports caloriques qui doivent être ajustés de façon individuelle. La majorité des études montre une reprise significative de poids avec une augmentation des apports nutritionnels, en particulier par adjonction de compléments oraux. D'autres auteurs ont montré que la prise en charge nutritionnelle des patients à travers l'éducation nutritionnelle des aidants familiaux pouvait aussi avoir un impact positif. Enfin, l'activité physique est un des moyens d'intervention simple qui permet de stimuler l'appétit et de restaurer la balance énergétique chez les patients.
Compte tenu de l'importance du phénomène dans la maladie d'Alzheimer, le dépistage de la dénutrition doit faire partie de l'évaluation initiale et du suivi du patient.
Les troubles de la marche, de l'équilibre et les chutes sont présents au cours de la maladie d'Alzheimer. Il semble même que les performances motrices soient affectées dès les stades légers à modérés de la pathologie. Le diagnostic de maladie d'Alzheimer multiplie par 3 le risque de chute et cela indépendamment du stade de la maladie et de la prise des médicaments. De nombreux éléments contribuent à aggraver les troubles de la marche et le risque de chute chez le sujet dément : les troubles du comportement, la malnutrition et la sarcopénie associée, ainsi que les causes iatrogènes, en particulier la prise de neuroleptiques. Les troubles du jugement, les troubles attentionnels, surtout lorsqu'il existe plusieurs informations simultanées, et les difficultés visuo-spatiales favorisent également la survenue de chutes. La maladie d'Alzheimer peut aussi s'accompagner d'une altération de la perception visuelle indépendamment de toute pathologie ophtalmologique. Ainsi, la perception des formes, des mouvements mais également des couleurs peut être altérée.
Les troubles de l'équilibre constituent un facteur prédicteur indépendant de la perte de l'autonomie, comme l'aggravation des troubles cognitifs. Une prise en charge de ces troubles mériterait d'être évaluée.
Divers mécanismes à l'origine de ces troubles ont été évoqués. Certains répondent à des atteintes des circuits sous-corticaux moteurs, d'autres à l'atteinte de fonctions cognitives corticales (apraxie et troubles exécutifs).
La maladie d'Alzheimer multiplie par 3 le risque de fracture par rapport à la population générale et cela après ajustement sur l'âge et le sexe. Les chutes sont en général plus graves chez les patients atteints de maladie d'Alzheimer. Il a été démontré que ces patients avaient une plus grande incidence de fracture du col du fémur que les populations témoins de même âge, et ce type de fracture a en général un plus mauvais pronostic fonctionnel chez le sujet atteint de maladie d'Alzheimer. En dehors des fractures, les chutes ont aussi des conséquences fonctionnelles ou sociales : inhibition psychomotrice, déclin fonctionnel plus rapide, déconditionnement physique et institutionnalisation.
Les réflexes archaïques (réflexes palmo-mentonnier, de préhension, de moue, de succion...) réapparaissent et leur présence est liée à la survenue d'une incontinence. La moitié des patients présenterait une incontinence après 6 ans d'évolution et 80 % après 8 ans. Une incontinence doit toujours faire rechercher une cause potentiellement réversible, a fortiori en l'absence de réflexes archaïques. La pression artérielle tend à diminuer, ceci d'autant que la démence est sévère.
Le risque de crises convulsives est multiplié par 10 chez les patients atteints de maladie d'Alzheimer, comme dans d'autres démences. Elles sont rapportées chez 21 % des patients atteints de maladie d'Alzheimer en institution, et 10-20 % des cas autopsiés et jusqu'à 64 %. Ce serait un facteur de déclin cognitif. La fréquence des myoclonies varie de 0 à 80 %, et augmente avec la sévérité de la maladie. C'est parfois un trait marquant de l'examen neurologique des formes familiales à début précoce.
La maladie évolue du déclin cognitif à la perte d'autonomie, puis à la dépendance
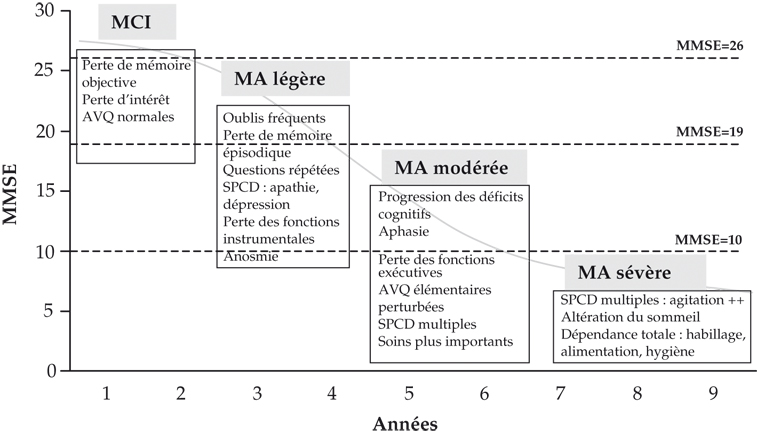
Le déclin cognitif mesuré par le MMSE (Mini Mental State Examination) n'apparaît pas linéaire dans le temps. Il semble plus lent aux stades légers et sévères de la maladie et plus rapide aux stades modérés. La vitesse de déclin initial prédit le déclin ultérieur, rapide ou lent. La sévérité du déclin cognitif initial (au moment de la première visite) est, de façon logique, un facteur de mauvais pronostic souvent retrouvé. À l'inverse, le fait de présenter une mesure stable pendant au moins 2 ans (« plateau ») est un facteur de bon pronostic sur un suivi de 7 ans. Cependant, le déclin cognitif est variable d'un individu à l'autre. On considère comme « déclineur rapide » un patient qui perd 3 points de MMSE ou plus par an et un « déclineur lent » un patient dont le MMSE diminue de moins de 2 points par an. La forme avec troubles mnésiques prédominants (forme temporale) avec peu ou pas de troubles des fonctions exécutives serait de meilleur pronostic. Des facteurs de mauvais pronostic ont été par ailleurs identifiés : sexe masculin, apraxie et signes « pariétaux », troubles du langage (non confirmés par certaines études), signes d'atteinte frontale, petite boîte crânienne, symptômes psychotiques et symptômes parkinsoniens, même chez des patients n'ayant jamais reçu de neuroleptiques.
Différentes échelles permettent d'évaluer l'évolution du déclin.
Échelles de détérioration cognitive générale utilisées pour le suivi dans la maladie d'Alzheimer
|
Type d'échelle
|
Référence
|
|
Mini Mental State Examination (MMSE)
|
|
|
Alzheimer's Disease Assessment Scale - cognitive subscale (ADAS-Cog)
|
|
|
Mattis Dementia Rating Scale (MDRS)
|
|
|
Le Mini Mental State Examination (mini-examen de l'état mental) a été élaboré par Folstein et collaborateurs en 1975 comme un test simple et standardisé pour évaluer les performances cognitives des sujets et éventuellement quantifier leur déficit. Ce test de passation rapide comporte 30 items.
|
Le déclin plus rapide et la plus forte mortalité chez les hommes pourraient s'expliquer par la co-existence de plus nombreuses pathologies et prescriptions thérapeutiques, notamment la prise d'anticholinergiques, et la pathologie vasculaire associée. Les facteurs de risque vasculaires n'ont cependant pas d'influence sur la progression de la maladie d'Alzheimer à 18 mois ou sur le passage du stade léger au stade modéré à 3 ans. Toutefois, l'hypertension artérielle chez les patients de moins de 65 ans, et la baisse de fonctionnalité des microvaisseaux cérébraux mesurée par Doppler transcrânien, pourraient influencer le déclin cognitif.
L'altération des fonctions cognitives est un facteur de risque de l'apparition d'incapacités pour les activités de base de la vie quotidienne. Le score de 16 au MMSE semble être un point de transition en dessous duquel les perturbations des activités de base de la vie quotidienne commencent à apparaître dans les 12 mois. La dépendance correspond à l'impossibilité partielle ou totale pour une personne d'effectuer sans aide les activités de la vie quotidienne. L'autonomie quant à elle peut se définir par la capacité de la personne à se gouverner elle-même.
L'évaluation des incapacités fait appel à des échelles qui mesurent les capacités à réaliser les différentes activités de la vie quotidienne. Parmi elles, les échelles des activités instrumentales de la vie quotidienne (IADL) et des activités de base de la vie quotidienne (ADL) sont les plus utilisées en pratique courante.
De nombreux travaux montrent que la réduction des activités quotidiennes dans la maladie d'Alzheimer est présente dès les stades débutants et touche précocement deux secteurs : la vie sociale et les loisirs. La réduction des activités sociales est un des premiers signes qui attire l'attention de l'entourage au même titre que les difficultés mnésiques ; elle est fortement liée à l'apathie, à la baisse de la motivation et aux difficultés de planification. D'autres études montrent que même au stade de MCI, certaines personnes peuvent déjà présenter des incapacités à réaliser certaines tâches de la vie quotidienne. Le suivi de ces sujets révèle un risque significativement plus élevé d'une évolution démentielle par rapport aux personnes qui ne présentent pas d'incapacités.
La réduction des activités quotidiennes est un élément essentiel au diagnostic de « démence ». Pour de nombreux sujets âgés, la survenue de la dépendance dans les activités de la vie quotidienne est le début de la spirale de la fragilité à l'origine d'un besoin des aides formelles et informelles et d'une grande fréquence des hospitalisations et des placements en maison de retraite. La majorité des études montre l'impact négatif de la dépendance sur la qualité de vie des patients atteints de maladie d'Alzheimer. Il faut toutefois souligner une importante variabilité dans l'aggravation de la dépendance au cours du temps chez des sujets atteints de maladie d'Alzheimer. En effet, même si l'évolution de l'altération des fonctions cognitives est un facteur déterminant, d'autres paramètres interviennent, comme par exemple les pathologies cardiovasculaires, les maladies rhumatologiques ou encore les déficits sensoriels.
Les différentes données mettent en évidence la complémentarité de l'approche fonctionnelle gérontologique et de l'approche neurologique classique dans le dépistage et le suivi des sujets déments ou à haut risque de démence. Elles indiquent par ailleurs l'importance de l'évaluation des déficits fonctionnels et des handicaps dans l'élaboration du projet de soins. En effet, le retentissement sur la vie quotidienne des différents déficits cognitifs ou fonctionnels doit pouvoir être évalué. La répercussion se discutera en général en termes de « risques », lesquels seront différents selon le stade de la maladie : la conduite automobile, l'autonomie financière et la gestion du budget, l'adéquation du patient à son mode de vie à domicile...
Principales échelles utilisées pour le suivi clinique global et la dépendance dans la maladie d'Alzheimer
|
|
|
Type d'échelle
|
Référence
|
|
Échelles d'évaluation clinique globale
| |
|
Clinical Dementia Rating scale (CDR)
|
|
|
Global Deterioration Scale (GDS)
|
|
|
Échelles d'évaluation de la dépendance
| |
|
Instrumental Activities of Daily Living (IADL)
|
|
|
Activities of Daily Living (ADL)
|
|
|
Disability Assessment for Dementia (DAD)
|
|
|
Grille AGGIR
|
|
|
Global Deterioration Scale-Functional Assessment Staging
|
|
|
Progressive Disease Scale
|
|
|
Alzheimer Disease Cooperative Study-Activities of Daily Living (ADCS-ADL)
|
|
|
Physical Self-Maintenance Scale
|
|
|
Functional Rating Scale
|
|
L'espérance de vie est compromise par la maladie d'Alzheimer, quel que soit le stade de la démence. La mortalité des patients déments est doublée chez les sujets de plus de 85 ans comparativement aux personnes non-démentes. La mortalité est très liée à la pente du déclin cognitif. Il y a peu d'informations sur la survie en cas de démence présénile (survenant avant 65 ans).
L'âge et le sexe masculin sont des facteurs prédictifs de mortalité plus élevée dans la majorité des travaux. La médiane de survie varie de 8,3 ans chez les personnes dont le diagnostic de maladie d'Alzheimer a été posé à l'âge de 65 ans, à 3,4 ans chez les personnes diagnostiquées à 90 ans.
L'espérance de vie des patients a augmenté depuis une quinzaine d'années, ce qui est probablement dû à de meilleurs soins, même si les patients déments restent moins bien soignés que les autres. Les causes de décès des patients atteints de maladie d'Alzheimer sont principalement les pneumopathies, les pathologies cardiovasculaires dont les embolies pulmonaires, et les accidents vasculaires cérébraux. Le risque de décès par accident vasculaire cérébral est multiplié par 3,7.
Les patients atteints de maladie d'Alzheimer ont davantage de risque d'entrer en institution que les patients sans démence. Ce risque est lié au déclin cognitif, à l'âge, au niveau d'éducation, parfois au statut marital, mais peu au genre. Les troubles du comportement, notamment l'agitation, sont également associés à l'institutionnalisation.
Le fardeau de l'aidant (mesuré par le score de Zarit) et le mode de vie (à domicile avec un membre de la famille autre qu'un époux, ou seul) sont des facteurs indépendants d'entrée en institution à 1 an. Les patients dont les aidants sont des époux sont moins à risque d'entrer en institution que les autres. Une étude australienne a montré que dans les 5 ans qui suivent le diagnostic de démence, 76 % des patients étaient institutionnalisés et 42 % décédés. L'information et le soutien des proches diminuaient sensiblement ces chiffres. Le fait que l'aidant vivant avec le patient ait une bonne évaluation de sa qualité de vie et un faible score à l'estimation de son « fardeau » est inversement associé à l'entrée en institution, soulignant l'intérêt des interventions directement en faveur de l'aidant.
Chez les patients à un stade de démence avancée, la mortalité à 6 mois après l'entrée en institution varie de 28 à 35 %. Plus les patients entrent tard en institution, moins l'institutionnalisation raccourcit la survie.
La maladie d'Alzheimer peut toucher des sujets jeunes, âgés de moins de 65 voire 50 ans dans certaines formes sporadiques, et des sujets encore plus jeunes dans certaines formes familiales. Généralement, les patients jeunes ont une meilleure conscience des troubles et en sont plus affectés que les sujets plus âgés. Ils ont souvent des difficultés attentionnelles et un déficit de la mémoire de travail proportionnellement plus sévères que leurs troubles de mémoire épisodique, des troubles instrumentaux, notamment du langage et des praxies, et leurs scores aux échelles de dépression pendant l'évolution de la maladie sont davantage altérés que dans les formes de début tardif. Les scores aux échelles neuropsychologiques déclinent plus vite. Les pneumopathies sont la cause principale de décès, comme chez les patients âgés, alors que ce n'est pas la cause de décès la plus habituelle à cet âge.
La prise en charge médicale des patients déments est généralement moins bonne que celle des patients non-déments. On trouve par exemple moins de maladies cardiovasculaires et de cancers dans les certificats de décès des patients souffrant de maladie d'Alzheimer que dans la population générale, ce qui montre que ces pathologies sont moins souvent diagnostiquées. De même, une hypercholestérolémie et une hypothyroïdie sont moins souvent diagnostiquées chez les patients déments. Seulement la moitié des autopsies confirme la cause exacte du décès dans cette population.
Il n'existe pas actuellement de traitement curatif de la maladie
La prise en charge médicamenteuse de la maladie d'Alzheimer consiste actuellement en un traitement symptomatique et non curatif.
Deux classes de médicaments sont disponibles. Une première classe agit sur le déficit en acétylcholine constaté dans le cerveau des patients. Elle se compose de trois molécules : le donépézil
2
Aricept®, autorisation de mise sur le marché (AMM) en 1997
, la rivastigmine
3
, la galantamine
4
. Un autre médicament, la mémantine
5
apparue depuis 2000, appartient à la classe des antiglutamatergiques visant à réduire les effets neurotoxiques du glutamate lorsqu'il est en excès.
Ces médicaments ont généralement été évalués dans les essais thérapeutiques sur quatre critères : détérioration cognitive, niveau fonctionnel, impression clinique globale et troubles comportementaux. La plupart des études a une durée de 6 mois, durée recommandée par les agences sanitaires pour mettre en évidence un effet symptomatique.
Pour le critère cognitif, l'échelle la plus couramment utilisée est l'ADASCog (Alzheimer's Disease Assessment Scale-cognitive subscale) sur un total de 70 points. Les patients déclinent spontanément en moyenne de 4 points en 6 mois, 6-8 points en 1 an, de façon non linéaire selon les stades de la maladie. Une amélioration moyenne d'au moins 2,5 points sur cette échelle a été considérée comme pertinente dans les essais pour révéler un gain symptomatique. Après un traitement de 6 mois, le bénéfice des anti-acétylcholinestérases est estimé en moyenne à 2,7 points. D'après les essais, les patients présentent également une moindre détérioration de leurs activités quotidiennes sous traitement que sous placebo. L'impression clinique globale est également jugeé meilleure. Le nombre nécessaire de patients à traiter pour observer un patient avec stabilisation ou amélioration à 6 mois varie entre 5 et 8. Avec la mémantine, le nombre de patients à traiter pour au moins observer une stabilisation à 6 mois est de 6. Enfin, d'après plusieurs études, ces médicaments montreraient une certaine efficacité, bien que faible, sur les troubles associés du comportement (évalués par le Neuropsychiatric Inventory, NPI) tels que l'apathie, les hallucinations, les symptômes dépressifs, l'agitation et l'anxiété, notamment en prévenant leur apparition. Ces médicaments, s'ils sont parfois mal tolérés notamment sur le plan digestif, n'ont pas montré d'effets indésirables graves.
D'après les recommandations de l'Agence européenne d'évaluation des médicaments (EMEA pour European Medical Evaluating Agency), un patient est considéré comme « répondeur » au traitement s'il s'améliore de plus de 3 points à l'ADAS-Cog par rapport à la ligne de base, sans détérioration à une échelle d'appréciation globale, sans détérioration fonctionnelle et, si possible, sans aggravation comportementale.
En France, les médicaments anti-acétylcholinestérasiques sont indiqués dans les formes légères à modérément sévères de la maladie d'Alzheimer (score au MMSE compris entre 10 et 26 inclus) et la mémantine aux stades modérés à sévères (score au MMSE entre 19 et 3 inclus). En 2007, la Haute Autorité de Santé
6
a reconnu un service médical rendu (SMR) important pour les 4 spécialités. Cependant, elle a considéré que les nouvelles données cliniques et l’expérience acquise sur ces traitements depuis leur commercialisation conduisaient à qualifier de « mineure » l’amélioration du service médical rendu (ASMR) dans le cadre de la prise en charge globale des patients. Au Royaume-Uni, le NICE (
National Institute of Clinical Excellence) recommande de poursuivre le traitement si le MMSE augmente ou ne diminue pas 2 à 4 mois après avoir atteint la dose susceptible d'avoir un effet.
D'après une étude d'observation réalisée en France, le risque d'entrer en institution, après un an de suivi, est moindre chez les patients traités par les médicaments anti-acétylcholinestérasiques par rapport aux patients n'ayant jamais été traités.
Dans un essai randomisé en double aveugle contre placebo, les patients qui étaient initialement sous placebo puis mis sous traitement après 6 mois ne rattrapaient pas les performances des patients qui avaient bénéficié du traitement pendant ces 6 mois.
La bithérapie associant un médicament agissant sur le déficit en acétylcholine et la mémantine a été étudiée pour les patients présentant un score MMSE inférieur à 19. La tolérance de l'association semble bonne. L'effet potentialisateur de la mémantine a été testé positivement avec le donépézil et la rivastigmine.
Le « Consensus sur la démence de type Alzheimer au stade sévère » (Société française de gériatrie et gérontologie, 2005) recommande que l’arrêt du traitement soit fondé, tant en institution qu’en ambulatoire, sur l’évaluation du rapport bénéfice/risque pour chaque patient.
Selon le rapport parlementaire de 2005
7
gallez c. La prise en charge de la maladie d'Alzheimer et des maladies apparentées. Rapport de l'Office Parlementaire d'Évaluation des Politiques de Santé (Opeps), 2005 : 256 p
, moins d'un tiers des patients atteints de la maladie d'Alzheimer en France sont traités par ces médicaments spécifiques. Ce nombre augmente très lentement. La prescription initiale et son renouvellement annuel sont effectués par les neurologues, psychiatres et médecins généralistes ayant une capacité en gérontologie. Les patients sont soumis à une surveillance particulière pendant le traitement, laquelle peut être assurée par le médecin généraliste. Le coût journalier du traitement est de l'ordre de 3 € pour les médicaments anti-acétylcholinestérasiques et de 3,5 € pour la mémantine.
Ces médicaments ont contribué à lever le tabou de la maladie auprès des patients et des familles et à modifier l'image de la maladie qui n'apparait plus comme une fatalité contre laquelle on ne peut rien faire. Ils concourent à l'investissement des médecins dans la connaissance de la maladie et la prise en charge des patients.
Une prise en charge professionnelle non pharmacologique semble indispensable pour cette maladie
La maladie d'Alzheimer ayant un retentissement sur le fonctionnement non seulement cognitif mais aussi psychologique et social du patient, il existe aujourd'hui un large consensus selon lequel la prise en charge des malades ne doit pas se limiter au traitement pharmacologique mais doit associer des approches de type non médicamenteux. Ces thérapies sont largement appliquées dans les accueils de jour, hôpitaux de jour, services de rééducation, centres mémoire, cabinets d'orthophonie, représentant un coût économique non négligeable. Il existe en effet une grande variété de thérapies non médicamenteuses qui sont actuellement proposées aux patients déments. Certaines de ces thérapies s'appuient sur une approche psychosociale, d'autres sont issues du domaine de la psychopathologie. Certaines encore ont été développées au regard des connaissances issues de la neuropsychologie cognitive acquises dans le domaine de la maladie d'Alzheimer. D'autres enfin s'appuient sur une stimulation physique ou sensorielle. Ces techniques ont pour objectif d'optimiser la prise en charge du malade en ciblant, en fonction de la thérapie appliquée, différents aspects de la maladie tels que les capacités cognitives, la dépendance, les troubles de l'humeur et du comportement, ou le bien-être du patient. Ces techniques sont très variées.
Principales approches non médicamenteuses de la maladie d'Alzheimer
|
Approches
|
Techniques
|
Aspects de la maladie ciblés
|
|
Cognitives
|
Stimulation cognitive
Rééducation cognitive
|
Cognition, autonomie, satisfaction de l'aidant
|
|
Psychosociales
|
Réminiscence
Validation
Self-maintenance therapy
Psychothérapie
Thérapie par présence simulée
Art-thérapie
Thérapie assistée par l'animal (chien)
|
Dépression, comportement, qualité de vie, satisfaction de l'aidant
|
|
Aménagement de l'environnement
|
Rééducation de l'orientation
|
Autonomie, cognition, social, qualité de vie
|
|
Sensorielles
|
Musicothérapie
Luminothérapie
Aromathérapie
Snoezelen (stimulation multisensorielle)
|
Dépression, comportement, qualité de vie, sommeil
|
|
Motrices
|
Entraînement moteur
Gymnastique
|
Cognition, comportement, autonomie
|
Au cours des vingt dernières années, un très grand nombre d'articles illustrant les bénéfices de ces thérapies dans la maladie d'Alzheimer ont été publiés. Selon les études, l'amélioration rapportée portait sur différentes mesures. Ces bénéfices pouvaient se traduire par une diminution de la symptomatologie dépressive, un déclin moins rapide de certaines mesures de la cognition, une préservation de l'autonomie dans certaines tâches de la vie quotidienne, l'atténuation de certains troubles du comportement, l'amélioration de mesures de la qualité de la vie ou encore une relative satisfaction rapportée par les aidants et/ou les soignants prenant en charge au quotidien ces malades. Ces résultats sont encourageants dans la mesure où ils suggèrent qu'une approche globale et multidisciplinaire de la maladie est susceptible d'atténuer certains symptômes et d'apporter un certain bien-être aux malades.
Néanmoins, il est important de souligner que ces résultats, pour la grande majorité, ont été tirés d'études d'une qualité méthodologique médiocre, les principales faiblesses de ces études étant l'absence d'un groupe témoin, l'absence de randomisation, l'absence de procédure d'évaluation en aveugle et la taille insuffisante des échantillons. La rareté de mesures à long terme évaluant le maintien de ces bénéfices au-delà de l'intervention est également à déplorer. Les études randomisées sont rares voire inexistantes pour certaines de ces techniques. Les méta-analyses n'incluant que les études répondant aux critères d'essais contrôlés randomisés rapportent quant à elles des bénéfices généralement plus modestes et pour la plupart limités à la durée de l'intervention.
Un point contribuant au manque de crédibilité de l'emploi de ces thérapies dans le cadre de la maladie d'Alzheimer est lié à l'absence d'homogénéité d'application d'une même technique par les soignants. En effet, pour une technique donnée, les programmes de prise en charge sont souvent décrits de manière variable d'une étude à l'autre. La conséquence pour la plupart de ces techniques est qu'il paraît difficile d'aboutir à un consensus définissant un programme de prise en charge comprenant des indications claires sur des points pourtant essentiels comme la qualité/formation des professionnels susceptibles d'appliquer ces techniques, le stade de sévérité des patients pouvant en bénéficier, la durée du programme, la fréquence des séances (quotidiennes, hebdomadaires...), les modalités (prestation de groupe ou individuelle ; avec ou sans participation des aidants ; relayé à domicile ou non) ou le contenu même des séances à proposer.
Méta-analyses effectuées sur les résultats issus d'essais randomisés évaluant l'efficacité de techniques de prise en charge non médicamenteuses dans la démence et/ou la maladie d'Alzheimer
|
Thérapie/Références
|
|
Bénéfices rapportés
|
|
1 Randomisés ou semi-randomisés inclus
|
|
|
6
|
Pas d'amélioration rapportée
|
|
|
6
|
Amélioration de certaines mesures cognitives et comportementales qui différaient en fonction des études
|
|
|
4
|
Amélioration d'une mesure de mémoire autobiographique ; de la symptomatologie dépressive ; de mesures du comportement ; du stress de l'aidant ; de la satisfaction des soignants
|
|
|
3
|
Pas de conclusion en raison de données insuffisantes pour réaliser la méta-analyse
|
|
|
5
|
Pas de conclusion en raison de données insuffisantes pour réaliser la méta-analyse
|
|
|
6
|
Amélioration de certaines mesures du sommeil et de l'activité rythmique circadienne
|
|
|
1
|
Réduction de l'agitation et des troubles neuropsychiatriques
|
|
|
2
|
Amélioration de mesures de l'apathie, de l'humeur et des capacités psychomotrices
|
|
|
30
|
Amélioration de certaines aptitudes physiques et de certaines mesures cognitives et comportementales qui différaient en fonction des études
|
Enfin, un grand nombre de ces études ayant été réalisées sur des patients ambulatoires, il est difficile de savoir si leurs résultats peuvent être généralisés aux patients vivant en institution ou si les bénéfices attendus chez ces patients sont susceptibles d'être différents. Ceci est particulièrement regrettable compte tenu de la très large utilisation de ces thérapies non pharmacologiques en institution.
Le rôle des aidants informels est encore insuffisamment reconnu
L'aidant informel est défini comme une personne issue de l'entourage du sujet dépendant qui n'a pas été formée pour cette tâche et qui assume la prise en charge de façon non rémunérée. Pour comprendre l'aide, il est nécessaire d'appréhender l'aidant comme quelqu'un ayant une histoire ou un passé commun avec la personne aidée avant l'installation de la relation d'aide, mais aussi qui interagit avec l'ensemble des aidants informels (appelés co-aidants) et des aidants professionnels.
Depuis toujours, la famille est le véritable pivot de la prise en charge à domicile des personnes âgées dépendantes et en particulier des sujets atteints de maladie d'Alzheimer. Longtemps considérée comme « naturelle », cette aide n'a pas suscité d'intérêt particulier de la part des pouvoirs publics. Avec le développement des politiques de soutien à domicile et la mise en place d'aides professionnelles spécifiques, l'évaluation des besoins de ces personnes a permis de prendre conscience de l'importance de cette aide informelle.
Cette reconnaissance s'est amorcée lors de la mise en place de la « prestation spécifique dépendance » puis de « l'allocation personnalisée d'autonomie », qui offrent la possibilité de rémunérer une personne non qualifiée pour l'aide qu'elle apporte à une personne âgée dépendante. La maladie d'Alzheimer, en elle-même, a largement contribué à renforcer cette visibilité : une des propositions du rapport Girard (septembre 2000), était de mettre en œ uvre une allocation spéciale au bénéfice des aidants informels. Le plan « Solidarité grand âge » présenté en juin 2006, souligne la nécessité d'apporter un soutien aux aidants familiaux, en créant notamment un droit de répit pour ces aidants. Ce répit pourra reposer sur le recours à l'hébergement temporaire ou le recours à de nouveaux modes de soutien comme le « baluchon Alzheimer » développé au Canada. Enfin, la Conférence de la famille en 2006 consacrée aux « solidarités entre générations, au sein et en faveur des familles » avait comme objectif de mieux reconnaître, soutenir et valoriser la place des aidants familiaux.
En France, il reste difficile d'estimer le nombre d'aidants de personnes atteintes de maladie d'Alzheimer. En effet, les données de l'enquête HID (Handicap-Incapacités-Dépendance)
8
Les résultats ont été obtenus à partir d'un échantillon de 8 800 personnes âgées de 60 ans et plus vivant à domicile en 1999.
estiment à 3 700 000 le nombre d'aidants de personnes âgées de 60 ans et plus, sans préciser la part de ces personnes atteintes de maladie d'Alzheimer. Les aidants sont les conjoints dans la moitié des cas et les enfants (ou leur conjoint) dans près d'un tiers des cas. Les aidants sont âgés en moyenne de 62 ans et sont des femmes dans 66 % des cas. En fait, il existe deux populations distinctes d'aidants représentées par des conjoints âgés et des enfants. Parmi les personnes âgées de 60 ans et plus ayant besoin d'une aide, la moitié serait aidée uniquement par l'entourage, 29 % bénéficieraient d'une aide mixte associant aide informelle et aide professionnelle et 21 % seraient assistées exclusivement par des professionnels.
En ce qui concerne les aidants des personnes atteintes de maladie d'Alzheimer, si l'on se réfère à la cohorte REAL.FR
9
Les résultats ont été obtenus à partir d'un échantillon de 686 personnes atteintes de maladie d'Alzheimer, vivant à domicile, ayant un aidant informel identifié et suivies dans un CHU français entre 2000 et 2002.
, les données relatives aux aidants sont assez comparables à celles de l'enquête HID : les aidants sont les conjoints dans plus de la moitié des cas et les enfants dans plus d'un tiers des cas. Les aidants sont âgés en moyenne de 64,7 ans et sont le plus souvent des femmes (59 %).
À domicile, le nombre d'heures d'aide apportée par l'aidant est considérable et représente deux à trois fois le volume d'aide professionnelle. Il existe une grande variabilité du volume d'aide informelle déclaré par l'aidant, lié à son mode de vie (notion de cohabitation avec l'aidé) et aux caractéristiques de la personne aidée (niveau de sévérité de la démence). La famille continue à jouer un rôle important, même après l'entrée en institution de la personne malade, tant au niveau des contacts qu'elle conserve avec la personne âgée qu'au niveau de la relation d'aide qui se poursuit dans 30 à 50 % des cas.
Les répercussions de l'aide sur la vie de l'aidant sont largement abordées dans la littérature et soulignent les limites de cette aide. Les répercussions de l'aide sur la santé mentale de l'aidant sont fréquentes avec des risques élevés de dépression (dans 30 % des cas), d'anxiété, de troubles du sommeil (dans 80 % des cas). Les répercussions sur la santé physique de l'aidant ne sont pas négligeables et seraient secondaires au stress ou liées à un moindre recours au soin de ces aidants.
La fragilité de l'aidant peut également s'appréhender par une mesure du vécu de l'aide ressenti par l'aidant. Ainsi, le concept de fardeau ou « burden », dont un des outils a été développé par Zarit, étudie les conséquences de l'aide sur la vie de l'aidant sous différentes dimensions (physique, psychologique, socioprofessionnelle et financière). Un niveau de fardeau élevé est important à repérer car c'est un déterminant majeur de rupture de l'aide à domicile se traduisant par un placement en institution. De nombreux facteurs peuvent expliquer le niveau de fardeau des aidants, certains liés aux caractéristiques de l'aidant (sexe, lien de parenté), d'autres aux caractéristiques de la personne aidée (sévérité de la dépendance, nature des troubles) et enfin aux caractéristiques de la relation d'aide.
L'aidant peut également avoir un vécu positif de l'aide (gratification, reconnaissance) qui va modérer son niveau de fardeau. Ceci peut en partie expliquer le fait que certains aidants sont réticents à recourir à des aides professionnelles et poursuivent seuls la prise en charge, parfois jusqu'à l'épuisement, ce qui est important à détecter.
L'aide à une personne atteinte de maladie d'Alzheimer doit donc être évaluée périodiquement pour identifier les problèmes rencontrés par les aidants et leur proposer des mesures adaptées. En effet, au cours de sa « carrière », l'aidant traverse des moments clés comme l'annonce du diagnostic, le recours aux aides professionnelles, la rupture de l'aide à domicile et le décès de la personne aidée.
La problématique de l'aide aux aidants est souvent mise en avant, et les aidants ont recours aux ressources disponibles et connues (services de répit, groupes de soutien, associations de malades) mais l'évaluation de ce type d'intervention repose rarement sur de véritables recherches. Les quelques études publiées dans ce domaine ont pu dans certains cas démontrer un effet bénéfique des programmes de soutien sur l'entrée en institution ou sur la capacité à gérer les troubles du comportement. Ces mesures doivent être bien évidemment compatibles avec la qualité de vie des malades.
Parallèlement, la recherche sur l'aide informelle s'est considérablement développée : aucune publication enregistrée dans la base bibliographique
Medline avant 1985 et 1 954 pour la période 2001-2006
10
La recherche a inclus tous les articles référencés avec comme mot-clé caregivers (MESH), en ne sélectionnant que les articles dont les aidants représentaient la thématique principale, dans la population âgée de 65 ans et plus.
. Dans un premier temps, les différents concepts de l'aide ont été abordés : la personnalité de l'aidant avec ses capacités d'adaptation (ou notion de «
coping »), les répercussions de l'aide sur la vie de l'aidant avec l'étude de la charge ressentie (ou concept de «
burden ») ainsi que l'étude de ces déterminants. Plus récemment, des tentatives d'intervention destinées à diminuer les conséquences de l'aide sur la vie de l'aidant se sont développées.
Au total, cette aide informelle est importante car elle retarde l'entrée en institution. Il apparaît nécessaire de la quantifier car on s'attend dans l'avenir, du fait de l'évolution démographique et d'un allongement de l'espérance de vie, à une diminution quantitative de cette aide, qu'il faudra remplacer par une aide professionnelle. Cette « pénurie » d'aidants devrait être accentuée par des changements socio-culturels déjà visibles (familles recomposées, femmes moins disponibles, éloignement des enfants). Les évolutions concernant les valeurs sociales (désir d'autonomie individuelle, importance accordée à la famille générationnelle, rôle attendu de l'état dans le soutien aux plus fragiles) seront importantes à observer et analyser.
La fréquence élevée de la maladie d'Alzheimer en fait un problème de santé publique majeur
En 2007, la population des plus de 60 ans s'élève à 13,1 millions de personnes, soit 21 % de la population française (source Insee). À l'horizon 2050, si l'augmentation de l'espérance de vie se poursuit au même rythme qu'aujourd'hui, les plus de 60 ans représenteraient environ 35 % de la population française, avec 22,4 millions d'individus.
Une étude sans recherche active des cas de démence, et plus particulièrement de maladie d'Alzheimer, conduit à ne comptabiliser que les cas diagnostiqués et pris en charge par le système de soins, et plus certainement les formes sévères que modérées. Il y a sous-estimation des chiffres concernant les sujets vivant en institution et principalement les sujets très âgés (>85 ans), ceci essentiellement en raison des difficultés diagnostiques et de la plus grande tolérance sociétale aux pertes cognitives des plus âgés. Une part de la variabilité des taux en fonction des études peut être expliquée par la proportion plus ou moins importante des démences modérées détectées. Les sujets non suivis le sont pour des raisons multiples, dont certaines sont directement liées au développement de la pathologie démentielle, comme par exemple l'entrée en institution. La modélisation biostatistique permet de mieux prendre en compte une part de ces phénomènes.
Les études en population avant 65 ans sont rares. Avant 65 ans, la prévalence est estimée entre 0,05 et 0,1 %, soit environ 32 000 malades en France. À partir d'analyses de données européennes du groupe Eurodem, le taux de prévalence des démences chez les sujets de plus de 65 ans est estimé à 6,4 %. La prévalence augmente avec l'âge.
Comment donner des estimations sur le nombre de démences et de cas de maladie d'Alzheimer en France en 2007 quand on sait qu'il n'existe pas d'indicateur sanitaire fiable, ni de registre permettant un recensement exhaustif et pérenne des cas ? Si ces données n'existent pas aujourd'hui, c'est aussi parce que le diagnostic de démence n'est bien souvent pas porté, même à des stades sévères de la maladie. Après 65 ans, la source principale de données sur la prévalence des démences en France provient de l'étude Paquid (Personnes âgées aquitaine ou QUID des personnes âgées), étude de cohorte menée en population générale depuis 1989 en Gironde et Dordogne. La prévalence a été estimée en 1989 puis ré évaluée en 1999 sur les plus de 75 ans survivants de la cohorte initiale. Dans l'étude Paquid, la prévalence en 1989 chez les plus de 75 ans était égale à 8 %. Principalement en raison d'un diagnostic plus précis et d'une longévité plus importante, ce chiffre a été revu à la hausse après 10 ans de suivi, avec un taux de 18 %. Nous ne disposons pas de données plus récentes et aucune étude n'est actuellement menée permettant d'apporter des informations actualisées sur l'épidémiologie descriptive des démences.
Il n'est pas possible de dire si la fréquence de cette maladie a vraiment augmenté au cours des dernières années. En effet, l'évolution des classifications (DSM III puis III-R et IV, CIM-9 puis 10) sur les 20 dernières années et des méthodologies d'enquête, de même qu'une meilleure sensibilisation au diagnostic de démence rendent les comparaisons difficiles. Il est possible que l'augmentation apparente corresponde à une véritable évolution, liée soit à une augmentation de la durée de la maladie, elle-même liée à une augmentation de l'espérance de vie ou à une meilleure prise en charge des patients, soit à une réelle augmentation de l'incidence.
En termes d'incidence, les analyses faites à partir de huit études européennes montrent un taux moyen qui augmente fortement de 2/1 000 personnes/année entre 65 et 69 ans à 70/1 000 personnes/année après 90 ans. Chez les sujets très âgés, aucune étude spécifique n'a été menée en France et les résultats d'une méta-analyse récente portant sur des données européennes et américaines permettent d'indiquer que les chiffres de prévalence sont situés dans une fourchette assez large entre 15 et 40 %, avec pour l'incidence des chiffres allant de 60 à 100 pour 1 000 personnes/année.
L'extrapolation de ces données au recensement de 2004 indique qu'il y aurait en France plus de 850 000 cas de démence. La maladie d'Alzheimer représente globalement 70 % de ces cas et les autres démences sont vasculaires (10 %) ou mixtes (20 %), avec quasiment trois fois plus de femmes atteintes que d'hommes, tandis que les plus de 90 ans représenteraient 230 000 cas. Environ 300 000 démences sont des démences sévères. Au niveau mondial, une analyse internationale reposant sur une méthodologie de consensus entre experts (Delphi consensus) fournit une estimation du nombre de cas de démences correspondant à 24,3 millions, avec près de 4,6 millions de nouveaux cas chaque année. Le nombre de cas attendus devrait doubler tous les 20 ans, et pourrait concerner plus de 80 millions d'individus en 2040.
L'identification de facteurs de risque et de facteurs protecteurs ouvre des perspectives de prévention
Depuis les premiers travaux publiés dans les années 1980-1990, la liste des facteurs de risque potentiels de la maladie d'Alzheimer s'est beaucoup allongée. Même si l'on peut aujourd'hui s'appuyer sur des résultats de cohorte et de quelques essais randomisés, il demeure difficile d'identifier les facteurs pour lesquels il faudrait proposer une étude d'intervention. Les résultats des études d'observation avec des traitements hormonaux substitutifs de la ménopause ou des anti-inflammatoires non stéroïdiens sont en discordance avec ceux des essais randomisés chez les femmes de plus de 65 ans (essai négatif, essai interrompu en raison d'événements indésirables graves).
Néanmoins, la recherche de facteurs de risque potentiellement modifiables constitue l'un des enjeux majeurs dans le problème de santé publique que représente la maladie d'Alzheimer. Même s'il s'agit d'une pathologie qui survient le plus souvent à un âge avancé, on s'intéresse de plus en plus globalement à la vie entière du sujet, en particulier la période 40-50 ans, plutôt qu'aux caractéristiques des sujets dans les années précédant le diagnostic. En effet, les facteurs conduisant à des maladies chroniques à des âges avancés peuvent avoir leur origine à des périodes précoces de la vie ou se cumuler tout au long de celle-ci. Certains facteurs comme l'hypertension artérielle peuvent en outre avoir des effets différents selon les périodes de la vie.
Parmi les critères sociodémographiques, si l'âge demeure le principal facteur de risque de maladie d'Alzheimer, avec une incidence qui double par tranche de 5 ans après 65 ans, d'autres facteurs ont été identifiés :
• le sexe féminin : l'incidence de la maladie augmente chez les femmes après 80 ans. Les hypothèses explicatives sont multiples même si un biais de survie sélective ne peut être écarté ;
• le bas niveau d'étude (faible nombre d'années d'éducation formelle ou un bas niveau atteint) est très fréquemment associé à un risque majoré de développer une maladie d'Alzheimer dans les études de cohorte. Les données françaises montrent un risque accru pour les sujets n'ayant pas obtenu le certificat d'étude. Ces résultats sont en accord avec l'hypothèse selon laquelle les sujets ayant un niveau d'étude élevé ont une plus grande capacité de réserve cognitive qui leur permettrait d'exprimer leur maladie différemment et d'en retarder l'expression clinique.
Parmi les facteurs liés au mode de vie, la richesse du réseau social et des activités de loisirs sont des facteurs potentiellement protecteurs. En effet, des activités comme la lecture, le jeu, la danse, le jardinage, les voyages, le bricolage ont été associées à un risque moindre de maladie d'Alzheimer. Cependant, on peut difficilement écarter l'hypothèse d'un arrêt de ces activités dans les stades pré-symptomatiques de la maladie, ce qui se traduirait par une surestimation de l'effet de ces facteurs. Les données longitudinales récentes montrent un risque accru chez les fumeurs alors que le tabac a longtemps été suggéré comme protecteur. La consommation modérée de vin ou d'autres boissons alcoolisées serait associée à un moindre risque de survenue de la maladie d'Alzheimer. Des mécanismes biologiques ont été avancés, mais l'effet pourrait être lié à un mode de vie particulier. D'importantes études d'observation incluant plusieurs milliers de sujets avec des suivis variables de 2 à 15 ans ont mis en évidence un effet protecteur d'une activité physique intense et/ou soutenue dans le temps, tant sur le déclin des fonctions cognitives que sur la survenue d'une démence.
Si l'association entre facteurs de risque cardiovasculaires et démence de type vasculaire – plus fréquente en cas d'hypertension artérielle – est prouvée, celle qui existerait entre facteurs vasculaires et maladie d'Alzheimer est en revanche moins claire. Selon la période de la vie considérée, les effets observés ne sont pas les mêmes. Ainsi, toutes les études rapportent une association entre une pression artérielle élevée mesurée 20 à 30 ans auparavant et le déclin cognitif ou la survenue d'une démence, avec un risque plus élevé en l'absence de traitement de l'hypertension. Une étude randomisée visant à abaisser la tension artérielle systolique a montré une diminution du risque de maladie d'Alzheimer, mais ce résultat n'a pas été confirmé dans d'autres essais. À l'inverse, les études montrent qu'un bas niveau de pression artérielle est plus souvent associé à une démence après 80 ans.
Des niveaux élevés de cholestérol seraient associés à une augmentation du risque de maladie d'Alzheimer, en particulier lorsqu'ils sont enregistrés entre 40 et 50 ans. Les premières études de prévention ne mettent pas en évidence le rôle bénéfique d'un traitement par les statines. Le diabète est généralement associé à un niveau plus bas de performance cognitive, à un déclin des fonctions cognitives plus prononcé dans le temps mais également à la survenue d'une maladie d'Alzheimer. Toutefois, la définition du diabète est variable d'une cohorte à l'autre, de même que l'effet sur le risque de démence, et en particulier selon l'ancienneté du diabète ou l'existence d'un traitement spécifique.
La prise en compte simultanée des facteurs de risque vasculaires est indispensable pour quantifier leur rôle respectif mais aussi pour essayer de mettre au point, comme dans les maladies cardiovasculaires, des scores de facteurs de risque.
Parmi les antécédents médicaux, les symptômes dépressifs sont associés à une augmentation du risque de maladie d'Alzheimer, même s'il est difficile de préciser si ceux-ci représentent un véritable facteur de risque ou un prodrome de la maladie. Plusieurs équipes ont évoqué le rôle des antécédents cardiaques (fibrillation auriculaire, insuffisance cardiaque ou coronarienne) dans l'altération des fonctions cognitives, mais tous les travaux ne sont pas concordants. Le rôle de l'anémie reste débattu en raison de la rareté des études longitudinales.
Le vieillissement, comme le déclin des fonctions cognitives, peut être à l'origine de modifications des comportements alimentaires et entraîner des déficiences nutritionnelles. La relation entre le poids et le risque de maladie d'Alzheimer est connue de longue date ; les premiers travaux ont montré qu'un index de masse corporelle particulièrement bas était associé au risque de démence et de maladie d'Alzheimer, mais des travaux récents ont souligné la relation positive entre l'obésité et le risque de survenue d'une démence ou d'un déclin des fonctions cognitives.
L'association entre une carence en vitamine B12, en vitamine B6 ou en folates (vitamine B9) et le risque de maladie d'Alzheimer reste incertaine. Il existe une relation inverse entre les taux plasmatiques d'homocystéine et le statut en vitamines B6, B12 et folates (apports alimentaires, taux plasmatiques). L'hyperhomocystéinémie serait un facteur de risque vasculaire cérébral comme au niveau coronaire et périphérique. Plusieurs études de cohorte ont trouvé une relation entre l'apport en antioxydants et un moindre risque de démence ou de déclin cognitif mais avec des discordances ; les résultats sont néanmoins en faveur d'un rôle possible de la vitamine E plus que de la vitamine C, mais aussi des caroténoïdes et du sélénium. Les résultats des essais randomisés chez le sujet âgé sain ou avec une maladie d'Alzheimer ou un MCI ne sont pas encore suffisamment convaincants pour envisager des recommandations spécifiques pour la prévention des démences. L'effet protecteur de la consommation de poissons riches en acides gras poly-insaturés ω3 sur le risque de démence a été décrit dans différentes études longitudinales portant sur des sujets âgés.
L'analyse épidémiologique des relations entre consommation de nutriments et déclin cognitif est complexe et il est très peu probable qu'un seul composé joue un rôle majeur. La notion d'une approche plus globale de la nutrition doit être développée. L'intérêt pour le régime méditerranéen en est un exemple : des travaux convergents montrent une diminution du risque de maladies cardiovasculaires, de la mortalité et peut-être de maladie d'Alzheimer avec une alimentation favorisant des apports élevés en légumes, fruits et céréales, en graisses insaturées, modérément élevés en produits laitiers et vin et faibles en viandes.
Enfin, d'autres facteurs (traumatismes crâniens, aluminium dans l'eau de boisson, anesthésies...) ont été évoqués mais leur association avec la maladie d'Alzheimer repose sur des données controversées.
Il est important de souligner le manque d'études épidémiologiques tenant compte de l'ensemble des facteurs de risque suspectés. La recherche de scores de facteurs de risque, à l'exemple de ce qui a été fait dans le domaine cardiovasculaire, doit être poursuivie. Les efforts doivent se concentrer sur les facteurs de risque modifiables dans l'objectif de développer des stratégies préventives de la maladie d'Alzheimer. L'étude des facteurs de risque liés au mode de vie doit reposer sur une approche globale de ces facteurs nécessitant la multidisciplinarité des équipes (par exemple : l'étude des facteurs nutritionnels doit inclure un enregistrement de la prise alimentaire et une analyse des comportements alimentaires).
Le temps des actions ne doit plus être reporté. La majorité des essais répertoriés n'avait pas pour objectif principal l'évaluation cognitive. Concernant les facteurs pour lesquels il existe déjà un faisceau d'arguments, de nouveaux projets doivent être initiés. En particulier, il faut évaluer les effets des thérapeutiques médicales (traitements antihypertenseurs, prise en charge du diabète, de l'hypercholestérolémie) et les effets des facteurs nutritionnels (via des modifications des habitudes alimentaires), ou de programmes favorisant l'activité physique, les activités intellectuelles ou cognitives et le réseau social.
L'accès au diagnostic demeure un problème en France
La maladie d'Alzheimer n'est pas considérée comme une priorité en médecine générale et elle est même souvent ignorée. Une enquête concernant la mise en œ uvre des recommandations de l'Anaes a été réalisée dans 9 régions de France en 2000-2001 par les médecins conseils de l'assurance maladie auprès de 3 510 patients. Elle montre que les procédures diagnostiques de maladie d'Alzheimer sont dans l'ensemble conformes aux recommandations officielles, avec un recours au spécialiste dans près de 95 % des cas pour les patients traités (30% seulement des malades), avec une mesure du score au MMSE – test psychométrique universellement reconnu pour mesurer la sévérité de la démence – dans 85,5 % des cas, et une imagerie cérébrale réalisée dans 85 % des cas. En revanche, des dysfonctionnements apparaissent en cas d'absence de recours des malades au système de soins ou en situation de plainte au médecin quand celui-ci ne programme pas le bilan diagnostique. Ainsi, dans l'étude des « 3 cités » réalisée dans trois villes de France (Bordeaux, Dijon et Montpellier), la consultation d'un généraliste et surtout le recours au spécialiste est très variable selon l'âge du sujet.
Proportions de consultations d'un médecin généraliste pour troubles cognitifs et de recours au spécialiste chez les sujets présentant une démence prévalente (étude des « 3 Cités », 2002, N=201)
|
Âge (ans)
|
Consultation d'un généraliste (%)
|
Recours au spécialiste (%)
|
|
65-74
|
65,8
|
55,0
|
|
75-79
|
64,7
|
42,3
|
|
80 et plus
|
55,1
|
19,7
|
Les résultats indiquent que 4 malades sur 5 âgés d'au moins 80 ans n'ont pas eu accès aux procédures diagnostiques recommandées. L'enquête européenne « Facing Dementia Survey » réalisée en 2005 dans 6 pays (France, Grande-Bretagne, Allemagne, Italie, Espagne et Pologne) montre que selon les médecins, seuls 4 malades sur 10 consultent pour la première fois à un stade de démence légère, 54 % à un stade modéré et 7 % ne consultent qu'à un stade sévère. Les résultats de la France se situent dans la moyenne européenne. Le délai moyen entre l'apparition des troubles et la pose du diagnostic est de 24 mois en France ; c'est le plus mauvais score enregistré en Europe après la Grande-Bretagne (32 mois), le délai le plus court étant observé en Allemagne (10 mois). Ainsi, la maladie d'Alzheimer et les autres démences sont souvent ignorées dans la population générale, surtout après 80 ans.
Les causes du sous-diagnostic des démences dans la population sont multiples. Elles sont superposables en grande partie aux causes des dysfonctionnements dans la prise en charge des patients. On peut en distinguer quatre catégories :
• causes liées aux difficultés propres de la reconnaissance de la maladie en raison de ses caractéristiques sémiologiques ;
• causes liées à l'image de la maladie dans la population ;
• causes liées à l'attitude des médecins face à la maladie ;
• causes liées au manque de lien et de coordination entre le champ social et le champ sanitaire.
Les conséquences précises du sous-diagnostic des démences sont mal connues et l'intérêt d'un dépistage systématique, y compris en situation de déni du patient, a fait l'objet de très peu de travaux. Ceci explique que les recommandations nationales pour une détection précoce de la démence et plus précisément de la maladie d'Alzheimer en France, comme aux États-Unis ou au Canada, se sont appuyées essentiellement sur un consensus d'opinion d'experts.
Si on admet que les traitements disponibles, médicamenteux et non médicamenteux, de même que l'information et le soutien à l'aidant, sont efficaces sur l'évolution de la maladie, tout retard ou défaut de diagnostic peut être considéré comme une perte de chance pour les malades. De plus, l'ignorance du diagnostic expose le patient à des risques liés à ses difficultés dans les activités de la vie quotidienne (conduite automobile, par exemple). Une autre conséquence concerne le recours inadapté au système de soins, et en particulier à l'hospitalisation d'urgence. Enfin, l'absence de diagnostic – et donc de prise en charge – laisse les familles désemparées, sans aide, sans prévention des situations de crises, sans anticipation des problèmes liés à la dépendance.
Dans l'avenir, les interventions thérapeutiques devront se faire le plus tôt possible : le développement de nouveaux médicaments visant à ralentir et contrer le processus pathologique va rendre nécessaire l'identification des patients atteints de maladie d'Alzheimer au stade précoce, pré-démentiel.
L'offre de soins s'est beaucoup développée ces dernières années mais reste à évaluer par rapport aux besoins
Les données concernant l'offre de soins en France proviennent essentiellement des administrations chargées de la prise en charge des personnes âgées (Dhos, DGAS, Drass), des instituts et services producteurs de données statistiques (Drees, Irdes, Insee, Fnors) et de fédérations (Fédération Médéric Alzheimer, Fédération nationale des CMRR). Un constat a été dressé à l'occasion du rapport de l'Opeps en 2005
11
gallez c. La prise en charge de la maladie d’Alzheimer et des maladies apparentées. Rapport de L’Office Parlementaire d’Évaluation des Politiques de Santé (Opeps), 2005 : 256 p.
et mis à jour pour cette expertise. Cependant, il ne s'agit pas d'une analyse mettant en relation les besoins et les structures existantes sur le territoire.
Les services de prise en charge de la maladie d'Alzheimer sont de trois types : diagnostic, information/coordination et prise en charge médicale et médico-sociale. La plupart de ces services ont largement augmenté leur capacité d'accueil au cours de ces trois dernières années.
Un état des lieux 2007 sur les dispositifs de prise en charge et d’accompagnement des personnes malades et de leurs aidants vient d’être publié par la Fondation Médéric Alzheimer
12
Annuaire national 2007. Dispositifs de prise en charge des personnes atteintes de la maladie d’Alzheimer ou de maladies apparentées et dispositifs d’aide à leurs aidants familiaux. Fondation Médéric Alzheimer, Paris, 2007 : 446 pSite de la Fondation Médéric Alzheimer :
http://www.fondation-mederic-alzheimer.org/
.
Types de services et de structures de prise en charge des personnes atteintes de la maladie d'Alzheimer en 2007
|
Type de services
|
Structures
|
Nombres de structures en France métropolitaine (taux pour 1 000 personnes âgées de plus de 75 ans)
|
|
Diagnostic
|
Consultations mémoire
|
3661
|
| |
Centres mémoire de Ressources et de Recherche (CMRR et centres hospitaliers)
| |
| |
Neurologues libéraux
| |
| | |
251
|
| | |
7632 (0,97)
|
|
Information/coordination
|
Centres locaux d'information et de coordination (CLIC) labellisés selon l'étendue de leur mission
| |
| |
Réseaux de coordination gérontologiques
| |
| |
Structures d'aide aux aidants
|
5383
|
| | | |
| | |
521
|
| | |
237 (0,06)2
|
|
Prise en charge médicale, médico-sociale
|
Médecins de ville (généralistes, psychiatres, neuropsychiatres)
| |
| |
Services de soins infirmiers à domicile
|
114 227 (11,83)2
|
| |
Accueil de jour
| |
| |
Hébergements temporaires
| |
| |
Établissements d'hébergement pour personnes âgées
|
80 643 places (18,25)2
|
| |
EHPA
|
4 085 places1
|
| | |
2 500 places1
|
| |
EHPAD (dépendantes)
| |
| |
Services d'aide à domicile
| |
| |
Hôpitaux
|
666 997 places2
|
|
|
|
671 000 places2
|
1 Source : DGS, Bilan de la mise en œ uvre du plan Alzheimer pour les dipositifs sanitaires au 31 décembre 2006
2 Source : Opeps, Rapport Gallez sur la maladie d'Alzheimer et les maladies apparentées, 2005
3 Source : Ministère de la santé et des solidarités, 2006, http://www.personnes-agees.gouv.fr/ [Consulté en 2007]
|
Différents pays (États-Unis, Allemagne, Angleterre) ont expérimenté des modalités de parcours de soins coordonnés en s'appuyant sur des modèles de prise en charge hiérarchisée en fonction des besoins des malades (annexe 3). Ce type d'approche novatrice fait successivement appel à un « gestionnaire de soins » (disease/care manager) puis à un « gestionnaire de cas » (case manager).
En relais des actions pour la promotion de la santé, les programmes de « gestion des soins » développés initialement pour répondre aux besoins de personnes atteintes de maladie chronique (diabète, insuffisance cardiaque, asthme...) ont pour objectif principal d'encourager l'éducation thérapeutique en favorisant une meilleure prise en charge de leur pathologie par les malades eux-mêmes. Ils visent à améliorer les connaissances des patients, et éventuellement de leur famille, et à développer leurs compétences. Ces programmes tendent également à favoriser la coordination des soins (aide à l'orientation des patients, planification des consultations et des soins...). Concrètement, le modèle d'intervention le plus commun se fonde sur des appels téléphoniques émis par un professionnel de santé. Au-delà de la dimension technique des entretiens, la capacité à développer une relation d'empathie avec le patient est considérée comme essentielle.
Lorsque les besoins de soins s'intensifient et que les risques pour le patient atteignent un certain seuil, un niveau d'action supplémentaire consiste à mettre en place une gestion des soins plus personnalisée par l'intervention d'un gestionnaire de cas. La gestion de cas consiste à développer une fonction d'appui pour la prise en charge individuelle des situations les plus difficiles. Cet appui ne se limite pas au seul champ sanitaire mais englobe le versant social. Ainsi, le gestionnaire de cas – le plus fréquemment une infirmière – constitue un correspondant privilégié et unique, responsable de la prise en charge globale du patient. C'est aussi un interlocuteur direct de la personne, de sa famille et du médecin traitant. Son action est par principe continue dans le temps (y compris dans les situations d'hospitalisation). Ce type d'intervention a été appliqué pour le suivi des personnes âgées dans différents pays et démontre un bon niveau de preuve quant à l'amélioration à l'accessibilité aux aides, de l'utilisation des soins, de l'autonomie et du respect des règles de bonnes pratiques, tout en diminuant le recours à l'institutionnalisation, les hospitalisations et les coûts médico-sociaux. En France, la coordination des soins pour les personnes atteintes de maladie d'Alzheimer par des gestionnaires de cas a été également expérimentée, notamment dans quelques régions, et son évaluation est actuellement en cours.
Les représentations sociétales de la maladie contribuent à ralentir sa prise en charge
La sociologie de la santé, qui compte peu de chercheurs par rapport à d'autres champs thématiques, a mieux traité les pathologies soit plus anciennement reconnues comme préoccupantes (le cancer), soit à forte mobilisation sociétale (infections par le VIH). Mais il est aussi probable que l'assimilation de la maladie d'Alzheimer à la vieillesse a contribué à tenir les sociologues éloignés de l'intérêt qu'ils auraient pu porter à cette pathologie.
Cette faiblesse de la production sociologique a pour conséquence une accumulation de résultats médiocres : les enquêtes sont pour une très grande part qualitatives (et donc reposent sur de petits échantillons) et mériteraient d'être répétées pour une validation, ce qui est rarement le cas. L'analyse des publications semble montrer que les sociologues répondent davantage aux interrogations de la sociologie elle-même qu'à la demande sociétale : la thématique de la maladie d'Alzheimer se prête à des recherches théoriques sur l'identité individuelle (la question du maintien de soi) ou sur les identités sociales (la diversité des représentations de la maladie), mais elle n'est guère stimulée par les questionnements venant de la société.
On peut cependant retenir trois domaines d'investigation qui ont apporté des résultats significatifs, même si les enquêtes demanderaient à être complétées ou validées en dehors du contexte des États-Unis.
Un des principaux objets sur lesquels s'est penchée la sociologie de la maladie d'Alzheimer est celui de l'expérience de la maladie, et plus particulièrement celui du maintien de l'identité individuelle en dépit du développement de la maladie. En effet, pour les sociologues, l'identité sociale est construite grâce aux interactions avec les autres. En étudiant les changements dans les interactions avec l'entourage du malade Alzheimer, aussi bien l'entourage familial que professionnel ou plus largement sociétal, les chercheurs ont mis en évidence des stratégies du maintien de soi face aux autres. Ces stratégies indiquent combien le malade reste généralement actif face à sa maladie, et comment les personnes de l'entourage peuvent s'appuyer sur elles pour entrer dans le jeu du maintien de l'identité personnelle. L'analyse de l'expérience de la maladie révèle que les troubles qui lui sont liés doivent s'apprécier à l'aune des réactions des personnes de l'entourage du malade.
Le deuxième domaine de recherche travaillé par la sociologie en rapport avec la maladie d'Alzheimer est celui des représentations sociales de la maladie. Le constat majeur que l'on peut dresser à la lecture de ces travaux est celui de la diversité des représentations : d'une part selon les groupes sociaux ou culturels, d'autre part selon la place des acteurs face à la maladie. Certaines recherches portent en effet sur les différences selon les contextes culturels, certaines cultures donnant un sens différent à la perte de mémoire ou aux capacités cognitives. De plus, la maladie n'a pas la même signification lorsqu'on est le malade lui-même, un proche familial, ou lorsqu'on n'est pas concerné directement par la maladie. Ainsi, les medias développent peur et misérabilisme, alors que ceux qui sont touchés par la maladie (malades ou aidants) relativisent ces images négatives. Ces représentations « profanes » entrent aussi en concurrence avec les représentations scientifiques à l'occasion de l'annonce du diagnostic.
Quelques recherches portent sur les associations concernées par la maladie d'Alzheimer, soit pour analyser les conditions sociales de leur naissance et de leur développement, soit pour interroger leur rôle. Les associations semblent apparaître davantage comme des groupes de pression visant à porter la question de la maladie sur la scène socio-politique que comme porte-paroles des malades.
Un des résultats principaux de l'analyse de la production sociologique à l'égard de la maladie d'Alzheimer et des démences apparentées est finalement l'opposition entre l'expérience de la maladie dont la sociologie montre que les malades et leurs proches révèlent des compétences à faire face (certes non sans peine ni souffrance) et des représentations sociétales déployant les images négatives de peur qui sont parfois excessives et délétères.
Le coût médico-social de la maladie est largement supérieur à son coût médical
Les études économiques sur la maladie d'Alzheimer comprennent principalement des études sur le coût de la maladie et le coût par patient, ainsi que des évaluations médico-économiques des thérapies médicamenteuses. Les études sur les évaluations des prises en charge non médicamenteuses sont rares. Par ailleurs, il y a peu de recherches économiques relatives à l'éclairage de la décision pour les pouvoirs publics qui aient une perspective large et macroéconomique sur des thèmes comme l'arbitrage entre prise en charge à domicile et en hébergement, la question des comorbidités, les facteurs prédictifs de l'hospitalisation, l'intérêt économique du diagnostic précoce. Non pas que ces questions ne soient pas traitées, mais elles le sont souvent dans le cadre d'études aux dimensions modestes et d'échantillons à la représentativité problématique.
Sur 71 études de coûts en langue anglaise publiées entre 1985 et 2000 (dont 21 répondaient à des critères scientifiques), les évaluations globales du coût par patient s'échelonnaient entre 1 500 € et 91 000 € pour l'année 2000. Les différences s'expliquent par les méthodologies adoptées et les systèmes de soins considérés. Le périmètre des coûts varie en fonction des objectifs de la recherche. Dans la perspective du tiers payant qu'est l'assurance maladie, l'intérêt se portera sur les coûts médicaux. Dans une perspective de protection sociale, ce sont les coûts directs sociaux et médicaux financés par les pouvoirs publics qui feront l'objet de l'analyse, éventuellement étendus aux coûts directs informels pour rendre compte de l'exercice des solidarités familiales au côté des solidarités publiques. Enfin, du point de vue sociétal, les coûts seront envisagés de la façon la plus large.
Il y a consensus pour considérer que la maladie d'Alzheimer est un facteur aggravant du coût du patient âgé, le facteur multiplicatif global variant entre 1,5 et 2. Le coût médico-social est plus élevé que le coût médical, et la famille est le principal contributeur. Le coût augmente avec la détérioration psychique, en raison de l'institutionnalisation des patients, quelle que soit l'échelle utilisée pour mesurer cette détérioration. Il augmente quand la capacité du patient pour les activités de la vie courante diminue. Cette croissance des coûts est renforcée par les troubles du comportement et la comorbidité. L'accroissement concerne aussi bien les coûts directs que les coûts indirects. Les aidants informels de patients atteints de maladie d'Alzheimer au stade sévère consacrent davantage d'heures, ont un absentéisme professionnel et une contribution financière accrus.
Les prises en charge médicamenteuses ont donné lieu à de multiples études coûts/efficacité, rythmées par l'apparition des nouveaux médicaments et pratiquement toutes financées par l'industrie pharmaceutique. Un nombre important d'études pharmaco-économiques se rapportent aux inhibiteurs d'acétylcholinestérase (donépézil, rivastigmine, galantamine) utilisés principalement pour les stades légers à modérés de la maladie ou à l'anti-glutamatergique (mémantine) utilisé aux stades modérés à sévères.
Selon les cas, l'indicateur de résultat est la stabilisation du niveau du MMSE, la réduction du recours à l'hospitalisation ou le délai dans le recours à l'institutionnalisation et son effet sur le volume des soins informels. Certaines études font appel à un indicateur synthétique du type « Qaly » qui indique la qualité de vie par année de vie gagnée. Mais l'appréciation de la qualité de vie de patients dont la communication verbale est souvent détériorée reste délicate. Le National Institute of Clinical Excellence (NICE, 2005) au Royaume-Uni a eu recours à ce type d'indicateur pour l'évaluation médico-économique des traitements médicamenteux dans la maladie d'Alzheimer.
De fait, les résultats des différentes études ne convergent pas complètement, sont même parfois contradictoires et il est difficile de tirer d'une comparaison de ces études des conclusions économiques définitives et consensuelles sur le caractère coûts/efficacité de ces médicaments.
En France, le coût de la maladie d'Alzheimer a fait l'objet de plusieurs estimations. En 1993, par exemple, le coût annuel net moyen par patient a été chiffré à 18 265 €. L'Organisation de coopération et de développement économiques (OCDE) avançait le chiffre de 19 581 € pour le coût total par patient en 2000. Le rapport de l'Opeps
13
gallez c. La prise en charge de la maladie d’Alzheimer et des maladies apparentées. Rapport de l’Office Parlementaire d’Évaluation des Politiques de santé (Opeps), 2005 : 256 p.
, quant à lui, estime le coût annuel moyen par patient à 22 099 €, dont 5 791 € de dépenses médicales et 16 307 € de dépenses médico-sociales (dont 55 % à charge des familles). C'est au niveau médico-social que la collectivité dépense le plus pour la maladie d'Alzheimer (90 % de la dépense) et non au niveau médical. La part actuelle de la dépense de médicaments est très limitée : 369 € en moyenne par patient et par an. Enfin, c'est une maladie ruineuse pour le patient (12 146 € en moyenne par famille et par an en 2004), alors que la retraite moyenne était de 14 400 €, 10 800 € pour les femmes et 18 600 € pour les hommes.
Ces études sont autant de prises de conscience du problème économique posé par les soins à donner à tous les patients atteints de maladie d'Alzheimer. Elles offrent aux décideurs des ordres de grandeur, plus ou moins travaillés.
L'estimation d'un coût global de la maladie autorise la construction de scénarios simples. Celui envisagé par l'Opeps est un scénario de type « toutes choses égales par ailleurs ». Le produit intérieur brut (PIB) et le prix des services médico-sociaux croissent au taux de 1,5 point et les salaires au taux de 1,6 point. Il indique que le montant total des dépenses va croître de 9,9 Mds € en 2004 à 15,2 Mds € en 2020 et 28,9 Mds € en 2040 (soit 1,04 % du PIB). Un second scénario consiste à introduire une qualification des services médico-sociaux et aligne la croissance de leur rémunération sur celle des salaires. Le total des dépenses est alors de 19,3 Mds € en 2020 et de 50,4 Mds € en 2040 (soit 1,82 % du PIB).
Au total, la connaissance économique des conséquences de la maladie d'Alzheimer en France reste insuffisante et les études économiques disponibles sont de qualité inégale. Une partie d'entre elles ne s'intéresse qu'à un très petit nombre de patients, sur des durées allant de 3 mois à 1 an. Il n'y a pas de suivi individuel et longitudinal de la consommation de ressources, à domicile et en institution, pour ce type de patients et les effets économiques à long terme ne sont pas intégrés dans les calculs. Les estimations des coûts portent principalement sur la maladie d'Alzheimer de sévérité moyenne et sévère et il y a peu de données sur la première phase de la maladie, pas plus que sur les coûts de la phase très sévère ou terminale de la maladie.
Une des hypothèses fortes des analyses coûts/efficacité est que le coût des soins est lié à la capacité cognitive (repérée grâce au MMSE) qui est supposée déterminer l'institutionnalisation. Or, il est difficile d'établir une corrélation claire entre l'institutionnalisation et les troubles cognitifs évalués par le MMSE. L'institutionnalisation dépend également de la capacité du patient à accomplir les actes essentiels de la vie, de l'apparition de troubles du comportement, de la situation économique, sociale et familiale de l'aidant et de sa capacité à faire face.
Une condition nécessaire à la qualité des études économiques est la délimitation précise de la population cible, du périmètre des soins et du coût de production des services. Cette condition n'est pas remplie en raison de l'importance du nombre de cas non diagnostiqués, de la diversité des pratiques cliniques et de la variabilité des coûts. Par ailleurs, la plupart des patients souffre de polypathologies. Il est malaisé de savoir quelle est la part des coûts qui est strictement imputable à la maladie d'Alzheimer car la majorité de ces patients est prise en charge « globalement », dans le cadre de dispositifs qui ne distinguent pas la dépendance d'origine physique ou psychique.
Toutefois, la difficulté majeure vient du fait que les coûts aussi bien que les bénéfices des prises en charge des patients atteints de maladie d'Alzheimer relèvent à titre principal des sphères médico-sociales et domestiques. Les conclusions des études économiques sont donc largement tributaires du mode de valorisation de l'aide informelle. La mesure du temps d'aide est souvent réalisée sur une courte période puis généralisée à la longue période, en raison du déficit de cohortes de longue durée. Le temps d'aide varie au jour le jour et l'intensité des soins est variable. La mesure des soins est difficile parce qu'ils se rapportent à la sphère familiale et domestique. De plus, la valeur de l'aide informelle peut être estimée selon différentes méthodes : par l'aidant lui-même, par le montant des allocations versées aux aidants par les pouvoirs publics, par le coût de remplacement de l'aidant par un professionnel, ou encore par le coût d'opportunité pour l'aidant de consacrer du temps à son parent atteint de démence.
Une mention particulière doit être faite aux travaux qui traitent des différentes formules de répit proposées aux aidants (et particulièrement les centres de jour) et de la possibilité d'équilibrer le budget des centres de jour par les économies ainsi réalisées. Différentes études se sont intéressées à la performance financière des services de répit. Il existe un bénéfice positif au niveau de l'aidant en cas d'utilisation d'un centre de jour à la fois sur courte période (3 mois) et sur longue période (1 an). Les coûts sont plus faibles en cas d'utilisation longue que d'utilisation courte, ce qui suggère qu'il faut encourager une participation précoce des aidants à ces programmes. Il a par ailleurs été rapporté un moindre recours à l'hospitalisation aiguë (mais pas aux urgences) pour l'aidant en cas d'existence d'un « gestionnaire de cas ».
Les politiques publiques et les plans gouvernementaux récents traduisent la prise de conscience de l'importance du problème
La maladie d'Alzheimer et les syndromes apparentés ont été pratiquement ignorés par les décideurs politiques jusqu'à la fin du XXe siècle. Une des preuves les plus remarquables de cette ignorance est le rapport du Haut comité de santé publique de 1998, censé faire le point sur les problèmes majeurs de santé publique de notre pays à cette époque et qui ne mentionnait ni la maladie d'Alzheimer, ni la démence, alors que ces affections touchaient déjà au moins 500 000 français.
La prise de conscience de l'importance du problème par les autorités politiques et les administrations de la santé date seulement du début du XXIe siècle en raison du vieillissement plus marqué de la population, notamment après la pause relative liée à la dénatalité de la période de la guerre de 1914-1918, de l'émergence de traitements et de modes de prise en charge de ces maladies, de la médiatisation de certains cas célèbres comme Ronald Reagan, et de l'action des associations de familles de malades réunies dans une seule association nationale, l'Association France Alzheimer.
Compte tenu de l'augmentation du nombre de personnes atteintes de la maladie d'Alzheimer dans l'ensemble de l'Europe, les différents pays doivent faire face aux mêmes problèmes. Même si les contextes sociaux et les moyens diffèrent d'un pays à l'autre, les objectifs sont identiques.
Objectifs des politiques de lutte contre la maladie d'Alzheimer en Europe (rapport de l'OCDE, 2004)
|
Maintenir à domicile le plus longtemps possible et retarder l'institutionnalisation
|
|
Aider les aidants afin de faciliter le maintien à domicile
|
|
Favoriser une participation des patients à leurs soins le plus longtemps possible
|
|
Coordonner les services au niveau local
|
|
Promouvoir une égalité dans le traitement des besoins
|
|
Favoriser le diagnostic précoce
|
L'organisation de notre système de santé est caractérisée par une grande complexité avec de multiples structures associant un système médical libéral privé surtout ambulatoire et un système public essentiellement hospitalier, avec des administrations tutélaires séparées pour les aspects sanitaires et les aspects sociaux aux niveaux local, régional et national. Cette complexité explique que les politiques publiques en matière de santé sont fondées sur des plans nationaux relayés par des plans régionaux. Seuls ces plans peuvent impulser et structurer une démarche « volontariste » et cohérente concernant une maladie ou un problème sanitaire donné, si on considère que ce domaine est une priorité de santé publique et nécessite une action concertée pour progresser dans la résolution des problèmes posés. Enfin, à un niveau supplémentaire, la complexité du processus est relayée par la séparation des deux entités que sont le Ministère de la santé et le Ministère de la recherche.
Un premier plan national intitulé « Programme d'actions destiné aux personnes souffrant de maladie d'Alzheimer et de maladies apparentées » a été lancé pour la période 2001-2004 de manière conjointe par les Ministères de la santé, des affaires sociales et le Secrétariat d'État auprès des personnes âgées. Ce plan comportait six objectifs majeurs :
• identifier les premiers symptômes et orienter ;
• structurer l'accès à un diagnostic de qualité ;
• préserver la dignité des personnes ;
• soutenir et informer les personnes malades et leurs familles ;
• améliorer les structures d'hébergement et les renforcer ;
• favoriser les études et la recherche clinique.
Ce premier plan a entraîné la création des premiers Centres mémoire de Ressources et de Recherche (CMRR) à vocation régionale et des Consultations mémoire (CM) à vocation plus locale. Le plan a été conforté par la mise en place de l'Allocation personnalisée autonomie (APA) et des Centres locaux d'information et de coordination gérontologiques (CLIC).
Dans la prolongation de ce premier plan, un deuxième plan national intitulé « Plan Alzheimer et maladies apparentées » a été lancé pour la période 2004-2007 par le Ministère des solidarités, de la santé et de la famille et le Secrétariat d'État aux personnes âgées avec dix objectifs.
Ce deuxième plan a permis de conforter l'offre de soins avec la création de 25 CMRR réunis dans une Fédération nationale et de 366 CM mises en réseau avec les CMRR. L'objectif d'arriver à une CM pour 15 000 habitants de plus de 75 ans devrait être atteint en 2007. La maladie d'Alzheimer a été identifiée parmi les affections de longue durée et une réflexion éthique nationale a été mise en place autour de cette pathologie avec l'organisation de 5 colloques nationaux. Une incitation forte et des moyens ont été affectés pour la création de réseaux de santé, d'accueil de jour (15 500 places prévues en 2007) et de structures d'hébergement temporaire.
Dix objectifs du plan Alzheimer et maladies apparentées (2004-2007)
|
Reconnaître la maladie d'Alzheimer et les maladies apparentées comme une maladie à part entière et promouvoir le respect de la personne malade
|
|
Anticiper les besoins des malades et des familles et faciliter l'adaptation de l'offre aux besoins
|
|
Faciliter le diagnostic précoce et sa qualité afin de ralentir l'évolution de la maladie et de prévenir ses complications
|
|
Mettre en place une politique d'accompagnement renforcée pour les malades à un stade précoce et les familles
|
|
Mieux accompagner les malades qui vivent à domicile
|
|
Adapter les établissements d'hébergement pour personnes âgées pour prendre en compte la spécificité de cette maladie
|
|
Développer la formation des professionnels et aider les bénévoles
|
|
Faciliter la prise en charge des malades en situation de crise
|
|
Prendre en compte la spécificité des patients jeunes
|
|
Favoriser les études et la recherche clinique
|
Il est indéniable que ces deux premiers plans ont permis de prendre la mesure du phénomène et de développer des structures de qualité sur l'ensemble du territoire pour une meilleure prise en charge des malades et pour l'évaluation. En revanche, les plans ont oublié la politique volontariste d'encourager la recherche sur les différents aspects de la maladie d'Alzheimer. Il a fallu attendre 2007 pour que soit lancé un appel d'offre « Neurosciences, neurologie et psychiatrie » de l'Agence nationale de la recherche (ANR) incluant un volet « Alzheimer et syndromes apparentés » ainsi qu'un appel d'offre « Longévité et vieillissement ».
Par ailleurs, de nombreux problèmes restent encore à résoudre, notamment pour la détection plus précoce de la maladie qui demeure sous-diagnostiquée et pour laquelle le diagnostic est posé à un stade trop tardif, pour le suivi des malades en raison de l'absence de recommandations officielles, pour l'évaluation des besoins en hôpitaux de jour ou en accueil de jour, pour préciser la place des hébergements temporaires, des foyers logements, des Ehpad. Le récent plan « Solidarité grand âge » devrait dans ce dernier domaine permettre une amélioration de la prise en charge en Ehpad avec une augmentation annoncée du ratio nombre du personnel/nombre de malades, actuellement très inférieur à 1 en France. Le rapport de l’Opeps (2005) sur la maladie d'Alzheimer et les syndromes apparentés a fait un certain nombre de recommandations pour améliorer la situation des malades et de leur famille. Trois de ces recommandations ont été particulièrement soulignées par les députés et les sénateurs :
• changer l'image de la maladie dans la population par des campagnes d'information, notamment pour promouvoir une détection plus rapide et dédramatiser le vécu de la maladie ;
• aider le médecin généraliste et coordonner l'ensemble des prises en charge par la création d'un interlocuteur unique, le « gestionnaire de cas » qui serait responsable de la coordination des soins ;
• donner un nouvel élan à la recherche clinique et en santé publique, sans oublier la recherche fondamentale par la réalisation d'un appel d'offre ambitieux couvrant tous les aspects de la prise en charge de la maladie.
Le gouvernement semble suivre ces recommandations puisque la maladie d'Alzheimer a été décrétée « grande cause nationale » en 2007, des expériences de gestionnaire de cas sont actuellement en cours et seront évaluées. Il persiste toutefois un déficit de coordination entre les acteurs du secteur sanitaire et ceux du secteur médico-social.