Pesticides et effets sur la santé
Nouvelles données
2021
→ Aller vers ANALYSE→ Aller vers SYNTHESE
| Communications |
Cohorte AGRIculture & CANcer (AGRICAN)
Contexte
Objectifs
Principaux éléments de méthode
 ). La phase
d’inclusion s’est terminée fin 2007, la validation des données du
questionnaire a débuté en 2008 ainsi que la phase descriptive des
données. Parallèlement, des analyses ont été réalisées sur les
pathologies non cancéreuses, prévalentes à l’inclusion (asthme,
bronchite chronique...). Le suivi de l’état de santé a débuté pour
chaque membre de la cohorte dès son inclusion et concerne son statut
vital, les causes de décès et la survenue d’un cancer. La première
phase de suivi direct des expositions a débuté en 2014 par l’envoi
du questionnaire principal de suivi, destiné à mettre à jour les
informations sur les expositions professionnelles et les facteurs de
confusion potentiels ainsi qu’à approfondir certains aspects de
l’histoire professionnelle agricole et explorer d’autres évènements
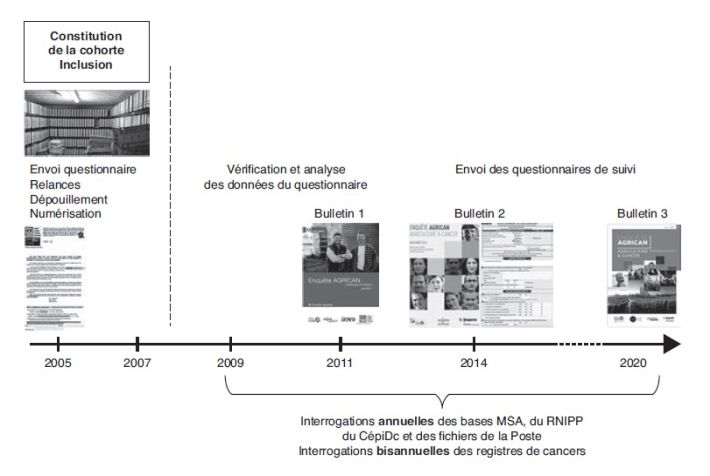
de santé. La figure ci-dessous rappelle brièvement les différentes
étapes du déroulement de la cohorte AGRICAN sur la période allant de
2005 à 2020.
). La phase
d’inclusion s’est terminée fin 2007, la validation des données du
questionnaire a débuté en 2008 ainsi que la phase descriptive des
données. Parallèlement, des analyses ont été réalisées sur les
pathologies non cancéreuses, prévalentes à l’inclusion (asthme,
bronchite chronique...). Le suivi de l’état de santé a débuté pour
chaque membre de la cohorte dès son inclusion et concerne son statut
vital, les causes de décès et la survenue d’un cancer. La première
phase de suivi direct des expositions a débuté en 2014 par l’envoi
du questionnaire principal de suivi, destiné à mettre à jour les
informations sur les expositions professionnelles et les facteurs de
confusion potentiels ainsi qu’à approfondir certains aspects de
l’histoire professionnelle agricole et explorer d’autres évènements
de santé. La figure ci-dessous rappelle brièvement les différentes
étapes du déroulement de la cohorte AGRICAN sur la période allant de
2005 à 2020. ), près de 80 % des membres de la cohorte
étaient toujours en vie, 20 % étaient décédés et le statut vital
était inconnu pour seulement 1 % des membres de la cohorte (1 730
personnes). Parmi les personnes vivantes au 31 décembre 2015, elles
étaient 2 973 à être sorties de la zone de suivi des registres (2 %,
dont 54 % d’hommes).
), près de 80 % des membres de la cohorte
étaient toujours en vie, 20 % étaient décédés et le statut vital
était inconnu pour seulement 1 % des membres de la cohorte (1 730
personnes). Parmi les personnes vivantes au 31 décembre 2015, elles
étaient 2 973 à être sorties de la zone de suivi des registres (2 %,
dont 54 % d’hommes).Tableau I Statut vital des membres de la cohorte AGRICAN à partir des données des MSA, du RNIPP et des services d’État civil des mairies de naissance entre l’inclusion et la fin d’année 2015
|
Membres de la cohorte
|
Vivants
|
Décédés
|
Statut inconnu
|
|---|---|---|---|
|
Tous (n = 181 842)
|
143 581 (79,0 %)
|
36 531 (20,0 %)
|
1 730 (1,0 %)
|
|
Hommes (n = 98 794)
|
76 969 (77,9 %)
|
20 899 (21,2 %)
|
926 (0,9 %)
|
|
Femmes (n = 83 048)
|
66 612 (80,2 %)
|
15 632 (18,8 %)
|
804 (1,0 %)
|
Résultats
Description de la mortalité par cause
 ).
Au total, sur la période entre l’inclusion et la fin d’année
2015, 20 899 hommes et 15 632 femmes de la cohorte sont décédés
(tableau I
).
Au total, sur la période entre l’inclusion et la fin d’année
2015, 20 899 hommes et 15 632 femmes de la cohorte sont décédés
(tableau I ). Les rapports
standardisés de mortalité (RSM) ont été calculés en prenant
comme population de référence la population générale des
départements concernés sur la même période, par sexe et par
tranches de 5 ans d’âge. Les résultats sont présentés dans le
tableau II
). Les rapports
standardisés de mortalité (RSM) ont été calculés en prenant
comme population de référence la population générale des
départements concernés sur la même période, par sexe et par
tranches de 5 ans d’âge. Les résultats sont présentés dans le
tableau II . Les
principales tendances observées sur la période 2005-2009
(Levêque-Morlais et coll., 2015
. Les
principales tendances observées sur la période 2005-2009
(Levêque-Morlais et coll., 2015 ) sont confirmées avec presque toujours
des valeurs de RSM inférieures à 1, mais se rapprochant de cette
valeur avec le temps. Ainsi, la mortalité globale présentait un
RSM = 0,68 chez les hommes et RSM = 0,71 chez les femmes pour la
période 2005-2009, et un RSM = 0,75 quel que soit le sexe sur la
période 2005-2015. Parmi l’ensemble des causes de décès (période
2005-2009), deux apparaissent légèrement plus fréquentes chez
les affiliés : i) les décès par arthrite rhumatoïde
(RSM = 1,10 chez les hommes et RSM = 1,06 chez les femmes), se
maintenant à un RSM = 1,13 chez les hommes mais diminuant
nettement chez les femmes (RSM = 0,85), ii) les suicides
significativement surreprésentés chez les hommes (RSM = 1,14) et
chez les femmes (RSM = 1,46) sur la période 2005-2015. Cette
surmortalité par suicide était observée aussi bien chez les
exploitants que chez les salariés avec des valeurs plus fortes
chez les femmes chefs d’exploitations (RSM = 2,05) et dans tous
les départements sauf la Vendée et les départements alsaciens
(données non présentées). Les résultats concernant les décès par
cancer ne sont pas présentés car moins informatifs que ceux
portant sur l’incidence. L’analyse de ces données se poursuit
par la production de RSM incluant les dernières années, par
statut professionnel (exploitant versus salarié) et par
département. Une attention particulière est portée à certaines
causes de décès par maladies neurodégénératives (sclérose
latérale amyotrophique ou SLA, maladies de Parkinson et
d’Alzheimer) dans le cadre d’un travail conduit au sein du
consortium AGRICOH par l’équipe EPICENE de Bordeaux.
) sont confirmées avec presque toujours
des valeurs de RSM inférieures à 1, mais se rapprochant de cette
valeur avec le temps. Ainsi, la mortalité globale présentait un
RSM = 0,68 chez les hommes et RSM = 0,71 chez les femmes pour la
période 2005-2009, et un RSM = 0,75 quel que soit le sexe sur la
période 2005-2015. Parmi l’ensemble des causes de décès (période
2005-2009), deux apparaissent légèrement plus fréquentes chez
les affiliés : i) les décès par arthrite rhumatoïde
(RSM = 1,10 chez les hommes et RSM = 1,06 chez les femmes), se
maintenant à un RSM = 1,13 chez les hommes mais diminuant
nettement chez les femmes (RSM = 0,85), ii) les suicides
significativement surreprésentés chez les hommes (RSM = 1,14) et
chez les femmes (RSM = 1,46) sur la période 2005-2015. Cette
surmortalité par suicide était observée aussi bien chez les
exploitants que chez les salariés avec des valeurs plus fortes
chez les femmes chefs d’exploitations (RSM = 2,05) et dans tous
les départements sauf la Vendée et les départements alsaciens
(données non présentées). Les résultats concernant les décès par
cancer ne sont pas présentés car moins informatifs que ceux
portant sur l’incidence. L’analyse de ces données se poursuit
par la production de RSM incluant les dernières années, par
statut professionnel (exploitant versus salarié) et par
département. Une attention particulière est portée à certaines
causes de décès par maladies neurodégénératives (sclérose
latérale amyotrophique ou SLA, maladies de Parkinson et
d’Alzheimer) dans le cadre d’un travail conduit au sein du
consortium AGRICOH par l’équipe EPICENE de Bordeaux.Tableau II Causes de décès (hors cancers) au sein de la cohorte AGRICAN sur la période 2005-2015
|
Libellé CIM 10
|
Hommes
|
Femmes
|
||||
|---|---|---|---|---|---|---|
|
Décès
|
RSM (IC 95 %)
|
Décès
|
RSM (IC 95 %)
|
|||
|
I.
|
Maladies infectieuses
et parasitaires |
387
|
0,71 (0,63-0,78)*
|
303
|
0,70 (0,62-0,78)*
|
|
|
III.
|
Maladies du sang et des organes
hématopoïétiques
|
82
|
0,77 (0,61-0,95)*
|
65
|
0,71 (0,55-0,90)*
|
|
|
IV.
|
Maladies endocriniennes,
nutritionnelles et métaboliques
|
608
|
0,67 (0,62-0,72)*
|
570
|
0,66 (0,61-0,72)*
|
|
|
Diabète sucré
|
360
|
0,62 (0,56-0,69)*
|
304
|
0,65 (0,58-0,73)*
|
||
|
V.
|
Troubles mentaux
et du comportement |
499
|
0,59 (0,54-0,65)*
|
524
|
0,56 (0,51-0,61)*
|
|
|
VI.
|
Maladies du système nerveux
et des organes des sens |
1 013
|
0,71 (0,67-0,75)*
|
987
|
0,63 (0,60-0,68)*
|
|
|
IX.
|
Maladie de l’appareil
circulatoire
|
6 249
|
0,78 (0,76-0,80)*
|
5 459
|
0,80 (0,78-0,82)*
|
|
|
Cardiopathies ischémiques
|
1 747
|
0,74 (0,70-0,77)*
|
1 095
|
0,79 (0,74-0,83)*
|
||
|
Maladies cérébrovasculaires
|
1 284
|
0,78 (0,74-0,82)*
|
1 288
|
0,78 (0,74-0,82)*
|
||
|
X.
|
Maladies de l’appareil
respiratoire
|
1 498
|
0,70 (0,67-0,74)*
|
929
|
0,67 (0,62-0,71)*
|
|
|
Asthme
|
28
|
0,99 (0,66-1,43)
|
26
|
0,60 (0,39-0,88)*
|
||
|
XI.
|
Maladies de l’appareil
digestif
|
761
|
0,67 (0,62-0,72)*
|
543
|
0,68 (0,62-0,73)*
|
|
|
XII.
|
Infections de la peau et du tissu
cellulaire sous-cutané
|
49
|
0,84 (0,62-1,11)
|
45
|
0,55 (0,40-0,73)*
|
|
|
XIII.
|
Maladies du système ostéo-articulaire,
des muscles et du tissu conjonctif
|
166
|
0,99 (0,84-1,15)
|
151
|
0,75 (0,64-0,88)*
|
|
|
Arthrite rhumatoïde
et ostéoarthrite |
19
|
1,13 (0,68-1,77)
|
35
|
0,85 (0,59-1,19)
|
||
|
XIV.
|
Maladies de l’appareil
génito-urinaire
|
353
|
0,64 (0,58-0,71)*
|
257
|
0,65 (0,57-0,73)*
|
|
|
XX.
|
Causes externes de blessure
et d’empoisonnement |
1 357
|
0,86 (0,81-0,91)*
|
819
|
0,80 (0,75-0,86)*
|
|
|
Accidents
|
867
|
0,78 (0,73-0,83)*
|
653
|
0,74 (0,69-0,80)*
|
||
|
Intoxications accidentelles
|
41
|
0,70 (0,50-0,95)*
|
43
|
0,88 (0,64-1,19)
|
||
|
Suicides
|
423
|
1,14 (1,03-1,25)*
|
121
|
1,46 (1,21-1,75)*
|
||
|
Toutes causes de décès
|
20 899
|
0,75 (0,74-0,76)*
|
15 632
|
0,75 (0,74-0,76)*
|
||
CIM-10 : 10e révision de la Classification internationale des maladies ; RSM : rapports standardisés de mortalité. * : p < 0,05
Description de l’incidence des cancers
Comparaison à la population générale des départements concernés
 ). Sont présentés ci-après les principaux résultats
obtenus entre l’inclusion et le 31 décembre 2015. Ainsi,
après le quatrième croisement avec les données des registres
de cancers réalisé en 2018, un nombre total de
18 619 cancers incidents a été enregistré. Le
tableau III
). Sont présentés ci-après les principaux résultats
obtenus entre l’inclusion et le 31 décembre 2015. Ainsi,
après le quatrième croisement avec les données des registres
de cancers réalisé en 2018, un nombre total de
18 619 cancers incidents a été enregistré. Le
tableau III présente les résultats pour les principaux cancers,
disponibles pour 46 localisations tumorales chez les hommes
et 47 chez les femmes. Au total, les principales conclusions
chez les hommes sont les suivantes :
présente les résultats pour les principaux cancers,
disponibles pour 46 localisations tumorales chez les hommes
et 47 chez les femmes. Au total, les principales conclusions
chez les hommes sont les suivantes :Tableau III Rapports standardisés d’incidence (RSI) des cancers au sein de la cohorte AGRICAN sur la période 2005-2015
|
Cancers
|
RSI (IC 95 % ; nombre de cas
incidents)
|
||
|---|---|---|---|
|
Hommes
|
Femmes
|
||
|
Tous cancers
|
0,93* (0,91-0,95 ;
12 026)
|
0,95* (0,93-0,98 ;
6 590)
|
|
|
Mélanomes cutanés
|
0,97 (0,87-1,08 ; 323)
|
1,29* (1,15-1,45 ;
299)
|
|
|
Cancers des lèvres
|
1,55* (1,13-2,08 ;
44)
|
0,80 (0,35-1,58 ; 8)
|
|
|
Cancers du pharynx et cavité
orale
|
0,57* (0,51-0,64 ;
296)
|
0,64* (0,50-0,81 ;
71)
|
|
|
Cancers du côlon
|
0,87* (0,82-0,93 ;
949)
|
0,95 (0,88-1,03 ; 681)
|
|
|
Cancers du rectum
|
1,00 (0,92-1,08 ; 595)
|
0,83* (0,73-0,94 ;
249)
|
|
|
Cancers de l’œsophage
|
0,78* (0,68-0,89 ;
232)
|
0,72* (0,52-0,98 ;
41)
|
|
|
Cancers de l’estomac
|
0,88* (0,79-0,98 ;
316)
|
1,00 (0,84-1,17 ; 145)
|
|
|
Cancers hépatiques
|
0,75* (0,68-0,83 ;
410)
|
0,69* (0,54-0,86 ;
73)
|
|
|
Cancers pancréatiques
|
0,79* (0,71-0,89 ;
305)
|
0,97 (0,86-1,09 ; 287)
|
|
|
Cancers du sein
|
0,87 (0,58-1,26 ; 28)
|
0,86* (0,82-0,91 ;
1 700)
|
|
|
Cancers de l’ovaire
|
1,11 (0,98-1,25 ; 260)
|
||
|
Cancers de la prostate
|
1,03* (1,00-1,06 ;
3 911)
|
||
|
Cancers du testicule
|
0,91 (0,61-1,29 ; 30)
|
||
|
Cancers broncho-pulmonaires
|
0,58* (0,55-0,62 ;
1 066)
|
0,67* (0,59-0,75 ;
282)
|
|
|
Cancers de la vessie
|
0,66* (0,61-0,72 ;
502)
|
0,78* (0,64-0,94 ;
111)
|
|
|
Cancers du rein
|
0,95 (0,87-1,04 ; 496)
|
1,03 (0,89-1,17 ; 214)
|
|
|
Cancers du système nerveux
central
|
1,00 (0,84-1,18 ; 146)
|
0,97 (0,78-1,19 ; 87)
|
|
|
Glioblastomes
|
1,05 (0,85-1,28 ; 94)
|
0,87 (0,64-1,17 ; 45)
|
|
|
Cancers de la thyroïde
|
0,92 (0,72-1,16 ; 74)
|
1,15 (0,99-1,33 ; 180)
|
|
|
Maladie de Hodgkin
|
0,99 (0,66-1,42 ; 29)
|
1,14 (0,65-1,85 ; 16)
|
|
|
Lymphome malin non
hodgkinien
|
1,09* (1,02-1,16 ;
1 004)
|
1,07 (0,99-1,16 ; 597)
|
|
|
Leucémie lymphoïde
chronique
|
1,03 (0,90-1,17 ; 238)
|
0,91 (0,75-1,09 ; 115)
|
|
|
Lymphome Diffus à Cellules
B
|
1,04 (0,89-1,21 ; 164)
|
0,97 (0,79-1,17 ; 104)
|
|
|
Myélome multiple
|
1,20* (1,05-1,37 ;
227)
|
1,21* (1,03-1,42 ;
156)
|
|
|
Lymphome
lymphoplasmocytaire
|
1,49* (1,22-1,80 ;
107)
|
1,58* (1,17-2,10 ;
48)
|
|
|
Leucémie aiguë myéloïde
|
0,92 (0,74-1,12 ; 97)
|
0,96 (0,74-1,23 ; 65)
|
|
|
Syndrome myélodysplasique
|
0,93 (0,81-1,05 ; 225)
|
1,07 (0,91-1,26 ; 148)
|
|
|
Syndrome myéloprolifératif
chronique
|
0,94 (0,80-1,11 ; 145)
|
1,02 (0,85-1,23 ; 115)
|
|
|
Sarcomes
|
1,02 (0,86-1,21 ; 136)
|
0,93 (0,74-1,14 ; 89)
|
|
* RSI statistiquement significatif au seuil 5 %, en fond gris sombre ceux avec un risque significativement supérieur à 1 et en fond gris clair ceux avec un risque significativement inférieur à 1
Analyse interne des déterminants de cancers et de maladies non cancéreuses
Lien avec les activités agricoles (élevages et cultures) et tâches spécifiques
 ), bronchite chronique (Tual et
coll., 2013
), bronchite chronique (Tual et
coll., 2013 ) et maladie de Parkinson
(Pouchieu et coll.,
2018
) et maladie de Parkinson
(Pouchieu et coll.,
2018 ) et sur plusieurs cancers : les
cancers pulmonaires (globalement et pour 3 sous-types
histologiques : les adénocarcinomes, les cancers
épidermoïdes et les cancers à petites cellules) (Tual et
coll., 2017
) et sur plusieurs cancers : les
cancers pulmonaires (globalement et pour 3 sous-types
histologiques : les adénocarcinomes, les cancers
épidermoïdes et les cancers à petites cellules) (Tual et
coll., 2017 ; Boulanger et coll.,
2018
; Boulanger et coll.,
2018 ), les cancers de la prostate
(Lemarchand et coll.,
2016
), les cancers de la prostate
(Lemarchand et coll.,
2016 ), les cancers de la vessie
(Boulanger et coll.,
2017
), les cancers de la vessie
(Boulanger et coll.,
2017 ), les cancers du sein (thèse
doctorale de C. Lemarchand,
2015
), les cancers du sein (thèse
doctorale de C. Lemarchand,
2015 ) les cancers du système nerveux
central (globalement et pour les gliomes et les
méningiomes) (Piel et coll.,
2017
) les cancers du système nerveux
central (globalement et pour les gliomes et les
méningiomes) (Piel et coll.,
2017 ) et les myélomes multiples
(Tual et coll., 2019
) et les myélomes multiples
(Tual et coll., 2019 ). D’autres analyses sont en
cours de publication sur les sarcomes (Renier et coll.,
soumis pour publication), les lymphomes non hodgkiniens
globalement et pour trois sous-types de lymphomes
(lymphomes diffus à grandes cellules B ; leucémies
lymphoïdes chroniques et myélomes multiples).
). D’autres analyses sont en
cours de publication sur les sarcomes (Renier et coll.,
soumis pour publication), les lymphomes non hodgkiniens
globalement et pour trois sous-types de lymphomes
(lymphomes diffus à grandes cellules B ; leucémies
lymphoïdes chroniques et myélomes multiples). et V
et V ).
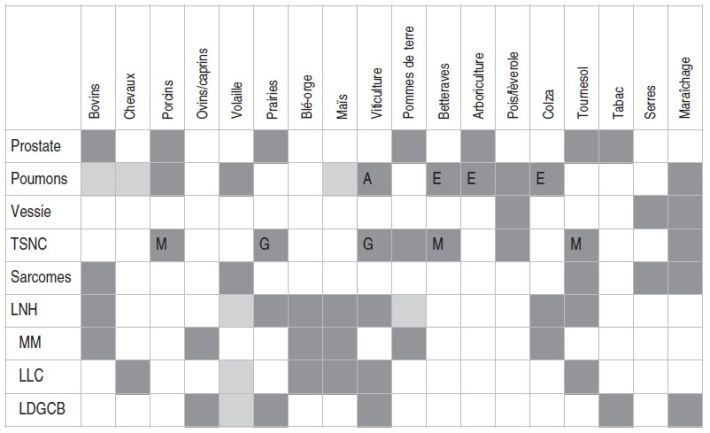
). | Tableau IV Synthèse des résultats sur l’association entre cultures ou élevages et le risque de cancer selon la localisation dans la cohorte AGRICAN (au 1er mai 2020) |
 ci-dessous et portaient sur la bronchite chronique (Tual
et coll., 2013
ci-dessous et portaient sur la bronchite chronique (Tual
et coll., 2013 ), l’asthme (Baldi et coll.,
2014
), l’asthme (Baldi et coll.,
2014 ) et le lien entre expositions
professionnelles aux pesticides et maladie de Parkinson
(Pouchieu et coll.,
2018
) et le lien entre expositions
professionnelles aux pesticides et maladie de Parkinson
(Pouchieu et coll.,
2018 ). Les prévalences observées
lors de l’inclusion dans la cohorte étaient
respectivement de 8 % pour la bronchite chronique et
l’asthme et de 1,2 % pour la maladie de Parkinson.
). Les prévalences observées
lors de l’inclusion dans la cohorte étaient
respectivement de 8 % pour la bronchite chronique et
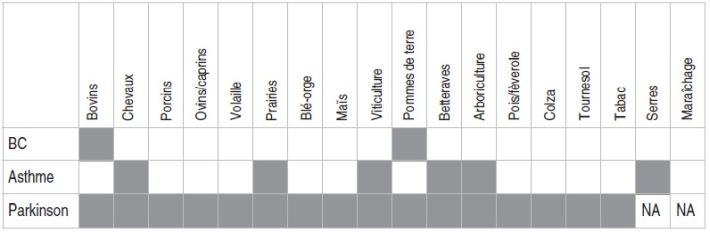
l’asthme et de 1,2 % pour la maladie de Parkinson. | Tableau V Synthèse des résultats sur l’association entre l’exercice de différentes activités agricoles et le risque de pathologies non cancéreuses dans la cohorte AGRICAN |
Lien avec l’exposition à des pesticides particuliers
 ). D’autres analyses issues du
travail de thèse de Clément Piel ont fait l’objet de
deux publications (Piel et coll.,
2019a
). D’autres analyses issues du
travail de thèse de Clément Piel ont fait l’objet de
deux publications (Piel et coll.,
2019a ; Piel et coll.,
2019b
; Piel et coll.,
2019b ) et portent d’une part sur le
lien entre les tumeurs du système nerveux central et
l’exposition aux insecticides de la famille des
carbamates (19 molécules étudiées), l’exposition aux
herbicides carbamates (7 molécules) ou thiocarbamates
(7 molécules également) et les fongicides carbamates
(5 molécules) et dithiocarbamates (11 molécules). Le
choix de ces familles s’appuyait sur des arguments
toxicologiques (capacité à traverser la barrière
hématoencéphalique, classement vis-à-vis de la
cancérogénicité, possibilité de donner des dérivés
nitrosés). Neuf des 19 insecticides carbamates ont été
associés positivement aux tumeurs du système nerveux
central, 3 d’entre eux en confirmation de données
épidémiologiques existantes (carbaryl, fénoxycarbe et
thiodicarbe) et d’autres de façon originale
(formétanate, dioxacarbe, promécarbe, isolane, thiofanox
et méthomyl). Parallèlement, l’exposition aux fongicides
carbamates et dans une moindre mesure aux herbicides
carbamates a été associée positivement au risque de
tumeurs du système nerveux central. Des associations
positives ont été également mises en évidence avec des
molécules spécifiques fongicides (mancozèbe, manèbe et
métirame) ou herbicides (chlorprophame, prophame et
diallate).
) et portent d’une part sur le
lien entre les tumeurs du système nerveux central et
l’exposition aux insecticides de la famille des
carbamates (19 molécules étudiées), l’exposition aux
herbicides carbamates (7 molécules) ou thiocarbamates
(7 molécules également) et les fongicides carbamates
(5 molécules) et dithiocarbamates (11 molécules). Le
choix de ces familles s’appuyait sur des arguments
toxicologiques (capacité à traverser la barrière
hématoencéphalique, classement vis-à-vis de la
cancérogénicité, possibilité de donner des dérivés
nitrosés). Neuf des 19 insecticides carbamates ont été
associés positivement aux tumeurs du système nerveux
central, 3 d’entre eux en confirmation de données
épidémiologiques existantes (carbaryl, fénoxycarbe et
thiodicarbe) et d’autres de façon originale
(formétanate, dioxacarbe, promécarbe, isolane, thiofanox
et méthomyl). Parallèlement, l’exposition aux fongicides
carbamates et dans une moindre mesure aux herbicides
carbamates a été associée positivement au risque de
tumeurs du système nerveux central. Des associations
positives ont été également mises en évidence avec des
molécules spécifiques fongicides (mancozèbe, manèbe et
métirame) ou herbicides (chlorprophame, prophame et
diallate).Perspectives
 ; Agopian et coll.,
2009
; Agopian et coll.,
2009 ) et au sein de nouvelles collections biologiques dans
différents secteurs de production agricole ;
) et au sein de nouvelles collections biologiques dans
différents secteurs de production agricole ;Conclusion
 ).
Ainsi la cohorte AGRICAN dispose d’une puissance statistique unique
pour l’étude des liens avec les cancers en milieu agricole.
L’existence de la cohorte AGRICAN au niveau international a incité
tout d’abord le National Cancer Institute (co-porteur de la
cohorte AHS) puis le Centre international de recherche sur le cancer
à mettre en place un consortium international de cohortes
agricoles : le consortium AGRICOH. Il comprend à ce jour 29 cohortes
menées dans 12 pays, sur l’ensemble des continents (Leon et coll.,
2011
).
Ainsi la cohorte AGRICAN dispose d’une puissance statistique unique
pour l’étude des liens avec les cancers en milieu agricole.
L’existence de la cohorte AGRICAN au niveau international a incité
tout d’abord le National Cancer Institute (co-porteur de la
cohorte AHS) puis le Centre international de recherche sur le cancer
à mettre en place un consortium international de cohortes
agricoles : le consortium AGRICOH. Il comprend à ce jour 29 cohortes
menées dans 12 pays, sur l’ensemble des continents (Leon et coll.,
2011 ). Ce
consortium a d’ores et déjà produit des résultats en matière
d’exposition aux pesticides (Brouwer et coll.,
2016
). Ce
consortium a d’ores et déjà produit des résultats en matière
d’exposition aux pesticides (Brouwer et coll.,
2016 ;
Brouwer et coll., 2017
;
Brouwer et coll., 2017 ), de lien entre hémopathies malignes
lymphoïdes et exposition à des pesticides (Leon et coll.,
2019
), de lien entre hémopathies malignes
lymphoïdes et exposition à des pesticides (Leon et coll.,
2019 ) ou à
des activités d’élevage (El-Zaemey et coll.,
2019
) ou à
des activités d’élevage (El-Zaemey et coll.,
2019 ),
ainsi que des comparaisons de prévalences de pathologies
respiratoires entre les différentes cohortes (Fix et coll.,
2020
),
ainsi que des comparaisons de prévalences de pathologies
respiratoires entre les différentes cohortes (Fix et coll.,
2020 ).
).Références issues du programme AGRICAN




















Autres références