II. Approches par pathologies
2019
13-
Bronchopneumopathie chronique obstructive
La bronchopneumopathie chronique obstructive (BPCO) est une maladie fréquente, évitable et traitable. Elle se caractérise par la persistance des symptômes respiratoires et de la limitation des débits bronchiques qui sont dus à des anomalies des voies aériennes et/ou des alvéoles provoquées habituellement par une exposition significative à des particules ou des gaz nocifs (
Global initiative for Chronic Obstructive Lung Disease, 2017

). Elle s’accompagne également de nombreux effets extra-pulmonaires dits systémiques qui déterminent en partie la sévérité globale de la pathologie (Decramer et coll., 2012

). Les atteintes systémiques (musculaires, cardiaques, vasculaires...) sont telles que la BPCO est actuellement présentée comme une maladie générale à point de départ respiratoire. Parmi ces atteintes, l’altération de la fonction musculaire périphérique nous intéressera tout particulièrement.
Données épidémiologiques majeures
La BPCO est une maladie en progression constante. En 2008, un rapport de l’Organisation mondiale de la santé (OMS) prévoyait que la mortalité due à la BPCO serait en 2030 la 3
e principale cause de mortalité au niveau mondial (
World Health Statistics, 2008

). Des données récentes montrent malheureusement que cette prévision était sous-estimée, puisque en 2012 elle atteignait déjà ce rang (Lozano et coll., 2012

). Depuis les 30-40 dernières années, la mortalité liée à la BPCO augmente plus rapidement chez les femmes que chez les hommes en dépit de larges fluctuations selon les pays concernés et la gravité de l’exposition au tabac (Rycroft et coll., 2012

).
En France, la prévalence de la BPCO est estimée entre 5 et 10 % (Fuhrman et Delmas, 2010

), bien que très certainement sous-évaluée, en raison d’un dépistage complexe et coûteux à mettre en œuvre dans le cadre d’études épidémiologiques. Son incidence tend à se stabiliser chez les hommes mais augmente chez les femmes, le nombre d’hospitalisations augmentant globalement (Fuhrman et Delmas, 2010

). Entre 2000 et 2010, la mortalité liée à la BPCO a reculé chez les hommes (-1 % en moyenne par an) et augmenté chez les femmes [+ 0,6 % par an (Prost et Rey, 2015

)]. En 2012, le nombre d’hospitalisations pour exacerbation de la BPCO était compris entre 95 000 et 145 000 selon les indicateurs employés (Prost et Rey, 2015

). Le coût direct moyen de la BPCO varie globalement entre 3 700 et 7 500 euros par patient et par an selon la gravité de la pathologie, auquel il convient d’ajouter des coûts indirects liés aux pertes de productivité et à un absentéisme professionnel (Patout et coll., 2014

) et au-delà, pour la personne, la dégradation de la qualité de vie en raison d’une dyspnée invalidante et d’une altération de sa tolérance à l’effort.
En dehors de l’oxygénothérapie de longue durée destinée aux patients les plus gravement atteints, l’activité physique est à l’heure actuelle la seule thérapeutique avec un niveau de preuve de grade A (critère le plus élevé dans l’
Evidence Based Medicine1
Ou Médecine Basée sur la Preuve. Elle est définie comme étant une « utilisation consciencieuse, explicite et judicieuse des meilleures preuves actuelles, afin de prendre des décisions concernant la prise en charge personnalisée de chaque patient » (Sackett et coll., 1996

).
) pour la prise en charge de ces patients. Ses bases physiopathologiques sont connues et permettent de comprendre les effets de l’exercice sur la BPCO, sur les contraintes ventilatoires, sur la dysfonction musculaire et métabolique ainsi que sur les altérations cardiaques souvent reliées à des interactions cœur-poumons dépendantes de l’hyperinflation dynamique
2
Augmentation de la capacité résiduelle fonctionnelle survenant au cours de l’exercice. Les conséquences principales sont une diminution de la capacité inspiratoire, une utilisation des muscles respiratoires dans une configuration géométrique défavorable induisant un surcoût énergétique de la ventilation et une dyspnée, ainsi que des répercussions cardiaques liées aux modifications importantes des pressions intra-thoraciques.
(Spruit et coll., 2013

). Depuis 1996, date de la première méta-analyse sur la question, l’efficacité de l’activité physique, véritable pierre angulaire de la réhabilitation respiratoire, a été régulièrement étayée et confirmée. Les données relatives aux effets de l’activité physique sont essentiellement issues de cette littérature riche et abondante.
Bénéfices de la pratique d’une activité physique en termes
de mortalité
La première revue générale de consensus réalisée en 2007 (Ries et coll., 2007

) avait conclu que la réhabilitation respiratoire avait un impact sur la baisse de la mortalité, mais seulement avec un grade C (
Evidence Based Medicine). Ce constat reposait sur deux travaux aux résultats peu consistants, qui ne permettaient donc pas une quelconque généralisation (Griffiths et coll., 2000

; Ries et coll., 1995

). De nouveaux travaux ont complété cette évaluation de façon parfois indirecte mais convaincante, par l’analyse des impacts fonctionnels de la réhabilitation respiratoire sur des éléments liés à la gravité de la BPCO et à sa mortalité. Sur un suivi de 3 ans chez 80 patients atteints de BPCO, il a été montré que la réhabilitation respiratoire permettait de réduire le rythme de déclin du volume expiratoire maximal par seconde (VEMS), marqueur essentiel de la gravité de l’obstruction bronchique (74 ml chez les patients entraînés
versus 149 ml chez les patients contrôles ; Stav et coll., 2009

). Cette donnée est d’une grande importance puisque la relation entre la mortalité et le VEMS est élevée quand ce dernier est inférieur à 50 % de sa valeur théorique (Celli, 2010

). Stav et coll. (2009

) ont également mis en évidence des effets majeurs obtenus sur la tolérance à l’effort et la réduction de la dyspnée déjà largement cités depuis les premières méta-analyses sur l’efficacité de la réhabilitation respiratoire, et il est maintenant clairement établi que la distance au test de marche de 6 minutes est un excellent prédicteur de survie. En effet, en deçà d’une performance comprise entre 334 m (Spruit et coll., 2012

) et 361 m (Casanova et coll., 2008

), le risque de mortalité associé à la BPCO augmente de façon significative, ce risque étant potentialisé en cas de désaturation au test de marche (Casanova et coll., 2008

). Cette efficacité est également retrouvée sur des performances fonctionnelles évaluées avec d’autres tests comme le
sit-to-stand test (Bohannon, 2012

) ou la mesure de la force des fléchisseurs des doigts (Puhan et coll., 2013

). Enfin, il est maintenant reconnu que la perte de masse musculaire (Marquis et coll., 2002

) et la faiblesse musculaire (Swallow et coll., 2007

) sont fortement associées à la mortalité, indépendamment de la sévérité de l’atteinte respiratoire. Ces travaux mettent en évidence le caractère prédictif de l’altération des adaptations fonctionnelles d’exercice et leurs déterminants musculaires avec le risque de mortalité chez les personnes atteintes de BPCO.
Au-delà des effets sur la réhabilitation respiratoire rapportés dans la littérature, d’autres travaux longitudinaux de grande qualité éclairent le caractère prédictif du niveau d’activité physique sur la probabilité de survie des patients atteints de BPCO, en utilisant des méthodes différentes basées sur des mesures objectives (Garcia-Rio et coll., 2012

; Waschki et coll., 2011

) ou auto-rapportées (Garcia-Aymerich et coll., 2008

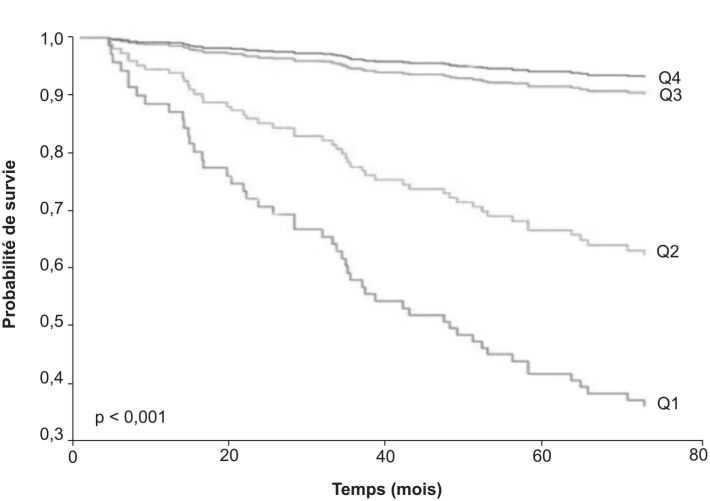
) du niveau d’activité physique. Les résultats obtenus sur différentes cohortes incluant 170 à plus de 6 500 patients suivis sur des périodes de 4 à 18 ans, sont extrêmement homogènes et révèlent que la probabilité de survie chute de façon spectaculaire avec la diminution du niveau d’activité physique habituel, même en tenant compte de tous les facteurs confondants comme l’obstruction bronchique. La figure 13.1

illustre parfaitement cette réalité : la médiane supérieure des patients les plus actifs (Q3 et Q4) présente des probabilités de survie sur 6 ans comprises entre 95 et 97 % quand la médiane inférieure des patients les moins actifs (Q1 et Q2) voit la probabilité de survie chuter entre 38 et 65 % pour la même durée de suivi.
L’impact du niveau d’activité physique sur la survie et les exacerbations dans la BPCO est également attesté par une revue systématique (Gimeno-Santos et coll., 2014

). Cette revue met en évidence chez les patients les plus actifs une diminution significative du risque relatif d’épisodes d’exacerbations [risque relatif (RR) compris entre 0,1 et 0,8 selon les travaux] et de mortalité (à l’exception d’une étude, le RR est compris entre 0,01 et 0,81). Par ailleurs, le niveau d’activité physique s’avère être à lui seul un prédicteur remarquable de la survie. Sur un suivi longitudinal de 4 ans, il a pu être ainsi démontré que le risque absolu de mortalité chez des patients très inactifs, sédentaires et actifs (au sens de la classification de l’OMS) était respectivement de 31 %, 9 %, and 0 % (Waschki et coll., 2011

). De même, ces auteurs ont pu déterminer que la réalisation de 1 845 pas quotidiens supplémentaires diminuait de moitié le risque de décès [
hazard ratio (HR) = 0,46]. Plus étonnant encore, le niveau d’activité physique se révèle être plus prédictif de la survie que les marqueurs de l’inflammation systémique, les variables morphologiques et fonctionnelles cardiaques, les taux d’adipokines (Waschki et coll., 2011

), le profil métabolique et lipidique, la consommation de tabac et d’alcool et l’utilisation des soins de santé sur les 12 derniers mois (Garcia-Aymerich et coll., 2008

). Enfin, il a été récemment démontré par une étude interventionnelle que la pratique d’une heure d’activité physique par jour chez ces patients permettait de réduire de 30 % la mortalité sur une période de 6,5 ans (Loprinzi et Walker, 2016

).
Niveau d’activité physique et de sédentarité des patients atteints de bronchopneumopathie chronique obstructive
Depuis la fin des années 1990, il est connu que les patients atteints de BPCO ont globalement un niveau d’activité physique réduit comparé à des sujets sains de même âge avec en moyenne 40 à 60 % de nombre de pas en moins et une réduction de moitié du temps de marche. Les travaux récents ont complété ces données en prenant en compte les disparités nationales (
via des études multicentriques), l’intensité des activités physiques pratiquées et la sévérité de la BPCO. Il est ainsi établi que la réduction d’activité physique concerne toutes les intensités possibles (depuis les efforts les plus modestes aux intensités d’exercice les plus élevées) ; les patients atteints de BPCO pratiquent une quantité d’activité physique d’intensité légère, modérée ou élevée
3
Les intensités des activités physiques sont définies ici en fonction d’un multiple du METs (le METs est un équivalent énergétique correspondant à une dépense énergétique de repos). Une activité physique sera qualifiée de légère à partir d’une intensité de 2,5 METs, de modérée à partir de 3,6 METs et élevée au-delà de 6 METs.
se situant respectivement à 50 %, 36 % et 34 % de ce que font des sujets sains d’âge équivalent (Troosters et coll., 2010

). Des résultats comparables sont obtenus avec une méthode différente reposant sur un ratio entre la dépense énergétique totale de la journée et la dépense énergétique nocturne (Watz et coll., 2009

). Cette méthode permet de définir des patients actifs quand ce ratio (appelé NAP pour Niveau d’Activité Physique) est supérieur à 1,7, sédentaires quand il est compris entre 1,4 et 1,69 et très inactifs quand il est inférieur à 1,4 (Black et coll., 1996

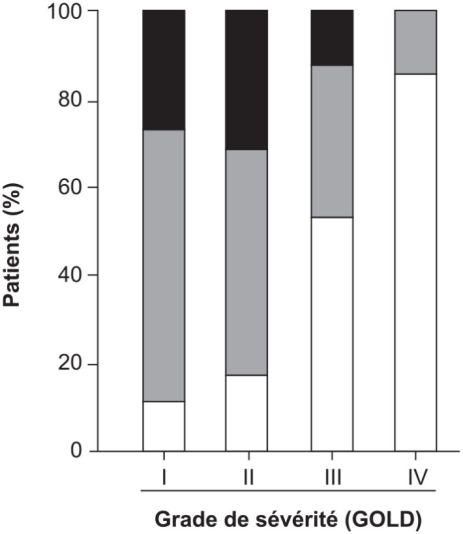
). L’impact de la sévérité de la pathologie sur l’activité physique est également un élément majeur : la proportion de patients très inactifs augmente avec l’importance de l’obstruction bronchique. Seulement 10 % des patients présentant une sévérité de grade III sont considérés comme actifs et aucun au grade IV (selon la classification GOLD
4
Ces niveaux de sévérités sont définis à partir d’un groupement international de consensus (GOLD pour Global initiative for Chronic Obstructive Lung Disease) ayant donné son nom à ces classifications. Les classes de I à IV sont basées sur la sévérité croissante de l’obstruction bronchique.
, ce grade est caractérisé par l’obstruction bronchique la plus importante ; figure 13.2

). Des résultats similaires sont retrouvés avec une mesure objective du nombre de pas : en fonction de la gravité de la BPCO (du grade I au grade IV), le nombre de pas réalisés quotidiennement se situe respectivement à 87, 70, 49 et 29 % de ce que font les sujets sains de même âge. Par conséquent, les patients atteints de BPCO réduisent d’autant plus leur activité physique que leur pathologie est sévère. Sur un plan plus qualitatif, le niveau d’activité physique d’intensité modérée est réduit de 47 % chez les patients atteints de BPCO de grade I jusqu’à 78 % pour le grade IV. Il est important de mentionner que les exacerbations, fréquemment rencontrées chez les patients atteints de BPCO, sont caractérisées par des baisses importantes d’activité physique (Alahmari et coll., 2016

), tout spécialement chez les patients les plus sévères. Au total, la littérature fait clairement ressortir que les patients BPCO les plus sévères seront ceux qui réaliseront le moins d’activité physique au jour le jour, avec une inactivité sévère extrêmement préoccupante.
Ces données sont d’une importance capitale car les recommandations internationales insistent sur la nécessité de pratiquer des activités physiques d’intensité suffisante pour avoir un impact bénéfique sur la santé. Les patients atteints de BPCO seront donc d’autant plus éloignés de ces recommandations que l’activité physique demandée est intense et leur maladie sévère.
Les recommandations de l’Organisation mondiale de la santé (OMS, Recommandations mondiales sur l’activité physique pour la santé, 2010

) ou de l’Office de Prévention des maladies et de la Promotion de la Santé (ODPHP,
Physical Activity Guidelines for Americans, 2008

) font en effet ressortir que des activités modérées ou vigoureuses sont nécessaires pour obtenir un impact positif sur la santé (au moins 150 minutes par semaine d’intensité modérée ou 75 minutes par semaine d’intensité vigoureuse ou toute combinaison équivalente...). D’autres recommandations sont proposées en fonction du nombre de pas réalisés chaque jour qui permettent de classer les individus actifs (à partir de 10 000 pas/jour), faiblement à peu actifs (entre 5 et 10 000 pas/jour) et sédentaires (moins de 5 000 pas/jour).
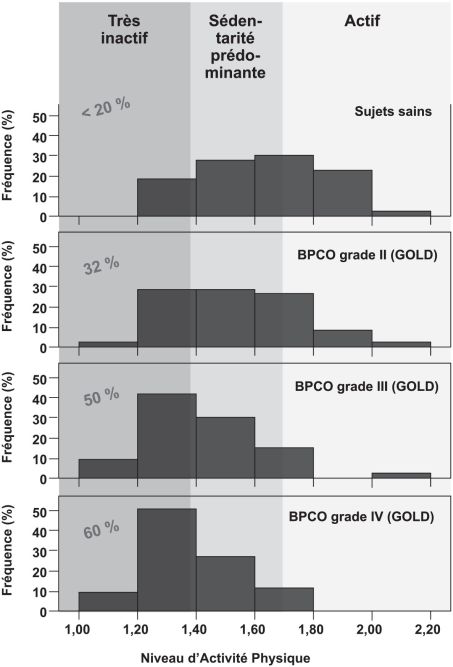
Il est ainsi très instructif de reprendre les études de la littérature et, au-delà des différences statistiques par rapport aux sujets sains, de regarder comment les patients BPCO se situent au regard de ces recommandations basées sur le nombre de pas ou sur la dépense énergétique quotidienne. Le constat est sans surprise : les patients atteints de BPCO n’atteignent que rarement les recommandations, et cet écart est d’autant plus important que la pathologie est sévère (figure 13.3

), et ce quelles que soient les variables de mesure de l’activité physique retenues (Troosters et coll., 2010

; Walker et coll., 2008

; Waschki et coll., 2012

; Watz et coll., 2009

). Les patients ayant une BPCO de grade IV ont des niveaux d’activité physique bien en deçà des minimas requis pour se maintenir en bonne santé (Troosters et coll., 2010

; Watz et coll., 2009

). À titre d’exemple, le taux de patients atteints de BPCO très inactifs est de 32 % quand la sévérité est de grade II, et ce taux est quasiment doublé quand la BPCO devient sévère (grade IV). Les impacts d’une faible activité physique chez ces patients sont multiples et préoccupants : hyperinflation dynamique (Garcia-Rio et coll., 2009

), augmentation des exacerbations et des hospitalisations (Benzo et coll., 2010

; Garcia-Aymerich et coll., 2008

; Garcia-Rio et coll., 2012

) et risque accru de la mortalité comme présenté précédemment. Une étude épidémiologique remarquable, menée chez plus de 6 560 sujets (issus d’une population générale, c’est-à-dire non spécifiquement à risque de développer une BPCO) suivis sur une période de 16 ans en moyenne, a permis de compléter les connaissances de l’impact de l’activité physique sur l’histoire naturelle de la BPCO (Garcia-Aymerich et coll., 2008

). Ces auteurs ont classé les sujets suivis selon 3 niveaux de pratique d’activité physique : faible, modérée et élevée (sur la base de questionnaires
5
Classification réalisée sur la base du questionnaire de Saltin et Grimby (1968)

:– activité physique faible : moins de 2 heures par semaine d’activité physique légère (marche, vélo...) ;– activité physique modérée : entre 2 et 4 heures d’activité physique légère par semaine ;– activité physique élevée : plus de 4 heures d’activité physique légère par semaine ou entre 2 et 4 heures par semaine d’activité physique plus intense et/ou pratique compétitive d’un sport.
). Ces auteurs ont ainsi mis en évidence que l’activité physique réduisait le risque d’apparition de la BPCO. Les personnes pratiquant une activité physique modérée à élevée présentaient une diminution significative du risque de développer une BPCO comparativement au groupe ayant une faible activité physique régulière (
odd ratio [OR] = 0,76). Le niveau de pratique apparaît avoir un impact considérable sur le rythme de déclin de la fonction respiratoire ; quand le VEMS déclinait d’environ 28 mL/an dans le groupe de sujets ayant une faible qualité d’activité physique, cette altération était réduite de 6,5 et 10,2 mL/an dans les groupes ayant une activité physique modérée et élevée. Au regard de la méthodologie utilisée, il est donc pertinent de penser qu’augmenter de façon relativement minime sa quantité d’activité physique habituelle permettrait d’obtenir des résultats positifs sur l’évolution de la BPCO, en termes de ralentissement du déclin de la fonction respiratoire, de diminution du nombre d’hospitalisations et de mortalité (2 heures d’activité physique légère par semaine représentent de fait environ 17 minutes/jour et il suffit de doubler cette quantité pour être dans le groupe activité physique modérée). En revanche, une réduction significative des hospitalisations ne s’observe que pour un niveau d’activité physique élevé : seuls les patients atteints de BPCO ayant un niveau d’activité physique élevé présentaient une réduction significative du risque relatif (RR = 0,68 vs 1,10 pour les patients avec un niveau d’activité physique modéré seulement).
Si l’activité physique, véritable pierre angulaire de la réhabilitation respiratoire, a des effets parfaitement reconnus sur les déterminants de la tolérance à l’effort et sur les symptômes de la maladie, il est également important de savoir si elle permet de modifier les comportements des patients atteints de BPCO vis-à-vis de leur activité physique quotidienne. Une méta-analyse a été réalisée à ce sujet (Ng et coll., 2012

) et a recensé 2 essais cliniques randomisés et 5 études interventionnelles (aucun essai randomisé contrôlé) totalisant un suivi de 419 patients sur une période allant jusqu’à 6 mois. Cette publication a par ailleurs uniquement retenu les études ayant réalisé un suivi objectif de l’activité physique à l’aide d’un accéléromètre ou d’un pédomètre. Le résultat majeur de cette méta-analyse est de mettre en évidence un effet significatif de la réhabilitation respiratoire sur l’augmentation de l’activité physique spontanée des patients atteint de BPCO, malgré un effet de taille assez modeste (0,14 ; p = 0,04). Cependant, des progrès doivent encore être réalisés pour accroître l’activité physique chez ces patients, tant ses bénéfices sont importants. Il conviendrait donc de pouvoir disposer de suivis de patients sur le long terme et d’essais randomisés contrôlés de bonne qualité.
Au total, la question sur le niveau d’activité physique des patients BPCO est extrêmement bien documentée, avec des méthodologies de qualité et des périodes de suivi significatives. L’ensemble des données collectées montre clairement que l’activité physique a un impact majeur sur la réduction du risque d’évolution de la BPCO et de ses conséquences en termes d’exacerbations, d’hospitalisations, de mortalité et de réduction des symptômes. Ces effets sont suffisamment francs pour être observés quelles que soient les techniques de mesure de l’activité physique. Ces résultats très positifs au regard des faibles niveaux d’activité physique constatés des patients atteints de BPCO font de l’adoption d’une activité physique quotidienne pérenne un enjeu de toute première importance.
Évaluation des adaptations à l’exercice
Concernant les risques liés à la pratique, deux méta-analyses confirment que la réhabilitation respiratoire et par conséquent l’activité physique ne sont pas associées à une augmentation de la mortalité (Kruis et coll., 2013

; Peytremann-Bridevaux et coll., 2014

). La seule exception à cette littérature homogène est un travail de 2016 d’une équipe danoise qui a rapporté une mortalité accrue dans un groupe de 15 patients atteints de BPCO ayant été soumis à un entraînement à haute intensité (Schaadt et coll., 2016

). Au-delà de l’effectif réduit des patients, les entraînements utilisés s’apparentaient davantage à des pratiques menées jusqu’à l’épuisement
6
Très précisément une pratique à 95 % de šVO2pic maintenue aussi longtemps que possible.
qu’à des entraînements à hautes intensités classiques, c’est-à-dire caractérisés par des intensités très élevées, mais maintenues sur des temps courts. La méthodologie de ce travail ne permet donc pas de remettre sérieusement en cause les données des méta-analyses disponibles.
Dans un souci de sécurité et de justesse de la prescription, les recommandations actuelles demandent que la pratique d’une activité physique, comme dans le cas d’une réhabilitation respiratoire, puisse être précédée par une évaluation à l’exercice, au moyen, par exemple, d’une épreuve d’effort cardiorespiratoire (
American Thoracic et American College of Chest, 2003

). Les objectifs de cette évaluation sont d’individualiser l’intensité de la pratique, de détecter le cas échéant un besoin de supplémentation aiguë en oxygène, de vérifier l’absence de contre-indication(s) et d’identifier les facteurs liés à la limitation à l’exercice (Spruit et coll., 2013

). Le recours à l’épreuve d’effort maximale n’est toutefois pas toujours possible et l’un des tests les plus utilisés dans le domaine de la BPCO est le test de marche de six minutes : il donne de façon simple des informations capitales en termes de tolérance à l’exercice. Deux autres tests sont également utilisés dans le cadre de la BPCO : le test navette incrémental (ISWT ; test au cours duquel la vitesse est progressivement augmentée au moyen de signaux sonores pré-enregistrés) et le test navette d’endurance (ESWT) qui consiste à mesurer le temps d’endurance à un pourcentage donné de la performance mesurée au ISWT. Si le test de 6 minutes est auto-calibré et d’intensité relativement constante, l’ISWT est un test progressif qui se rapproche fortement du type de sollicitation de l’épreuve d’effort maximale ; il est donc important de vérifier auparavant l’absence de contre-indication à un test de terrain maximal. Le choix de l’un ou l’autre de ces tests dépendra des conditions de passation disponibles (notamment de l’espace disponible pour la réalisation du test), mais également de la volonté que l’évaluateur aura d’individualiser un entraînement à partir des résultats obtenus. De ce point de vue, l’ISWT est plus pertinent pour programmer des intensités relatives en pourcentage de la vitesse de marche atteinte en fin du test. Si leurs qualités métrologiques sont considérées relativement équivalentes, l’ISWT/ESWT bénéficie d’une plus grande sensibilité aux changements après une réhabilitation respiratoire (Holland et coll., 2014

) probablement en raison d’un effet plafond moins évident sur un test de nature incrémentale
versus auto-calibré comme le test de marche de 6 minutes et imposant une interdiction de courir. La littérature insiste cependant sur la nécessité de parfaitement respecter les conditions de passation de ces tests de terrain, quel que soit le choix du test qui sera opéré (
American Thoracic Society, 2002

; Holland et coll., 2014

).
D’autres tests plus récents évaluent la tolérance à l’exercice et/ou l’équilibre dynamique, mais ils sont nettement moins renseignés que les tests précédents. Leurs intérêts sont généralement d’être rapides, peu coûteux et réalisables par des patients présentant des altérations importantes de leur adaptation à l’exercice. Parmi ceux-ci, on peut citer notamment les tests :
sit-to-stand (Jones et coll., 2013

),
4-m gait speed (Kon et coll., 2013

) et
timed up and go (Mesquita et coll., 2016

).
Au-delà de leur capacité cardiorespiratoire ou de leur tolérance à l’effort intrinsèque, les patients atteints de BPCO présentent une spécificité qui peut modifier grandement leur capacité à réaliser un exercice physique : une éventuelle désaturation aiguë à l’exercice qui peut en effet survenir chez des patients normoxiques au repos. Si l’oxygénothérapie de longue durée (destinée aux BPCO chroniquement hypoxémiques) a fait l’objet de multiples études de validation, la supplémentation aiguë en oxygène reste un sujet encore très controversé, probablement en raison de la variabilité interindividuelle des réponses à ces supplémentations. En effet, il a été mis en évidence qu’à même niveau de correction de la saturation en oxygène (SaO
2), près d’un tiers des patients atteints de BPCO présentaient une réponse délétère paradoxale à la supplémentation aiguë en oxygène, tant du point de vue des adaptations ventilatoires et cardiaques que de leur tolérance à l’effort qui diminuait (Heraud et coll., 2008

). Bien que cette technique soit associée à des résultats très contradictoires, l’usage de la supplémentation en oxygène au cours de la pratique physique est encore souvent proposé, soit pour corriger des désaturations aiguës au cours de l’exercice, soit pour tenter d’optimiser les effets de l’entraînement. Toutefois, une méta-analyse menée sur le sujet (Nonoyama et coll., 2007

) montre clairement que l’entraînement sous oxygène des patients présentant une désaturation d’exercice ne joue pratiquement aucun rôle significatif sur la tolérance à l’exercice et sur les effets de la réhabilitation. Par conséquent, la supplémentation en oxygène mérite d’être réservée aux besoins de correction des désaturations transitoires à l’exercice.
Bénéfices des différentes modalités d’activité physique
Entraînements en endurance
Historiquement, les objectifs prioritaires de l’intervention ont porté sur l’amélioration de la capacité aérobie afin d’augmenter la tolérance à l’effort et réduire les symptômes délétères majeurs comme la dyspnée et la fatigue (Prefaut et coll., 1995

). Les entraînements en endurance ont donc logiquement été abordés dans les premières méta-analyses qui ont attesté de leur efficacité (Lacasse et coll., 1996

; Salman et coll., 2003

; Puhan et coll., 2009

). Peu d’informations nouvelles sont disponibles sur ce sujet, si ce n’est un travail récent mettant en évidence un effet plus important de la marche comparé aux entraînements sur cycloergomètres (Leung et coll., 2010

). L’efficacité des entraînements en endurance est maintenant reconnue et de nouvelles modalités sont maintenant proposées, soit dans un but d’optimisation des effets de la pratique physique, soit pour atteindre des buts spécifiques, soit pour tenter de réduire des difficultés rencontrées dans la mise en pratique des entraînements.
Entraînements fractionnés
Les entraînements fractionnés ont été proposés pour permettre de rendre la pratique possible chez des patients qui avaient de réelles difficultés à réaliser des séances complètes en raison de leur dyspnée et/ou de leur fatigue. Bien que leur réalisation non supervisée reste difficile lors du retour à domicile et que ces entraînements soient principalement réalisables sur cycloergomètres, ces méthodes alternatives à l’entraînement en endurance classique (continu) ont fait l’objet de nombreux travaux.
Pour maintenir une quantité de pratique comparable (produit du temps et de l’intensité) en réduisant la durée d’une séance, il a été proposé d’intercaler de courtes périodes à haute intensité (pics) entre des phases de pratiques à plus basse intensité (bases). Il est ainsi théoriquement possible de réduire les symptômes pour des intensités d’entraînement pourtant temporairement supérieures (Vogiatzis et coll., 2002

). Une revue systématique et une méta-analyse ont recensé 8 essais cliniques randomisés (soit 388 patients) dont 6 qui présentaient des protocoles dans lesquels la quantité de pratique était équivalente entre les 2 groupes. Aucun effet différentiel entre les entraînements continus ou fractionnés n’est obtenu (Beauchamp et coll., 2010

; Zainuldin et coll., 2011

) tant sur des variables liées à la capacité aérobie [différences moyennes obtenues entre les différentes techniques de l’ordre de 40 et 10 mL.min
-1 pour la consommation maximale d’oxygène symptôme-limitée (V̇O
2pic) et le seuil ventilatoire respectivement et de 1 W pour la puissance pic (Wpic
7
Wpic : puissance maximale développée lors d’une épreuve d’effort cardiorespiratoire maximale. Formellement, Wpic est la puissance à laquelle le sujet est à sa šVO2pic.
)], sur la tolérance à l’effort (4 m sur le test de marche de 6 min), sur la qualité de vie, que sur la proportion des abandons en cours d’entraînement. Il est toutefois important de noter qu’il existe une extrême hétérogénéité dans la construction des fractionnés. En effet, selon les travaux, les intensités des pics variaient de 80 à 150 % de Wpic. De même, les intensités des bases variaient entre 30 et 75 % de Wpic. Des écarts tout aussi importants étaient retrouvés sur la durée des bases, mais surtout de celle des pics qui pouvaient durer de 30 secondes à 3 minutes. Une analyse plus fine des résultats montre que la réduction des symptômes (notamment la dyspnée) lors des fractionnés n’existe que si la durée des pics est proche de 30 s. En les prolongeant au-delà, les effets positifs des fractionnés sur les symptômes au cours de la pratique disparaissent de façon totalement contreproductive.
Concernant les aspects structuraux du muscle, une revue systématique récente suggère que les entraînements fractionnés à haute intensité seraient particulièrement efficaces pour réduire la proportion des fibres de type IIb (les plus glycolytiques et dont la mise en jeu provoquera une sur-stimulation des centres respiratoires au cours de l’exercice et donc une dyspnée d’exercice majorée) et pour stimuler les voies de l’anabolisme musculaire, mais cela n’est pas encore vérifié par des essais randomisés contrôlés (De Brandt et coll., 2016

).
Au total, les entraînements fractionnés induisent des résultats très superposables aux entraînements continus. La meilleure tolérance aux entraînements fractionnés n’est vérifiée que pour des durées des pics contenues à une trentaine de secondes. Par conséquent, et compte tenu de la difficulté de poursuivre ces techniques d’entraînement à domicile, les fractionnés doivent être réservés aux patients tolérant mal les entraînements continus ou comme une alternative destinée à varier les modalités de pratiques pour rendre les entraînements moins ennuyeux, moins répétitifs.
Hautes versus basses intensités
L’étude comparative des entraînements hautes intensités versus basses intensités a surgi du besoin d’induire des effets significatifs de l’entraînement dans des cas où les pratiques longues pouvaient poser problème en raison soit de l’émergence de dyspnée trop importante, soit du temps qui peut être raisonnablement accordé à la pratique d’une activité physique. L’idée est très simple : pour assurer une quantité d’entraînement identique mais sur un temps plus court, il convient d’augmenter l’intensité de l’activité.
Très peu de travaux sont disponibles et tous n’ont pas contrôlé la quantité de travail réalisée dans chacune des 2 modalités. Une revue
Cochrane a toutefois été publiée et a mis en évidence des effets différentiels assez limités entre les 2 techniques (Zainuldin et coll., 2011

) ; les entraînements à haute intensité (réalisés à 80 % de Wpic
versus 50-60 % de Wpic pour les entraînements à plus faible intensité) induisent des effets plus marqués sur la diminution des taux de lactate sanguin (après entraînement, la lactatémie à même intensité d’exercice est inférieure de 1,7 mmol.L
-1 dans le groupe haute intensité par rapport au groupe basse intensité) et sur la diminution de la ventilation pour un niveau de travail donné (en moyenne le groupe s’étant entraîné à haute intensité aura une économie ventilatoire significativement plus importante que les patients de l’autre groupe, d’environ 6 L.min
-1). Par conséquent, si les entraînements à haute intensité semblent plus efficaces sur les déterminants de la dyspnée lors d’activités de la vie journalière, il faut toutefois garder à l’esprit que ces données sont obtenues sur un nombre relativement limité de travaux (3 études recensées pour un total de 231 patients). À l’inverse, aucun effet significatif n’est obtenu pour les paramètres maximaux (Wpic ou lactatémie maximale) : ils évoluent de façon similaire entre les deux modalités.
Les entraînements à haute intensité peuvent donc être utilisés en raison d’une efficacité comparable voire légèrement supérieure aux entraînements à basse intensité. Leur intérêt reste évidemment une réduction du temps de pratique pour une efficacité comparable ou supérieure sur la dyspnée et une variation possible dans les modalités de pratique pour éviter des techniques d’entraînement trop monotones et répétitives.
Entraînement en force
Parmi les atteintes extra-pulmonaires de la BPCO, la dysfonction musculaire (perte de masse musculaire et de force) est une des plus préoccupantes. En effet, selon les travaux, elle concerne de 30 à 70 % des patients atteints de BPCO et touche tous les niveaux de sévérité (Seymour et coll., 2010

). Les conséquences sur le plan fonctionnel sont évidentes (augmentation de la fatigue, de la dyspnée et du risque de chute, faible adaptabilité aux efforts même légers, etc.). De plus, la dysfonction musculaire est aujourd’hui prise très au sérieux depuis la publication de deux travaux mettant en évidence qu’à même niveau d’obstruction bronchique, la perte de masse musculaire ou de force est associée à une mortalité significativement et dramatiquement plus élevée (Marquis et coll., 2002

; Swallow et coll., 2007

). Enfin, sur un plan physiopathologique et au-delà de la perte de masse musculaire, la faiblesse musculaire apparaît également liée à des altérations corticales impactant directement le cortex moteur primaire. Il existe en effet chez les patients atteints de BPCO une réduction de l’excitabilité corticale qui se traduit lors des contractions maximales et sous-maximales volontaires par une sous-activation du cortex moteur primaire (Alexandre et coll., 2014

et 2016

). Ces altérations sont cohérentes avec de multiples travaux mettant en exergue des altérations anatomiques corticales importantes dans la BPCO, notamment une diminution de la densité de substance grise et blanche (Ryu et coll., 2013

; Zhang et coll., 2013

). Toutefois, la mise en évidence des facteurs corticaux dans la faiblesse musculaire est extrêmement récente et les effets de la pratique physique sur la sous-activation du cortex moteur lors de production de force volontaire ne sont pas encore connus.
Si l’entraînement en endurance est capable de corriger partiellement la faiblesse musculaire, la nécessité de proposer des techniques plus spécifiques de renforcement musculaire s’est donc progressivement imposée. Une revue systématique s’est focalisée sur les effets différentiels entre les entraînements en endurance et en force (O’Shea et coll., 2009

). Les données ont été collectées sur 18 essais randomisés contrôlés pour un total de 543 patients. Les méthodes de renforcement musculaire sont très hétérogènes en termes de durée (de 6 à 26 semaines), de structuration d’une séance de renforcement musculaire (2 à 4 séries par séance et de 8 à 12 répétitions par série), et d’intensité (de 32 à 90 % du 1-RM
8
Le 1-RM (pour 1-Repetition Maximal) correspond à la charge qu’un groupe musculaire ne peut mobiliser qu’une seule fois.
). Malgré ces différences non négligeables, la revue systématique montre que le renforcement musculaire induit des effets comparables aux entraînements en endurance sur la consommation maximale d’oxygène des patients (V̇O
2pic), la distance au test de marche de 6 minutes, la densité minérale osseuse, la qualité de vie et l’anxiété. Les effets différentiels en faveur du renforcement musculaire sont spécifiques sur la force des fléchisseurs et extenseurs du genou ainsi que sur divers tests reliés à des activités de la vie journalière (test de montée des marches, élévation des bras,
sit to stand), avec des effets considérés comme modérés à importants
9
Les données fournies étant des différences moyennes standardisées (DMS), l’unité des variables testées disparaît. L’importance de l’effet est donc considérée comme faible, modérée ou importante selon la valeur de la DMS (respectivement : < 0,2, comprise entre 0,2 et 0,8 et supérieure à 0,8).
selon les variables testées. De façon assez surprenante, les résultats sont inconstants sur la prise de masse musculaire. Il semble que les effets dépendent fortement des intensités d’entraînement et que leur expression sur les voies de la synthèse protéique soit émoussée chez les patients cachectiques (De Brandt et coll., 2016

). La même variabilité des résultats est obtenue dans les études portant sur les modifications structurales avec une réduction non systématique du pourcentage de fibres IIb (De Brandt et coll., 2016

). La principale raison invoquée reste l’extrême hétérogénéité des méthodes utilisées.
Par ailleurs, le renforcement musculaire a un effet sur la capacité vitale forcée qui serait expliqué par une diminution de l’hyperinflation dynamique (Strasser et coll., 2013

).
L’ensemble de ces résultats est obtenu dans un contexte d’excellente adhésion à ces programmes.
Au total, le renforcement musculaire permet d’augmenter de façon spécifique la force musculaire, sans modification majeure de prise de masse musculaire. Il permet également d’améliorer l’adaptabilité aux activités de la vie journalière. Son utilisation en complément des entraînements en endurance est donc tout à fait pertinente. Il conviendrait toutefois de mieux cerner les modalités de pratiques répondant spécifiquement aux conditions d’efficacité des entraînements en force. De même, les impacts potentiels de l’activité physique sur la réduction de la sous-activation corticale des aires motrices impliquée dans la faiblesse musculaire, demandent encore à être spécifiquement évalués.
Pratique d’activités terrestres versus activités aquatiques
Si par le passé il a pu être redouté que l’augmentation du retour veineux et la compression thoracique lors de l’immersion pouvaient engendrer un travail cardiaque et pulmonaire trop élevé, la pratique d’activités physiques en milieu aquatique (hors natation) est considérée à l’heure actuelle comme sûre, et présente un certain nombre d’intérêts spécifiques : la flottabilité permet de compenser les problèmes de masse corporelle chez des patients atteints de BPCO en surpoids ou obèses, la résistance à l’avancée dans l’eau augmente le travail musculaire lors des déplacements et la chaleur (quand la pratique a lieu en piscine chauffée) augmente le débit sanguin musculaire. L’intérêt ludique de ces pratiques est également à souligner. Une méta-analyse a récemment mis en évidence l’efficacité comparée de ce type de pratique comparé aux activités physiques terrestres. À durée équivalente, les activités physiques en milieu aquatique améliorent significativement plus les capacités d’exercice (tolérance à l’effort et endurance), et ce dans des proportions parfois considérables : la distance parcourue évaluée par le test d’endurance ESWT est améliorée en moyenne de 313 mètres de plus dans le groupe ayant pratiqué dans l’eau,
range 232-394 m. Elles améliorent également la composition corporelle (rapport masse grasse/masse maigre) et la qualité de vie (McNamara et coll., 2013

). La pratique en milieu aquatique est préférée par 49 % des patients (36 % préférant pratiquer sur terre et 15 % ne manifestant aucune préférence). Enfin, aucun événement indésirable sérieux n’est rapporté, confirmant que ce type de pratique est parfaitement compatible avec la BPCO.
Les pratiques d’activités physiques aquatiques sont donc non seulement bien tolérées par les patients, mais elles induisent des effets particulièrement intéressants au regard du temps de pratique par rapport aux activités terrestres. L’adhésion des patients est excellente et les activités aquatiques permettent donc de proposer des modalités de pratique efficaces, ludiques et variées.
Entraînement des membres supérieurs
Bien que les membres supérieurs puissent être sollicités lors des techniques décrites précédemment, il est important de les citer spécifiquement. Les patients atteints de BPCO rencontrent fréquemment des problèmes dans des activités de la vie journalière (AVJ) comme l’habillement, les tâches ménagères... Il n’existe pas vraiment de techniques d’entraînement en endurance ou en force spécifiques des membres supérieurs. Il convient toutefois de citer l’importance d’inclure dans les programmes d’activités physiques des sollicitations des biceps, triceps, deltoïdes, pectoraux et grands dorsaux. Une revue systématique d’actualisation (Janaudis-Ferreira et coll., 2009

) a rassemblé toutes les formes d’entraînement des membres supérieurs qu’elles soient de type «
supported » (exercice des membres supérieurs sur cyclo-ergomètres à bras) ou «
unsupported » (manipulation de charges, jets de balles lestées, etc.). Les fréquences d’entraînement et leurs durées étaient très variables selon les travaux référencés. Ainsi, la nature exacte des sollicitations musculaire et métabolique est quasiment impossible à connaître. Il n’est donc pas surprenant que cette revue systématique soit peu conclusive avec des résultats inconstants sur l’augmentation de performance des membres supérieurs, sur la diminution de la dyspnée dans les activités de la vie quotidienne et sur la qualité de vie. Depuis, une méta-analyse a inclus des travaux postérieurs à la revue systématique de Janaudis-Ferreira, qui sont principalement des études sur les entraînements de type
unsupported (Pan et coll., 2012

). Cette méta-analyse met en évidence un effet significatif de ces entraînements sur la dyspnée et la fatigue rencontrées au cours des AVJ. Toutefois, les améliorations restent en deçà du seuil de différence minimale clinique significative (MCID). La conclusion de cette étude est donc de révéler l’existence d’une réduction de la fatigue et de la dyspnée lors des AVJ, mais sans en garantir une preuve clinique. La poursuite de ces travaux est indispensable afin de déterminer l’existence ou non d’effets cliniques, notamment en étudiant plus spécifiquement la dyspnée lors de situation
isowork10
Les études réalisées sur des conditions isowork consistent à étudier les adaptations au cours d’un exercice à une intensité donnée sous-maximale, identique avant et après entraînement. L’intérêt de ces protocoles est de fournir des données précieuses sur la tolérance à l’effort au cours de tâches de la vie journalière dont l’intensité absolue varie peu dans le temps.
. De même, il conviendrait d’avoir sur ces travaux une attitude plus cohérente sur les méthodes utilisées et faire des distinctions claires entre les entraînements à dominante force ou endurance, seul moyen de dépasser l’imprécision des effets induits. En effet, parmi les derniers travaux réalisés sur le sujet, lorsque le travail accompli est réellement du renforcement musculaire, il induit des effets significatifs sur la force musculaire et la capacité d’exercice des membres supérieurs et il réduit la dyspnée et la fatigue des bras lors des exercices de musculation (Calik-Kutukcu et coll., 2017

). Mais le plus important réside dans les adaptations au cours des AVJ : il existe effectivement une diminution de la dyspnée et une augmentation de la performance et la satisfaction des patients au cours de celles-ci (Calik-Kutukcu et coll., 2017

), probablement en raison d’une commande centrale ventilatoire réduite (Romagnoli et coll., 2013

).
Au total, la littérature sur l’intérêt spécifique de l’entraînement des membres supérieurs est encore très contradictoire, probablement plus en raison de profondes différences des approches proposées que d’une absence d’efficacité. L’entraînement des membres supérieurs modifierait la commande ventilatoire qui expliquerait la réduction de la dyspnée lors des exercices. Ces améliorations fonctionnelles nécessitent toutefois un véritable travail spécifique de renforcement musculaire.
Souplesse
L’entretien et le développement de la souplesse sont généralement conseillés dans les pratiques physiques chez le patient atteint de BPCO. Son intérêt spécifique réside dans le couplage entre la respiration et la posture. À notre connaissance, il n’existe toutefois aucune étude clinique qui ait pu mettre en évidence l’efficacité ciblée et spécifique de ces exercices qui restent toutefois conseillés dans les recommandations sous un angle de bon sens. Le but est de réaliser des étirements doux sur l’ensemble des groupes musculaires du tronc, des membres supérieurs et inférieurs, de façon à minimiser le cas échéant des déformations ou des rigidités susceptibles d’altérer la mécanique ventilatoire et d’augmenter le coût de la respiration des patients atteints de BPCO (Spruit et coll., 2013

).
Entraînement des muscles inspiratoires
La nature des entraînements des muscles inspiratoires (EMI) est très particulière car assujettie à l’usage de valves externes utilisées pour créer les résistances lors de l’inspiration. De plus, le travail réalisé est limité aux seuls muscles inspiratoires. Cet aspect est donc marginal par rapport au spectre de cette expertise collective, mais les problèmes respiratoires spécifiques à la BPCO méritent que cette partie ne soit pas complètement délaissée. En effet, les patients atteints de BPCO génèrent des forces inspiratoires maximales inférieures à la normale, en raison de l’hyperinflation pulmonaire qui place le diaphragme dans une position défavorable en termes de production de force, en raison des effets délétères des corticoïdes sur la fonction musculaire, voire d’un état de dénutrition. Les répercussions fonctionnelles sont significatives car cela augmente la dyspnée et impacte négativement la tolérance à l’effort. Il existe une liste déjà longue de méta-analyses ou revues systématiques sur le sujet et leurs conclusions sont généralement assez contrastées et de portée clinique souvent assez discutée par les auteurs eux-mêmes. Les résultats hétérogènes sont probablement liés à des difficultés méthodologiques conséquentes dont les deux principales sont :
• les différentes techniques de valves utilisées (valves résistives dont la résistance sera dépendante du débit inspiratoire généré et valves à seuil pour l’essentiel) ;
• les techniques de mesure qui sont très fortement dépendantes de la compliance du patient et pour certaines, très manipulateur-dépendantes.
Les revues systématiques les plus récentes montrent toutefois que l’EMI isolé permet d’obtenir des effets sur la force et l’endurance des muscles inspiratoires (Geddes et coll., 2008

; Gosselink et coll., 2011

; O’Brien et coll., 2008

). Il est également possible de réduire la dyspnée au cours des AVJ, d’améliorer la performance au test de marche mais cette technique reste sans effet sur la V̇O
2pic (Geddes et coll., 2008

) et les gains de qualité de vie sont minimes. Utilisée en complément des entraînements classiques (corps entier), l’EMI n’apporte pas d’effets additionnels sur la capacité d’exercice ou la dyspnée et ses effets restent limités aux muscles inspiratoires. Enfin, la méta-analyse de Gosselink et coll. (2011

) indique que le renforcement musculaire des muscles respiratoires est plus efficace que leur entraînement en endurance et que les patients les plus faibles sont ceux qui bénéficient le plus de ces techniques. Au total, les recommandations de sociétés savantes comme l’
American Thoracic Society et l’
European Respiratory Society restent mesurées sur l’intérêt de l’ajout des EMI aux entraînements classiques et préfèrent les conseiller aux sujets dont la faiblesse des muscles inspiratoires les rend peu aptes à réaliser des programmes de réentraînement à l’effort (Spruit et coll., 2013

).
Au total, l’EMI semble trouver sa place dans des contextes très particuliers de faiblesse importante des muscles inspiratoires mais demande à être considéré avec prudence dans la mesure où les effets seront forcément limités dans le temps (Weiner et coll., 2004

) et une continuité de ce type de pratique en dehors des centres de réhabilitation est assez peu crédible. Enfin, l’ajout de charges inspiratoires doit être utilisé de façon mesurée en raison d’un risque important de lésions des sarcomères musculaires des patients atteints de BPCO, particulièrement sensibles aux charges inspiratoires (Orozco-Levi et coll., 2001

).
Tai Chi
Le Tai Chi est à l’origine un art martial ancien développé en Chine. C’est également une pratique associant le corps et l’esprit, enracinée dans la culture et la philosophie chinoises. Il connaît depuis de nombreuses années un succès croissant en occident et est souvent présenté comme une alternative à l’exercice, avec un objectif d’amélioration de la santé. La Tai Chi est basé sur la succession de mouvements circulaires lents et contrôlés (impliquant la totalité du corps et souvent dans une position de semi-squat), associés à une concentration importante et un contrôle respiratoire constant. Il existe de nombreuses formes différentes de Tai Chi qui rendent parfois complexe une analyse systématique de son intérêt et la comparaison des essais cliniques randomisés. En effet, les postures peuvent être différentes en fonction des styles utilisés, tout comme leur ordre d’arrivée, la dépense énergétique imposée (fonction de la vitesse d’exécution des mouvements et de l’amplitude articulaires des membres inférieurs)... (Chen et coll., 2007

; Lan et coll., 2002

). Le Tai Chi étant généralement considéré comme un exercice d’intensité légère à modérée (Lan et coll., 2004

), il est même parfois retiré purement et simplement des méta-analyses réalisées sur les effets de l’exercice (McCarthy et coll., 2015

). Pourtant de nombreux travaux ont pu faire la démonstration d’effets positifs importants sur l’état de santé dans de diverses affections chroniques (Chen et coll., 2016

). La littérature scientifique est riche en travaux montrant que des pratiques régulières d’intensité modérée sont capables d’induire des adaptations musculo-squelettiques et cardiovasculaires compatibles avec une amélioration de la santé. Le Tai Chi peut donc être une alternative intéressante pour des patients ayant des difficultés à entrer dans des programmes de prescription de l’exercice musculaire en raison d’une dyspnée trop pénalisante. Il permet notamment un travail important sur le contrôle de la course du diaphragme au cours des différents mouvements et postures. Une amélioration de la fonction pulmonaire est donc possible, bien que ce point ait fait l’objet de controverses importantes (Guo et coll., 2016

).
Depuis quelques années, de nombreuses revues systématiques et méta-analyses ont été publiées sur le sujet, afin de pouvoir évaluer la pratique du Tai Chi en comparaison avec les soins usuels ou la pratique d’exercices musculaires plus traditionnels. Ainsi, sur les 3 dernières années, pas moins de 6 revues systématiques ou méta-analyses ont été publiées sur le sujet, présentant des données synthétiques sur des effectifs compris entre 540 et plus de 1 350 patients. Si le besoin de pouvoir s’appuyer sur des essais cliniques randomisés contrôlés de meilleure qualité est quasi unanimement exprimé, de grandes tendances sont retrouvées. Tout d’abord, les essais cliniques randomisés ne rapportent aucun effet indésirable dans la pratique du Tai Chi (Ngai et coll., 2016

; Yan et coll., 2013

). Cette technique est donc bien tolérée par les patients et les données concernant l’adhésion à la pratique sont excellentes (de 83 à 100 % selon les travaux ; Yan et coll., 2013

). Quand les patients pratiquant le Tai Chi sont comparés à des groupes ne recevant que des soins courants (donc hors réhabilitation respiratoire), toutes les méta-analyses mettent en évidence un effet significatif sur la tolérance à l’effort mesurée par le test de marche de 6 minutes [quelles que soient les méta-analyses, la distance au test augmente en moyenne d’une trentaine de mètres (Chen et coll., 2016

; Ding et coll., 2014

; Guo et coll., 2016

; Ngai et coll., 2016

; Wu et coll., 2014

; Yan et coll., 2013

)] et sur la fonction respiratoire quand celle-ci est rapportée [avec un gain de VEMS de l’ordre de 0,10 L (Ding et coll., 2014

; Guo et coll., 2016

; Ngai et coll., 2016

; Yan et coll., 2013

)]. Cette belle unanimité n’est malheureusement pas retrouvée sur la réduction de la dyspnée et l’amélioration de la qualité de vie des patients qui ne sont pas systématiquement significatives (Chen et coll., 2016

), notamment dans la méta-analyse publiée par la prestigieuse
Cochrane Library (Ngai et coll., 2016

). Par conséquent, si les impacts fonctionnels de la pratique du Tai Chi sont avérés, ses effets sur des variables plus subjectives liées à l’expérience personnelle de la dyspnée et de l’impact de la maladie sur la qualité de vie ne bénéficient pas actuellement d’un niveau de preuve suffisant. Enfin, quand il est comparé à d’autres techniques basées essentiellement sur de l’activité physique d’endurance, le Tai Chi n’induit aucun effet supérieur ou additionnel (Ding et coll., 2014

; Ngai et coll., 2016

) ou alors de façon très marginale (Wu et coll., 2014

).
Au total, le Tai Chi est une technique qui peut parfaitement trouver sa place dans le spectre des techniques d’activités physiques proposées aux patients atteints de BPCO : il ne demande aucun matériel ni infrastructure particulière, est parfaitement toléré par les patients, ne présente aucun effet indésirable et améliore la tolérance à l’effort et la fonction respiratoire de repos. Il sera notamment particulièrement utile pour les patients trop dyspnéiques qui trouveront dans sa pratique des méthodes de contrôle respiratoire et d’utilisation du diaphragme susceptibles d’améliorer leur confort respiratoire. Toutefois, l’extrême variabilité des techniques et postures utilisables en Tai Chi rend encore difficile une vision claire des séances les plus adaptées aux malades respiratoires obstructifs.
Efficacité de l’exercice par rapport aux traitements médicamenteux
Nous avons vu en introduction que depuis les premières méta-analyses, la réhabilitation respiratoire avec le réentraînement à l’effort comme pierre angulaire était le seul traitement ayant une efficacité de grade A sur la tolérance à l’effort, la dyspnée et la qualité de vie notamment. Il existe également une méta-analyse de 2015 qui correspond à une actualisation d’une ancienne version datant de 2006, comparant l’efficacité de la réhabilitation respiratoire (avec au minimum 4 semaines d’entraînement) par rapport aux soins courants (conseil oraux fournis aux patients, optimisation de leur traitement médicamenteux). Les résultats montrent clairement que la réhabilitation respiratoire basée sur la pratique d’activités physiques induit des effets significativement plus importants que les soins usuels et dépassant les différences cliniques minimales significatives (MCID) sur 4 domaines de la qualité de vie mesurée par le CRQ
11
Chronic Respiratory Disease Questionnaire.
(dyspnée, fatigue, fonction émotionnelle, contrôle) et tous les domaines du SGRQ
12
St George’s Respiratory Questionnaire.
(McCarthy et coll., 2015

). Des effets semblables sont obtenus sur la capacité maximale d’exercice et sur les performances au test de marche de 6 minutes et à l’ISWT. Enfin, les programmes semblent avoir été plus efficaces quand ils ont été réalisés en milieu hospitalier.
Recommandations des sociétés savantes et instituts de santé concernant les types de pratiques
Les deux sources de recommandations disponibles sont celles très globales et non spécifiques à la BPCO de l’OMS, et les recommandations de diverses sociétés savantes ou groupes de consensus. Dans la mesure où seules ces dernières sont spécifiques de la BPCO, ce sont sur celles-ci que nous nous appuierons. Les tableaux 13.I

et 13.II

présentent sous forme comparative les principaux éléments de ces recommandations. Elles ont été édictées par l’ATS/ERS (recommandations communes de l’
American Thoracic Society et de l’
European Respiratory Society, Spruit et coll., 2013

), la GOLD (
Global Initiative for Chronic Obstructive Lung Disease, 2017

), la SPLF (Société de Pneumologie de Langue Française, 2010

) et la HAS (Haute Autorité de santé, 2014

).
Sans vouloir aller trop loin dans la comparaison de ces recommandations qui parfois se recoupent mutuellement, il est important de mentionner que ces données sont extraites de la littérature relative à la réhabilitation respiratoire basée sur la pratique d’activités physiques et qu’aucun consensus clair et indiscutable n’existe quant à l’intensité « idéale » de pratique. Cela est essentiellement lié à des visions assez radicalement différentes sur les attentes de la réhabilitation respiratoire. Soit les auteurs cherchent à obtenir les résultats immédiats les plus importants et les intensités les plus élevées seront naturellement favorisées, soit l’objectif est d’obtenir des modifications durables vis-à-vis de la pratique au moyen d’activités physiques régulières dans un climat de contrôle et de plaisir, favorisant l’autogestion par le patient de sa pratique, et des intensités plus basses seront utilisées (Clark et coll., 1996

), souvent basées sur une valeur individualisée au seuil ventilatoire
13
Le seuil ventilatoire est défini par l’intensité à partir de laquelle la relation entre la production de CO2 et la consommation d’oxygène change de pente. Ce point est également caractérisé par une augmentation non linéaire de la ventilation au regard de la puissance d’exercice.
(Vallet et coll., 1997

).
Tableau 13.I Recommandations générales de diverses sociétés savantes sur l’entraînement en endurance – issues de la littérature relative à la réhabilitation respiratoire
| |
ATS/ERS (2013)
|
GOLD (2016) 
|
SPLF (2010  ) |
HAS (2014) 
|
|
Endurance
|
|
Durée totale
|
8 semaines minimum
|
6 semaines minimum. Plus le programme dure, meilleurs seront les résultats. Au moins 28 séances pour éviter des résultats insuffisants
|
4 à 16 semaines
|
6 à 12 semaines ou 20 séances
|
|
Fréquence
|
3 à 5 fois/semaine
|
Journalière à hebdomadaire
|
3 à 5 fois/semaine
|
Ambulatoire :
2 à 3 fois/semaine
Hospitalisation :
5 fois/semaine
|
|
Durée/séance
|
20 à 60 minutes
|
10 à 45 minutes. Plus la durée est importante, meilleurs sont les résultats
|
30 à 45 minutes
|
30 à 45 minutes
|
|
Intensité
|
> 60 % de Wpic
|
50 % de la V̇O2pic au maximum toléré par le patient si épreuve d’effort
ou
60 à 80 % de la puissance maximale symptôme limitée
|
50 à 80 % de Wpic
|
/
|
|
Remarques
|
Les patients ne pouvant pas tolérer les entraînements continus peuvent bénéficier d’un entraînement fractionné, à condition que la durée des pics soit inférieure à 1 min et idéalement 30 s
|
Les entraînements fractionnés sont utiles quand la performance est limitée par des comorbidités importantes
|
Successions de créneaux de 4 min à 40 % de Wpic et 1 min de pic à haute intensité (non précisée)
|
/
|
ATS/ERS : American Thoracic Society/European Respiratory Society ; GOLD : Global Initiative for Chronic Obstructive Lung Disease ; SPLF : Société de Pneumologie de Langue Française ; HAS : Haute Autorité de santé ; Wpic : puissance maximale développée lors d’une épreuve d’effort cardiorespiratoire maximale.
Tableau 13.II Recommandations générales de diverses sociétés savantes sur l’entraînement en force
| |
ATS/ERS (2013)
|
GOLD (2016) 
|
SPLF (2010  ) |
HAS (2014) 
|
|
Renforcement musculaire
|
|
Fréquence
|
2 à 3 fois/semaine
|
Procédures non précisées, mais renforcement musculaire conseillé surtout en cas d’atrophie ou de faiblesse musculaire, et de comorbidités empêchant des exercices de durée prolongée (objectif de gain de masse musculaire et de force)
|
Procédures non précisées. La recommandation est d’inclure dans les séances des exercices de renforcement musculaire impliquant d’autres groupes musculaires que ceux des membres inférieurs
|
/
|
|
Durée/séance
|
/
|
/
|
|
Intensité
|
60 à 70 % du 1-RM
ou 8 à 12 RM
| |
Permettant de réaliser 10 répétitions pour chaque groupe musculaire
|
/
|
|
Remarques
|
La combinaison d’entraînement en endurance (continu ou fractionné) et en force produit des effets supérieurs sur la force et la capacité d’exercice qu’une technique utilisée seule, sans augmenter le temps de pratique
|
Ajout d’un apport nutritionnel enrichi en protéines pour augmenter la masse musculaire (objectif de gain de masse musculaire)
|
Tous les types d’exercices sollicitant les groupes musculaires les plus divers sont conseillés (lancer de balle, de medecine-ball, manipulation de bandes élastiques, de poids, de barres, etc.)
|
/
|
ATS/ERS : American Thoracic Society/European Respiratory Society ; GOLD : Global Initiative for Chronic Obstructive Lung Disease ; SPLF : Société de Pneumologie de Langue Française ; HAS : Haute Autorité de santé.
Les différences d’approches à court ou long terme expliquent donc largement les écarts dans les intensités proposées. Il est ainsi peu probable d’imaginer une poursuite durable d’activité induisant dyspnée et fatigue car trop intense (Steele et coll., 2008

). Il est actuellement évident que les effets induits ne seront pas maintenus si les patients ne continuent pas de pratiquer une ou des activités physiques sur le long terme. Par conséquent, et dans le cadre d’une prévention secondaire et tertiaire, il est urgent de prendre conscience que se fixer comme but prioritaire l’obtention des effets les plus importants à court terme (et donc les pratiques les plus intenses) est une attitude peu pertinente et peu responsable sur le long terme. Il convient donc de changer de priorité et de travailler sur les multiples déterminants du changement de comportement vis-à-vis de l’activité physique qui doit être progressivement perçue comme faisant partie intégrante de la prise en charge de sa pathologie par le patient lui-même. De ce point de vue, le plaisir dans la pratique et son abord valorisant et positif sont d’une importance considérable. Concernant la fréquence et la durée des séances, il est plus simple de faire une synthèse allant au-delà des différentes recommandations : une pratique aussi régulière que possible est souhaitable (un jour sur deux ou tous les jours si possible) et des durées de pratique minimales de 30 minutes semblent une position assez partagée dans les recommandations.
Conclusion
La littérature comporte de nombreuses méta-analyses et revues systématiques qui confirment l’importance de l’activité physique dans le maintien d’une santé optimale des patients atteints de BPCO via des effets positifs sur la fonction respiratoire à long terme, sur la tolérance à l’effort et la qualité de vie associée à la maladie, ainsi que la réduction des symptômes, des hospitalisations et des exacerbations. Il est également avéré que le maintien d’un niveau d’activité physique suffisant représente un enjeu important pour réduire la mortalité associée à la BPCO. Pourtant, les patients atteints de BPCO sont clairement trop inactifs, à la fois quantitativement (dépense énergétique globale) et qualitativement (intensité des activités journalières), ce constat s’aggravant au fur et à mesure de la sévérité de la maladie. Modifier de façon durable le niveau d’activité des patients et leur adhésion pérenne à la pratique régulière d’activités physiques est donc un enjeu majeur. Les activités physiques recommandées associent les entraînements en endurance et en force, de façon à améliorer la tolérance à l’effort des patients et de lutter contre la dysfonction musculaire et ses multiples effets délétères. Il existe un nombre considérable de pratiques différentes qui attestent d’un niveau de preuve d’efficacité satisfaisant. L’implication des patients atteints de BPCO doit impérativement être pensée sous la forme d’une conjonction des différentes méthodes et conditions de pratiques, de façon à les rendre attractives, ludiques et variées ; car en définitive, le seul véritable enjeu à relever aujourd’hui ne réside pas tant dans l’amélioration fonctionnelle immédiate après la pratique, mais dans la capacité à modifier durablement le comportement des patients vis-à-vis de l’activité physique qui doit impérativement être systématiquement préservée et développée au quotidien.
Références
[1] Alahmari AD, Kowlessar BS, Patel AR, et al . Physical activity and exercise capacity in patients with moderate COPD exacerbations.
Eur Respir J. 2016;
48:340
-39

[2] Alexandre F, Heraud N, Oliver N, et al . Cortical implication in lower voluntary muscle force production in non-hypoxemic COPD patients.
PLoS One. 2014;
9:e100961

[3] Alexandre F, Heraud N, Sanchez AM, et al . Brain Damage and motor cortex Impairment in chronic obstructive pulmonary disease: implication of nonrapid eye movement sleep desaturation.
Sleep. 2016;
39:327
-35

[4] American Thoracic S, American College of Chest P. ATS/ACCP statement on cardiopulmonary exercise testing.
Am J Respir Crit Care Med. 2003;
167:211
-77

[5] American Thoracic Society. ATS statement: guidelines for the six-minute walk test.
Am J Respir Crit Care Med. 2002;
166:111
-7

[6] Beauchamp MK, Nonoyama M, Goldstein RS, et al . Interval versus continuous training in individuals with chronic obstructive pulmonary disease: a systematic review.
Thorax. 2010;
65:157
-64

[7] Benzo RP, Chang CC, Farrell MH, et al . Physical activity, health status and risk of hospitalization in patients with severe chronic obstructive pulmonary disease.
Respiration. 2010;
80:10
-8

[8] Black AE, Coward WA, Cole TJ, et al . Human energy expenditure in affluent societies: an analysis of 574 doubly-labelled water measurements.
Eur J Clin Nutr. 1996;
50:72
-92

[9] Bohannon RW. Measurement of sit-to-stand among older adults.
Topics Geriatric Rehabil. 2012;
28:11
-6

[10] Calik-Kutukcu E, Arikan H, Saglam M, et al . Arm strength training improves activities of daily living and occupational performance in patients with COPD.
Clin Respir J. 2017;
11:820
-32

[11] Casanova C, Cote C, Marin JM, et al . Distance and oxygen desaturation during the 6-min walk test as predictors of long-term mortality in patients with COPD.
Chest. 2008;
134:746
-52

[12] Celli BR. Predictors of mortality in COPD.
Respir Med. 2010;
104:773
-9

[13] Chen KM, Hsu YC, Chen WT, et al . Well-being of institutionalized elders after Yang-style Tai Chi practice.
J Clin Nurs. 2007;
16:845
-52

[14] Chen YW, Hunt MA, Campbell KL, et al . The effect of Tai Chi on four chronic conditions-cancer, osteoarthritis, heart failure and chronic obstructive pulmonary disease: a systematic review and meta-analyses.
Br J Sports Med. 2016;
50:397
-407

[15] Clark CJ, Cochrane L, Mackay E. Low intensity peripheral muscle conditioning improves exercise tolerance and breathlessness in COPD.
Eur Respir J. 1996;
9:2590
-6

[16] Crapo RO, Casaburi R, Coates AL, et al . ATS statement: guidelines for the six-minute walk test.
Am J Respir Crit Care Med. 2002;
166:111
-7

[17] De Brandt J, Spruit MA, Derave W, et al . Changes in structural and metabolic muscle characteristics following exercise-based interventions in patients with COPD: a systematic review.
Expert Rev Respir Med. 2016;
10:521
-45

[18] Decramer M, Janssens W, Miravitlles M. Chronic obstructive pulmonary disease.
Lancet. 2012;
379:1341
-51

[19] Ding M, Zhang W, Li K, et al . Effectiveness of t’ai chi and qigong on chronic obstructive pulmonary disease: a systematic review and meta-analysis.
J Altern Complement Med. 2014;
20:79
-86

[20] Fuhrman C, Delmas MC. Epidémiologie descriptive de la bronchopneumopathie chronique obstructive (BPCO) en France.
Rev Mal Respir. 2010;
27:160
-8

[21] Garcia-Aymerich J, Lange P, Serra I, et al . Time-dependent confounding in the study of the effects of regular physical activity in chronic obstructive pulmonary disease: an application of the marginal structural model.
Ann Epidemiol. 2008;
18:775
-83

[22] Garcia-Rio F, Lores V, Mediano O, et al . Daily physical activity in patients with chronic obstructive pulmonary disease is mainly associated with dynamic hyperinflation.
Am J Respir Crit Care Med. 2009;
180:506
-12

[23] Garcia-Rio F, Rojo B, Casitas R, et al . Prognostic value of the objective measurement of daily physical activity in patients with COPD.
Chest. 2012;
142:338
-46

[24] Geddes EL, O’Brien K, Reid WD, et al . Inspiratory muscle training in adults with chronic obstructive pulmonary disease: an update of a systematic review.
Respir Med. 2008;
102:1715
-29

[25] Gimeno-Santos E, Frei A, Steurer-Stey C, et al . Determinants and outcomes of physical activity in patients with COPD: a systematic review.
Thorax. 2014;
69:731
-9

[26]Global Initiative for Chronic Obstructive Lung Disease. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease – updated 2016.
Global Initiative for Chronic Obstructive Lung Disease, Inc.. 2016;

[27]Global Initiative for Chronic Obstructive Lung Disease. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease – 2017 report.
Global Initiative for Chronic Obstructive Lung Disease, Inc.. 2017;

[28] Gosselink R, De Vos J, van den Heuvel SP, et al . Impact of inspiratory muscle training in patients with COPD: what is the evidence?.
Eur Respir J. 2011;
37:416
-25

[29] Griffiths TL, Burr ML, Campbell IA, et al . Results at 1 year of outpatient multidisciplinary pulmonary rehabilitation: a randomised controlled trial.
Lancet. 2000;
355:362
-8

[30] Guo JB, Chen BL, Lu YM, et al . Tai Chi for improving cardiopulmonary function and quality of life in patients with chronic obstructive pulmonary disease: a systematic review and meta-analysis.
Clin Rehabil. 2016;
30:750
-64

[32] Heraud N, Prefaut C, Durand F, et al . Does correction of exercise-induced desaturation by O
2 always improve exercise tolerance in COPD? A preliminary study.
Respir Med. 2008;
102:1276
-86

[33] Holland AE, Spruit MA, Troosters T, et al . An official European respiratory society/American thoracic society technical standard: field walking tests in chronic respiratory disease.
Eur Respir J. 2014;
44:1428
-46

[34] Janaudis-Ferreira T, Hill K, Goldstein R, et al . Arm exercise training in patients with chronic obstructive pulmonary disease: a systematic review.
J Cardiopulm Rehabil Prev. 2009;
29:277
-83

[35] Jones SE, Kon SS, Canavan JL, et al . The five-repetition sit-to-stand test as a functional outcome measure in COPD.
Thorax. 2013;
68:1015
-20

[36] Kon SS, Patel MS, Canavan JL, et al . Reliability and validity of 4-metre gait speed in COPD.
Eur Respir J. 2013;
42:333
-40

[37] Kruis AL, Smidt N, Assendelft WJ, et al . Integrated disease management interventions for patients with chronic obstructive pulmonary disease.
Cochrane Database Syst Rev. 2013;
CD009437

[38] Lacasse Y, Wong E, Guyatt GH, et al . Meta-analysis of respiratory rehabilitation in chronic obstructive pulmonary disease.
Lancet. 1996;
348:1115
-9

[39] Lan C, Chen SY, Lai JS. Relative exercise intensity of Tai Chi Chuan is similar in different ages and gender.
Am J Chin Med. 2004;
32:151
-60

[40] Lan C, Lai JS, Chen SY. Tai Chi Chuan: an ancient wisdom on exercise and health promotion.
Sports Med. 2002;
32:217
-24

[41] Leung RW, Alison JA, McKeough ZJ, et al . Ground walk training improves functional exercise capacity more than cycle training in people with chronic obstructive pulmonary disease (COPD): a randomised trial.
J Physiother. 2010;
56:105
-12

[42] Loprinzi PD, Walker JF. Increased daily movement associates with reduced mortality among COPD patients having systemic inflammation.
Int J Clin Pract. 2016;
70:286
-91

[43] Lozano R, Naghavi M, Foreman K, et al . Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global burden of disease study 2010.
Lancet. 2012;
380:2095
-128

[44] Marquis K, Debigare R, Lacasse Y, et al . Midthigh muscle cross-sectional area is a better predictor of mortality than body mass index in patients with chronic obstructive pulmonary disease.
Am J Respir Crit Care Med. 2002;
166:809
-13

[45] McCarthy B, Casey D, Devane D, et al . Pulmonary rehabilitation for chronic obstructive pulmonary disease.
Cochrane Database Syst Rev. 2015;
CD003793

[46] McNamara RJ, McKeough ZJ, McKenzie DK, et al . Water-based exercise training for chronic obstructive pulmonary disease.
Cochrane Database Syst Rev. 2013;
CD008290

[47] Mesquita R, Wilke S, Smid DE, et al . Measurement properties of the Timed Up and Go test in patients with COPD.
Chron Respir Dis. 2016;
1
-10

[48] Ng C, Mackney J, Jenkins S, et al . Does exercise training change physical activity in people with COPD? A systematic review and meta-analysis.
Chron Respir Dis. 2012;
9:17
-26

[49] Ngai SP, Jones AY, Tam WW. Tai Chi for chronic obstructive pulmonary disease (COPD).
Cochrane Database Syst Rev. 2016;
CD009953

[50] Nonoyama ML, Brooks D, Lacasse Y, et al . Oxygen therapy during exercise training in chronic obstructive pulmonary disease.
Cochrane Database Syst Rev. 2007;
CD005372

[51] O’Brien K, Geddes EL, Reid WD, et al . Inspiratory muscle training compared with other rehabilitation interventions in chronic obstructive pulmonary disease: a systematic review update.
J Cardiopulm Rehabil Prev. 2008;
28:128
-41

[52] O’Shea SD, Taylor NF, Paratz JD. Progressive resistance exercise improves muscle strength and may improve elements of performance of daily activities for people with COPD: a systematic review.
Chest. 2009;
136:1269
-83

[53] Orozco-Levi M, Lloreta J, Minguella J, et al . Injury of the human diaphragm associated with exertion and chronic obstructive pulmonary disease.
Am J Respir Crit Care Med. 2001;
164:1734
-9

[54] Pan L, Guo YZ, Yan JH, et al . Does upper extremity exercise improve dyspnea in patients with COPD? A meta-analysis.
Respir Med. 2012;
106:1517
-25

[55] Patout M, Zysman M, Raherison Semjen C, et al . Epidémiologie et dépistage de la BPCO en France.
Workshop de la Société de pneumologie de langue francaise (SPLF). Rev Mal Respir. 2014;
31:693
-9

[56] Peytremann-Bridevaux I, Taffe P, Burnand B, et al . Mortality of patients with COPD participating in chronic disease management programmes: a happy end?.
Thorax. 2014;
69:865
-6

[58] Prefaut C, Varray A, Vallet G. Pathophysiological basis of exercise training in patients with chronic obstructive lung disease.
Eur Respir Rev. 1995;
5:27
-32

[60] Puhan MA, Siebeling L, Zoller M, et al . Simple functional performance tests and mortality in COPD.
Eur Respir J. 2013;
42:956
-63

[61] Puhan M, Scharplatz M, Troosters T, et al . Pulmonary rehabilitation following exacerbations of chronic obstructive pulmonary disease.
Cochrane Database Syst Rev. 2009;
CD005305

[63] Ries AL, Bauldoff GS, Carlin BW, et al . Pulmonary rehabilitation: joint ACCP/AACVPR evidence-based clinical practice guidelines.
Chest. 2007;
131:4S
-42S

[64] Ries AL, Kaplan RM, Limberg TM, et al . Effects of pulmonary rehabilitation on physiologic and psychosocial outcomes in patients with chronic obstructive pulmonary disease.
Ann Intern Med. 1995;
122:823
-32

[65] Romagnoli I, Scano G, Binazzi B, et al . Effects of unsupported arm training on arm exercise-related perception in COPD patients.
Respir Physiol Neurobiol. 2013;
186:95
-102

[66] Rycroft CE, Heyes A, Lanza L, et al . Epidemiology of chronic obstructive pulmonary disease: a literature review.
Int J Chron Obstruct Pulmon Dis. 2012;
7:457
-94

[67] Ryu CW, Jahng GH, Choi CW, et al . Microstructural change of the brain in chronic obstructive pulmonary disease: a voxel-based investigation by MRI.
COPD. 2013;
10:357
-66

[68] Sackett DL, Rosenberg WM, Gray JA, et al . Evidence based medicine: what it is and what it isn’t.
BMJ. 1996;
312:71
-2

[69] Salman GF, Mosier MC, Beasley BW, et al . Rehabilitation for patients with chronic obstructive pulmonary disease: meta-analysis of randomized controlled trials.
J Gen Intern Med. 2003;
18:213
-21

[70] Saltin B, Grimby G. Physiological analysis of middle-aged and old former athletes.
Comparison with still active athletes of the same ages. Circulation. 1968;
38:1104
-15

[71] Schaadt L, Christensen R, Kristensen LE, et al . Increased mortality in patients with severe COPD associated with high-intensity exercise: a preliminary cohort study.
Int J Chron Obstruct Pulmon Dis. 2016;
11:2329
-34

[72] Seymour JM, Spruit MA, Hopkinson NS, et al . The prevalence of quadriceps weakness in COPD and the relationship with disease severity.
Eur Respir J. 2010;
36:81
-8

[73]SPLF. Rehabilitation of COPD patients.
Rev Mal Respir. 2010;
27:S36
-69

[74] Spruit MA, Polkey MI, Celli B, et al . Predicting outcomes from 6-minute walk distance in chronic obstructive pulmonary disease.
J Am Med Dir Assoc. 2012;
13:291
-7

[75] Spruit MA, Singh SJ, Garvey C, et al . An official American thoracic society/European respiratory society statement: key concepts and advances in pulmonary rehabilitation.
Am J Respir Crit Care Med. 2013;
188:e13
-64

[76] Stav D, Raz M, Shpirer I. Three years of pulmonary rehabilitation: inhibit the decline in airflow obstruction, improves exercise endurance time, and body-mass index, in chronic obstructive pulmonary disease.
BMC Pulm Med. 2009;
9:26

[77] Steele BG, Belza B, Cain KC, et al . A randomized clinical trial of an activity and exercise adherence intervention in chronic pulmonary disease.
Arch Phys Med Rehabil. 2008;
89:404
-12

[78] Strasser B, Siebert U, Schobersberger W. Effects of resistance training on respiratory function in patients with chronic obstructive pulmonary disease: a systematic review and meta-analysis.
Sleep Breath. 2013;
17:217
-26

[79] Swallow EB, Reyes D, Hopkinson NS, et al . Quadriceps strength predicts mortality in patients with moderate to severe chronic obstructive pulmonary disease.
Thorax. 2007;
62:115
-20

[80] Troosters T, Sciurba F, Battaglia S, et al . Physical inactivity in patients with COPD, a controlled multi-center pilot-study.
Respir Med. 2010;
104:1005
-11

[81] Vallet G, Ahmaidi S, Serres I, et al . Comparison of two training programmes in chronic airway limitation patients: standardized versus individualized protocols.
Eur Respir J. 1997;
10:114
-22

[82] Vogiatzis I, Nanas S, Roussos C. Interval training as an alternative modality to continuous exercise in patients with COPD.
Eur Respir J. 2002;
20:12
-9

[83] Walker PP, Burnett A, Flavahan PW, et al . Lower limb activity and its determinants in COPD.
Thorax. 2008;
63:683
-9

[84] Waschki B, Kirsten A, Holz O, et al . Physical activity is the strongest predictor of all-cause mortality in patients with COPD: a prospective cohort study.
Chest. 2011;
140:331
-42

[85] Waschki B, Spruit MA, Watz H, et al . Physical activity monitoring in COPD: compliance and associations with clinical characteristics in a multicenter study.
Respir Med. 2012;
106:522
-30

[86] Watz H, Waschki B, Meyer T, et al . Physical activity in patients with COPD.
Eur Respir J. 2009;
33:262
-72

[87] Weiner P, Magadle R, Beckerman M, et al . Maintenance of inspiratory muscle training in COPD patients: one year follow-up.
Eur Respir J. 2004;
23:61
-5

[89] Wu W, Liu X, Wang L, et al . Effects of Tai Chi on exercise capacity and health-related quality of life in patients with chronic obstructive pulmonary disease: a systematic review and meta-analysis.
Int J Chron Obstruct Pulmon Dis. 2014;
9:1253
-63

[90] Yan JH, Guo YZ, Yao HM, et al . Effects of Tai Chi in patients with chronic obstructive pulmonary disease: preliminary evidence.
PLoS One. 2013;
8:e61806

[91] Zainuldin R, Mackey MG, Alison JA. Optimal intensity and type of leg exercise training for people with chronic obstructive pulmonary disease.
Cochrane Database Syst Rev. 2011;
CD008008

[92] Zhang H, Wang X, Lin J, et al . Reduced regional gray matter volume in patients with chronic obstructive pulmonary disease: a voxel-based morphometry study.
Am J Neuroradiol. 2013;
34:334
-9

→ Aller vers SYNTHESE
 ). Elle s’accompagne également de nombreux effets extra-pulmonaires dits systémiques qui déterminent en partie la sévérité globale de la pathologie (Decramer et coll., 2012
). Elle s’accompagne également de nombreux effets extra-pulmonaires dits systémiques qui déterminent en partie la sévérité globale de la pathologie (Decramer et coll., 2012 ). Les atteintes systémiques (musculaires, cardiaques, vasculaires...) sont telles que la BPCO est actuellement présentée comme une maladie générale à point de départ respiratoire. Parmi ces atteintes, l’altération de la fonction musculaire périphérique nous intéressera tout particulièrement.
). Les atteintes systémiques (musculaires, cardiaques, vasculaires...) sont telles que la BPCO est actuellement présentée comme une maladie générale à point de départ respiratoire. Parmi ces atteintes, l’altération de la fonction musculaire périphérique nous intéressera tout particulièrement. ). Des données récentes montrent malheureusement que cette prévision était sous-estimée, puisque en 2012 elle atteignait déjà ce rang (Lozano et coll., 2012
). Des données récentes montrent malheureusement que cette prévision était sous-estimée, puisque en 2012 elle atteignait déjà ce rang (Lozano et coll., 2012 ). Depuis les 30-40 dernières années, la mortalité liée à la BPCO augmente plus rapidement chez les femmes que chez les hommes en dépit de larges fluctuations selon les pays concernés et la gravité de l’exposition au tabac (Rycroft et coll., 2012
). Depuis les 30-40 dernières années, la mortalité liée à la BPCO augmente plus rapidement chez les femmes que chez les hommes en dépit de larges fluctuations selon les pays concernés et la gravité de l’exposition au tabac (Rycroft et coll., 2012 ).
). ), bien que très certainement sous-évaluée, en raison d’un dépistage complexe et coûteux à mettre en œuvre dans le cadre d’études épidémiologiques. Son incidence tend à se stabiliser chez les hommes mais augmente chez les femmes, le nombre d’hospitalisations augmentant globalement (Fuhrman et Delmas, 2010
), bien que très certainement sous-évaluée, en raison d’un dépistage complexe et coûteux à mettre en œuvre dans le cadre d’études épidémiologiques. Son incidence tend à se stabiliser chez les hommes mais augmente chez les femmes, le nombre d’hospitalisations augmentant globalement (Fuhrman et Delmas, 2010 ). Entre 2000 et 2010, la mortalité liée à la BPCO a reculé chez les hommes (-1 % en moyenne par an) et augmenté chez les femmes [+ 0,6 % par an (Prost et Rey, 2015
). Entre 2000 et 2010, la mortalité liée à la BPCO a reculé chez les hommes (-1 % en moyenne par an) et augmenté chez les femmes [+ 0,6 % par an (Prost et Rey, 2015 )]. En 2012, le nombre d’hospitalisations pour exacerbation de la BPCO était compris entre 95 000 et 145 000 selon les indicateurs employés (Prost et Rey, 2015
)]. En 2012, le nombre d’hospitalisations pour exacerbation de la BPCO était compris entre 95 000 et 145 000 selon les indicateurs employés (Prost et Rey, 2015 ). Le coût direct moyen de la BPCO varie globalement entre 3 700 et 7 500 euros par patient et par an selon la gravité de la pathologie, auquel il convient d’ajouter des coûts indirects liés aux pertes de productivité et à un absentéisme professionnel (Patout et coll., 2014
). Le coût direct moyen de la BPCO varie globalement entre 3 700 et 7 500 euros par patient et par an selon la gravité de la pathologie, auquel il convient d’ajouter des coûts indirects liés aux pertes de productivité et à un absentéisme professionnel (Patout et coll., 2014 ) et au-delà, pour la personne, la dégradation de la qualité de vie en raison d’une dyspnée invalidante et d’une altération de sa tolérance à l’effort.
) et au-delà, pour la personne, la dégradation de la qualité de vie en raison d’une dyspnée invalidante et d’une altération de sa tolérance à l’effort. ). Depuis 1996, date de la première méta-analyse sur la question, l’efficacité de l’activité physique, véritable pierre angulaire de la réhabilitation respiratoire, a été régulièrement étayée et confirmée. Les données relatives aux effets de l’activité physique sont essentiellement issues de cette littérature riche et abondante.
). Depuis 1996, date de la première méta-analyse sur la question, l’efficacité de l’activité physique, véritable pierre angulaire de la réhabilitation respiratoire, a été régulièrement étayée et confirmée. Les données relatives aux effets de l’activité physique sont essentiellement issues de cette littérature riche et abondante. ) avait conclu que la réhabilitation respiratoire avait un impact sur la baisse de la mortalité, mais seulement avec un grade C (Evidence Based Medicine). Ce constat reposait sur deux travaux aux résultats peu consistants, qui ne permettaient donc pas une quelconque généralisation (Griffiths et coll., 2000
) avait conclu que la réhabilitation respiratoire avait un impact sur la baisse de la mortalité, mais seulement avec un grade C (Evidence Based Medicine). Ce constat reposait sur deux travaux aux résultats peu consistants, qui ne permettaient donc pas une quelconque généralisation (Griffiths et coll., 2000 ; Ries et coll., 1995
; Ries et coll., 1995 ). De nouveaux travaux ont complété cette évaluation de façon parfois indirecte mais convaincante, par l’analyse des impacts fonctionnels de la réhabilitation respiratoire sur des éléments liés à la gravité de la BPCO et à sa mortalité. Sur un suivi de 3 ans chez 80 patients atteints de BPCO, il a été montré que la réhabilitation respiratoire permettait de réduire le rythme de déclin du volume expiratoire maximal par seconde (VEMS), marqueur essentiel de la gravité de l’obstruction bronchique (74 ml chez les patients entraînés versus 149 ml chez les patients contrôles ; Stav et coll., 2009
). De nouveaux travaux ont complété cette évaluation de façon parfois indirecte mais convaincante, par l’analyse des impacts fonctionnels de la réhabilitation respiratoire sur des éléments liés à la gravité de la BPCO et à sa mortalité. Sur un suivi de 3 ans chez 80 patients atteints de BPCO, il a été montré que la réhabilitation respiratoire permettait de réduire le rythme de déclin du volume expiratoire maximal par seconde (VEMS), marqueur essentiel de la gravité de l’obstruction bronchique (74 ml chez les patients entraînés versus 149 ml chez les patients contrôles ; Stav et coll., 2009 ). Cette donnée est d’une grande importance puisque la relation entre la mortalité et le VEMS est élevée quand ce dernier est inférieur à 50 % de sa valeur théorique (Celli, 2010
). Cette donnée est d’une grande importance puisque la relation entre la mortalité et le VEMS est élevée quand ce dernier est inférieur à 50 % de sa valeur théorique (Celli, 2010 ). Stav et coll. (2009
). Stav et coll. (2009 ) ont également mis en évidence des effets majeurs obtenus sur la tolérance à l’effort et la réduction de la dyspnée déjà largement cités depuis les premières méta-analyses sur l’efficacité de la réhabilitation respiratoire, et il est maintenant clairement établi que la distance au test de marche de 6 minutes est un excellent prédicteur de survie. En effet, en deçà d’une performance comprise entre 334 m (Spruit et coll., 2012
) ont également mis en évidence des effets majeurs obtenus sur la tolérance à l’effort et la réduction de la dyspnée déjà largement cités depuis les premières méta-analyses sur l’efficacité de la réhabilitation respiratoire, et il est maintenant clairement établi que la distance au test de marche de 6 minutes est un excellent prédicteur de survie. En effet, en deçà d’une performance comprise entre 334 m (Spruit et coll., 2012 ) et 361 m (Casanova et coll., 2008
) et 361 m (Casanova et coll., 2008 ), le risque de mortalité associé à la BPCO augmente de façon significative, ce risque étant potentialisé en cas de désaturation au test de marche (Casanova et coll., 2008
), le risque de mortalité associé à la BPCO augmente de façon significative, ce risque étant potentialisé en cas de désaturation au test de marche (Casanova et coll., 2008 ). Cette efficacité est également retrouvée sur des performances fonctionnelles évaluées avec d’autres tests comme le sit-to-stand test (Bohannon, 2012
). Cette efficacité est également retrouvée sur des performances fonctionnelles évaluées avec d’autres tests comme le sit-to-stand test (Bohannon, 2012 ) ou la mesure de la force des fléchisseurs des doigts (Puhan et coll., 2013
) ou la mesure de la force des fléchisseurs des doigts (Puhan et coll., 2013 ). Enfin, il est maintenant reconnu que la perte de masse musculaire (Marquis et coll., 2002
). Enfin, il est maintenant reconnu que la perte de masse musculaire (Marquis et coll., 2002 ) et la faiblesse musculaire (Swallow et coll., 2007
) et la faiblesse musculaire (Swallow et coll., 2007 ) sont fortement associées à la mortalité, indépendamment de la sévérité de l’atteinte respiratoire. Ces travaux mettent en évidence le caractère prédictif de l’altération des adaptations fonctionnelles d’exercice et leurs déterminants musculaires avec le risque de mortalité chez les personnes atteintes de BPCO.
) sont fortement associées à la mortalité, indépendamment de la sévérité de l’atteinte respiratoire. Ces travaux mettent en évidence le caractère prédictif de l’altération des adaptations fonctionnelles d’exercice et leurs déterminants musculaires avec le risque de mortalité chez les personnes atteintes de BPCO. ; Waschki et coll., 2011
; Waschki et coll., 2011 ) ou auto-rapportées (Garcia-Aymerich et coll., 2008
) ou auto-rapportées (Garcia-Aymerich et coll., 2008 ) du niveau d’activité physique. Les résultats obtenus sur différentes cohortes incluant 170 à plus de 6 500 patients suivis sur des périodes de 4 à 18 ans, sont extrêmement homogènes et révèlent que la probabilité de survie chute de façon spectaculaire avec la diminution du niveau d’activité physique habituel, même en tenant compte de tous les facteurs confondants comme l’obstruction bronchique. La figure 13.1
) du niveau d’activité physique. Les résultats obtenus sur différentes cohortes incluant 170 à plus de 6 500 patients suivis sur des périodes de 4 à 18 ans, sont extrêmement homogènes et révèlent que la probabilité de survie chute de façon spectaculaire avec la diminution du niveau d’activité physique habituel, même en tenant compte de tous les facteurs confondants comme l’obstruction bronchique. La figure 13.1 illustre parfaitement cette réalité : la médiane supérieure des patients les plus actifs (Q3 et Q4) présente des probabilités de survie sur 6 ans comprises entre 95 et 97 % quand la médiane inférieure des patients les moins actifs (Q1 et Q2) voit la probabilité de survie chuter entre 38 et 65 % pour la même durée de suivi.
illustre parfaitement cette réalité : la médiane supérieure des patients les plus actifs (Q3 et Q4) présente des probabilités de survie sur 6 ans comprises entre 95 et 97 % quand la médiane inférieure des patients les moins actifs (Q1 et Q2) voit la probabilité de survie chuter entre 38 et 65 % pour la même durée de suivi. ). Cette revue met en évidence chez les patients les plus actifs une diminution significative du risque relatif d’épisodes d’exacerbations [risque relatif (RR) compris entre 0,1 et 0,8 selon les travaux] et de mortalité (à l’exception d’une étude, le RR est compris entre 0,01 et 0,81). Par ailleurs, le niveau d’activité physique s’avère être à lui seul un prédicteur remarquable de la survie. Sur un suivi longitudinal de 4 ans, il a pu être ainsi démontré que le risque absolu de mortalité chez des patients très inactifs, sédentaires et actifs (au sens de la classification de l’OMS) était respectivement de 31 %, 9 %, and 0 % (Waschki et coll., 2011
). Cette revue met en évidence chez les patients les plus actifs une diminution significative du risque relatif d’épisodes d’exacerbations [risque relatif (RR) compris entre 0,1 et 0,8 selon les travaux] et de mortalité (à l’exception d’une étude, le RR est compris entre 0,01 et 0,81). Par ailleurs, le niveau d’activité physique s’avère être à lui seul un prédicteur remarquable de la survie. Sur un suivi longitudinal de 4 ans, il a pu être ainsi démontré que le risque absolu de mortalité chez des patients très inactifs, sédentaires et actifs (au sens de la classification de l’OMS) était respectivement de 31 %, 9 %, and 0 % (Waschki et coll., 2011 ). De même, ces auteurs ont pu déterminer que la réalisation de 1 845 pas quotidiens supplémentaires diminuait de moitié le risque de décès [hazard ratio (HR) = 0,46]. Plus étonnant encore, le niveau d’activité physique se révèle être plus prédictif de la survie que les marqueurs de l’inflammation systémique, les variables morphologiques et fonctionnelles cardiaques, les taux d’adipokines (Waschki et coll., 2011
). De même, ces auteurs ont pu déterminer que la réalisation de 1 845 pas quotidiens supplémentaires diminuait de moitié le risque de décès [hazard ratio (HR) = 0,46]. Plus étonnant encore, le niveau d’activité physique se révèle être plus prédictif de la survie que les marqueurs de l’inflammation systémique, les variables morphologiques et fonctionnelles cardiaques, les taux d’adipokines (Waschki et coll., 2011 ), le profil métabolique et lipidique, la consommation de tabac et d’alcool et l’utilisation des soins de santé sur les 12 derniers mois (Garcia-Aymerich et coll., 2008
), le profil métabolique et lipidique, la consommation de tabac et d’alcool et l’utilisation des soins de santé sur les 12 derniers mois (Garcia-Aymerich et coll., 2008 ). Enfin, il a été récemment démontré par une étude interventionnelle que la pratique d’une heure d’activité physique par jour chez ces patients permettait de réduire de 30 % la mortalité sur une période de 6,5 ans (Loprinzi et Walker, 2016
). Enfin, il a été récemment démontré par une étude interventionnelle que la pratique d’une heure d’activité physique par jour chez ces patients permettait de réduire de 30 % la mortalité sur une période de 6,5 ans (Loprinzi et Walker, 2016 ).
). ). Des résultats comparables sont obtenus avec une méthode différente reposant sur un ratio entre la dépense énergétique totale de la journée et la dépense énergétique nocturne (Watz et coll., 2009
). Des résultats comparables sont obtenus avec une méthode différente reposant sur un ratio entre la dépense énergétique totale de la journée et la dépense énergétique nocturne (Watz et coll., 2009 ). Cette méthode permet de définir des patients actifs quand ce ratio (appelé NAP pour Niveau d’Activité Physique) est supérieur à 1,7, sédentaires quand il est compris entre 1,4 et 1,69 et très inactifs quand il est inférieur à 1,4 (Black et coll., 1996
). Cette méthode permet de définir des patients actifs quand ce ratio (appelé NAP pour Niveau d’Activité Physique) est supérieur à 1,7, sédentaires quand il est compris entre 1,4 et 1,69 et très inactifs quand il est inférieur à 1,4 (Black et coll., 1996 ). L’impact de la sévérité de la pathologie sur l’activité physique est également un élément majeur : la proportion de patients très inactifs augmente avec l’importance de l’obstruction bronchique. Seulement 10 % des patients présentant une sévérité de grade III sont considérés comme actifs et aucun au grade IV (selon la classification GOLD4
, ce grade est caractérisé par l’obstruction bronchique la plus importante ; figure 13.2
). L’impact de la sévérité de la pathologie sur l’activité physique est également un élément majeur : la proportion de patients très inactifs augmente avec l’importance de l’obstruction bronchique. Seulement 10 % des patients présentant une sévérité de grade III sont considérés comme actifs et aucun au grade IV (selon la classification GOLD4
, ce grade est caractérisé par l’obstruction bronchique la plus importante ; figure 13.2 ). Des résultats similaires sont retrouvés avec une mesure objective du nombre de pas : en fonction de la gravité de la BPCO (du grade I au grade IV), le nombre de pas réalisés quotidiennement se situe respectivement à 87, 70, 49 et 29 % de ce que font les sujets sains de même âge. Par conséquent, les patients atteints de BPCO réduisent d’autant plus leur activité physique que leur pathologie est sévère. Sur un plan plus qualitatif, le niveau d’activité physique d’intensité modérée est réduit de 47 % chez les patients atteints de BPCO de grade I jusqu’à 78 % pour le grade IV. Il est important de mentionner que les exacerbations, fréquemment rencontrées chez les patients atteints de BPCO, sont caractérisées par des baisses importantes d’activité physique (Alahmari et coll., 2016
). Des résultats similaires sont retrouvés avec une mesure objective du nombre de pas : en fonction de la gravité de la BPCO (du grade I au grade IV), le nombre de pas réalisés quotidiennement se situe respectivement à 87, 70, 49 et 29 % de ce que font les sujets sains de même âge. Par conséquent, les patients atteints de BPCO réduisent d’autant plus leur activité physique que leur pathologie est sévère. Sur un plan plus qualitatif, le niveau d’activité physique d’intensité modérée est réduit de 47 % chez les patients atteints de BPCO de grade I jusqu’à 78 % pour le grade IV. Il est important de mentionner que les exacerbations, fréquemment rencontrées chez les patients atteints de BPCO, sont caractérisées par des baisses importantes d’activité physique (Alahmari et coll., 2016 ), tout spécialement chez les patients les plus sévères. Au total, la littérature fait clairement ressortir que les patients BPCO les plus sévères seront ceux qui réaliseront le moins d’activité physique au jour le jour, avec une inactivité sévère extrêmement préoccupante.
), tout spécialement chez les patients les plus sévères. Au total, la littérature fait clairement ressortir que les patients BPCO les plus sévères seront ceux qui réaliseront le moins d’activité physique au jour le jour, avec une inactivité sévère extrêmement préoccupante. ) ou de l’Office de Prévention des maladies et de la Promotion de la Santé (ODPHP, Physical Activity Guidelines for Americans, 2008
) ou de l’Office de Prévention des maladies et de la Promotion de la Santé (ODPHP, Physical Activity Guidelines for Americans, 2008 ) font en effet ressortir que des activités modérées ou vigoureuses sont nécessaires pour obtenir un impact positif sur la santé (au moins 150 minutes par semaine d’intensité modérée ou 75 minutes par semaine d’intensité vigoureuse ou toute combinaison équivalente...). D’autres recommandations sont proposées en fonction du nombre de pas réalisés chaque jour qui permettent de classer les individus actifs (à partir de 10 000 pas/jour), faiblement à peu actifs (entre 5 et 10 000 pas/jour) et sédentaires (moins de 5 000 pas/jour).
) font en effet ressortir que des activités modérées ou vigoureuses sont nécessaires pour obtenir un impact positif sur la santé (au moins 150 minutes par semaine d’intensité modérée ou 75 minutes par semaine d’intensité vigoureuse ou toute combinaison équivalente...). D’autres recommandations sont proposées en fonction du nombre de pas réalisés chaque jour qui permettent de classer les individus actifs (à partir de 10 000 pas/jour), faiblement à peu actifs (entre 5 et 10 000 pas/jour) et sédentaires (moins de 5 000 pas/jour). ), et ce quelles que soient les variables de mesure de l’activité physique retenues (Troosters et coll., 2010
), et ce quelles que soient les variables de mesure de l’activité physique retenues (Troosters et coll., 2010 ; Walker et coll., 2008
; Walker et coll., 2008 ; Waschki et coll., 2012
; Waschki et coll., 2012 ; Watz et coll., 2009
; Watz et coll., 2009 ). Les patients ayant une BPCO de grade IV ont des niveaux d’activité physique bien en deçà des minimas requis pour se maintenir en bonne santé (Troosters et coll., 2010
). Les patients ayant une BPCO de grade IV ont des niveaux d’activité physique bien en deçà des minimas requis pour se maintenir en bonne santé (Troosters et coll., 2010 ; Watz et coll., 2009
; Watz et coll., 2009 ). À titre d’exemple, le taux de patients atteints de BPCO très inactifs est de 32 % quand la sévérité est de grade II, et ce taux est quasiment doublé quand la BPCO devient sévère (grade IV). Les impacts d’une faible activité physique chez ces patients sont multiples et préoccupants : hyperinflation dynamique (Garcia-Rio et coll., 2009
). À titre d’exemple, le taux de patients atteints de BPCO très inactifs est de 32 % quand la sévérité est de grade II, et ce taux est quasiment doublé quand la BPCO devient sévère (grade IV). Les impacts d’une faible activité physique chez ces patients sont multiples et préoccupants : hyperinflation dynamique (Garcia-Rio et coll., 2009 ), augmentation des exacerbations et des hospitalisations (Benzo et coll., 2010
), augmentation des exacerbations et des hospitalisations (Benzo et coll., 2010 ; Garcia-Aymerich et coll., 2008
; Garcia-Aymerich et coll., 2008 ; Garcia-Rio et coll., 2012
; Garcia-Rio et coll., 2012 ) et risque accru de la mortalité comme présenté précédemment. Une étude épidémiologique remarquable, menée chez plus de 6 560 sujets (issus d’une population générale, c’est-à-dire non spécifiquement à risque de développer une BPCO) suivis sur une période de 16 ans en moyenne, a permis de compléter les connaissances de l’impact de l’activité physique sur l’histoire naturelle de la BPCO (Garcia-Aymerich et coll., 2008
) et risque accru de la mortalité comme présenté précédemment. Une étude épidémiologique remarquable, menée chez plus de 6 560 sujets (issus d’une population générale, c’est-à-dire non spécifiquement à risque de développer une BPCO) suivis sur une période de 16 ans en moyenne, a permis de compléter les connaissances de l’impact de l’activité physique sur l’histoire naturelle de la BPCO (Garcia-Aymerich et coll., 2008 ). Ces auteurs ont classé les sujets suivis selon 3 niveaux de pratique d’activité physique : faible, modérée et élevée (sur la base de questionnaires5
). Ces auteurs ont ainsi mis en évidence que l’activité physique réduisait le risque d’apparition de la BPCO. Les personnes pratiquant une activité physique modérée à élevée présentaient une diminution significative du risque de développer une BPCO comparativement au groupe ayant une faible activité physique régulière (odd ratio [OR] = 0,76). Le niveau de pratique apparaît avoir un impact considérable sur le rythme de déclin de la fonction respiratoire ; quand le VEMS déclinait d’environ 28 mL/an dans le groupe de sujets ayant une faible qualité d’activité physique, cette altération était réduite de 6,5 et 10,2 mL/an dans les groupes ayant une activité physique modérée et élevée. Au regard de la méthodologie utilisée, il est donc pertinent de penser qu’augmenter de façon relativement minime sa quantité d’activité physique habituelle permettrait d’obtenir des résultats positifs sur l’évolution de la BPCO, en termes de ralentissement du déclin de la fonction respiratoire, de diminution du nombre d’hospitalisations et de mortalité (2 heures d’activité physique légère par semaine représentent de fait environ 17 minutes/jour et il suffit de doubler cette quantité pour être dans le groupe activité physique modérée). En revanche, une réduction significative des hospitalisations ne s’observe que pour un niveau d’activité physique élevé : seuls les patients atteints de BPCO ayant un niveau d’activité physique élevé présentaient une réduction significative du risque relatif (RR = 0,68 vs 1,10 pour les patients avec un niveau d’activité physique modéré seulement).
). Ces auteurs ont classé les sujets suivis selon 3 niveaux de pratique d’activité physique : faible, modérée et élevée (sur la base de questionnaires5
). Ces auteurs ont ainsi mis en évidence que l’activité physique réduisait le risque d’apparition de la BPCO. Les personnes pratiquant une activité physique modérée à élevée présentaient une diminution significative du risque de développer une BPCO comparativement au groupe ayant une faible activité physique régulière (odd ratio [OR] = 0,76). Le niveau de pratique apparaît avoir un impact considérable sur le rythme de déclin de la fonction respiratoire ; quand le VEMS déclinait d’environ 28 mL/an dans le groupe de sujets ayant une faible qualité d’activité physique, cette altération était réduite de 6,5 et 10,2 mL/an dans les groupes ayant une activité physique modérée et élevée. Au regard de la méthodologie utilisée, il est donc pertinent de penser qu’augmenter de façon relativement minime sa quantité d’activité physique habituelle permettrait d’obtenir des résultats positifs sur l’évolution de la BPCO, en termes de ralentissement du déclin de la fonction respiratoire, de diminution du nombre d’hospitalisations et de mortalité (2 heures d’activité physique légère par semaine représentent de fait environ 17 minutes/jour et il suffit de doubler cette quantité pour être dans le groupe activité physique modérée). En revanche, une réduction significative des hospitalisations ne s’observe que pour un niveau d’activité physique élevé : seuls les patients atteints de BPCO ayant un niveau d’activité physique élevé présentaient une réduction significative du risque relatif (RR = 0,68 vs 1,10 pour les patients avec un niveau d’activité physique modéré seulement). ) et a recensé 2 essais cliniques randomisés et 5 études interventionnelles (aucun essai randomisé contrôlé) totalisant un suivi de 419 patients sur une période allant jusqu’à 6 mois. Cette publication a par ailleurs uniquement retenu les études ayant réalisé un suivi objectif de l’activité physique à l’aide d’un accéléromètre ou d’un pédomètre. Le résultat majeur de cette méta-analyse est de mettre en évidence un effet significatif de la réhabilitation respiratoire sur l’augmentation de l’activité physique spontanée des patients atteint de BPCO, malgré un effet de taille assez modeste (0,14 ; p = 0,04). Cependant, des progrès doivent encore être réalisés pour accroître l’activité physique chez ces patients, tant ses bénéfices sont importants. Il conviendrait donc de pouvoir disposer de suivis de patients sur le long terme et d’essais randomisés contrôlés de bonne qualité.
) et a recensé 2 essais cliniques randomisés et 5 études interventionnelles (aucun essai randomisé contrôlé) totalisant un suivi de 419 patients sur une période allant jusqu’à 6 mois. Cette publication a par ailleurs uniquement retenu les études ayant réalisé un suivi objectif de l’activité physique à l’aide d’un accéléromètre ou d’un pédomètre. Le résultat majeur de cette méta-analyse est de mettre en évidence un effet significatif de la réhabilitation respiratoire sur l’augmentation de l’activité physique spontanée des patients atteint de BPCO, malgré un effet de taille assez modeste (0,14 ; p = 0,04). Cependant, des progrès doivent encore être réalisés pour accroître l’activité physique chez ces patients, tant ses bénéfices sont importants. Il conviendrait donc de pouvoir disposer de suivis de patients sur le long terme et d’essais randomisés contrôlés de bonne qualité. ; Peytremann-Bridevaux et coll., 2014
; Peytremann-Bridevaux et coll., 2014 ). La seule exception à cette littérature homogène est un travail de 2016 d’une équipe danoise qui a rapporté une mortalité accrue dans un groupe de 15 patients atteints de BPCO ayant été soumis à un entraînement à haute intensité (Schaadt et coll., 2016
). La seule exception à cette littérature homogène est un travail de 2016 d’une équipe danoise qui a rapporté une mortalité accrue dans un groupe de 15 patients atteints de BPCO ayant été soumis à un entraînement à haute intensité (Schaadt et coll., 2016 ). Au-delà de l’effectif réduit des patients, les entraînements utilisés s’apparentaient davantage à des pratiques menées jusqu’à l’épuisement6
qu’à des entraînements à hautes intensités classiques, c’est-à-dire caractérisés par des intensités très élevées, mais maintenues sur des temps courts. La méthodologie de ce travail ne permet donc pas de remettre sérieusement en cause les données des méta-analyses disponibles.
). Au-delà de l’effectif réduit des patients, les entraînements utilisés s’apparentaient davantage à des pratiques menées jusqu’à l’épuisement6
qu’à des entraînements à hautes intensités classiques, c’est-à-dire caractérisés par des intensités très élevées, mais maintenues sur des temps courts. La méthodologie de ce travail ne permet donc pas de remettre sérieusement en cause les données des méta-analyses disponibles. ). Les objectifs de cette évaluation sont d’individualiser l’intensité de la pratique, de détecter le cas échéant un besoin de supplémentation aiguë en oxygène, de vérifier l’absence de contre-indication(s) et d’identifier les facteurs liés à la limitation à l’exercice (Spruit et coll., 2013
). Les objectifs de cette évaluation sont d’individualiser l’intensité de la pratique, de détecter le cas échéant un besoin de supplémentation aiguë en oxygène, de vérifier l’absence de contre-indication(s) et d’identifier les facteurs liés à la limitation à l’exercice (Spruit et coll., 2013 ). Le recours à l’épreuve d’effort maximale n’est toutefois pas toujours possible et l’un des tests les plus utilisés dans le domaine de la BPCO est le test de marche de six minutes : il donne de façon simple des informations capitales en termes de tolérance à l’exercice. Deux autres tests sont également utilisés dans le cadre de la BPCO : le test navette incrémental (ISWT ; test au cours duquel la vitesse est progressivement augmentée au moyen de signaux sonores pré-enregistrés) et le test navette d’endurance (ESWT) qui consiste à mesurer le temps d’endurance à un pourcentage donné de la performance mesurée au ISWT. Si le test de 6 minutes est auto-calibré et d’intensité relativement constante, l’ISWT est un test progressif qui se rapproche fortement du type de sollicitation de l’épreuve d’effort maximale ; il est donc important de vérifier auparavant l’absence de contre-indication à un test de terrain maximal. Le choix de l’un ou l’autre de ces tests dépendra des conditions de passation disponibles (notamment de l’espace disponible pour la réalisation du test), mais également de la volonté que l’évaluateur aura d’individualiser un entraînement à partir des résultats obtenus. De ce point de vue, l’ISWT est plus pertinent pour programmer des intensités relatives en pourcentage de la vitesse de marche atteinte en fin du test. Si leurs qualités métrologiques sont considérées relativement équivalentes, l’ISWT/ESWT bénéficie d’une plus grande sensibilité aux changements après une réhabilitation respiratoire (Holland et coll., 2014
). Le recours à l’épreuve d’effort maximale n’est toutefois pas toujours possible et l’un des tests les plus utilisés dans le domaine de la BPCO est le test de marche de six minutes : il donne de façon simple des informations capitales en termes de tolérance à l’exercice. Deux autres tests sont également utilisés dans le cadre de la BPCO : le test navette incrémental (ISWT ; test au cours duquel la vitesse est progressivement augmentée au moyen de signaux sonores pré-enregistrés) et le test navette d’endurance (ESWT) qui consiste à mesurer le temps d’endurance à un pourcentage donné de la performance mesurée au ISWT. Si le test de 6 minutes est auto-calibré et d’intensité relativement constante, l’ISWT est un test progressif qui se rapproche fortement du type de sollicitation de l’épreuve d’effort maximale ; il est donc important de vérifier auparavant l’absence de contre-indication à un test de terrain maximal. Le choix de l’un ou l’autre de ces tests dépendra des conditions de passation disponibles (notamment de l’espace disponible pour la réalisation du test), mais également de la volonté que l’évaluateur aura d’individualiser un entraînement à partir des résultats obtenus. De ce point de vue, l’ISWT est plus pertinent pour programmer des intensités relatives en pourcentage de la vitesse de marche atteinte en fin du test. Si leurs qualités métrologiques sont considérées relativement équivalentes, l’ISWT/ESWT bénéficie d’une plus grande sensibilité aux changements après une réhabilitation respiratoire (Holland et coll., 2014 ) probablement en raison d’un effet plafond moins évident sur un test de nature incrémentale versus auto-calibré comme le test de marche de 6 minutes et imposant une interdiction de courir. La littérature insiste cependant sur la nécessité de parfaitement respecter les conditions de passation de ces tests de terrain, quel que soit le choix du test qui sera opéré (American Thoracic Society, 2002
) probablement en raison d’un effet plafond moins évident sur un test de nature incrémentale versus auto-calibré comme le test de marche de 6 minutes et imposant une interdiction de courir. La littérature insiste cependant sur la nécessité de parfaitement respecter les conditions de passation de ces tests de terrain, quel que soit le choix du test qui sera opéré (American Thoracic Society, 2002 ; Holland et coll., 2014
; Holland et coll., 2014 ).
). ), 4-m gait speed (Kon et coll., 2013
), 4-m gait speed (Kon et coll., 2013 ) et timed up and go (Mesquita et coll., 2016
) et timed up and go (Mesquita et coll., 2016 ).
). ). Bien que cette technique soit associée à des résultats très contradictoires, l’usage de la supplémentation en oxygène au cours de la pratique physique est encore souvent proposé, soit pour corriger des désaturations aiguës au cours de l’exercice, soit pour tenter d’optimiser les effets de l’entraînement. Toutefois, une méta-analyse menée sur le sujet (Nonoyama et coll., 2007
). Bien que cette technique soit associée à des résultats très contradictoires, l’usage de la supplémentation en oxygène au cours de la pratique physique est encore souvent proposé, soit pour corriger des désaturations aiguës au cours de l’exercice, soit pour tenter d’optimiser les effets de l’entraînement. Toutefois, une méta-analyse menée sur le sujet (Nonoyama et coll., 2007 ) montre clairement que l’entraînement sous oxygène des patients présentant une désaturation d’exercice ne joue pratiquement aucun rôle significatif sur la tolérance à l’exercice et sur les effets de la réhabilitation. Par conséquent, la supplémentation en oxygène mérite d’être réservée aux besoins de correction des désaturations transitoires à l’exercice.
) montre clairement que l’entraînement sous oxygène des patients présentant une désaturation d’exercice ne joue pratiquement aucun rôle significatif sur la tolérance à l’exercice et sur les effets de la réhabilitation. Par conséquent, la supplémentation en oxygène mérite d’être réservée aux besoins de correction des désaturations transitoires à l’exercice. ). Les entraînements en endurance ont donc logiquement été abordés dans les premières méta-analyses qui ont attesté de leur efficacité (Lacasse et coll., 1996
). Les entraînements en endurance ont donc logiquement été abordés dans les premières méta-analyses qui ont attesté de leur efficacité (Lacasse et coll., 1996 ; Salman et coll., 2003
; Salman et coll., 2003 ; Puhan et coll., 2009
; Puhan et coll., 2009 ). Peu d’informations nouvelles sont disponibles sur ce sujet, si ce n’est un travail récent mettant en évidence un effet plus important de la marche comparé aux entraînements sur cycloergomètres (Leung et coll., 2010
). Peu d’informations nouvelles sont disponibles sur ce sujet, si ce n’est un travail récent mettant en évidence un effet plus important de la marche comparé aux entraînements sur cycloergomètres (Leung et coll., 2010 ). L’efficacité des entraînements en endurance est maintenant reconnue et de nouvelles modalités sont maintenant proposées, soit dans un but d’optimisation des effets de la pratique physique, soit pour atteindre des buts spécifiques, soit pour tenter de réduire des difficultés rencontrées dans la mise en pratique des entraînements.
). L’efficacité des entraînements en endurance est maintenant reconnue et de nouvelles modalités sont maintenant proposées, soit dans un but d’optimisation des effets de la pratique physique, soit pour atteindre des buts spécifiques, soit pour tenter de réduire des difficultés rencontrées dans la mise en pratique des entraînements. ). Une revue systématique et une méta-analyse ont recensé 8 essais cliniques randomisés (soit 388 patients) dont 6 qui présentaient des protocoles dans lesquels la quantité de pratique était équivalente entre les 2 groupes. Aucun effet différentiel entre les entraînements continus ou fractionnés n’est obtenu (Beauchamp et coll., 2010
). Une revue systématique et une méta-analyse ont recensé 8 essais cliniques randomisés (soit 388 patients) dont 6 qui présentaient des protocoles dans lesquels la quantité de pratique était équivalente entre les 2 groupes. Aucun effet différentiel entre les entraînements continus ou fractionnés n’est obtenu (Beauchamp et coll., 2010 ; Zainuldin et coll., 2011
; Zainuldin et coll., 2011 ) tant sur des variables liées à la capacité aérobie [différences moyennes obtenues entre les différentes techniques de l’ordre de 40 et 10 mL.min-1 pour la consommation maximale d’oxygène symptôme-limitée (V̇O2pic) et le seuil ventilatoire respectivement et de 1 W pour la puissance pic (Wpic7
)], sur la tolérance à l’effort (4 m sur le test de marche de 6 min), sur la qualité de vie, que sur la proportion des abandons en cours d’entraînement. Il est toutefois important de noter qu’il existe une extrême hétérogénéité dans la construction des fractionnés. En effet, selon les travaux, les intensités des pics variaient de 80 à 150 % de Wpic. De même, les intensités des bases variaient entre 30 et 75 % de Wpic. Des écarts tout aussi importants étaient retrouvés sur la durée des bases, mais surtout de celle des pics qui pouvaient durer de 30 secondes à 3 minutes. Une analyse plus fine des résultats montre que la réduction des symptômes (notamment la dyspnée) lors des fractionnés n’existe que si la durée des pics est proche de 30 s. En les prolongeant au-delà, les effets positifs des fractionnés sur les symptômes au cours de la pratique disparaissent de façon totalement contreproductive.
) tant sur des variables liées à la capacité aérobie [différences moyennes obtenues entre les différentes techniques de l’ordre de 40 et 10 mL.min-1 pour la consommation maximale d’oxygène symptôme-limitée (V̇O2pic) et le seuil ventilatoire respectivement et de 1 W pour la puissance pic (Wpic7
)], sur la tolérance à l’effort (4 m sur le test de marche de 6 min), sur la qualité de vie, que sur la proportion des abandons en cours d’entraînement. Il est toutefois important de noter qu’il existe une extrême hétérogénéité dans la construction des fractionnés. En effet, selon les travaux, les intensités des pics variaient de 80 à 150 % de Wpic. De même, les intensités des bases variaient entre 30 et 75 % de Wpic. Des écarts tout aussi importants étaient retrouvés sur la durée des bases, mais surtout de celle des pics qui pouvaient durer de 30 secondes à 3 minutes. Une analyse plus fine des résultats montre que la réduction des symptômes (notamment la dyspnée) lors des fractionnés n’existe que si la durée des pics est proche de 30 s. En les prolongeant au-delà, les effets positifs des fractionnés sur les symptômes au cours de la pratique disparaissent de façon totalement contreproductive. ).
). ) ; les entraînements à haute intensité (réalisés à 80 % de Wpic versus 50-60 % de Wpic pour les entraînements à plus faible intensité) induisent des effets plus marqués sur la diminution des taux de lactate sanguin (après entraînement, la lactatémie à même intensité d’exercice est inférieure de 1,7 mmol.L-1 dans le groupe haute intensité par rapport au groupe basse intensité) et sur la diminution de la ventilation pour un niveau de travail donné (en moyenne le groupe s’étant entraîné à haute intensité aura une économie ventilatoire significativement plus importante que les patients de l’autre groupe, d’environ 6 L.min-1). Par conséquent, si les entraînements à haute intensité semblent plus efficaces sur les déterminants de la dyspnée lors d’activités de la vie journalière, il faut toutefois garder à l’esprit que ces données sont obtenues sur un nombre relativement limité de travaux (3 études recensées pour un total de 231 patients). À l’inverse, aucun effet significatif n’est obtenu pour les paramètres maximaux (Wpic ou lactatémie maximale) : ils évoluent de façon similaire entre les deux modalités.
) ; les entraînements à haute intensité (réalisés à 80 % de Wpic versus 50-60 % de Wpic pour les entraînements à plus faible intensité) induisent des effets plus marqués sur la diminution des taux de lactate sanguin (après entraînement, la lactatémie à même intensité d’exercice est inférieure de 1,7 mmol.L-1 dans le groupe haute intensité par rapport au groupe basse intensité) et sur la diminution de la ventilation pour un niveau de travail donné (en moyenne le groupe s’étant entraîné à haute intensité aura une économie ventilatoire significativement plus importante que les patients de l’autre groupe, d’environ 6 L.min-1). Par conséquent, si les entraînements à haute intensité semblent plus efficaces sur les déterminants de la dyspnée lors d’activités de la vie journalière, il faut toutefois garder à l’esprit que ces données sont obtenues sur un nombre relativement limité de travaux (3 études recensées pour un total de 231 patients). À l’inverse, aucun effet significatif n’est obtenu pour les paramètres maximaux (Wpic ou lactatémie maximale) : ils évoluent de façon similaire entre les deux modalités. ). Les conséquences sur le plan fonctionnel sont évidentes (augmentation de la fatigue, de la dyspnée et du risque de chute, faible adaptabilité aux efforts même légers, etc.). De plus, la dysfonction musculaire est aujourd’hui prise très au sérieux depuis la publication de deux travaux mettant en évidence qu’à même niveau d’obstruction bronchique, la perte de masse musculaire ou de force est associée à une mortalité significativement et dramatiquement plus élevée (Marquis et coll., 2002
). Les conséquences sur le plan fonctionnel sont évidentes (augmentation de la fatigue, de la dyspnée et du risque de chute, faible adaptabilité aux efforts même légers, etc.). De plus, la dysfonction musculaire est aujourd’hui prise très au sérieux depuis la publication de deux travaux mettant en évidence qu’à même niveau d’obstruction bronchique, la perte de masse musculaire ou de force est associée à une mortalité significativement et dramatiquement plus élevée (Marquis et coll., 2002 ; Swallow et coll., 2007
; Swallow et coll., 2007 ). Enfin, sur un plan physiopathologique et au-delà de la perte de masse musculaire, la faiblesse musculaire apparaît également liée à des altérations corticales impactant directement le cortex moteur primaire. Il existe en effet chez les patients atteints de BPCO une réduction de l’excitabilité corticale qui se traduit lors des contractions maximales et sous-maximales volontaires par une sous-activation du cortex moteur primaire (Alexandre et coll., 2014
). Enfin, sur un plan physiopathologique et au-delà de la perte de masse musculaire, la faiblesse musculaire apparaît également liée à des altérations corticales impactant directement le cortex moteur primaire. Il existe en effet chez les patients atteints de BPCO une réduction de l’excitabilité corticale qui se traduit lors des contractions maximales et sous-maximales volontaires par une sous-activation du cortex moteur primaire (Alexandre et coll., 2014 et 2016
et 2016 ). Ces altérations sont cohérentes avec de multiples travaux mettant en exergue des altérations anatomiques corticales importantes dans la BPCO, notamment une diminution de la densité de substance grise et blanche (Ryu et coll., 2013
). Ces altérations sont cohérentes avec de multiples travaux mettant en exergue des altérations anatomiques corticales importantes dans la BPCO, notamment une diminution de la densité de substance grise et blanche (Ryu et coll., 2013 ; Zhang et coll., 2013
; Zhang et coll., 2013 ). Toutefois, la mise en évidence des facteurs corticaux dans la faiblesse musculaire est extrêmement récente et les effets de la pratique physique sur la sous-activation du cortex moteur lors de production de force volontaire ne sont pas encore connus.
). Toutefois, la mise en évidence des facteurs corticaux dans la faiblesse musculaire est extrêmement récente et les effets de la pratique physique sur la sous-activation du cortex moteur lors de production de force volontaire ne sont pas encore connus. ). Les données ont été collectées sur 18 essais randomisés contrôlés pour un total de 543 patients. Les méthodes de renforcement musculaire sont très hétérogènes en termes de durée (de 6 à 26 semaines), de structuration d’une séance de renforcement musculaire (2 à 4 séries par séance et de 8 à 12 répétitions par série), et d’intensité (de 32 à 90 % du 1-RM8
). Malgré ces différences non négligeables, la revue systématique montre que le renforcement musculaire induit des effets comparables aux entraînements en endurance sur la consommation maximale d’oxygène des patients (V̇O2pic), la distance au test de marche de 6 minutes, la densité minérale osseuse, la qualité de vie et l’anxiété. Les effets différentiels en faveur du renforcement musculaire sont spécifiques sur la force des fléchisseurs et extenseurs du genou ainsi que sur divers tests reliés à des activités de la vie journalière (test de montée des marches, élévation des bras, sit to stand), avec des effets considérés comme modérés à importants9
selon les variables testées. De façon assez surprenante, les résultats sont inconstants sur la prise de masse musculaire. Il semble que les effets dépendent fortement des intensités d’entraînement et que leur expression sur les voies de la synthèse protéique soit émoussée chez les patients cachectiques (De Brandt et coll., 2016
). Les données ont été collectées sur 18 essais randomisés contrôlés pour un total de 543 patients. Les méthodes de renforcement musculaire sont très hétérogènes en termes de durée (de 6 à 26 semaines), de structuration d’une séance de renforcement musculaire (2 à 4 séries par séance et de 8 à 12 répétitions par série), et d’intensité (de 32 à 90 % du 1-RM8
). Malgré ces différences non négligeables, la revue systématique montre que le renforcement musculaire induit des effets comparables aux entraînements en endurance sur la consommation maximale d’oxygène des patients (V̇O2pic), la distance au test de marche de 6 minutes, la densité minérale osseuse, la qualité de vie et l’anxiété. Les effets différentiels en faveur du renforcement musculaire sont spécifiques sur la force des fléchisseurs et extenseurs du genou ainsi que sur divers tests reliés à des activités de la vie journalière (test de montée des marches, élévation des bras, sit to stand), avec des effets considérés comme modérés à importants9
selon les variables testées. De façon assez surprenante, les résultats sont inconstants sur la prise de masse musculaire. Il semble que les effets dépendent fortement des intensités d’entraînement et que leur expression sur les voies de la synthèse protéique soit émoussée chez les patients cachectiques (De Brandt et coll., 2016 ). La même variabilité des résultats est obtenue dans les études portant sur les modifications structurales avec une réduction non systématique du pourcentage de fibres IIb (De Brandt et coll., 2016
). La même variabilité des résultats est obtenue dans les études portant sur les modifications structurales avec une réduction non systématique du pourcentage de fibres IIb (De Brandt et coll., 2016 ). La principale raison invoquée reste l’extrême hétérogénéité des méthodes utilisées.
). La principale raison invoquée reste l’extrême hétérogénéité des méthodes utilisées. ).
). ). La pratique en milieu aquatique est préférée par 49 % des patients (36 % préférant pratiquer sur terre et 15 % ne manifestant aucune préférence). Enfin, aucun événement indésirable sérieux n’est rapporté, confirmant que ce type de pratique est parfaitement compatible avec la BPCO.
). La pratique en milieu aquatique est préférée par 49 % des patients (36 % préférant pratiquer sur terre et 15 % ne manifestant aucune préférence). Enfin, aucun événement indésirable sérieux n’est rapporté, confirmant que ce type de pratique est parfaitement compatible avec la BPCO. ) a rassemblé toutes les formes d’entraînement des membres supérieurs qu’elles soient de type « supported » (exercice des membres supérieurs sur cyclo-ergomètres à bras) ou « unsupported » (manipulation de charges, jets de balles lestées, etc.). Les fréquences d’entraînement et leurs durées étaient très variables selon les travaux référencés. Ainsi, la nature exacte des sollicitations musculaire et métabolique est quasiment impossible à connaître. Il n’est donc pas surprenant que cette revue systématique soit peu conclusive avec des résultats inconstants sur l’augmentation de performance des membres supérieurs, sur la diminution de la dyspnée dans les activités de la vie quotidienne et sur la qualité de vie. Depuis, une méta-analyse a inclus des travaux postérieurs à la revue systématique de Janaudis-Ferreira, qui sont principalement des études sur les entraînements de type unsupported (Pan et coll., 2012
) a rassemblé toutes les formes d’entraînement des membres supérieurs qu’elles soient de type « supported » (exercice des membres supérieurs sur cyclo-ergomètres à bras) ou « unsupported » (manipulation de charges, jets de balles lestées, etc.). Les fréquences d’entraînement et leurs durées étaient très variables selon les travaux référencés. Ainsi, la nature exacte des sollicitations musculaire et métabolique est quasiment impossible à connaître. Il n’est donc pas surprenant que cette revue systématique soit peu conclusive avec des résultats inconstants sur l’augmentation de performance des membres supérieurs, sur la diminution de la dyspnée dans les activités de la vie quotidienne et sur la qualité de vie. Depuis, une méta-analyse a inclus des travaux postérieurs à la revue systématique de Janaudis-Ferreira, qui sont principalement des études sur les entraînements de type unsupported (Pan et coll., 2012 ). Cette méta-analyse met en évidence un effet significatif de ces entraînements sur la dyspnée et la fatigue rencontrées au cours des AVJ. Toutefois, les améliorations restent en deçà du seuil de différence minimale clinique significative (MCID). La conclusion de cette étude est donc de révéler l’existence d’une réduction de la fatigue et de la dyspnée lors des AVJ, mais sans en garantir une preuve clinique. La poursuite de ces travaux est indispensable afin de déterminer l’existence ou non d’effets cliniques, notamment en étudiant plus spécifiquement la dyspnée lors de situation isowork10
. De même, il conviendrait d’avoir sur ces travaux une attitude plus cohérente sur les méthodes utilisées et faire des distinctions claires entre les entraînements à dominante force ou endurance, seul moyen de dépasser l’imprécision des effets induits. En effet, parmi les derniers travaux réalisés sur le sujet, lorsque le travail accompli est réellement du renforcement musculaire, il induit des effets significatifs sur la force musculaire et la capacité d’exercice des membres supérieurs et il réduit la dyspnée et la fatigue des bras lors des exercices de musculation (Calik-Kutukcu et coll., 2017
). Cette méta-analyse met en évidence un effet significatif de ces entraînements sur la dyspnée et la fatigue rencontrées au cours des AVJ. Toutefois, les améliorations restent en deçà du seuil de différence minimale clinique significative (MCID). La conclusion de cette étude est donc de révéler l’existence d’une réduction de la fatigue et de la dyspnée lors des AVJ, mais sans en garantir une preuve clinique. La poursuite de ces travaux est indispensable afin de déterminer l’existence ou non d’effets cliniques, notamment en étudiant plus spécifiquement la dyspnée lors de situation isowork10
. De même, il conviendrait d’avoir sur ces travaux une attitude plus cohérente sur les méthodes utilisées et faire des distinctions claires entre les entraînements à dominante force ou endurance, seul moyen de dépasser l’imprécision des effets induits. En effet, parmi les derniers travaux réalisés sur le sujet, lorsque le travail accompli est réellement du renforcement musculaire, il induit des effets significatifs sur la force musculaire et la capacité d’exercice des membres supérieurs et il réduit la dyspnée et la fatigue des bras lors des exercices de musculation (Calik-Kutukcu et coll., 2017 ). Mais le plus important réside dans les adaptations au cours des AVJ : il existe effectivement une diminution de la dyspnée et une augmentation de la performance et la satisfaction des patients au cours de celles-ci (Calik-Kutukcu et coll., 2017
). Mais le plus important réside dans les adaptations au cours des AVJ : il existe effectivement une diminution de la dyspnée et une augmentation de la performance et la satisfaction des patients au cours de celles-ci (Calik-Kutukcu et coll., 2017 ), probablement en raison d’une commande centrale ventilatoire réduite (Romagnoli et coll., 2013
), probablement en raison d’une commande centrale ventilatoire réduite (Romagnoli et coll., 2013 ).
). ).
). ; Gosselink et coll., 2011
; Gosselink et coll., 2011 ; O’Brien et coll., 2008
; O’Brien et coll., 2008 ). Il est également possible de réduire la dyspnée au cours des AVJ, d’améliorer la performance au test de marche mais cette technique reste sans effet sur la V̇O2pic (Geddes et coll., 2008
). Il est également possible de réduire la dyspnée au cours des AVJ, d’améliorer la performance au test de marche mais cette technique reste sans effet sur la V̇O2pic (Geddes et coll., 2008 ) et les gains de qualité de vie sont minimes. Utilisée en complément des entraînements classiques (corps entier), l’EMI n’apporte pas d’effets additionnels sur la capacité d’exercice ou la dyspnée et ses effets restent limités aux muscles inspiratoires. Enfin, la méta-analyse de Gosselink et coll. (2011
) et les gains de qualité de vie sont minimes. Utilisée en complément des entraînements classiques (corps entier), l’EMI n’apporte pas d’effets additionnels sur la capacité d’exercice ou la dyspnée et ses effets restent limités aux muscles inspiratoires. Enfin, la méta-analyse de Gosselink et coll. (2011 ) indique que le renforcement musculaire des muscles respiratoires est plus efficace que leur entraînement en endurance et que les patients les plus faibles sont ceux qui bénéficient le plus de ces techniques. Au total, les recommandations de sociétés savantes comme l’American Thoracic Society et l’European Respiratory Society restent mesurées sur l’intérêt de l’ajout des EMI aux entraînements classiques et préfèrent les conseiller aux sujets dont la faiblesse des muscles inspiratoires les rend peu aptes à réaliser des programmes de réentraînement à l’effort (Spruit et coll., 2013
) indique que le renforcement musculaire des muscles respiratoires est plus efficace que leur entraînement en endurance et que les patients les plus faibles sont ceux qui bénéficient le plus de ces techniques. Au total, les recommandations de sociétés savantes comme l’American Thoracic Society et l’European Respiratory Society restent mesurées sur l’intérêt de l’ajout des EMI aux entraînements classiques et préfèrent les conseiller aux sujets dont la faiblesse des muscles inspiratoires les rend peu aptes à réaliser des programmes de réentraînement à l’effort (Spruit et coll., 2013 ).
). ) et une continuité de ce type de pratique en dehors des centres de réhabilitation est assez peu crédible. Enfin, l’ajout de charges inspiratoires doit être utilisé de façon mesurée en raison d’un risque important de lésions des sarcomères musculaires des patients atteints de BPCO, particulièrement sensibles aux charges inspiratoires (Orozco-Levi et coll., 2001
) et une continuité de ce type de pratique en dehors des centres de réhabilitation est assez peu crédible. Enfin, l’ajout de charges inspiratoires doit être utilisé de façon mesurée en raison d’un risque important de lésions des sarcomères musculaires des patients atteints de BPCO, particulièrement sensibles aux charges inspiratoires (Orozco-Levi et coll., 2001 ).
). ; Lan et coll., 2002
; Lan et coll., 2002 ). Le Tai Chi étant généralement considéré comme un exercice d’intensité légère à modérée (Lan et coll., 2004
). Le Tai Chi étant généralement considéré comme un exercice d’intensité légère à modérée (Lan et coll., 2004 ), il est même parfois retiré purement et simplement des méta-analyses réalisées sur les effets de l’exercice (McCarthy et coll., 2015
), il est même parfois retiré purement et simplement des méta-analyses réalisées sur les effets de l’exercice (McCarthy et coll., 2015 ). Pourtant de nombreux travaux ont pu faire la démonstration d’effets positifs importants sur l’état de santé dans de diverses affections chroniques (Chen et coll., 2016
). Pourtant de nombreux travaux ont pu faire la démonstration d’effets positifs importants sur l’état de santé dans de diverses affections chroniques (Chen et coll., 2016 ). La littérature scientifique est riche en travaux montrant que des pratiques régulières d’intensité modérée sont capables d’induire des adaptations musculo-squelettiques et cardiovasculaires compatibles avec une amélioration de la santé. Le Tai Chi peut donc être une alternative intéressante pour des patients ayant des difficultés à entrer dans des programmes de prescription de l’exercice musculaire en raison d’une dyspnée trop pénalisante. Il permet notamment un travail important sur le contrôle de la course du diaphragme au cours des différents mouvements et postures. Une amélioration de la fonction pulmonaire est donc possible, bien que ce point ait fait l’objet de controverses importantes (Guo et coll., 2016
). La littérature scientifique est riche en travaux montrant que des pratiques régulières d’intensité modérée sont capables d’induire des adaptations musculo-squelettiques et cardiovasculaires compatibles avec une amélioration de la santé. Le Tai Chi peut donc être une alternative intéressante pour des patients ayant des difficultés à entrer dans des programmes de prescription de l’exercice musculaire en raison d’une dyspnée trop pénalisante. Il permet notamment un travail important sur le contrôle de la course du diaphragme au cours des différents mouvements et postures. Une amélioration de la fonction pulmonaire est donc possible, bien que ce point ait fait l’objet de controverses importantes (Guo et coll., 2016 ).
). ; Yan et coll., 2013
; Yan et coll., 2013 ). Cette technique est donc bien tolérée par les patients et les données concernant l’adhésion à la pratique sont excellentes (de 83 à 100 % selon les travaux ; Yan et coll., 2013
). Cette technique est donc bien tolérée par les patients et les données concernant l’adhésion à la pratique sont excellentes (de 83 à 100 % selon les travaux ; Yan et coll., 2013 ). Quand les patients pratiquant le Tai Chi sont comparés à des groupes ne recevant que des soins courants (donc hors réhabilitation respiratoire), toutes les méta-analyses mettent en évidence un effet significatif sur la tolérance à l’effort mesurée par le test de marche de 6 minutes [quelles que soient les méta-analyses, la distance au test augmente en moyenne d’une trentaine de mètres (Chen et coll., 2016
). Quand les patients pratiquant le Tai Chi sont comparés à des groupes ne recevant que des soins courants (donc hors réhabilitation respiratoire), toutes les méta-analyses mettent en évidence un effet significatif sur la tolérance à l’effort mesurée par le test de marche de 6 minutes [quelles que soient les méta-analyses, la distance au test augmente en moyenne d’une trentaine de mètres (Chen et coll., 2016 ; Ding et coll., 2014
; Ding et coll., 2014 ; Guo et coll., 2016
; Guo et coll., 2016 ; Ngai et coll., 2016
; Ngai et coll., 2016 ; Wu et coll., 2014
; Wu et coll., 2014 ; Yan et coll., 2013
; Yan et coll., 2013 )] et sur la fonction respiratoire quand celle-ci est rapportée [avec un gain de VEMS de l’ordre de 0,10 L (Ding et coll., 2014
)] et sur la fonction respiratoire quand celle-ci est rapportée [avec un gain de VEMS de l’ordre de 0,10 L (Ding et coll., 2014 ; Guo et coll., 2016
; Guo et coll., 2016 ; Ngai et coll., 2016
; Ngai et coll., 2016 ; Yan et coll., 2013
; Yan et coll., 2013 )]. Cette belle unanimité n’est malheureusement pas retrouvée sur la réduction de la dyspnée et l’amélioration de la qualité de vie des patients qui ne sont pas systématiquement significatives (Chen et coll., 2016
)]. Cette belle unanimité n’est malheureusement pas retrouvée sur la réduction de la dyspnée et l’amélioration de la qualité de vie des patients qui ne sont pas systématiquement significatives (Chen et coll., 2016 ), notamment dans la méta-analyse publiée par la prestigieuse Cochrane Library (Ngai et coll., 2016
), notamment dans la méta-analyse publiée par la prestigieuse Cochrane Library (Ngai et coll., 2016 ). Par conséquent, si les impacts fonctionnels de la pratique du Tai Chi sont avérés, ses effets sur des variables plus subjectives liées à l’expérience personnelle de la dyspnée et de l’impact de la maladie sur la qualité de vie ne bénéficient pas actuellement d’un niveau de preuve suffisant. Enfin, quand il est comparé à d’autres techniques basées essentiellement sur de l’activité physique d’endurance, le Tai Chi n’induit aucun effet supérieur ou additionnel (Ding et coll., 2014
). Par conséquent, si les impacts fonctionnels de la pratique du Tai Chi sont avérés, ses effets sur des variables plus subjectives liées à l’expérience personnelle de la dyspnée et de l’impact de la maladie sur la qualité de vie ne bénéficient pas actuellement d’un niveau de preuve suffisant. Enfin, quand il est comparé à d’autres techniques basées essentiellement sur de l’activité physique d’endurance, le Tai Chi n’induit aucun effet supérieur ou additionnel (Ding et coll., 2014 ; Ngai et coll., 2016
; Ngai et coll., 2016 ) ou alors de façon très marginale (Wu et coll., 2014
) ou alors de façon très marginale (Wu et coll., 2014 ).
). ). Des effets semblables sont obtenus sur la capacité maximale d’exercice et sur les performances au test de marche de 6 minutes et à l’ISWT. Enfin, les programmes semblent avoir été plus efficaces quand ils ont été réalisés en milieu hospitalier.
). Des effets semblables sont obtenus sur la capacité maximale d’exercice et sur les performances au test de marche de 6 minutes et à l’ISWT. Enfin, les programmes semblent avoir été plus efficaces quand ils ont été réalisés en milieu hospitalier. et 13.II
et 13.II présentent sous forme comparative les principaux éléments de ces recommandations. Elles ont été édictées par l’ATS/ERS (recommandations communes de l’American Thoracic Society et de l’European Respiratory Society, Spruit et coll., 2013
présentent sous forme comparative les principaux éléments de ces recommandations. Elles ont été édictées par l’ATS/ERS (recommandations communes de l’American Thoracic Society et de l’European Respiratory Society, Spruit et coll., 2013 ), la GOLD (Global Initiative for Chronic Obstructive Lung Disease, 2017
), la GOLD (Global Initiative for Chronic Obstructive Lung Disease, 2017 ), la SPLF (Société de Pneumologie de Langue Française, 2010
), la SPLF (Société de Pneumologie de Langue Française, 2010 ) et la HAS (Haute Autorité de santé, 2014
) et la HAS (Haute Autorité de santé, 2014 ).
). ), souvent basées sur une valeur individualisée au seuil ventilatoire13
(Vallet et coll., 1997
), souvent basées sur une valeur individualisée au seuil ventilatoire13
(Vallet et coll., 1997 ).
). ). Il est actuellement évident que les effets induits ne seront pas maintenus si les patients ne continuent pas de pratiquer une ou des activités physiques sur le long terme. Par conséquent, et dans le cadre d’une prévention secondaire et tertiaire, il est urgent de prendre conscience que se fixer comme but prioritaire l’obtention des effets les plus importants à court terme (et donc les pratiques les plus intenses) est une attitude peu pertinente et peu responsable sur le long terme. Il convient donc de changer de priorité et de travailler sur les multiples déterminants du changement de comportement vis-à-vis de l’activité physique qui doit être progressivement perçue comme faisant partie intégrante de la prise en charge de sa pathologie par le patient lui-même. De ce point de vue, le plaisir dans la pratique et son abord valorisant et positif sont d’une importance considérable. Concernant la fréquence et la durée des séances, il est plus simple de faire une synthèse allant au-delà des différentes recommandations : une pratique aussi régulière que possible est souhaitable (un jour sur deux ou tous les jours si possible) et des durées de pratique minimales de 30 minutes semblent une position assez partagée dans les recommandations.
). Il est actuellement évident que les effets induits ne seront pas maintenus si les patients ne continuent pas de pratiquer une ou des activités physiques sur le long terme. Par conséquent, et dans le cadre d’une prévention secondaire et tertiaire, il est urgent de prendre conscience que se fixer comme but prioritaire l’obtention des effets les plus importants à court terme (et donc les pratiques les plus intenses) est une attitude peu pertinente et peu responsable sur le long terme. Il convient donc de changer de priorité et de travailler sur les multiples déterminants du changement de comportement vis-à-vis de l’activité physique qui doit être progressivement perçue comme faisant partie intégrante de la prise en charge de sa pathologie par le patient lui-même. De ce point de vue, le plaisir dans la pratique et son abord valorisant et positif sont d’une importance considérable. Concernant la fréquence et la durée des séances, il est plus simple de faire une synthèse allant au-delà des différentes recommandations : une pratique aussi régulière que possible est souhaitable (un jour sur deux ou tous les jours si possible) et des durées de pratique minimales de 30 minutes semblent une position assez partagée dans les recommandations.