II. Approches par pathologies
2019
16-
Cancers
Grâce aux progrès thérapeutiques, la survie relative à 5 ans après un cancer, tous cancers confondus, se situe aujourd’hui entre 50 et 60 % (Inca et coll., 2010

). Cependant, les effets secondaires à court, moyen et long termes, variables en fonction du type de cancer, de l’évolution de la maladie et des traitements, sont nombreux et conduisent à une altération de l’état général et de la qualité de vie des patients. Un déconditionnement physique et psychosocial associé à une altération des capacités cardiorespiratoires et une diminution de la force et de la masse musculaires (sarcopénie), sont couramment observés, indépendamment du stade de la maladie et de l’état nutritionnel (Lakoski et coll., 2012

; Siegel et coll., 2012

). Les mécanismes sous-jacents restent à préciser, mais impliquent entre autres des processus inflammatoires systémiques et métaboliques (Siegel et coll., 2012

; Lakoski et coll., 2012

; Christensen et coll., 2014

). D’origine multifactorielle, le déconditionnement est une conséquence des processus néoplasiques, des traitements, notamment de la chimiothérapie, et de la baisse fréquente de l’activité physique. Il se trouve aggravé par l’existence de comorbidités cardiovasculaires ou métaboliques (diabète de type2, obésité), présentes selon les études, chez 30 à 80 % des patients (Christensen et coll., 2014

). Le déconditionnement cardiorespiratoire, l’altération du fonctionnement musculaire et la sarcopénie constituent des facteurs de mauvais pronostic et sont associés à une augmentation des effets secondaires, une moindre efficacité des traitements et une diminution significative de la survie globale des tumeurs solides, indépendamment du stade au diagnostic (Christensen et coll., 2014

; Shachar et coll., 2016

). Le déconditionnement est à l’origine d’une fatigue invalidante, d’une diminution de la qualité de vie et d’une intolérance à l’exercice (Siegel et coll., 2012

; Burnett et coll., 2013

; Christensen et coll., 2014

; Inca, 2017

).
La fatigue, dans toutes ses dimensions, physique, cognitive et émotionnelle, est l’effet secondaire le plus fréquent de la maladie. Elle est retrouvée chez 28 à 90 % des patients, et 80 à 90 % de ceux recevant une chimiothérapie ou une radiothérapie. Chez de nombreux patients, la fatigue persiste jusqu’à plusieurs années après la maladie (Siegel et coll., 2012

). Elle est fréquemment associée à la dépression, une diminution de la qualité de vie et de la qualité du sommeil, ainsi qu’à la douleur (de Jong et coll., 2002

). La baisse fréquente de l’activité physique (Kwan et coll., 2012

; Foucaut, 2013

; Van Blarigan et Meyerhardt, 2015

; Fassier et coll., 2016

), et l’existence d’une sédentarité, plus importante qu’en population générale (Kim et coll., 2013b

) peuvent conduire le patient vers un cercle vicieux d’aggravation du déconditionnement physique et augmenter la fatigue (Inca, 2017

). Par ailleurs, la sédentarité, facteur de risque de certains cancers, indépendant de l’activité physique, pourrait également avoir un impact sur la santé des patients après un cancer (Lynch, 2010

; Lynch et coll., 2013

; Vallance et coll., 2014

; Nelson et coll., 2016

).
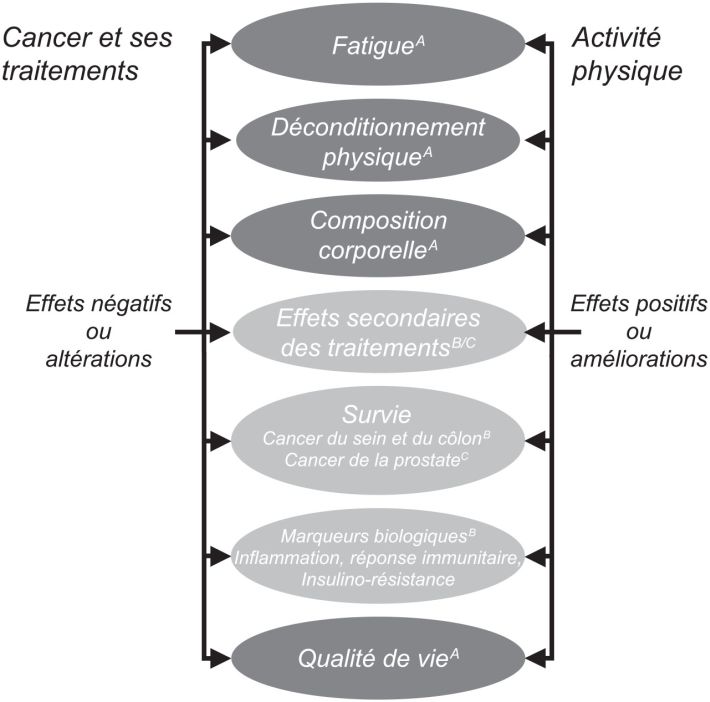
De très nombreuses études prospectives, essais randomisés et méta-analyses ont étudié l’activité physique chez les patients atteints de cancer et montrent un ratio bénéfice-risque favorable de l’activité physique sur les conséquences de la maladie et effets secondaires des traitements (figure 16.1

). La plupart des études a porté sur les cancers du sein, du côlon et de la prostate, et la grande majorité s’est intéressée aux personnes atteintes de cancer à un stade précoce. Les études ont évalué l’effet de l’activité physique pendant et après la fin des traitements. Peu de travaux ont porté sur l’impact de l’activité physique en situation néo-adjuvante ou chez des personnes atteintes de cancer à un stade avancé.
En 2017, l’Institut national du Cancer (INCa) a publié un état des lieux des connaissances concernant les « Bénéfices de l’Activité physique pendant et après un cancer » (Inca, 2017

). Le présent chapitre a pris en compte les conclusions de cette expertise, tout en étudiant davantage l’effet de l’activité physique sur les effets secondaires et conséquences des traitements.
Malgré les résultats convergents en faveur d’un ratio bénéfice-risque largement favorable de l’activité physique chez les patients atteints de cancer, on constate une grande hétérogénéité des études, en ce qui concerne les objectifs et effets étudiés ; les situations cliniques (types et stades de cancer, traitements) ; les programmes d’activité physique étudiés (intensité, durée, fréquence, type d’activité physique, type et durée du programme) ; la période de la pratique (avant, pendant ou après les traitements) ; les outils utilisés pour l’évaluation de l’activité physique et de l’effet ; la qualité des études (Inca, 2017

). L’hétérogénéité des études rend certaines comparaisons difficiles et pourrait contribuer à une éventuelle sous-estimation des effets de l’activité physique. Ainsi, le recrutement basé sur le volontariat, aurait pu conduire à un recrutement de patients plus actifs, et peu d’études ont sélectionné ou stratifié les patients en fonction du niveau d’activité physique de départ. Dennett et coll. (2016

) dans une méta-analyse de 42 essais randomisés, notent un taux d’inclusion médian de 63 % des patients éligibles. Très peu d’études ont rapporté les caractéristiques des non-participants (âge, niveau d’activité physique, caractéristiques socioéconomiques) et les raisons de non-participation, ce qui rend difficile d’apprécier l’existence d’un biais de sélection pouvant être à l’origine d’une sur- ou sous-estimation de l’effet (Dennett et coll., 2016

). Un manque de puissance, notamment pour les effets de l’activité physique évalués en tant qu’objectif secondaire, a également pu contribuer à une sous-estimation dans certaines études. Enfin, l’augmentation de l’activité physique chez les patients du groupe contrôle a pu impacter les résultats de certaines études, mais peu d’informations sont disponibles pour apprécier un éventuel biais de contamination. Enfin, on note, pour grand nombre d’études, l’absence de progressivité du niveau d’activité physique dans le protocole d’entraînement (Campbell et coll., 2012

; Sasso et coll., 2015

).
Nous revoyons dans le présent chapitre les données de la littérature relatives à l’impact de l’activité physique sur le déconditionnement physique et la composition corporelle, la fatigue, les effets secondaires des traitements, la qualité de vie et la survie des patients atteints de cancer. Nous analysons ensuite les effets secondaires et contre-indications relatives à l’activité physique, et aborderons les indications spécifiques de l’activité physique en fonction des étapes de la maladie et de sa prise en charge.
Impact de l’activité physique sur le déconditionnement physique et la composition corporelle
De nombreuses méta-analyses et revues systématiques ont évalué l’effet de l’activité physique structurée sur le déconditionnement cardiorespiratoire et musculaire, ainsi que la composition corporelle.
Capacités aérobies
Malgré la grande hétérogénéité des programmes d’activité physique ayant évalué les effets sur les capacités cardiorespiratoires (type de cancer, traitements, taille des effectifs, durée de suivi, type d’exercices, fréquence, durées, méthodes d’évaluation et de mesure des capacités cardiorespiratoires), les études montrent de façon convergente une amélioration des capacités cardiorespiratoires et fonctionnelles, aussi bien pendant qu’après les traitements (Inca, 2017

). Nous reportons ici les principales méta-analyses sur le sujet.
La méta-analyse de Speck et coll. (2010

) incluant 66 essais randomisés (83 % de femmes atteintes de cancer du sein) ayant évalué la mise en œuvre d’un programme d’activité physique au cours (40 %) ou dans les suites du traitement (programmes de 5 semaines en moyenne, 80 % activité physique de type aérobie seule ou combinée, d’une intensité modérée à intense
1
Dans cet article, intensité modérée à intense est définie comme une activité physique aérobie qui débute à 40 % de la fréquence cardiaque de réserve ou une activité en résistance qui débute à 60 % d’une répétition maximum ; pour une discussion sur les définitions de l’intensité de l’exercice, voir le chapitre « Notions préalables ».
), montre une amélioration modérée, mais significative des capacités cardiorespiratoires pendant les traitements (17 études, taille de l’effet moyennes pondérées 0,33 ; IC 95 % [0,08-0,57], p = 0,009, I
2 = 73 %) et après les traitements (14 études, taille de l’effet moyennes pondérées 0,32 ; IC 95 % [0,036-0,59], p = 0,03, I
2 = 65,6 %) (Speck et coll., 2010

). Le suivi et les modalités d’évaluation ne sont pas précisés.
Une autre méta-analyse de 6 essais randomisés (dont 3 concernant le cancer du sein) incluant au total 571 patients (âge moyen de 49 à 66 ans selon les études) ayant mesuré directement les capacités cardiorespiratoires par le pic de consommation maximale d’oxygène (V̇O
2pic), rapporte une amélioration de la V̇O
2pic (+ 2,9 mL.min
-1.kg
-1 ; IC 95 % [1,16-4,64]) dans les groupes d’intervention, tandis que les valeurs de V̇O
2pic baissent chez les patients du groupe sans intervention (en moyenne de -1,02 mL.min
-1.kg
-1 (IC 95 % [-1,46 -0,58])) (Jones et coll., 2011

). L’hétérogénéité des études ne permet pas d’identifier l’influence du type d’exercice sur les réponses physiologiques. À noter que l’amélioration de V̇O
2pic est plus importante pour l’activité physique après traitement que pendant les traitements (3,36 mL.min
-1.kg
-1versus 1,21 mL.min
-1.kg
-1) (p < 0,001).
La méta-analyse de Fong et coll. (2012) de 34 essais randomisés (âge moyen 55 ans [39-74]), ayant évalué l’activité physique de type aérobie (86 %) ou combinée à du renforcement musculaire (14 %), rapporte une amélioration significative de la fonction cardiorespiratoire, des performances aérobies (7 essais, V̇O
2pic 2,2 mL.min
-1.kg
-1 (IC 95 % [1,0-3,4] ; p < 0,01, I
2 = 18 %)), du pic de puissance mesuré sur l’ergomètre (3 essais Ppic 21,0 W (IC 95 % [13,0-29,1] ; p < 0,01, I
2 = 0 %)) et de la distance de marche (5 essais, test de marche 6 minutes (29 m (IC 95 % [4-55] ; p < 0,03, I
2 = 20 %)) pour des programmes d’activité physique après traitement (durée moyenne 13 semaines [3-60]). L’ensemble de ces données concerne des patientes atteintes de cancer du sein. Seulement 13 études décrivent l’intensité des exercices (11 études appliquent un programme d’activité physique d’intensité modérée, et deux d’intensité élevée) (Fong et coll., 2012

).
Une revue
Cochrane (Mishra et coll., 2012b

) de 56 essais randomisés (4 826 patients atteints de différents types de cancer, âge moyen dans les études entre 40 et 71 ans) a évalué les effets d’un programme d’activité physique sur différentes composantes, dont les capacités fonctionnelles (mesures principalement par questionnaire ou parfois combinées à des tests de performances) pour des intensités d’exercices physiques modérées à élevées. Les auteurs rapportent une amélioration des capacités fonctionnelles à 12 semaines (8 études, 540 patients, différence moyenne standardisée (DMS) 0,69 ; IC 95 % [0,16-1,22]) ou à 6 mois (4 études, 305 patients, DMS 0,28 ; IC 95 % [0,00-0,55]).
Une méta-analyse de 15 essais randomisés (1 135 patients atteints de cancer de la prostate de 50 à 80 ans), dont 4 (261 patients) ayant évalué les effets d’un programme d’activité physique sur le V̇O
2pic, rapportent une amélioration significative du V̇O
2pic après un suivi de plus de 6 mois (DMS 0,59 ; IC 95 % [0,16-1,03] ; p = 0,007, I
2 = 0 %) (Yunfeng et coll., 2017

).
Une méta-analyse de trois essais incluant 178 patients ayant subi une résection pulmonaire pour cancer du poumon (âge moyen entre 63 et 65 ans, 63 % hommes) montre qu’un programme d’entraînement améliore les capacités aérobies, évalués par le test de marche de 6 minutes (+ 50 m ; IC 95 % [15-85]) (Cavalheri et coll., 2014

). En revanche, les deux essais ayant évalué l’impact sur la fonction pulmonaire, ne retrouvent pas de différence significative.
La méta-analyse de Kim et coll. (2009) incluant 10 essais randomisés (588 femmes atteintes de cancer du sein ; 51,1 ± 4,6 ans), montre qu’un programme d’activité physique améliore significativement le V̇O
2pic (3 essais ; DMS 0,92 L/min ; IC 95 % [0,37-1,47] ; p < 0,001) et la distance de marche (3 essais ; DMS 0,50 m ; IC 95 % [0,20-0,80] ; p < 0,001) (Kim et coll., 2009

).
Une méta-analyse
Cochrane (Furmaniak et coll., 2016

), mise à jour de la méta-analyse de Markes (Markes et coll., 2006

de 32 essais randomisés évaluant l’effet de l’activité physique pendant les traitements (néo)adjuvants (radiothérapie, chimiothérapie) chez des femmes atteintes de cancer du sein, montre sur la base de 15 essais (1 310 femmes, suivi 18 semaines à 6 mois) une amélioration significative de la capacité cardiorespiratoire (différence moyenne standardisée DMS 0,42 ; IC 95 % [0,25-0,59] ; p < 0,00001, I
2 = 49 %), évaluée par le V̇O
2pic (12 études) et/ou la distance de marche (8 études).
Une amélioration des capacités fonctionnelles chez des patients atteints de cancer ORL a été suggérée dans la revue systématique de Capozzi et coll. (2016), mais les données sont limitées (Capozzi et coll., 2016

).
En situation de cancer avancé, la revue systématique de Dittus et coll. (2017) de 26 études avec des méthodologies et populations hétérogènes, suggère que l’activité physique, chez des personnes atteintes d’un cancer avancé, permet de maintenir ou d’améliorer la capacité aérobie, évaluée par le V̇O
2pic et/ou la distance de marche : 14 études sur 19 (74 %) montrent une amélioration significative et les 5 restantes un maintien (Dittus et coll., 2017

).
En résumé, les méta-analyses d’essais randomisés montrent une amélioration des capacités cardiorespiratoires (V̇O
2pic ou distance de marche) associée à l’activité physique supervisée (niveau de preuve A). L’impact de l’activité physique a surtout été étudié pour des patients atteints de cancer du sein (Kim et coll., 2009

; Furmaniak et coll., 2016

) et de la prostate (Yunfeng et coll., 2017

). L’amélioration des capacités cardiorespiratoires a été montrée lorsque le programme d’activité physique est initié au début de la chimiothérapie, dès la fin des traitements, ou à distance de ceux-ci (niveau de preuve A).
Plusieurs études et méta-analyses ont montré une corrélation significative entre la distance de marche, évaluée par le test de marche de 6 minutes, le V̇O
2pic et la perception de la forme physique par les patients atteints de cancer (évalué par le questionnaire de type SF-36 le plus souvent) (Speck et coll., 2010

; Schmidt et coll., 2013

). Le test de marche de 6 minutes peut donc
a priori être utilisé pour évaluer la capacité aérobie d’un patient atteint de cancer. La différence minimale considérée comme cliniquement importante chez les patients atteints de cancer est de 25 m (Fong et coll., 2012

). L’amélioration du V̇O
2pic couramment observée varie de 1,7 à 3,4 mL.min
-1.kg
-1, soit approximativement de 8 à 12 % des valeurs initiales, et ce pour des programmes de six à huit semaines. Dans le même temps, les données montrent, de façon convergente, une baisse des valeurs de V̇O
2pic chez les patients des groupes contrôle. Pendant les traitements, l’activité physique peut donc prévenir une baisse des capacités aérobies, et améliorer de façon significative le V̇O
2pic. Les programmes d’intensité modérée et élevée ont permis d’obtenir des résultats positifs. Cependant, plus la période d’observation est prolongée, moins les effets de l’activité physique sur l’augmentation des valeurs de V̇O
2pic sont marqués (Yu et Jones, 2016

). L’absence d’adaptation et de progressivité de l’intensité de l’exercice au cours du programme pourrait expliquer ces observations (Sasso et coll., 2015

). Cela souligne l’importance de l’observance et de l’ajustement de l’intensité des exercices dans le temps (Sasso et coll., 2015

; Inca, 2017

). Aussi, les modalités et déterminants de l’activité physique au-delà des programmes supervisés initiaux restent à déterminer (Kampshoff et coll., 2014

). En situation de cancer avancé, l’activité physique permet d’améliorer ou maintenir les capacités cardiorespiratoires. Il semblerait qu’il y ait un effet de l’intensité des exercices sur l’augmentation des capacités cardiorespiratoires et leur maintien dans le temps (Inca, 2017

).
Masse et force musculaires
Les patients atteints de cancer ont un risque accru de perte de la masse et de la force musculaires, par deux mécanismes distincts : la sarcopénie, définie comme la diminution de la masse musculaire, de la force et de la fonction musculaires associée à l’âge ; et la cachexie (cf. ci-dessous), conséquence des modifications métaboliques associées au processus tumoral et aux traitements. À noter que la perte de la force musculaire n’est pas seulement une conséquence de l’atrophie musculaire, mais résulte également d’un dysfonctionnement contractile significatif (Roberts et coll., 2013

). Une moindre force musculaire est associée à une mortalité spécifique accrue après cancer (Dankel et coll., 2018

). La sarcopénie et le syndrome cachectique concernent respectivement 15 à 50 % et 25 à 80 % des patients atteints de cancer et peuvent être présents simultanément (Argiles et coll., 2014

; Peterson et Mozer, 2017

).
La méta-analyse de Speck montre une amélioration significative de la force musculaire liée à l’activité physique pendant les traitements (haut du corps, 8 essais, effet moyennes pondérées 0,39 (IC 95 % [0,12-0,65], p = 0,005, I
2 = 57,7 %) ; bas du corps, 7 essais, effet moyennes pondérées 0,24 (IC 95 % [0,07-0,41], p = 0,006, I
2 = 0 %)) et après les traitements (haut du corps : 6 essais, effet moyennes pondérées 0,99 (IC 95 % [0,67-1,32], p = 0,0001, I
2 = 14,6 %) ; bas du corps : 7 essais, effet moyennes pondérées 0,90 (IC 95 % [0,12-1,68], p = 0,024, I
2 = 80,9 %)). En revanche, il n’y a pas d’augmentation significative de la masse maigre dans les 5 études ayant évalué ce paramètre pendant les traitements (5 essais) et après (5 essais), bien que certaines études montraient individuellement une amélioration significative. Ceci suggère une amélioration de la qualité musculaire, c’est-à-dire de la force développée par kg de muscle (Speck et coll., 2010

).
La méta-analyse de Fong et coll. (2012

) ne retrouve pas d’impact de l’activité physique sur la masse musculaire (Fong et coll., 2012

) (évalué dans 7 essais de patientes atteintes de cancer du sein, I
2 = 0 %). L’étude rapporte en revanche une amélioration significative de la force musculaire, évaluée par différents tests (poids de la presse de banc (muscles de l’épaule, pectoraux, biceps) (6 kg ; IC 95 % [4-8], p < 0,01) et poids de la presse à cuisses (19 kg ; IC 95 % [9-28], p < 0,01), force de préhension des mains et avant-bras (3,5 kg ; IC 95 % [0,3-6,7], p < 0,001) dans 5 essais (I2 [54-71 %]). L’amélioration de la force de préhension des mains et avant-bras droits (évaluée par le test de serrage
grip test) n’est pas jugée cliniquement pertinente. La revue de Stene et coll. (2013

) de 16 essais randomisés a évalué l’activité physique de type aérobie, renforcement musculaire ou combiné, chez des patients en cours de traitement (cancers du sein, de la prostate et du côlon, hémopathies malignes). Seules six études (cancer du sein, prostate, pathologies hématologiques) ont étudié la masse musculaire et ont montré un maintien de cette masse musculaire chez les patients bénéficiant du programme d’activité physique, par rapport aux patients sans activité physique. Quatorze essais ont évalué la force musculaire. Respectivement 5, 3 et 7 essais rapportent une amélioration de la force musculaire avec de l’activité physique aérobie, de renforcement musculaire ou combinée (Stene et coll., 2013

).
La méta-analyse de Kim et coll. (2009) incluant 10 essais randomisés (588 femmes atteintes de cancer du sein ; 51,1 ± 4,6 ans), ne décrit pas d’amélioration significative de la masse musculaire (3 essais, 80 patientes) (Kim et coll., 2009

).
La méta-analyse de Bourke et coll. (2013) retrouve une amélioration de la force musculaire (évaluée dans 3 essais, 91 patients) (DMS 0,51 ; IC 95 % [0,09-0,93]) (Bourke et coll., 2013

).
La méta-analyse de Strasser et coll. (2013) ayant inclus 11 essais randomisés rapporte un bénéfice significatif de l’activité physique de renforcement sur la force musculaire des membres inférieurs et supérieurs, pendant ou après le traitement (différence moyenne pondérée + 14,6 kg, p = 0,0005 et + 6,9 kg, p < 0,00001, respectivement) et des effets modérés sur la masse musculaire évaluée par DEXA
2
Absorptiométrie biphotonique à rayons X (Dual x-ray absorptiometry, DEXA).
(différence moyenne pondérée + 1,1 kg, p < 0,0001) (Strasser et coll., 2013

).
Enfin, une étude randomisée (Adams et coll., 2016

) a évalué chez 200 patientes atteintes de cancer du sein localisé de façon spécifique, l’effet d’une intervention d’activité physique pendant la chimiothérapie adjuvante sur la sarcopénie (rapport masse maigre (évaluée par DEXA) en kg/taille en m
2, – 1 à 2 DS par rapport à la moyenne pour l’âge et le sexe) et la force musculaire (poids levé (kg)/masse corporelle (kg), – 1 à 2 DS par rapport à la moyenne pour l’âge et le sexe). Pour les exercices de renforcement (66 patientes), les résultats montrent une amélioration significative de la sarcopénie (0,32 kg/m
2, p = 0,017) et de la force musculaire des membres supérieurs (0,12 kg de poids soulevé/kg de masse corporelle ; p < 0,001) et inférieurs (0,27 kg de poids soulevé/kg de masse corporelle ; p < 0,001). L’activité physique de renforcement est également supérieure comparativement aux groupes « soins courants » (70 patientes) et « activité physique aérobie » (64 patientes) réunis, pour la sarcopénie (p = 0,039) et la force musculaire (p = 0,019).
En résumé, prévenir la perte de masse et de fonction musculaires pendant les traitements du cancer peut aider à maintenir les activités de la vie quotidienne, et ainsi la qualité de vie des patients (Inca, 2017

). L’activité physique de renforcement pendant et dans les suites des traitements améliore la force des groupes musculaires sollicités (Niveau de preuve A). Les résultats en termes d’impact sur la masse musculaire sont hétérogènes (Niveau de preuve C). Ce paramètre a été évalué dans un plus petit nombre d’études, et la plupart d’entre elles avaient un suivi à court terme. L’hétérogénéité peut résulter en partie de la technique de mesure de la masse musculaire qui n’est pas facile à évaluer en pratique courante. L’activité physique aérobie semble avoir des effets moins complets sur les qualités du muscle. Les données de la littérature relatives aux pratiques d’entraînement chez les personnes indemnes de cancer, suggèrent que la pratique d’activités aérobies (avec les activités de renforcement musculaire) peut atténuer l’augmentation de la masse musculaire, mais les mécanismes de cet effet « d’interférence » ne sont pas connus (Coffey et Hawley, 2017

).
Enfin, il manque des études chez des patients à des stades avancés et/ou ayant une pathologie hématologique avec greffe et recevant de fortes doses de chimiothérapie associées à une fonte musculaire.
Cachexie
Le syndrome cachectique concerne plus particulièrement les patients atteints de cancers ORL, bronchopulmonaire, gastrique, hépatocellulaire ou pancréatique (Porporato, 2016

). Le syndrome cachectique, conséquence du processus tumoral et des traitements, est un facteur de mauvais pronostic et est associé à une mortalité augmentée (Shachar et coll., 2016

). Différentes modifications métaboliques contribuent à la perte de la masse musculaire associée à la cachexie cancéreuse et contribuent à cette perte musculaire (anomalies dans la synthèse et dégradation (protéolyse) des protéines et du métabolisme des acides aminés (transport et oxydation) ; augmentation de l’apoptose et diminution de la capacité de régénération) (Argiles et coll., 2014

). Le syndrome cachectique est responsable d’une diminution de l’activité physique, d’une augmentation de la fatigue, et est associé à une augmentation des effets indésirables et une moindre efficacité des traitements (Inca, 2017

).
Malgré un rationnel scientifique et des données expérimentales suggérant un bénéfice de l’activité physique dans la gestion de la cachexie (voir chapitre « Mécanismes moléculaires du déconditionnement musculaire et des adaptations musculaires à l’exercice dans les pathologies chroniques »), très peu d’études ont évalué les bénéfices de l’activité physique sur la cachexie chez les patients atteints de cancers. Une revue
Cochrane (Grande et coll., 2014

), n’a pas permis d’identifier des essais randomisés ayant étudié le bénéfice de l’activité physique sur la masse musculaire chez des patients atteints de syndrome cachectique, ni son acceptabilité ou la sécurité de l’exercice dans cette population.
Composition corporelle
Plus de 50 % des patients, tous types de cancer confondus, sont en surpoids ou obèses au moment du diagnostic (rapport Vican2
3
: Inca, 2014

), données comparables à la population générale du même âge ; et 40 % des patients passent dans une catégorie IMC supérieure pendant ou après les traitements. Cette prise de poids, qui concerne plus particulièrement les femmes atteintes de cancer du sein, est favorisée par l’âge jeune au diagnostic, la chimiothérapie, le manque d’activité physique et l’existence d’un surpoids ou d’une obésité avant le diagnostic. Le surpoids et l’obésité chez des patients atteints de cancer sont associés à une augmentation significative de la mortalité globale et spécifique, notamment pour le cancer du sein (Chan et coll., 2014

).
De nombreuses méta-analyses et revues systématiques (McNeely et coll., 2006

; Kim et coll., 2009

; Speck et coll., 2010

; Wolin et coll., 2010

; Fong et coll., 2012

; Sheean et coll., 2012

; Strasser et coll., 2013

) ont évalué l’impact de l’activité physique, pendant et après le traitement, sur la composition corporelle. La plupart des études concernent les femmes atteintes de cancer du sein. Malgré la grande diversité des programmes d’activité physique rapportés dans les méta-analyses, l’activité physique commencée pendant et/ou après le traitement est le plus souvent associée à une réduction de poids, d’IMC, et de masse grasse (Niveau de preuve A). Les données en termes d’impact sur la masse musculaire sont hétérogènes (Niveau de preuve C). Cette divergence peut être liée à différents facteurs pouvant influencer la composition corporelle : statut ménopausique, régimes alimentaires, types d’activité physique, durée et intensité des programmes (Sheean et coll., 2012

). D’après les données de plusieurs méta-analyses, un programme d’activité physique comprenant du renforcement musculaire, a un effet plus important sur la masse musculaire et la composition corporelle qu’une activité aérobie seule (McNeely et coll., 2006

; Kim et coll., 2009

; Speck et coll., 2010

; Wolin et coll., 2010

; Fong et coll., 2012

; Inca, 2017

). La combinaison optimale des deux types d’activité physique reste à déterminer (Sasso et coll., 2015

).
Lorsque les interventions sont limitées aux femmes ménopausées, la majorité des études interventionnelles montre un effet favorable de l’activité physique, avec une diminution du pourcentage de masse grasse et un gain ou un maintien de masse musculaire chez des femmes initialement inactives (Inca, 2017

) (Niveau de preuve A). Dans une revue systématique récente, les interventions qui se sont avérées efficaces chez les patients atteints d’un cancer, obèses ou en surpoids, combinaient l’activité physique et une prise en charge nutritionnelle (Hoedjes et coll., 2017

). Ces approches permettent d’éviter la perte de masse musculaire, observée pour des interventions nutritionnelles seules (Hoedjes et coll., 2017

).
Impact sur la fatigue
La fatigue chronique est l’effet secondaire le plus fréquent de la maladie, retrouvée chez 80 à 90 % des patients recevant une chimiothérapie ou une radiothérapie, et restant cliniquement significatif chez 50 % des personnes 5 ans après un cancer. Cette fatigue chronique est à distinguer de la fatigue aiguë après un exercice dont on récupère avec du repos. De très nombreux essais randomisés et méta-analyses ont analysé l’effet de l’activité physique sur la fatigue chez les patients atteints de cancer, pendant et après les traitements.
Dans la méta-analyse de Speck et coll. (2010) de 66 essais randomisés sélectionnés sur la qualité méthodologique (83 % de femmes atteintes de cancer du sein), respectivement 15 et 14 essais ont analysé les effets de l’activité physique pendant et après les traitements (Speck et coll., 2010

). Un bénéfice significatif sur la fatigue a été observé pour les études ayant évalué un programme d’activité physique après traitement (effet moyennes pondérées -0,54 ; IC 95 % [-0,90 à -0,19] ; p < 0,003 ; I2 = 84,9 %).
La méta-analyse
Cochrane incluant 56 études (1 461 patients ayant suivi un programme d’activité physique et 1 187 participants « contrôles » ; âge moyen 39 à 70 ans), dont 50 % portant sur le cancer du sein, rapporte un effet statistiquement significatif sur la réduction de la fatigue et ce pendant (DMS -0,23 ; IC 95 % [-0,33 ; -0,12], I2 = 0 %) et après (DMS -0,44 ; IC 95 % [-0,79 ; -0,09], I2 = 72,0 %) les traitements adjuvants (Cramp et Byron-Daniel, 2012

). La réduction significative de la fatigue est observée chez les patients porteurs de cancer du sein et de la prostate, mais pas pour les hémopathies malignes. L’effet significatif est observé pour des programmes d’activité physique aérobie (DMS -0,22 ; IC 95 % [-0,34 ;-0,10], I2 = 20,0 %), mais pas pour des programmes de renforcement musculaire (DMS -0,18 ; IC 95 % [-0,39-0,02], I2 = 0 %). Aucun effet n’a été rapporté pour des interventions « corps-esprit » (
mind-body interventions, yoga, Chi Gong) (DMS -0,10 ; IC 95 % [-0,39-0,19], I2 = 0 %).
Une méta-analyse récente de 42 essais randomisés (3 816 patients ; âge moyen 55 ans) dont 70 % de femmes et 81 % de patients porteurs de tumeurs solides, principalement des cancers du sein (64 %) et de la prostate (26 %), a évalué l’impact des programmes d’activité physique pendant (30 études) et après les traitements (Dennett et coll., 2016

). L’activité physique comportait des activités à dominante aérobie (45 %), de renforcement musculaire (12 %) ou combinant les 2 (33 %), dans des programmes supervisés (55 %) ou libres (45 %), réalisés ou non en centre spécialisé, de deux semaines à un an. L’analyse poolée de 34 études montre une diminution significative de la fatigue (DMS 0,32 ; IC 95 % [0,13-0,52], I2 = 82 %). Celle-ci est plus importante pour les programmes d’activité physique mis en œuvre dès le début des traitements (26 études, 1 909 patients ; DMS 0,33 ; IC 95 % [0,12-0,53], I2 = 81 %), que dans les suites de traitements (8 études, 833 patients ; DMS 0,19 ; IC 95 % [-0,19-0,58], I2 = 81 %). L’effet de l’activité physique est plus marqué pour les tumeurs solides (DMS 0,37 ; IC 95 % [0,16-0,58], I2 = 82 %) et non significatif dans les études portant sur les hémopathies malignes (4 études) ou combinant les deux. Les programmes d’activité physique associant exercices aérobies et renforcement musculaire ont un effet plus important (DMS 0,41 ; IC 95 % [0,06-0,75]) que les programmes ne contenant que des exercices aérobies (DMS 0,27 ; IC 95 % [0,00-0,54]), ou de renforcement musculaire seuls (DMS 0,19 ; IC 95 % [-0,24-0,62]). Enfin, l’analyse dose-réponse montre un effet maximal pour une activité physique de niveau modéré à intense. Au-delà, la relation dose-réponse entre l’intensité de l’exercice aérobie et l’effet sur la fatigue a tendance à s’inverser (Dennett et coll., 2016

).
La méta-analyse de Carayol et coll. (2013) rapporte une diminution de la fatigue (p < 0,03) en fonction du volume d’activité physique sur la base de l’analyse de 11 études (Carayol et coll., 2013

). Les résultats suggèrent que l’activité physique pendant les traitements adjuvants réduit la sensation de fatigue au cours du cancer du sein, mais de façon plus limitée si elle est d’intensité élevée. Un volume hebdomadaire d’activité physique < 12 MET h/semaine semble être la situation la plus favorable pour l’amélioration de la fatigue. Les programmes d’intervention ciblant une augmentation progressive de l’activité physique selon la phase de chimiothérapie, de 2 à 5 MET h/semaine d’activité physique au cours des 10 premiers jours suivant l’administration de la chimiothérapie, et 5 à 10 MET h/semaine pendant les jours suivants, apparaissent bien adaptés pour réduire la fatigue.
Une méta-analyse
Cochrane (Furmaniak et coll., 2016

), mise à jour de la méta-analyse de Markes (Markes et coll., 2006

), montre un bénéfice significatif en termes de réduction de la fatigue (DMS -0,28 ; IC 95 % [-0,41 ; -0,16], I2 = 29 %) dans l’analyse de 19 essais randomisés chez des femmes atteintes de cancer du sein (1 698 femmes). À noter que seuls deux essais avaient individuellement montré des résultats significatifs.
La méta-analyse de Mustian et coll. (2017) ayant analysé 113 essais randomisés (11 525 patients, âge moyen 54 ans), dont 47 % d’essais chez des femmes atteintes de cancer du sein (Mustian et coll., 2017

), montre un bénéfice significatif en termes de réduction de la fatigue comparable pour l’exercice (taille de l’effet moyennes pondérées 0,30 ; IC 95 % [0,25-0,36]), l’intervention psychologique (0,27 ; IC 95 % [0,21-0,33]) et des approches combinant les deux (0,26 ; IC 95 % [0,13-0,38]), tandis que les interventions médicamenteuses (chlorhydrate de paroxétine, modafinil ou armodafinil, chlorhydrate de méthylphénidate ou dexyméthylphénidate, dexamphétamine, méthylprednisolone) ne montrent pas de bénéfice.
Au total, nous avons identifié 22 méta-analyses ayant analysé l’effet de l’activité physique sur la fatigue. Malgré la très grande hétérogénéité des études, les données montrent de façon convergente que l’activité physique régulière améliore l’état de fatigue de patients porteurs de tumeurs solides, les cancers du sein et de la prostate étant les plus étudiés (Speck et coll., 2010

; Velthuis et coll., 2010

; McMillan et Newhouse, 2011

; Brown et coll., 2011

; Fong et coll., 2012

; Cramp et Byron-Daniel, 2012

; Mishra et coll., 2012a

; Mishra et coll., 2012b

; Tomlinson et coll., 2014

; Dennett et coll., 2016

; Furmaniak et coll., 2016

; Bourke et coll., 2016

; van Vulpen et coll., 2016

; Tian et coll., 2016

; Inca, 2017

) (niveau de preuve A). Le bénéfice sur la réduction de la fatigue semble moindre chez les patients porteurs d’hémopathies malignes, sans que les raisons en soient élucidées (Cramp et Byron-Daniel, 2012

; Tomlinson et coll., 2014

; Dennett et coll., 2016

). Les données suggèrent également des effets bénéfiques de l’activité physique sur la fatigue pour d’autres tumeurs solides (cancers gynécologiques (endomètre et ovaire), ORL (poumon), mais les données sont plus limitées et hétérogènes (Tian et coll., 2016

; Inca, 2017

) (niveau de preuve B/C). À noter que globalement peu d’études incluses dans les méta-analyses montrent individuellement des résultats significatifs.
L’amélioration de la fatigue est observée aussi bien pour des programmes d’activité physique réalisés pendant les traitements (Speck et coll., 2010

; Brown et coll., 2011

; Duijts et coll., 2011

; McMillan et Newhouse, 2011

; Fong et coll., 2012

; Puetz et Herring, 2012

; Mishra et coll., 2012b

; Meneses-Echavez et coll., 2015a

) qu’après les traitements (Speck et coll., 2010

; Brown et coll., 2011

; Duijts et coll., 2011

; Cramp et Byron-Daniel, 2012

; Fong et coll., 2012

; Puetz et Herring, 2012

; Mishra et coll., 2012a

; Meneses-Echavez et coll., 2015b

). Les données les plus récentes suggèrent un bénéfice plus important lorsque l’activité physique est proposée dès le début des traitements (Dennett et coll., 2016

). Par ailleurs, la méta-analyse de Tomlinson et coll. (2014

) retrouve un effet plus important pour les études publiées depuis 2009 (DMS -0,61 ; IC 95 % [-0,79 ; -0,43], p < 0,001) comparé aux études publiées avant 2009 (DMS -0,25 ; IC 95 % [-0,40 ; -0,10], p = 0,001) (Tomlinson et coll., 2014

).
Un effet significatif sur la réduction de la fatigue est observé par plusieurs méta-analyses pour l’activité physique aérobie (McMillan et Newhouse, 2011

; Cramp et Byron-Daniel, 2012

; Tian et coll., 2016

), mais pas pour l’activité physique de renforcement musculaire (McMillan et Newhouse, 2011

; Cramp et Byron-Daniel, 2012

; Strasser et coll., 2013

; Meneses-Echavez et coll., 2015a

). La méta-analyse de Dennett rapporte un effet plus important pour des programmes d’activité physique mixte (Dennett et coll., 2016

).
L’analyse dose-réponse montre un bénéfice maximal en termes de réduction de la fatigue pour une activité physique de niveau modéré à intense, comparé à une activité physique de plus faible intensité d’une part (Brown et coll., 2011

; Cramp et Byron-Daniel, 2012

; Buffart et coll., 2012

), et une activité physique d’intensité élevée, d’autre part (Mishra et coll., 2012a

; Carayol et coll., 2015

; Dennett et coll., 2016

). Le bénéfice semble plus important lorsque l’activité physique est réalisée dans le cadre d’un programme supervisé, comparé à l’activité physique non supervisée (Velthuis et coll., 2010

; McMillan et Newhouse, 2011

; van Vulpen et coll., 2016

).
En résumé, l’activité physique ciblée sur le développement des capacités cardiorespiratoires, de type aérobie, ou mixtes (associant activité physique aérobie et de renforcement musculaire), semble être la plus efficace sur la réduction de la fatigue (niveau de preuve A). Les données sont en faveur d’une activité physique d’intensité modérée (3 à 6 MET h soit < 10-12 MET.h/semaine) ; l’augmentation de l’intensité au-delà étant inversement associée au bénéfice sur la fatigue (niveau de preuve B/C). Une adaptation du niveau d’activité physique en fonction du niveau de fatigue perçue avant exercice serait pertinente, mais n’a pas été évaluée dans les études à notre connaissance. Une meilleure compréhension des déterminants et facteurs modulant l’efficacité des programmes d’intervention est nécessaire.
Impact sur les fonctions cognitives
Une altération des fonctions cognitives, ressenties et objectives, est fréquemment observée chez des patients atteints de cancer, allant jusqu’à 60 % des patients, selon les études, le type de cancer et le traitement, et persiste chez plus d’un tiers des patients au-delà de la fin des traitements (Janelsins et coll., 2014

; Zimmer et coll., 2016

; Myers et coll., 2017). Cette altération concerne plus particulièrement les patients recevant une chimiothérapie (jusqu’à 75 % des patients), mais est observée également après d’autres types de traitement, comme la radiothérapie, la chirurgie ou l’hormonothérapie (Zimmer et coll., 2016

). Une revue systématique de 19 études (expérimentales chez l’animal : 5 études ; chez des patients atteints de cancer : 14 études dont 6 essais randomisés) suggère un possible bénéfice de l’activité physique sur les capacités cognitives (Zimmer et coll., 2016

). Si les données suggèrent que l’activité physique pourrait être une intervention potentielle pour améliorer la fonction cognitive après cancer, les données sont préliminaires et hétérogènes et des questions demeurent concernant les modalités optimales (Zimmer et coll., 2016

; Myers et coll., 2017).
Impact sur les douleurs
La prévalence de la douleur (viscérale, somatique ou neuropathique) chez les patients atteints de cancer est estimée à 59 % au cours du diagnostic et des traitements, 33 % après un cancer et 64 % en situation évolutive ou métastatique (Siegel et coll., 2012

). Les douleurs sont le plus souvent liées directement à la maladie, mais la fréquence et la gravité des douleurs iatrogènes (post-opératoires, mucites, douleurs musculaires ou osseuses associées à la chimiothérapie ou l’hormonothérapie, douleurs d’origine inflammatoire et nécroses suite à la radiothérapie) seraient souvent sous-estimées (Inca, 2017

). Deux revues
Cochrane portant sur la qualité de vie (Mishra et coll., 2012a

; Mishra et coll., 2012b

) ont inclus une analyse de l’impact de l’activité physique sur les douleurs. Pendant les traitements (Mishra et coll., 2012b

), les auteurs suggèrent une tendance positive sur la base d’un faible nombre d’études avec une très grande hétérogénéité des programmes d’activité physique et d’outils d’évaluation. Après cancer (Mishra et coll., 2012a

), les auteurs, sur la base de 4 études (289 patients), rapportent une diminution significative de la douleur à 12 semaines de suivi (DMS -0,29 ; IC 95 % [-0,55 ; -0,04]), mais pas avec un suivi plus long. L’importante hétérogénéité des études cliniques est là aussi notée par les auteurs. Le rapport de l’Inca (2017

), sur la base de 3 essais randomisés chez des patientes atteintes de cancer du sein, suggère un bénéfice significatif de l’activité physique (renforcement musculaire ± assouplissement) pendant la radiothérapie sur les douleurs au niveau de l’épaule et du bras du côté opéré (Inca, 2017

). Les effets antalgiques de l’activité physique seraient liés à la réduction de l’inflammation induite par la radiothérapie, évaluée par des concentrations circulantes d’IL-6 et du rapport IL-6/IL-1ra (Schmidt et coll., 2016

).
Par ailleurs, les inhibiteurs de l’aromatase ou anti-aromatases (AA) constituent actuellement le traitement de référence en adjuvant et en phase métastatique du cancer du sein. Les arthralgies associées aux AA représentent un effet indésirable chez 33 à 74 % des patients (Gaillard et Stearns, 2011

), sont évaluées comme étant modérées à sévères pour 70 % des patients et fréquemment à l’origine d’un arrêt des AA (Hershman et coll., 2011

). Ces symptômes apparaissent 6 à 12 mois après le démarrage du traitement et disparaissent le plus souvent à l’arrêt des AA. La douleur a un effet délétère sur la qualité de vie et en affecte l’ensemble des dimensions physiques et psychologiques. Un essai randomisé ayant évalué un programme d’activité physique de 12 mois chez 121 patientes (âge moyen 61 ans, < 90 min activité physique/semaine) traitées par AA et présentant des arthralgies (apparition sous traitement ou aggravation d’arthralgies préexistantes), montre une amélioration significative de la douleur à 12 mois (Irwin et coll., 2015

).
Une méta-analyse
Cochrane de 3 essais randomisés (104 patients, âge moyen 52 à 61 ans) évaluant l’effet de l’activité physique sur la réduction de la douleur et des dysfonctionnements de la ceinture scapulaire et de l’épaule (Carvalho et coll., 2012

), montre une réduction significative du score douleur (DM -6,26 ; IC 95 % [-12,20 ; -0,31]) et une amélioration des scores de mobilité de l’épaule.
Plusieurs études publiées rapportent un effet antalgique des programmes d’activité physique dans différentes situations cliniques, plus particulièrement chez les patientes atteintes de cancer du sein (Hwang et coll., 2008

; Steindorf et coll., 2014

; Irwin et coll., 2015

; Galiano-Castillo et coll., 2016

) et patients atteints de cancer ORL (McNeely et coll., 2008

; Carvalho et coll., 2012

), et notamment sur la récupération de l’épaule et sur les douleurs associées. L’activité physique régulière semble améliorer certaines douleurs liées aux cancers et aux traitements (niveau de preuve C).
Impact sur les effets secondaires des traitements
Neuropathies chimio-induites
La neuropathie périphérique chimio-induite (NPCI), définie par des dommages du système nerveux périphérique, engendre des douleurs neuropathiques (15 à 25 % des patients atteints de cancer), des symptômes moteurs et troubles de la proprioception qui peuvent gêner la pratique de l’activité physique. L’incidence varie en fonction du type de chimiothérapie (notamment les taxanes, platines, vinca-alcaloïdes, et certaines thérapies ciblées), de la dose et du schéma d’administration. L’existence chez le patient d’une neuropathie préexistante (liée aux diabète, alcool, carence folates/vit B12, neuropathies héréditaires) ou paranéoplasique peuvent favoriser la NPCI. Peu d’études ont analysé l’effet de l’activité physique sur la NPCI. Une revue de 5 études (dont 2 essais randomisés), incluant au total 147 patients en cours de traitement présentant des symptômes de NPCI, observe des améliorations significatives du contrôle postural et des symptômes de NPCI, notamment pour un protocole combinant l’activité physique de type aérobie et de renforcement associé à des exercices sensorimoteurs durant 36 semaines (Duregon et coll., 2018

). Un essai randomisé de 355 patients (56 ± 11 ans, 79 % de femmes atteintes d’un cancer du sein) a évalué le bénéfice d’un programme d’activité physique concomitant à une chimiothérapie à base de taxanes, platines ou vinca-alcaloïdes, associant activité physique aérobie et de renforcement musculaire d’intensité modérée, à domicile, de 6 semaines (Kleckner et coll., 2017

). Les résultats montrent une diminution significative de la prévalence et de la gravité des symptômes de NPCI (sensibilité à la chaleur et au froid dans les mains et pieds, engourdissement et picotements) dans le groupe ayant bénéficié du programme d’activité physique.
Des données de la littérature sont en faveur d’un bénéfice de l’activité physique sur la NPCI chez les patients atteints de cancer (niveau de preuve C). Les mécanismes restent à élucider. Compte tenu du risque augmenté de blessures, il est important d’évaluer l’équilibre, la stabilité et les difficultés de marche avant toute activité physique, qui doit être adaptée en fonction des limitations (NCCN, 2017

). Selon la sévérité des limitations, une rééducation ou prise en charge adaptée par des professionnels de santé peut être requise (Décret n
o 2016-1990)
4
.
Toxicité cardiovasculaire
Plusieurs traitements médicamenteux du cancer sont associés à une toxicité cardiovasculaire, notamment les anthracyclines, pouvant être à l’origine d’une insuffisance cardiaque chronique, les agents anti-HER2, tels que le trastuzumab, pouvant provoquer une cardiomyopathie partiellement réversible et perturber le métabolisme des lipides, certains traitements hormonaux, tels que les anti-aromatases, certains inhibiteurs de la tyrosine kinase et certains traitements anti-angiogéniques, ainsi que l’irradiation médiastinale (Haykowsky et coll., 2009

; Ades et coll., 2014

; Khosrow-Khavar et coll., 2017

). La toxicité cardiovasculaire varie selon les substances, les doses et le schéma, l’âge du patient, et peut se déclarer durant le traitement ou à distance, jusqu’à plusieurs années après le traitement. L’existence de facteurs de risque (obésité, intolérance à l’exercice, diabète, hyperlipidémie), ou de comorbidités cardiovasculaires (hypertension), peuvent augmenter le risque de morbidité et de mortalité (Haykowsky et coll., 2017

). Les effets cardiovasculaires peuvent se manifester sous forme d’insuffisance cardiaque, d’ischémie du myocarde, d’hypertension artérielle ou d’arythmie ainsi que d’accidents vasculaires cérébraux et de thromboses artérielles et veineuses (Moudgil et Yeh, 2016

). Comparativement aux femmes de même âge, les femmes atteintes d’un cancer du sein ont 1,7 fois plus de risque de mortalité cardiovasculaire, 1,3 fois plus de risque de maladie cardiovasculaire (coronaropathie, AVC, insuffisance cardiaque) et 1,3 à 3,1 fois plus de facteurs de risque de maladie cardiovasculaire (hypertension, diabète, dyslipidémie), conséquence des traitements et du déconditionnement (Scott et coll., 2016

). Les mécanismes biologiques impliqués dans les lésions cardiaques secondaires aux traitements restent en partie incompris.
Au-delà de l’étude de l’impact sur le V̇O
2pic, peu de données existent sur l’impact de l’activité physique sur les facteurs de risque et événements cardiovasculaires (Yu et Jones, 2016

; Haykowsky et coll., 2017

). Une amélioration du pic de V̇O
2 associé à l’exercice a été suggérée chez les femmes atteintes de cancer du sein avec insuffisance cardiaque et fraction d’éjection préservée, mais les mécanismes responsables de cette amélioration restent à élucider (Haykowsky et coll., 2016

). Une étude prospective issue de deux cohortes, incluant 2 973 femmes après un cancer du sein localisé (suivi médian 8,6 ans), a mis en évidence une diminution de 23 % du risque d’événements cardiovasculaires chez les femmes ayant une activité physique ≥ 9 MET h/semaine (soit au moins 2 heures/semaine à une intensité modérée de 4,5 MET) comparativement aux femmes ne les atteignant pas (Jones et coll., 2016

). L’étude observe une relation dose-effet avec l’augmentation du nombre de MET h/semaine. Il n’existait pas d’interaction avec le type de traitement adjuvant (anthracyclines, anti-aromatase).
Par ailleurs, plusieurs études chez les rongeurs, revues par Kirkham et coll. (2015), suggèrent un bénéfice de l’activité physique comparée à la sédentarité, pour prévenir ou atténuer la toxicité cardiovasculaire associée aux anthracyclines en modulant certains des mécanismes associés à la toxicité cardiovasculaire. L’effet observé semble notamment lié à une diminution du stress oxydant et de l’inflammation (Dolinsky et coll., 2013

; Kirkham et Davis, 2015

). Un effet sur la fonction des cellules endothéliales a également été suggéré (Jones et coll., 2013

; Kirkham et Davis, 2015

). Ces mécanismes restent cependant à démontrer chez l’homme.
En résumé, l’activité physique aérobie est associée à des effets bénéfiques sur les facteurs de risque cardiovasculaires (niveau de preuve A), et de nombreuses études ont montré le bénéfice de l’activité physique sur les capacités cardiorespiratoires chez les patients atteints de cancer (niveau de preuve A). Un bénéfice de l’activité physique sur la prévention et réduction de la toxicité cardiovasculaire a été suggéré (niveau de preuve C), mais ces données nécessitent confirmation dans des essais randomisés conçus pour étudier le bénéfice de l’activité physique sur la toxicité cardiovasculaire.
Densité minérale osseuse
Les traitements des cancers sont fréquemment associés à une perte de la densité minérale osseuse (DMO), notamment chez les femmes atteintes de cancer du sein et les hommes atteints de cancer de la prostate où les traitements par inhibiteur de l’aromatase et l’hormonothérapie anti-androgénique peuvent aggraver cette perte osseuse. La plupart des études portant sur l’impact de l’activité physique sur la DMO ont été conduites chez des femmes atteintes de cancer du sein, mais elles sont hétérogènes et restent limitées en nombre. Deux revues de la littérature (Winters-Stone et coll., 2010

; Knobf et Winters-Stone, 2013

) suggèrent que l’activité physique pourrait prévenir la perte de la DMO associée à l’hormonothérapie et la ménopause précoce, chez les femmes atteintes de cancer du sein. Cet effet semble davantage exister chez les femmes plus jeunes, préménopausées au moment du diagnostic, et a été observé aussi bien dans des études avec l’activité physique aérobie, qu’avec des activités de renforcement ou une combinaison des deux (Saarto et coll., 2012

; Winters-Stone et coll., 2012

; Hojan et coll., 2013

). À noter qu’un essai randomisé récent ayant évalué une activité physique aérobie et de renforcement chez 121 femmes traitées par inhibiteur de l’aromatase n’a pas retrouvé ce bénéfice (Thomas et coll., 2017

).
Les données disponibles concernant le bénéfice de l’activité physique sur la densité osseuse chez les hommes atteints de cancer de la prostate ne permettent pas de conclure (Gardner et coll., 2014

). Enfin, un essai randomisé de 60 patients (âge moyen 62,7 ans ; principalement cancers du sein, du poumon et de la prostate), présentant des métastases osseuses, rapporte un bénéfice de l’activité physique associée à l’irradiation
versus l’irradiation seule sur la densité osseuse des métastases spinales (Rief et coll., 2014

).
Lymphœdème
Le lymphœdème du membre supérieur est une complication classique du traitement par chirurgie et radiothérapie du cancer du sein, provoqué par le ralentissement ou le blocage de la circulation de la lymphe. Le lymphœdème a des répercussions importantes sur le plan physique et fonctionnel (diminution de la mobilité de l’épaule et baisse de la force du haut du corps), ainsi que de la qualité de vie des femmes, et constitue fréquemment un obstacle à la reprise d’une activité professionnelle. L’incidence varie considérablement, allant de 6 % à 63 % selon les populations étudiées, les critères de mesure utilisés et la durée de suivi (Cormier et coll., 2010

). Ces quinze dernières années, la technique du ganglion sentinelle a permis de réduire l’incidence du lymphœdème, avec des taux rapportés de l’ordre de 7 % (Cormier et coll., 2010

). Le taux de lymphœdème est augmenté lorsque la chirurgie au niveau de l’aisselle est associée à de la radiothérapie, avec des taux de près de 45 % (Cormier et coll., 2010

). Le lymphœdème peut apparaître quelques semaines ou mois après l’intervention mais également plus tardivement (plusieurs années à distance du traitement). Les autres facteurs de risque de lymphœdème sont l’âge, l’obésité et la prise de poids après traitement, les traumatismes et les infections au niveau de la main ou du bras du côté opéré et possiblement le manque d’activité physique.
Plusieurs essais randomisés et méta-analyses ayant évalué l’impact d’une activité physique modérée à intense de type aérobie et/ou de résistance pendant ou après le traitement adjuvant sur le lymphœdème après un cancer du sein montrent, de façon convergente, l’absence de risque à pratiquer une activité physique régulière et progressive en post-opératoire : absence de complications et de détérioration du lymphœdème (mesure du périmètre du bras) et des symptômes (McNeely et coll., 2010

; Chan et coll., 2010

; Cheema et coll., 2014

; Paramanandam et Roberts, 2014

; Nelson et coll., 2016

; Keilani et coll., 2016

; Singh et coll., 2016b

; Inca, 2017

). Les études montrent également de façon convergente une amélioration de la fonction scapulo-humérale avec augmentation de l’amplitude des mouvements, de la force du haut et du bas du corps (McNeely et coll., 2010

; Cheema et coll., 2014

). Une méta-analyse de 5 essais randomisés (patients âgés de 46 à 62 ans) ayant évalué l’impact de l’activité physique de type renforcement musculaire note une diminution significative de l’incidence et/ou réduction de la progression du lymphœdème (Cheema et coll., 2014

). Une méta-analyse
Cochrane montre, sur la base de 10 études (âge moyen 49 à 62 ans), un bénéfice significatif sur le plan fonctionnel d’un exercice précoce (débuté entre J1 et J3 post-opératoire) comparé à un début plus tardif (≥ J4), mais rapporte une augmentation du volume et de la durée du drainage post-opératoire (McNeely et coll., 2010

). Les auteurs montrent l’absence d’augmentation de risque de lymphœdème pour l’activité physique concomitante aux traitements adjuvants.
À noter que les interventions et critères d’évaluation dans les études sont hétérogènes et ne permettent pas de dégager un type d’activité physique plus particulièrement favorable. Les données sont insuffisantes pour conclure à l’intérêt ou non du port d’un manchon de compression pendant l’activité physique (Singh et coll., 2016a

).
Si l’activité physique n’a pas montré à ce jour de bénéfice réel dans la prévention du risque d’apparition de lymphœdème chez les patientes atteintes de cancer du sein, la balance bénéfice-risque est en faveur d’une activité physique régulière et progressive en post-opératoire (exercices aérobies et de renforcement musculaire en respectant les précautions et recommandations d’hygiène de vie) (niveau de preuve A). Plusieurs études rapportent une amélioration de l’amplitude des mouvements de l’épaule après chirurgie avec curage ganglionnaire (Inca, 2017

). L’interdiction à pratiquer un exercice physique impliquant le membre supérieur du côté opéré n’est plus indiquée (Inca, 2017

; NCCN, 2017

).
Mis à part le cancer du sein, le lymphœdème secondaire aux traitements est également observé dans les cancers gynécologiques, uro-génitaux, ORL et le mélanome. Peu d’études ont évalué l’activité physique dans ces situations. Une enquête transversale auprès de 213 patientes atteintes de cancer de l’utérus (29-94 ans ; 75 % cancers de l’endomètre) suggère une diminution significative du risque de lymphœdème chez les femmes les plus actives par comparaison aux moins actives (tendance significative) (Brown et coll., 2014

).
Impact sur la réalisation des traitements
Peu d’études ont analysé l’effet de l’activité physique sur le taux d’accomplissement des traitements (report, arrêt de traitement, ou réduction de dose). Une amélioration significative du taux d’achèvement de la chimiothérapie a été suggérée (critère secondaire dans 3 essais randomisés) pour les patients atteints de cancer du sein (Courneya et coll., 2007

; van Waart et coll., 2015

) et de lymphomes (Courneya et coll., 2009

). Ces résultats nécessitent confirmation.
Impact sur la qualité de vie
L’effet de l’activité physique sur la qualité de vie globale et ses différentes dimensions, spécifiques ou non au cancer, a été étudié dans de très nombreuses études et a fait l’objet de plus de 25 méta-analyses, portant en particulier sur les patientes atteintes de cancer du sein pour lesquelles les essais randomisés sont les plus nombreux et les plus rigoureux méthodologiquement. De récentes méta-analyses concernent également les cancers du poumon et de la prostate.
Cancer du sein
Quatre méta-analyses majeures rapportent un effet significatif de l’activité physique sur l’amélioration de la qualité de vie chez des patientes atteintes d’un cancer du sein, pendant ou après les traitements (Speck et coll., 2010

; Duijts et coll., 2011

; Carayol et coll., 2013

; Zeng et coll., 2014

).
La méta-analyse de Speck et coll. (2010) retrouve un effet favorable de l’activité physique d’intensité modérée à intense, de type aérobie ou combinée à du renforcement musculaire (ou à d’autres interventions) sur la qualité de vie (séances de 30 à 45 minutes, 3 à 5 fois/semaine, durant cinq semaines) (Speck et coll., 2010

). La qualité de vie est améliorée lorsque l’activité physique est pratiquée dès le début (DMS 0,13 ; IC 95 % [0,005-0,260]) ou après les traitements du cancer (DMS 0,29 ; IC 95 % [0,03-0,54]).
Une autre méta-analyse portant sur 13 essais randomisés auprès de femmes atteintes de cancer du sein pendant (six études) ou après les traitements (sept études), montre une amélioration significative de la qualité de vie (DMS 0,298 ; IC 95 % [0,117-0,479], p < 0,001) (Duijts et coll., 2011

).
La méta-analyse de Carayol, incluant 17 essais randomisés, montre une amélioration significative de la qualité de vie pour les patientes atteintes de cancer du sein en cours de traitement adjuvant (DMS 0,343 ; IC 95 % [0,067-0,620]). Les programmes d’activité physique étaient diversifiés (aérobie, renforcement musculaire, pratique mixte, yoga) et d’une durée variable (2 à 6 séances par semaine de 20 à 60 minutes, pendant 5 à 26 semaines) (Carayol et coll., 2013

). Les auteurs rapportent une relation dose-effet inversement associée au bénéfice sur la qualité de vie lors de la période du traitement adjuvant du cancer du sein. Ainsi, la prescription d’une quantité d’activité physique hebdomadaire inférieure à 20 MET h/semaine, est plus efficace pour l’amélioration de la qualité de vie qu’une quantité hebdomadaire supérieure (Carayol, 2013). La prescription d’une quantité d’activité physique modérée (quotidienne ou hebdomadaire) est associée à un plus fort taux d’adhésion des patientes, comparée à de simples recommandations transmises oralement (p < 0,001). Les effets des programmes d’activité physique sur la qualité de vie sont plus prononcés si leur durée est supérieure à 18 semaines (Carayol et coll., 2013

).
La méta-analyse de Zeng et coll. (2014) confirme le bénéfice de la pratique de l’activité physique sur la qualité de vie des patientes atteintes d’un cancer du sein ayant terminé leur traitement depuis trois semaines à 2,5 ans (SF-36, SF-12 : DMS 0,70 [0,21-1,19] ; FACT-G, EORTC, QLQ-C30 : DMS 0,38 [0,03-0,74]) (Zeng et coll., 2014

). Dans les 25 essais randomisés contrôlés analysés, les programmes d’activité physique proposés sont très divers : exercice aérobie (11 études), exercice anaérobie (4 études), yoga (3 études), Tai Chi (2 études), exercice aérobie et étirements (2 études), renforcement musculaire (1 étude), activité physique combinant exercice aérobie et renforcement musculaire (1 étude), combinant renforcement musculaire et étirements (1 étude). Les séances d’activité physique sont proposées une à cinq fois par semaine pendant 15 à 90 min sur quatre à 52 semaines. La méta-analyse de Buffart et coll. (2012) analyse l’effet de la pratique d’activité physique de faible intensité comme le yoga supervisé (comprenant un travail postural associé à des exercices de relaxation, respiration ou méditation) sur la qualité de vie des patientes atteintes de cancer du sein ou de lymphome (Buffart et coll., 2012

). Pendant et après les traitements, cette pratique (sur une durée moyenne de 7 semaines, avec une à trois séances de 30 à 120 min par semaine) s’avère bénéfique sur la qualité de vie (DMS 0,37 [0,11-0,62]). Par contre, une méta-analyse de sept études (dont 3 essais randomisés) incluant 201 patientes atteintes de cancer du sein ayant évalué le Tai Chi ne retrouve pas d’amélioration de la qualité de vie des patients (DMS 0,45 [0,25-1,14] ; p = 0,21) (Lee et coll., 2010

). L’absence d’effet décelable de ce type de pratique peut s’expliquer par l’origine des patientes incluses, majoritairement d’origine asiatique. La pratique du Tai Chi étant une pratique « courante » dans cette culture, l’absence d’effet pourrait être la conséquence d’un effet de « lissage » des résultats.
Le suivi à 5 ans des patientes d’un essai randomisé français de 251 femmes atteintes d’un cancer du sein, a évalué le bénéfice d’un séjour en cure thermale de 15 jours après la fin des traitements, incluant des séances d’activité physique surpervisées quotidiennes, ainsi qu’une prise en charge nutritionnelle et psychologique. La qualité de vie globale des patients (toutes dimensions confondues) a été significativement améliorée par l’intervention, la plus grande différence entre les groupes survenant juste après l’intervention mesurée à 6 mois (222 patientes, DM 0,63 [0,37-0,89], p < 0,00001), mais se maintient à 5 ans (137 patientes, DM 0,45 [0,11-0,80], p < 0,01) (Kwiatkowski et coll., 2017

). L’ampleur de l’effet de l’intervention sur la qualité de la vie pendant toute la période de suivi était de 0,33 [0,23-0,43].
Autres cancers
Les conclusions de deux revues
Cochrane publiées par Mishra rapportent que la prescription d’un programme d’activité physique modérée à intense, pendant ou après les traitements, améliore significativement la qualité de vie de patients atteints de différents types de cancer (sein, prostate, gynécologique, hématologique) (Mishra et coll., 2012a

; Mishra et coll., 2012b

). Les deux méta-analyses incluent des essais randomisés contrôlés comportant un groupe activité physique (de type aérobie, comme la marche ou le vélo, douces comme le yoga, le Chi Gong ou le Tai Chi, ou de renforcement musculaire comme la gymnastique) comparé à un groupe contrôle. Dans cette méta-analyse de 56 essais cliniques, incluant 4 826 patients atteints de différents types de cancer, la qualité de vie liée à la santé est améliorée après 12 semaines de suivi (DMS 0,47 ; IC 95 % [0,16-0,79] (Mishra et coll., 2012a

). Lorsque le programme est mis en place après les traitements, l’amélioration de la qualité de vie liée à la santé est observée après 12 semaines d’intervention (DMS 0,48 ; IC 95 % [0,16-0,81]), ainsi qu’après six mois de suivi (0,46 ; IC 95 % [0,09-0,84]) (Mishra et coll., 2012b

). Les auteurs soulignent l’hétérogénéité importante des programmes d’activité physique (Mishra et coll., 2012a

; Mishra et coll., 2012b

). Pendant et après les traitements, l’activité physique d’une intensité modérée à élevée est associée à un bénéfice supérieur par rapport à un programme d’activité physique de faible intensité (Mishra et coll., 2012a

; Mishra et coll., 2012b

).
La méta-analyse de Ferrer et coll. (2011), incluant des résultats de 78 études menées avec des patients atteints de divers types de cancer (dont 54 % des études sur le cancer du sein), souligne un effet bénéfique plus important des programmes d’activité physique ayant une durée et une intensité plus forte d’activité aérobie (Ferrer et coll., 2011

). Cette méta-analyse suggère que pour une durée moyenne d’intervention de 26 semaines, une activité physique aérobie d’intensité modérée comme la marche (3-4 MET) donne peu ou pas d’amélioration de la qualité de vie, contrairement à une activité physique aérobie d’intensité plus élevée (modérément « haute », 6 MET) comme par exemple la pratique du vélo. Par ailleurs, la durée du programme influence la qualité de vie. Les interventions inférieures à huit semaines ne montrent pas d’amélioration de la qualité de vie, et ce, quelle que soit l’intensité de l’activité physique. De plus, l’effet de la pratique de l’activité physique est plus marqué pour les programmes proposés aux femmes. Cela justifie de développer davantage de recherches sur les programmes les mieux adaptés aux hommes atteints de cancer souvent sous-représentés dans les essais d’intervention.
Deux méta-analyses ont évalué l’effet de l’activité physique chez des patients atteints de cancer de la prostate (Bourke et coll., 2016

; Yang et Wang, 2017

). Sur la base de 7 essais (912 patients, suivi médian 12 semaines) et 10 essais (841 patients) respectivement, les auteurs suggèrent une amélioration significative de la qualité de vie. L’effet semble plus important dans les études de bonne qualité (Bourke et coll., 2016

). Une amélioration de la qualité de vie chez des patients atteints de cancer ORL (Capozzi et coll., 2016

) et de l’endomètre (Babatunde et coll., 2016

) a été suggérée dans deux revues systématiques, mais le nombre d’essais ayant évalué l’impact sur la qualité de vie est limité. En revanche, l’activité physique avant traitement chirurgical chez des patients atteints de cancer broncho-pulmonaire non à petites cellules ne semble pas montrer d’amélioration sur la qualité de vie (Granger et coll., 2011

), mais le nombre d’essais est limité et les études très hétérogènes. Par ailleurs, deux méta-analyses récentes (Sweegers et coll., 2017

; Buffart et coll., 2017

) montrent que la prescription de l’activité physique dans des programmes supervisés a un bénéfice supérieur en termes de qualité de vie, comparé à des programmes non-supervisés.
La question qui se pose aujourd’hui est la manière d’optimiser les programmes en complément des traitements et après. Les spécialistes de la recherche interventionnelle parlent d’études d’implémentation (voir chapitre « Évaluation des programmes d’activité physique à visée de santé »). La supervision du programme par un professionnel (Sweegers et coll., 2017

) et sa prescription par un médecin semblent indispensables. L’augmentation progressive de la dose d’activité physique pour des patients physiquement inactifs et sédentaires l’est aussi. L’association avec un conseil diététique et/ou un soutien psychologique peut être favorable à la qualité de vie. Par exemple, la méta-analyse de Duijts évalue les effets de la pratique d’activité physique auprès de femmes atteintes de cancer du sein pendant et après traitement ainsi que ceux des thérapies cognitivo-comportementales (thérapie cognitive, hypnose, thérapie de soutien, techniques de relaxation, etc.) sur la qualité de vie (Duijts et coll., 2011

). Les auteurs se basent sur deux études pour montrer que l’association des techniques cognitivo-comportementales avec un programme d’activité physique pratiqué en groupe dans les suites de traitements, améliore la qualité de vie de manière plus importante que la pratique de l’activité physique seule, ou le recours seul à une thérapie comportementale (Cho et coll., 2006

; Fillion et coll., 2008

). De même, les études de Fong et de Scott montrent qu’une pratique d’activité physique associée à des entretiens motivationnels en face-à-face, complété par un suivi téléphonique, est le moyen le plus efficace de générer un changement positif sur la qualité de vie (Fong et coll., 2012

; Scott et coll., 2014

). Réfléchir aux conditions d’implémentation est une manière de faire profiter à toutes et tous des bénéfices à court et moyen termes de l’activité physique sur la qualité de vie, quitte à cumuler plusieurs interventions différentes pour les personnes les plus précaires et les plus affectées par un cancer et ses conséquences.
En résumé, les méta-analyses d’études interventionnelles d’activité physique concluent de façon convergente en faveur d’un bénéfice de l’activité physique régulière dans des programmes supervisés, sur la qualité de vie des patientes atteints d’un cancer du sein limité. Que les programmes soient initiés pendant les traitements ou après, un bénéfice sur la qualité de vie est observé (niveau de preuve A). Cependant, la diversité des programmes proposés dans les études ne permet pas de préciser à ce jour le contenu optimal d’un programme d’activité physique. Néanmoins, une durée supérieure à 2 mois optimise les bénéfices sur la qualité de vie des participantes. Une composante aérobie supérieure à 3-4 MET est également nécessaire. L’intensité doit augmenter progressivement jusqu’à un niveau optimal qui reste encore à déterminer. Une vigilance doit être apportée lors des traitements car l’effet semble s’inverser lorsque la quantité hebdomadaire d’activité physique dépasse les 20 MET h/semaine. La prescription de l’activité physique dans des programmes supervisés a un bénéfice supérieur en termes de qualité de vie, comparé à des programmes non-supervisés.
Impacts sur la survie après cancer
L’impact de l’activité physique sur la survie globale, la survie spécifique et le risque de récidive a été analysé dans plusieurs études épidémiologiques prospectives, notamment des études de cohorte en population, pour les cancers du sein et du côlon en particulier, ainsi que les cancers de la prostate, de l’endomètre et de l’ovaire. Plusieurs méta-analyses ont analysé les données portant sur les cancers du sein et du côlon-rectum. En revanche, il n’y a pas à ce jour d’essai randomisé publié ayant étudié l’impact de l’activité physique sur la survie après cancer. Les essais randomisés publiés à ce jour ne possèdent ni la puissance ni la durée de suivi suffisantes pour évaluer l’effet de l’activité physique sur la survie (Romieu et coll., 2012

; Ballard-Barbash et coll., 2012

). Une amélioration non significative à 8 ans de la survie globale et sans récidive a été suggérée dans l’essai randomisé Start portant sur 242 patientes atteintes de cancer du sein, mais l’essai manquait de puissance (Ballard-Barbash et coll., 2009

; Courneya, 2014

).
Nous avons analysé ici plus particulièrement l’effet de l’activité physique après un diagnostic de cancer. Pour l’effet de l’activité physique avant diagnostic sur la survie globale et survie spécifique, nous renvoyons au rapport de l’Inca (Inca, 2017

).
Cancer du sein
Plus de 20 études de cohortes prospectives montrent l’effet bénéfique de l’activité physique avant et après diagnostic sur le risque de récidive et la mortalité globale et spécifique après un cancer du sein. Au total, 10 études de cohortes (Holmes et coll., 2005

; Holick et coll., 2008

; Irwin et coll., 2008

; Sternfeld et coll., 2009

; Bertram et coll., 2011

; Chen et coll., 2011

; Irwin et coll., 2011b

; Beasley et coll., 2012

; Bradshaw et coll., 2014

; Williams, 2014

) avec entre 933 et 13 302 sujets, ont été incluses dans des méta-analyses (Ibrahim et Al-Homaidh, 2011

; Schmid et Leitzmann, 2014

; Zhong et coll., 2014

;
World Cancer Research Fund International, 2014

; Lahart et coll., 2015

)
La méta-analyse d’Ibrahim incluant quatre grandes cohortes (10 383 femmes), a comparé la survie globale, spécifique et sans récidive des femmes pratiquant une activité physique en post-diagnostic (2,8 à < 8,9 MET h/semaine ; ≥ 8 MET h/semaine ; ≥ 15 MET h/semaine) à celle des femmes ayant le niveau d’activité physique le plus bas (≤ 3 MET h/semaine) (Ibrahim et Al-Homaidh, 2011). À noter que les catégories comparées ne sont pas identiques dans chaque étude et se chevauchent légèrement dans la méta-analyse. Une activité physique pratiquée après un diagnostic de cancer du sein diminue de façon significative la mortalité par cancer du sein de 34 % (hazards ratio (HR) 0,66 [0,57-0,77]), la mortalité globale de 41 % (HR 0,59 [0,53-0,65]) et le taux de récidive de cancer du sein de 24 % (HR 0,76 [0,66-0,87]). Le bénéfice le plus important est observé pour une activité physique de niveau intermédiaire à élevé (≥ 8 MET h/semaine). L’effet bénéfique de l’activité physique a été observé pour les tumeurs présentant des récepteurs aux œstrogènes, alors qu’aucun gain n’a été observé pour les tumeurs sans récepteurs aux œstrogènes (résultat fondé sur trois études).
La méta-analyse de Lahart et coll. (2015), incluant 9 études de cohorte (24 611 participantes, âge moyen 53 à 63,7 ans, suivi de 4,3 à 12,7 ans), retrouve une diminution de la mortalité globale de 48 % (HR 0,52 [0,43-0,64]) et une diminution de la mortalité par cancer du sein de 41 % (HR 0,59 [0,45-0,78]) chez les femmes dans la catégorie d’activité physique post-diagnostic la plus élevée comparé à celles ayant le niveau d’activité physique le plus faible (Lahart et coll., 2015

). La méta-analyse observe également une diminution de la mortalité globale de 46 % (HR 0,54 [0,38-0,76]) et une diminution de la mortalité par cancer du sein de 33 % (HR 0,67 [0,50-0,90]) pour une activité physique post-diagnostic conforme aux recommandations (≥ 8 MET h/semaine)
versus une activité physique < 8 MET h/semaine.
Ces données sont comparables aux résultats de la revue systématique du
World Cancer Research Fund (WCRF), qui observe une réduction de 38 % de la mortalité globale pour les patientes ayant les niveaux d’activité physique après diagnostic les plus élevés en comparaison de celles ayant les niveaux les plus bas (HR 0,62 [0,52-0,73]) (
World Cancer Research Fund International, 2014

). L’effet bénéfique sur la mortalité globale s’observe aussi bien pour l’activité physique totale (HR 0,63 [0,41-0,97]) que pour l’activité physique de loisir (HR 0,61 [0,52-0,74]). Les résultats des méta-analyses de Zhong et coll. (2014

) et de Schmid et Leitzmann (2014

) regroupent les quatre mêmes études (21 373 femmes) (Holick et coll., 2008

; Irwin et coll., 2008

; Irwin et coll., 2011b

; Beasley et coll., 2012

) et vont dans le même sens (Zhong et coll., 2014

; Schmid et Leitzmann, 2014

). La pratique d’une activité physique après diagnostic (comparaison des niveaux d’activité les plus élevés aux niveaux les plus bas) est associée à une réduction de la mortalité globale de 48 % (RR = 0,52 [0,42-0,64]) et à une diminution de la mortalité spécifique de 28 % (RR = 0,72 [0,60 -0,85]) (Schmid et Leitzmann, 2014

).
Les bénéfices de l’activité physique observés dans l’étude de Holmes, comparables aux résultats des méta-analyses en termes de réduction de mortalité globale (RR = 0,53 [0,37-0,75]) pour une activité physique≥ 9 MET h/semaine, comparée à une activité physique < 3 MET h/semaine), se traduisent par un gain de survie globale à 10 ans de 6 % (Holmes et coll., 2005

).
Relation dose-réponse
Trois méta-analyses (Schmid et Leitzmann, 2014

;
World Cancer Research Fund International, 2014

; Zhong et coll., 2014

) rapportent une relation dose-réponse linéaire pour l’activité physique pratiquée en post-diagnostic. Schmid et Leitzmann (2014

) décrivent une réduction significative du risque de mortalité globale et spécifique avec l’augmentation du niveau d’activité physique. Ainsi, pour une augmentation de l’activité physique de 5, 10 et 15 MET h/semaine, les auteurs rapportent une diminution de la mortalité globale respectivement de 13 % (RR = 0,87 [0,80-0,94]), 24 % (RR = 0,76 [0,64-0,89]) et 34 % (RR = 0,66 [0,52-0,84]).
Schmid et Leitzmann (2014

) analysent l’impact de l’évolution de l’activité physique avant et après le diagnostic (3 études, dont deux portant sur le cancer du sein (Irwin et coll., 2008

; Irwin et coll., 2011b

) et une sur le cancer colorectal (Meyerhardt et coll., 2006a

). Concernant les femmes atteintes de cancer du sein, comparées aux femmes ayant maintenu le même niveau d’activité physique avant et après le diagnostic, l’augmentation du niveau d’activité physique après diagnostic est associée à une diminution significative du risque de mortalité globale (RR = 0,61 [0,46-0,80]) et une diminution non significative du risque de mortalité spécifique (RR = 0,71 [0,45-1,12]). Une baisse du niveau d’activité physique après diagnostic est associée à une augmentation non significative du risque de mortalité globale (RR = 1,72 [0,76-3,87]) et spécifique (RR = 1,28 [0,87-1,90]).
Analyses en sous-groupes et stratifications
Lahart et coll. et Ibrahim et coll. retrouvent un bénéfice plus important de l’activité physique post-diagnostic en termes de diminution de la mortalité spécifique pour les femmes ayant un IMC≥ 25 kg/m
2, et en termes de réduction de la mortalité globale pour les femmes en post-ménopause (Ibrahim et Al-Homaidh, 2011 ; Lahart et coll., 2015

). Aucune diminution significative n’est retrouvée pour les femmes non-ménopausées. Les données en fonction du statut des récepteurs hormonaux, notamment des récepteurs d’œstrogènes (ER) sont divergentes (Ibrahim et Al-Homaidh, 2011 ;
World Cancer Research Fund International, 2014

; Lahart et coll., 2015

). Schmid et coll. (2014) n’observent pas de différence de bénéfice en fonction de l’IMC, du statut ménopausique et du statut des récepteurs hormonaux (Schmid et Leitzmann, 2014

). Ces auteurs ne retrouvent pas non plus de différence de bénéfice, en fonction de l’ajustement ou non sur le traitement du cancer et le tabagisme.
Cancer du côlon
Quatre méta-analyses ont analysé l’impact de l’activité physique sur la survie, après le diagnostic d’un cancer colorectal (Des Guetz et coll., 2013

; Je et coll., 2013

; Schmid et Leitzmann, 2014

; Wu et coll., 2016

). Les trois premières méta-analyses regroupent six études prospectives avec 6 348 patients (Meyerhardt et coll., 2006a

; Meyerhardt et coll., 2006b

; Meyerhardt et coll., 2009

; Baade et coll., 2011

; Kuiper et coll., 2012

; Campbell et coll., 2013

), la méta-analyse de Wu inclut en plus l’étude de Arem et coll. (Arem et coll., 2016

).
L’activité physique (de niveau élevé
versus faible) après un diagnostic de cancer colorectal est associée à une diminution significative de la mortalité globale d’environ 40 % : RR de 0,61 [0,52 à 0,71] ; 0,62 [0,54 à 0,71] ; 0,58 [0,48 à 0,70] et 0,58 [0,49-0,68] respectivement dans les quatre méta-analyses (Des Guetz et coll., 2013

; Je et coll., 2013

; Schmid et Leitzmann, 2014

; Wu et coll., 2016

). Dans les méta-analyses de Je et de Wu, une diminution significative de la mortalité globale est également observée pour les actifs (tous niveaux d’activité physique regroupés)
versus les inactifs avec des RR respectivement de 0,76 [0,64-0,90] et de 0,71 [0,63-0,81] (Je et coll., 2013

; Wu et coll., 2016

). Une activité physique post-diagnostic (de niveau élevé
versus faible) permet également une diminution significative de la mortalité spécifique de 35 % à 44 % selon les méta-analyses (Je et coll., 2013

; Des Guetz et coll., 2013

; Schmid et Leitzmann, 2014

; Wu et coll., 2016

). Les bénéfices de l’activité physique observés dans l’étude de Meyerhardt (668 hommes, âge médian 70 ans, stades I-III), comparables aux résultats des méta-analyses, en termes de diminution de la mortalité globale et spécifique (RR 0,59 [0,41-0,86] et 0,47 [0,24-0,92], respectivement pour une activité physique ≥ 27 MET h/semaine comparée à une activité physique < 3 MET h/semaine), se traduisent par un gain de survie globale à 10 ans de 9 % (Meyerhardt et coll., 2009

).
Schmid et coll. (2014) rapportent une relation dose-réponse entre le niveau d’activité physique post-diagnostic et la diminution du risque de mortalité globale et spécifique. Ainsi, pour une augmentation de l’activité physique post-diagnostic de 5, 10 et 15 MET h/semaine, les auteurs rapportent une diminution de la mortalité globale respectivement de 15 % (IC 95 % [10-19]), 28 % (IC 95 % [20-35]) et 38 % (IC 95 % [28-47]).
Cancer de la prostate
Au total, quatre études prospectives ont évalué le bénéfice de l’activité physique sur le risque de récidive et de décès chez des patients atteints de cancer de la prostate (Richman et coll., 2011

; Kenfield et coll., 2011

; Bonn et coll., 2015

; Friedenreich et coll., 2016

), mais n’ont pas fait l’objet d’une méta-analyse.
L’étude de Kenfield portant sur 2 705 patients (stade I, II, suivi médian post-diagnostic > 9 ans) rapporte une diminution significative de la mortalité globale pour :
• activité physique totale (≥ 9 MET h/semaine versus < 9 MET h/semaine : HR = 0,67 [0,56-0,82]) ;
• activité physique < 6 MET (≥ 10 h/semaine versus < 1 h/semaine : HR = 0,49 [0,35-0,69]) ;
• activité physique ≥ 6 MET (≥ 3 h/semaine versus < 1 h/semaine : HR = 0, 51 [0,36-0,72]) ;
• marche (vitesse ≥ 3 km/h, plus de 1 h 30/semaine versus marche lente < 3 km/h ; HR = 0,54 [0,36-0,71]) avec des relations dose-réponse significatives.
Seule une activité physique intense (≥ 6 MET), pratiquée plus de 3 h par semaine (versus < 1 h/semaine), était associée à une diminution du risque de mortalité spécifique (HR = 0,39 [0,18-0,84]). Une autre étude des mêmes auteurs (Richman et coll., 2011) ayant inclus 1 455 patients (âge moyen 65 ans, stades T1, T2) avec un suivi plus court que la précédente, rapporte une diminution significative du taux de progression du cancer pour la vitesse de marche (indépendant de la durée hebdomadaire) avec une relation dose-réponse significative. L’impact sur la mortalité n’a pas été analysé.
Dans une cohorte de 4 623 patients atteints de cancer de la prostate localisé (âge moyen 63,1 ans), avec un suivi entre 10 et 15 ans, Bonn et coll. rapportent une diminution significative de la mortalité globale associée à une activité physique de loisir > 35 MET h/semaine (HR = 0,63 [0,52-0,77] ; la marche ou du vélo > 20 min/jour (HR = 0,70 [0,57-0,86]) ; des travaux ménagers ≥ 1 h par jour (HR = 0,71 [0,59-0,86]) ; de l’exercice physique ≥ 1 h par semaine (HR = 0,74 [0,61-0,90]) (Bonn et coll., 2015

). Une diminution significative de la mortalité spécifique a été observée pour la marche ou le vélo > 20 min/jour (HR = 0,61 [0,43-0,87]) et de l’exercice physique ≥ 1 h par semaine (HR = 0,68 [0,48-0,94]). Enfin, Friedenreich et coll. (2016), dans une étude prospective de 835 patients atteints de cancer de la prostate (stades II-IV, âge moyen 67,3 ans, suivi médian 15,5 ans), rapportent une diminution significative de la mortalité globale associée à un niveau d’activité physique plus élevé, avec une relation dose-réponse pour l’activité physique totale (diminution de 42 % pour une activité physique > 119
versus < 42 MET h/semaine, p < 0,01), l’activité physique de loisir, l’activité physique professionnelle, l’activité physique intense (≥ 6 MET). Pour la mortalité spécifique, seule l’activité physique de loisir montre un effet significatif, avec une relation dose-réponse (diminution de 40 % pour activité physique > 13
versus < 4 MET h/semaine, p trend 0,01) (Friedenreich et coll., 2016

).
Autres cancers
Une étude prospective portant sur 580 femmes atteintes de cancer de l’endomètre (âge moyen 66,7 ans) avec un suivi médian de 7,1 ans, n’a pas mis en évidence de bénéfice de l’activité physique post-diagnostic sur la survie après cancer de l’endomètre (Arem et coll., 2016

). Une analyse poolée de 57 études portant sur l’effet de l’activité physique sur la mortalité spécifique et incluant des patients avec différents types de tumeurs solides, essentiellement des cancers du sein et du côlon, rapporte un effet plus important pour l’activité physique post-diagnostic (HR 0,60 [0,50-0,71], I2 = 53,8 %) comparé à l’activité physique pré-diagnostic (HR = 0,86 [0,80-0,90], I2 = 16,7 %) (Li et coll., 2016

). Deux études prospectives suggèrent un bénéfice significatif de l’activité physique pré-diagnostic sur la survie après un cancer de l’ovaire (Zhou et coll., 2014

; Cannioto et coll., 2016

), mais le bénéfice de l’activité physique après diagnostic sur la survie n’a pas été évalué.
Conclusions sur l’activité physique pratiquée après le diagnostic
et impact sur la survie
Les résultats des méta-analyses disponibles sont cohérents et montrent une association positive entre l’activité physique après le diagnostic, et la réduction du risque de récidive et de la mortalité globale et spécifique chez des patients atteints de cancers non métastatiques, du sein (niveau de preuve B) et du côlon (niveau de preuve B). Un bénéfice similaire est observé dans plusieurs études prospectives pour le cancer de la prostate (niveau de preuve C). Aucune étude n’a montré un impact défavorable. Une relation dose-réponse est suggérée, l’effet positif apparaît d’autant plus important que le niveau d’activité physique est élevé pour les cancers du sein, du côlon (niveau B) et de la prostate (niveau C). De plus, le fait d’augmenter le niveau de l’activité physique post-diagnostique, par rapport au niveau pré-diagnostique, est associé à une réduction de la mortalité globale.
Mécanismes et marqueurs biologiques
Plusieurs mécanismes ont été proposés pour expliquer les effets de l’activité physique sur le risque de cancer et de rechute. Ces données proviennent essentiellement d’études conduites chez des femmes atteintes de cancer du sein, et suggèrent une influence de l’activité physique sur plusieurs voies de signalisation impliquées dans le développement et l’évolution tumorale, notamment la voie de signalisation de l’insuline, de l’inflammation chronique et de l’immunité et de la régulation hormonale (Ballard-Barbash et coll., 2012

).
Métabolisme glucidique : insuline et IGF1
Chez les femmes atteintes de cancer du sein, l’hyperinsulinémie à jeun et la résistance à l’insuline sont associées à un risque augmenté de mortalité (Goodwin et coll., 2002

; Duggan et coll., 2011

). Un taux sanguin augmenté d’
Insulin-like Growth Factor-1 (IGF-1) est associé à un mauvais pronostic (Vadgama et coll., 1999

; Hartog et coll., 2013

) et une augmentation de la mortalité globale (Duggan et coll., 2013

). L’insuline est impliquée dans la croissance tumorale et l’inhibition de l’apoptose secondaires à l’augmentation de synthèse et d’activité de l’IGF-1 (Pollak, 2008

). L’association entre l’obésité, l’augmentation des taux d’IGF-1 et le développement et/ou la progression du cancer est bien établie. Des réponses biologiques à l’IGF-1 impliquent une augmentation de la prolifération tumorale et du caractère invasif, une résistance à l’apoptose et la promotion d’un microenvironnement tumoral inflammatoire. L’IGF
Binding Protein-3 (IGFBP-3) a un effet favorable sur l’induction de l’apoptose et l’inhibition de la croissance cellulaire.
Deux méta-analyses et deux revues non quantitatives ont analysé l’effet de l’activité physique sur l’insulinémie et l’IGF-1 (Ballard-Barbash et coll., 2012

; Löf et coll., 2012

; Meneses-Echavez et coll., 2016

; Kang et coll., 2017

). Une méta-analyse de 5 essais randomisés (Meneses-Echavez et coll., 2016

) incluant au total 235 patientes atteintes de cancer du sein (48 ± 3,2 ans), rapporte une diminution significative associée à l’activité physique après traitement adjuvant des taux circulants d’IGF-1, d’IGF-2, et une augmentation d’IGFBP-1 (
IGF Binding Protein-1) et d’IGFBP-3, de l’insulinémie à jeun et de la résistance à l’insuline. Une méta-analyse de 7 essais randomisés incluant 369 patientes atteintes de cancer du sein décrit une diminution significative de l’insulinémie, mais n’observe pas de différence significative en termes de résistance à l’insuline (5 études), de taux d’IGF-1 (4 études) et d’IGFBP-3 (4 études) (Kang et coll., 2017

). Les différences observées entre les deux méta-analyses, intégrant en grande partie les mêmes études, sont partiellement expliquées par l’utilisation de différentes mesures pour estimer la taille de l’effet : différence moyenne pondérée (Kang et coll., 2017

) et différence moyenne standardisée (Meneses-Echavez et coll., 2016

). Cette dernière semble préférable pour les études dont les critères de jugement, continus, sont semblables mais utilisent des outils de mesure différents.
Les deux revues non-quantitatives de Ballard-Barbash et coll. (2012) et Löf et coll. (2012) décrivent elles aussi une diminution de l’insulinémie et des données discordantes pour l’IGF-1 et l’IGFBP-3 (Ballard-Barbash et coll., 2012

; Löf et coll., 2012

). Si les taux plasmatiques d’IGF-1 sont soit augmentés, soit diminués, on retrouve de manière plus reproductible une augmentation des taux plasmatiques d’IGFBP-3, cohérente avec une baisse de la disponibilité d’IGF-1 libre biologiquement actif (Inca, 2017

).
À noter qu’il est parfois difficile de distinguer les effets propres de l’activité physique de ceux liés à une modification de la balance énergétique et des habitudes alimentaires, associé fréquemment à l’activité physique. Ainsi, dans la méta-analyse de Kang et coll. (2017), l’effet de l’activité physique sur la baisse de l’insulinémie était augmenté dans les études associées à des interventions de perte de poids (Kang et coll., 2017

).
Pour le cancer colorectal, une analyse des données de 443 patients issus d’une cohorte de 41 528 sujets (40-69 ans) montre chez les patients actifs (194 patients, activité physique ≥ 3 fois/semaine), une relation positive entre la diminution de la mortalité spécifique (suivi médian 5,6 ans) et les concentrations plasmatiques d’IGFBP-3 (Haydon et coll., 2006

).
Des études sont nécessaires pour d’autres localisations tumorales (Inca, 2017

).
Inflammation
Plusieurs essais randomisés ont évalué l’effet de l’activité physique sur les biomarqueurs de l’inflammation (en particulier IL6, TNFα, protéine C réactive (CRP)), notamment chez les patientes atteintes de cancer du sein, et n’ont pas mis en évidence d’effet significatif de l’intervention d’activité physique sur les taux de ces marqueurs. L’IL6 et le TNFα sont des cytokines sécrétées par une grande variété de cellules et tissus, incluant les macrophages, le tissu adipeux et les muscles. Le TNFα est une cytokine pro-inflammatoire stimulant la production d’autres cytokines comme l’IL6. L’inflammation est un facteur de risque de cancer et favorise la croissance tumorale. Des taux élevés de CRP sont associés à une augmentation de la mortalité chez les femmes atteintes de cancer du sein (Irwin et coll., 2011a

).
La méta-analyse de Kang et coll. (2017) rapporte une diminution à la limite de la significativité du taux de CRP (4 études, 175 patientes), associé à l’activité physique, mais pas d’effet sur les taux de TNFα (6 études, 233 patientes) et d’IL6 (9 études, 338 patientes) (Kang et coll., 2017

). La méta-analyse de Meneses-Echávez et coll. (2016) ayant analysé 8 essais randomisés, incluant 475 femmes atteintes de cancer du sein (54 ± 4 ans), rapporte une diminution significative des taux d’IL6 (8 études), de TNFα (6 études) et d’IL8 (4 études), mais pas de différence significative des taux d’IL2 (2 études), d’IL10 (2 études) et de CRP (2 études) (Meneses-Echavez et coll., 2016

).
En revanche, la méta-analyse de Kruijsen-Jaarsma et coll. (2013) portant sur 21 études, dont 10 essais randomisés, ne retrouve pas de variation des cytokines inflammatoires et anti-inflammatoires, ni de variation de la CRP au décours de programmes d’activité physique d’intensité élevée à modérée (Kruijsen-Jaarsma et coll., 2013

).
L’activité physique agirait également sur l’immunité anti-tumorale. La méta-analyse de Kruijsen-Jaarsma et coll. (2013) rapporte une amélioration de l’activité cytotoxique des lymphocytes «
natural-killer », mais des données divergentes existent concernant la prolifération des lymphocytes T (Kruijsen-Jaarsma et coll., 2013

).
Adipocytokines
Les adipocytokines, produites principalement par le tissu adipeux, exercent des effets sur la croissance tumorale. La leptine, positivement associée à la masse grasse, stimule la prolifération, la migration et l’invasion cellulaire et possède des effets angiogéniques par une régulation positive du
Vascular Epithelial Growth Factor (VEGF). L’adiponectine est inversement corrélée avec l’IMC et la masse grasse. Elle augmente la sensibilité à l’insuline et joue un rôle dans la régulation du métabolisme du glucose et dans l’inflammation. L’adiponectine inhibe la prolifération tumorale. Un taux sanguin diminué d’adiponectine chez des femmes atteintes de cancer du sein a été associé avec un moins bon pronostic (Duggan et coll., 2011

). La méta-analyse de Kang et coll. (2017), sur la base de trois essais randomisés (65 patients) rapporte une augmentation non significative du taux d’adiponectine associé à l’activité physique (Kang et coll., 2017

).
Hormones
L’activité physique exerce des effets directs et indirects sur la régulation des hormones sexuelles, par une diminution de la conversion des androgènes en œstrogènes par l’aromatase et une amélioration de la synthèse des globulines de transport des hormones sexuelles (ou SHBG), aboutissant à une réduction des taux d’œstrogènes libres. Un taux élevé d’estradiol est associé à un risque accru de récidive du cancer du sein chez les femmes ménopausées (Rock et coll., 2008

; Kim et coll., 2013a

). À notre connaissance, aucune étude n’a évalué l’effet de l’activité physique sur le taux d’estradiol chez les femmes atteintes de cancer du sein.
Système immunitaire
Des auteurs indiquent que l’exercice peut modifier de façon significative le nombre et la fonction des cellules circulantes du système immunitaire inné (neutrophiles, monocytes, cellules NK) et, dans une moindre mesure, du système immunitaire adaptatif (cellules T et B) (Koelwyn et coll., 2015

). Cependant, la question de savoir si la modulation du système immunitaire contribue aux propriétés antitumorales potentielles de l’exercice n’a pas été examinée en profondeur (Goh et coll., 2014

).
En résumé, l’effet de l’activité physique chez les patients atteints de cancer a été associé à plusieurs mécanismes impliqués dans la régulation de la prolifération tumorale. Ces effets et mécanismes sont le mieux documentés pour le cancer du sein et certains ont été associés au pronostic chez les femmes atteintes de cancer du sein. Les données sont cohérentes en faveur d’un effet positif sur la régulation glycémique et inflammatoire (niveau de preuve B) pouvant avoir un effet favorable sur l’environnement tumoral. Il est parfois difficile de distinguer les effets propres de l’activité physique, notamment
via un effet positif sur la composition corporelle et une diminution de la masse grasse, de ceux liés à la réduction du poids secondaire à une balance énergétique plus favorable. Aussi, les données de la littérature ne permettent pas de conclure à un lien de causalité entre les effets biologiques associés à l’activité physique et l’impact sur la survie des patients atteints de cancer. Plus particulièrement, le lien entre les changements systémiques et l’effet au niveau tumoral restent à élucider (Ashcraft et coll., 2016

).
Effets indésirables de l’activité physique
Globalement, peu d’effets secondaires sont rapportés dans les études ayant évalué l’activité physique chez les patients atteints de cancer (Speck et coll., 2010

; Schmitz et coll., 2010

; Jones, 2011

; Crandall et coll., 2014

; Gardner et coll., 2014 ; Meneses-Echavez et coll., 2015b

; Dennett et coll., 2016

; Furmaniak et coll., 2016

). La fréquence des effets secondaires dans le bras intervention semble comparable à celle du bras contrôle ou de la population générale (Morey et coll., 2009

; Bourke et coll., 2016

). Jones (2011

) a revu 118 études d’activité physique (44 % d’essais randomisés ; 5 529 patients atteints de cancer (36 % cancer du sein, 20 % cancer du poumon et 34 % incluant plusieurs types de tumeurs solides), âge moyen 53 ± 11 ans, 56 % de femmes) (Jones, 2011

). La majorité des études portait sur l’activité physique après chirurgie, dont 41 % pendant et 24 % après les traitements adjuvants. Seules 16 études (14 %) avaient évalué spécifiquement les effets indésirables et avaient enregistré, au total, 101 effets indésirables très variés (88 durant un test d’exercice et 13 durant l’activité physique), correspondant à un taux de 6,3 %. Pendant les tests d’exercice, les effets indésirables les plus fréquents étaient cardiovasculaires (64 %, sous-décalage du segment ST (n = 32), réponse réduite de la fréquence cardiaque ou de la pression artérielle (n = 13), ischémie (n = 11)) et des douleurs (13 %). Les 13 effets indésirables survenus durant l’exercice, dont un décès (cause de décès non précisée), étaient de nature et de gravité très variables.
Les six essais randomisés inclus dans la méta-analyse de Jones (2011

) ont renseigné les effets indésirables. Au total, 13 effets indésirables pour 571 patients adultes (2,3 %) ont été rapportés, deux au cours de tests d’exercices cardiorespiratoires, neuf au cours de l’activité physique, dont un infarctus du myocarde, ainsi que deux chez des patients des groupes contrôle (Jones, 2011

). Parmi les 82 études incluses dans la méta-analyse de Speck et coll. (2010, voir ci-dessus), 36 (44 %) ont documenté la présence ou l’absence d’effets secondaires durant l’intervention d’activité physique, dont 29 (80 %) rapportent l’absence d’effets indésirables (Speck et coll., 2010

). Morey et coll. (2009) dans leur essai randomisé de 641 patients (survivants d’un cancer colorectal, du sein ou de la prostate, âgés de 65 à 91 ans, IMC ≥ 25 et < 40), rapportent 201 événements, sans différence entre les 2 bras. Seuls 5 effets étaient attribuables à l’activité physique (Morey et coll., 2009

).
Dans la méta-analyse de Dennett et coll. (2016), 22 des 42 essais randomisés (52 %) ayant documenté des effets indésirables de l’activité physique, rapportent des effets indésirables ayant conduit à l’arrêt de l’activité physique pour 19 patients (1 %), incluant vertiges, fatigue, douleurs osseuses, douleurs thoraciques, infarctus du myocarde, anémie, dyspnée (Dennett et coll., 2016

). D’autres effets secondaires sans impact sur la participation, incluaient des douleurs du dos, des jambes ou des inconforts post exercice. Les effets secondaires ne sont pas augmentés par l’activité physique comparés au bras contrôle et ne diffèrent pas en fonction du type et de l’intensité de l’activité physique.
À noter une augmentation de la fatigue associée à l’activité physique d’un niveau d’intensité élevé mise en évidence dans plusieurs méta-analyses (voir ci-dessus).
Dans une revue de 20 études (Crandall et coll., 2014

) ayant évalué l’activité physique en pré- et/ou post-opératoire, neuf études (45 %) ont évalué les effets indésirables de l’activité physique. Seuls deux essais rapportent des complications attribuables à l’activité physique : une baisse de la pression artérielle systolique supérieure à 20 mmHg chez deux patients et des douleurs ostéo-articulaires chez trois patients ; les sept autres études ne rapportent aucun effet indésirable. Chez les femmes atteintes de cancer du sein, plusieurs essais randomisés et méta-analyses (McNeely et coll., 2010

; Cheema et coll., 2014

; Paramanandam et Roberts, 2014

; Keilani et coll., 2016

; Singh et coll., 2016b

) montrent l’absence de complications ou de détérioration du lymphœdème associées à la pratique d’une activité physique pendant ou après le traitement adjuvant (voir ci-dessus).
Deux recommandations pour la pratique clinique (Schmitz et coll., 2010

; Segal et coll., 2017

) concluent, sur la base des données de la littérature, que la pratique d’une activité physique est sans risque pour des patients atteints de cancer, pendant et après les traitements, et que la fréquence des effets indésirables est similaire à celle observée chez des personnes indemnes de cancer. Il n’existe pas de contre-indications absolues à la pratique d’une activité physique. Il est nécessaire d’évaluer en préalable à la pratique d’une activité physique les comorbidités, notamment cardiovasculaires, et effets latents des traitements pouvant engendrer un risque pour le patient, et adapter l’activité physique aux conditions du patient (Schmitz et coll., 2010

; Segal et coll., 2017

; Inca, 2017

; NCCN, 2017

).
Contre-indications et précautions
Plusieurs sociétés savantes internationales et institutions (Schmitz et coll., 2010

; Rock et coll., 2012

; Brown et Schmitz, 2014

; Bouillet et coll., 2015

; Inca, 2017

; NCCN, 2017

) ont établi des recommandations listant les situations cliniques, les comorbidités et les médications représentant des contre-indications relatives ou temporaires à la pratique d’une activité physique et nécessitant en conséquence une adaptation des exercices. Les états suivants constituent des contre-indications à l’exercice physique : fatigue extrême, anémie prononcée (hémoglobine ≤ 8 g.dL
-1), plaquettes < 50 000/mm
3, leucocytes < 1 500/mm
3, suites précoces de chirurgie (risque de déhiscence de cicatrice, d’hémorragie), syndrome infectieux sévère en cours d’évolution, décompensation de pathologie cardiopulmonaire, lésions osseuses lytiques du rachis ou des os longs (la contre-indication concerne la mobilisation du membre atteint), dénutrition sévère. Si ces situations représentent des contre-indications à la pratique d’une activité physique, la majorité peuvent être temporaires.
À noter également que ces contre-indications n’interdisent pas la pratique de soins de rééducation qui peuvent permettre la mobilité articulaire et l’entretien de la masse musculaire (Inca, 2017

). Les patients présentant une fatigue importante peuvent être encouragés à pratiquer 10 min d’exercice de faible intensité par jour.
Les recommandations insistent de façon unanime sur la nécessité de réévaluer régulièrement l’état du patient et d’adapter l’activité physique pour ne pas freiner l’engagement dans un comportement actif par la pratique régulière d’activité physique d’intensité modérée pendant les traitements, et dans les suites d’un cancer.
Situations particulières pouvant nécessiter des précautions
et une adaptation de l’activité physique
Il est important d’adapter l’activité physique à l’état clinique des patients et de personnaliser les recommandations en fonction d’éventuels effets indésirables des traitements, ou des comorbidités. Une adaptation de la prescription d’exercices physiques sera nécessaire notamment pour les patients dans les situations suivantes :
• comorbidités cardiovasculaires ou insuffisance pulmonaire (facteurs de risque cardiovasculaires, antécédent familial de mort subite, pathologie cardiovasculaire grave, bronchopneumopathie chronique obstructive) pouvant nécessiter une adaptation de l’intensité de l’activité physique ;
• ostéoporose et métastases osseuses avec risque de fracture élevé ;
• amyotrophie importante ;
• neuropathie périphérique induite ou non par les traitements pouvant gêner la pratique de l’activité physique (troubles de la proprioception) et entraîner un risque de chute ;
• altérations de la mobilité et de la stabilité des articulations de l’épaule (NCCN, 2017

) ;
• lymphœdème d’un membre. Il n’y a pas de risque de lymphœdème associé à la pratique d’exercices à visée cardiorespiratoire/aérobie ou à la pratique de renforcement musculaire des membres non affectés (NCCN, 2017

) ;
• stomies digestives ou urinaires. Elles ne constituent pas un obstacle en soi, dès lors que le patient est devenu autonome ;
• réponse immunitaire diminuée. Éviter les gymnases et piscines publics. Les patients post-greffe devraient éviter ces lieux pendant un an après transplantation ;
• pas d’activité aquatique pendant et jusqu’à 2-3 mois après la radiothérapie (marquage radiothérapie, perméabilité membranaire => risque d’infection).
Des patients avec des cathéters à demeure ou des tubes alimentaires devraient être prudents et éviter piscine, lac, mer ou autres risques microbiens pouvant entraîner des infections, mais aussi des exercices de renforcement musculaire impliquant des muscles dans la région de la sonde, afin d’éviter son délogement.
Activité physique en fonction des étapes de la maladie
et de sa prise en charge
Le Plan cancer 2014-2019 et les recommandations de l’HAS prévoient de systématiser, dans le parcours des patients atteints de cancer, une démarche de prévention incluant la réduction de la sédentarité et l’augmentation du niveau d’activité physique. Si les médecins reconnaissent les bénéfices de l’activité physique, les conseils donnés aux patients ne correspondent pas toujours aux recommandations en matière d’activité physique (Cantwell et coll., 2017

).
Les objectifs et indications de l’activité physique peuvent varier en fonction de l’étape de la maladie et des traitements. Ainsi l’activité physique pendant les traitements et la phase post-thérapeutique vise à prévenir le déconditionnement physique, la perte de la masse musculaire et la prise de poids, la fatigue, la détérioration de la qualité de vie, ainsi que certains effets secondaires de la maladie. L’activité physique après traitement vise à améliorer la condition physique, la fatigue et la qualité de vie, à prévenir le développement de comorbidités et de cancers secondaires et à réduire ses risques de morbidité et de mortalité sur le long terme.
Avant traitement
Plusieurs études ont posé la question du bénéfice d’une intervention en activité physique en pré-opératoire, notamment pour le cancer bronchopulmonaire. Une revue qualitative de 18 études (966 patients, âge 54-71 ans) portant sur le cancer du poumon (11), la prostate (4) et d’autres localisations notamment abdominales (côlon, rectum, foie...), ayant évalué l’impact de l’activité physique pré-opératoire, conclut à une amélioration des capacités fonctionnelles (marche) et cardiorespiratoires (V̇O
2max, fréquence cardiaque, débit cardiaque) (Singh et coll., 2013

).
Trois méta-analyses ont revu des données concernant la place de l’activité physique en pré-ou post-opératoire chez les patients atteints de cancer bronchopulmonaire (Ni et coll., 2016

; Sebio et coll., 2016

; Mainini et coll., 2016

. Ni et coll. (2016

), dans une méta-analyse de 15 études (350 patients, âge 54-70 ans), rapportent une diminution significative de la durée d’hospitalisation de 5 jours et des complications post-opératoires, associée à l’activité physique en pré-opératoire. La méta-analyse de Sebio-Garcia (Sebio et coll., 2016

), sur la base de 21 études (1 189 patients, âge moyen 64,6 ans), rapporte une amélioration significative de la fonction pulmonaire et une diminution significative de l’hospitalisation post-opératoire de 5 jours. Mainini et coll. (2016), dans une revue qualitative de six études, concluent que les données sont hétérogènes et ne permettent pas de trancher sur le type d’activité physique pré-opératoire le plus approprié (Mainini et coll., 2016

). Boereboom et coll. (2016), dans une revue qualitative de 8 études (âge 58-70 ans) dans le cancer colorectal, concluent à une amélioration de la condition physique pré-opératoire, mais les données sont insuffisantes pour conclure à une diminution du risque péri-opératoire ou une amélioration des résultats post-opératoires (Boereboom et coll., 2016

). Une revue systématique de 4 études de petite taille ayant évalué l’activité physique concomitante à des traitements néo-adjuvants dans le cancer du sein (3 études) et cancer du rectum localement avancé (1 études), montre la faisabilité de l’activité physique et une bonne observance (Loughney et coll., 2016

). En revanche, les auteurs concluent à l’insuffisance des données pour juger de l’impact sur d’autres paramètres. Dans le cancer de la prostate, la pratique d’une activité physique préalable à une prostatectomie pourrait prévenir le risque d’incontinence, mais l’impact sur la réduction des effets indésirables post-chirurgie ou post-radiothérapie reste à confirmer (Inca, 2017

).
Les données suggèrent un bénéfice de l’activité physique pré-opératoire sur la condition physique, la durée d’hospitalisation et les complications post-opératoires chez les patients atteints de cancer broncho-pulmonaire (niveau de preuve B/C).
Pendant les traitements et la phase post-thérapeutique
La majorité des patients réduisent leur activité physique après un diagnostic de cancer ou durant les traitements de la maladie (Foucaut, 2013

; Fassier et coll., 2016

). Le fait d’avoir un cancer à un stade avancé, de recevoir une chimiothérapie, la fatigue et des douleurs sont des facteurs associés à une baisse plus importante de l’activité physique. Les méta-analyses montrent de façon convergente de nombreux bénéfices et l’absence de risque à pratiquer une activité physique en post-opératoire et pendant la phase de traitement par chimiothérapie, hormonothérapie et radiothérapie. Les bénéfices démontrés concernent notamment l’amélioration des capacités cardiorespiratoires, de la force musculaire, de la qualité de vie et la réduction de la fatigue. Il a été suggéré que l’activité physique pendant les traitements contribue à contenir l’installation de la fatigue, alors qu’après les traitements, l’activité physique favorise la récupération (Puetz et Herring, 2012

; Inca, 2017

).
Les études suggèrent également des bénéfices possibles sur certains types de douleur, des neuropathies périphériques chimio-induites et du taux de réalisation de la chimiothérapie, mais ces données nécessitent confirmation.
Si les méta-analyses n’ont pas mis en évidence d’effets secondaires particuliers de l’activité physique chez les patients atteints de cancer, il convient d’évaluer de façon systématique dans cette population l’état clinique des patients, l’existence de comorbidités et d’effets secondaires des traitements anticancéreux (cf. ci-dessus) pouvant nécessiter une adaptation de l’activité physique en fonction des limitations identifiées ou représenter des contre-indications relatives. Le bilan pré-exercice comprend également une évaluation du niveau d’activité physique habituel, une évaluation des préférences/motivations du patient et des freins à la pratique sur les plans physiques, psychologiques, environnementaux et économiques ainsi qu’un bilan fonctionnel des capacités physiques, cognitives et sensorielles (Inca, 2017

).
L’objectif de l’activité physique pendant les traitements sera de prévenir la réduction du niveau d’activité et le déconditionnement des patients, dès le début de la prise en charge, de limiter les temps de sédentarité, et de favoriser l’adoption et le maintien d’une activité physique régulière au long cours. Si les méta-analyses des études prospectives ont montré une relation dose-réponse linéaire entre le niveau d’activité physique et la mortalité globale et spécifique ainsi qu’une diminution significative de la mortalité globale et spécifique pour l’augmentation du niveau d’activité physique post-diagnostic, comparé au niveau d’activité physique pré-diagnostic, les méta-analyses ayant évalué les bénéfices en termes de fatigue et de qualité de vie, suggèrent un effet plus favorable pour une activité physique de niveau modéré à intense comparé à une activité physique d’intensité élevée (Pastakia et Kumar, 2011

; Mishra et coll., 2012b

; Carayol et coll., 2013

; Dennett et coll., 2016

). Comparé à un niveau d’intensité élevé, une activité physique de niveau modéré à intense semble favoriser l’adhésion des patients et le maintien dans la durée (Segal et coll., 2017

). En revanche, le bénéfice d’activité physique de faible intensité 7n’a pas montré de bénéfice sur la réduction du niveau de fatigue comparé à des groupes contrôles (Cramp et Byron-Daniel, 2012

; Buffart et coll., 2012

). Trois méta-analyses montrent que la prescription de l’activité physique dans des programmes supervisés (Sweegers et coll., 2017

; Buffart et coll., 2017

) ou semi-supervisés (Bluethmann et coll., 2015

) a un bénéfice supérieur comparé à des programmes non-supervisés en termes de capacité physique et de qualité de vie (Sweegers et coll., 2017

; Buffart et coll., 2017

) et de changement de pratiques d’activité physique (Bluethmann et coll., 2015

).
Il est recommandé de combiner des activités de type aérobie et du renforcement musculaire, en augmentant progressivement la fréquence, la durée et l’intensité de l’activité physique (Stene et coll., 2013

; Sasso et coll., 2015

; Inca, 2017

; Segal et coll., 2017

). D’après les données de plusieurs méta-analyses, un programme d’activité physique combinant activité aérobie et renforcement musculaire a un effet plus important sur l’IMC, la masse musculaire et la composition corporelle qu’une activité aérobie seule (McNeely et coll., 2006

; Kim et coll., 2009

; Speck et coll., 2010

; Wolin et coll., 2010

; Fong et coll., 2012

; Inca, 2017

). La combinaison optimale des deux types d’activité physique reste à déterminer (Sasso et coll., 2015

). La méta-analyse de Kim et coll. (2009), sur la base d’une analyse en sous-groupes, rapporte un effet plus important sur la masse musculaire et le pourcentage de masse grasse lorsque l’activité physique est réalisée pendant les traitements comparé à l’activité physique débutée après traitement (Kim et coll., 2009

).
Après un cancer
La survie relative à 5 ans après un cancer est aujourd’hui supérieure à 50 %, voire 60 % selon les publications. En France, environ 3 millions de personnes vivent avec ou après un cancer. La moitié des patients est âgée de 70 ans ou plus. Les patients après un cancer du sein, un cancer de la prostate et un cancer colorectal représentent environ la moitié de cette population, suivie des hémopathies malignes et du cancer de l’endomètre (Siegel et coll., 2012

). Les taux de survie à 5 ans, tous stades confondus, se situent entre 80 et 90 % pour les cancers du sein et de la prostate et de 50 à 60 % pour le cancer colorectal. Les symptômes, tels que la fatigue, une capacité cardiovasculaire et une force musculaire réduites, une diminution de la qualité de vie, des douleurs, un lymphœdème et une neuropathie peuvent perdurer dans le temps. Selon l’INCa (étude VICAN5), 50 % des personnes rapportent une fatigue cliniquement significative 5 ans après un cancer.
Selon les études, 50 à 75 % des patients après un cancer ne suivent pas les recommandations en termes d’activité physique (Blanchard et coll., 2003

; Eakin et coll., 2007

). Selon l’enquête française Vican2 « La vie deux ans après un diagnostic de cancer », menée en France en 2012 auprès de 4 349 patients atteints de cancer, parmi les personnes qui avaient au moment du diagnostic une activité physique régulière (domestique et/ou professionnelle), la moitié ont diminué ou arrêté l’activité physique. Seuls 10 % l’ont augmentée (Inca, 2014

). L’étude de cohorte française Nutrinet a comparé l’activité physique avant diagnostic à l’activité physique post-diagnostic chez 942 patients atteints de cancer (âge moyen 59 ans, temps de suivi moyen 42 ± 16,7 mois). Les principales localisations concernaient le cancer du sein (n = 342), de la prostate (n = 152), de la peau (n = 102), et du côlon-rectum (n = 64). Le niveau d’activité physique totale et l’activité physique intense diminuaient de façon significative après le diagnostic, notamment chez les patients de plus de 60 ans, les hommes et les patients ayant arrêté leur activité professionnelle. Une augmentation significative de la sédentarité, notamment chez les femmes, les patients de plus de 60 ans et les patients ayant arrêté leur activité professionnelle est observée (Fassier et coll., 2016

).
Les personnes après un cancer présentent un risque accru de développer un second cancer primitif (Jegu et coll., 2014

; Morton et coll., 2014

), des maladies cardiovasculaires, un syndrome métabolique et une ostéoporose (Jung et coll., 2012

; Jacobs et Shulman, 2017

). Les pathologies cardiovasculaires constituent une cause de décès prépondérante chez les survivants 10 ans après un cancer du sein, de l’endomètre ou d’un cancer colorectal (Vijayvergia et Denlinger, 2015

). Dans une étude de cohorte canadienne incluant 1 526 survivants du cancer et 6 034 témoins, âgés de 35 à 69 ans (tous type de cancer confondus), les survivants du cancer présentaient un risque augmenté de pathologies cardiovasculaires, d’hypertension et de diabète (Keats et coll., 2017

). Comparé au groupe ayant un faible niveau d’activité physique, ceux ayant un niveau modéré ou élevé d’activité physique développaient significativement moins de facteurs de risque (hypertension OR = 0,73 ; IC 95 % [0,64-0,84] ; diabète OR = 0,66 ; IC 95 % [0,58-0,76]), et ceci également après ajustement sur le tabagisme, l’alcool, la consommation de fruits et légumes, la sédentarité, le tour de taille, l’IMC (mais pas après ajustement sur l’adiposité abdominale).
Pour la plupart des symptômes persistant à distance de la maladie, les essais randomisés chez les patients atteints de cancer ont montré un bénéfice de l’activité physique (cf. ci-dessus). De plus, les résultats des méta-analyses des études épidémiologiques montrent un bénéfice en termes de survie pour les pathologies cancéreuses les plus fréquentes chez les survivants après un cancer. Le surpoids, l’obésité et la prise de poids pendant et après un cancer sont associés à une augmentation de risque de 2
e cancer (Druesne-Pecollo et coll., 2012

;
World Cancer Research Fund International, 2014

), mais l’impact de l’activité physique sur le risque de 2
e cancer n’a pas été étudié (
World Cancer Research Fund International, 2014

). De même, les effets de l’activité physique sur les maladies cardiovasculaires et le diabète n’ont pas été étudiés spécifiquement chez les survivants d’un cancer, mais il est raisonnable de penser que les effets bénéfiques de l’activité physique ne différeraient pas de ceux observés dans la population générale.
En l’absence de limitations liées à la pathologie cancéreuse ou ses traitements, une activité physique régulière conforme aux recommandations de l’activité physique en population générale est recommandée chez les personnes après un cancer (niveau de preuve A). Les recommandations concernant l’évaluation des comorbidités et contre-indications relatives ainsi que l’adaptation et la progressivité de l’activité physique s’appliquent également aux patients après un cancer.
Patients atteints d’un cancer à un stade avancé ou en situation palliative
Une question centrale pour la programmation de l’activité physique est la visée choisie par les équipes d’oncologues et de soins de support en accord avec le patient. Dans une perspective de prévention, il s’agira notamment de permettre au patient de modifier son mode de vie s’il est sédentaire et d’intégrer régulièrement des séances d’activité physique comme d’autres soins. L’activité physique contribuera à faciliter le retour à une vie aussi normale que possible, notamment à travers la vie professionnelle (Duijts et coll., 2017

). Au contraire, dans une visée palliative, l’amélioration de la qualité de vie est la finalité pour celui qui conçoit un programme d’activité physique. Le plaisir ressenti lors de la pratique est déterminant. En revanche, il faut se garder de donner de faux espoirs à des patients en stade avancé en leur faisant croire à des vertus curatives du cancer par l’activité physique.
À ce jour, relativement peu d’études ont évalué l’activité physique chez des patients atteints de cancer à un stade avancé ou en situation palliative. Les cancers de stades avancés sont le plus souvent exclus des études pendant et après les traitements, en l’argumentant par des difficultés de faisabilité et des barrières à la pratique (Mas et coll., 2015

). Pourtant, cinq revues systématiques chez des patients atteints de cancer avancé suggèrent la faisabilité et la sécurité de la pratique d’activité physique (Lowe et coll., 2009

; Beaton et coll., 2009

; Albrecht et Taylor, 2012

; Dittus et coll., 2017

; Heywood et coll., 2017

). La revue systématique de Dittus et coll. (2017

) de 26 études avec des populations hétérogènes suggère que l’activité physique, chez des personnes atteintes d’un cancer avancé, permet de maintenir ou d’améliorer la condition physique et les fonctions physiques, de diminuer la fatigue et d’améliorer la qualité de vie. Une étude contrôlée randomisée (Oldervoll et coll., 2011

), menée auprès de 231 patients atteints de différents cancers métastatiques, a montré une amélioration des capacités physiques fonctionnelles chez les patients randomisés dans le groupe interventionnel (n = 131, 81 femmes, 40 hommes ; activité physique supervisée de 8 semaines) mais pas de changement du niveau de fatigue, par rapport au groupe contrôle (n = 110 avec n = 63 femmes et n = 47 hommes). D’autres études chez des patients atteints de différents types de cancer à un stade avancé ont également suggéré une amélioration des capacités fonctionnelles, mais sans amélioration de la qualité de vie, de l’anxiété ou la symptomatologie dépressive (Hwang et coll., 2012

; Kuehr et coll., 2014

; Quist et coll., 2015

; Ligibel et coll., 2016

). Cependant, la dose d’activité physique réalisable et optimale, chez les patients atteints de cancer avancé, reste à déterminer.
L’activité physique pourrait améliorer les capacités physiques fonctionnelles chez les patients atteints d’un cancer à un stade avancé (niveau de preuve B/C). Compte tenu de la diversité des situations cliniques, les données de la littérature sont insuffisantes pour formuler des recommandations systématiques. La pratique de l’activité physique en situation palliative doit être personnalisée en fonction de l’état clinique des patients et des comorbidités. Des études randomisées sont nécessaires pour confirmer les effets bénéfiques de l’activité physique chez les patients en situation palliative.
Conclusion et perspectives
Les nombreuses études prospectives, essais randomisés et méta-analyses permettent de conclure à un ratio bénéfice-risque favorable de l’activité physique sur les conséquences de la maladie et effets secondaires des traitements. Toutefois, la taille des échantillons dans nombre de ces études est limitée et le suivi de courte durée. La revue de littérature permet d’identifier plusieurs domaines et questions où les données scientifiques font actuellement défaut et qui devront faire l’objet de futures études pour améliorer les connaissances.
Ainsi, la plupart des études a porté sur les cancers les plus fréquents, à savoir les cancers du sein, du côlon et de la prostate, et des études randomisées complémentaires sont nécessaires pour mieux connaître le bénéfice de l’activité physique dans d’autres types de cancer. La grande majorité des études s’est intéressée aux personnes atteintes de cancer à un stade précoce. Des études randomisées sont nécessaires pour évaluer la place de l’activité physique dans la prise en charge des personnes atteintes de cancer à un stade avancé.
Les patients inclus dans les études existantes présentent souvent une meilleure condition physique et parfois un âge plus jeune que les patients en pratique courante (Lynch et coll., 2013

). Il est nécessaire d’évaluer davantage le bénéfice de l’activité physique dans des populations de patients insuffisamment étudiés à ce jour, notamment les patients âgés et/ou ayant des comorbidités, les patients inactifs, présentant une qualité de vie détériorée, ainsi que les patients en situation précaire. L’évaluation des bénéfices de l’activité physique dans ces différentes populations de patients doit s’accompagner d’une meilleure documentation des caractéristiques des non-participants ainsi que d’une évaluation plus systématique des effets secondaires. Compte tenu du rôle possible indépendant de la sédentarité sur la santé des patients après un cancer, celle-ci doit être mieux évaluée et ses mécanismes analysés. Dans la littérature, la nécessité de coupler les programmes d’activité physique avec une intervention nutritionnelle est rappelée (Inca, 2017

).
L’évaluation du bénéfice de l’activité physique sur le taux de réalisation complète du traitement prévu et le rôle de l’activité physique dans la gestion des effets secondaires tels que les douleurs, la cardiotoxicité, la neuropathie chimio-induite et la densité minérale osseuse, ainsi que les capacités cognitives, est à envisager dans des études avec une puissance suffisante. Plusieurs voies dérégulées par l’obésité et impliquées dans la résistance thérapeutique observée chez les patients obèses (Lashinger et coll., 2014

), sont favorablement influencées par l’activité physique. L’étude de l’impact de l’activité physique sur la résistance thérapeutique, notamment chez les patients en surpoids ou obèses serait pertinente.
De futurs essais devront identifier les caractéristiques de l’activité physique (type, durée, fréquence et intensité) les plus efficaces ainsi que les interventions permettant de modifier favorablement et durablement les comportements liés à l’activité physique chez les patients atteints de cancer (Courneya et coll., 2015

). Compte tenu des bénéfices démontrés de l’activité physique, comparer dans de futurs essais l’activité physique
versus l’absence d’activité physique semble aujourd’hui discutable d’un point de vue éthique (Inca, 2017

). En conséquence, les études devraient proposer de comparer différentes modalités d’activité physique.
Une meilleure compréhension des facteurs favorisant le maintien de l’activité physique dans le temps et des études permettant de déterminer comment implémenter l’activité physique au-delà des programmes supervisés initiaux seraient nécessaires, afin que l’activité physique s’inscrive sur le long terme. L’évaluation des bénéfices sur le long terme en prévention tertiaire, notamment en termes d’amélioration durable de la qualité de vie, d’évolution des effets secondaires des traitements et de l’incidence des comorbidités et de seconds cancers s’avère aussi importante.
L’impact positif de l’activité physique sur la réduction de la mortalité et du risque de récidive, chez des patients atteints de cancers non métastatiques, du sein, du côlon et de la prostate, mis en évidence de façon convergente dans des cohortes prospectives, doit être confirmé par des essais randomisés afin de permettre de conclure à une relation causale entre survie et activité physique post-diagnostic. La réalisation de tels essais soulève des questions d’ordre méthodologique. Ainsi, l’estimation de la taille de l’échantillon permettant une puissance suffisante pour détecter un effet significatif en termes de réduction de la mortalité globale ou spécifique est comprise entre 2 600 et plus de 11 000 patients, en fonction de la durée du suivi (trois ou cinq ans) et de réduction du rapport de risque envisagé (Ballard-Barbash et coll., 2009

; Romieu et coll., 2012

). La réalisation d’un essai randomisé de cette taille doit donc se faire impérativement de façon multicentrique, à un niveau national, voire international. Identifier et valider des marqueurs biologiques intermédiaires dans la voie causale entre l’activité physique et la survie comme critères de substitution de la survie globale (
surrogate endpoints) faciliterait ce type d’études.
Par ailleurs, le rôle joué par les modulations spécifiques de la masse musculaire sur les marqueurs métaboliques n’a pas été étudié. De plus, il serait intéressant d’étudier l’impact de l’activité physique sur des marqueurs tels que les cellules adipeuses stromales pour le cancer du sein, les cellules tumorales circulantes, des microARNs ou des marqueurs de stress oxydant (Goh et coll., 2014

; Hayes et coll., 2016

).
Des études permettant une meilleure compréhension des mécanismes biologiques impliqués dans l’association entre activité physique et survie sont nécessaires. Connaître la relation entre l’exercice et l’axe inflammatoire-immunitaire pourrait permettre d’optimiser l’efficacité de l’exercice concomitant aux traitements adjuvants (Goh et coll., 2014

). Les études devraient également s’efforcer de mieux comprendre les facteurs modifiant l’effet de l’activité physique, tels que l’IMC, la perte/prise de poids, le statut ménopausique, le statut des récepteurs d’œstrogènes pour les cancers du sein, mais également l’interaction de l’activité physique avec l’impact métabolique des traitements (hormonothérapie, chimiothérapie).
Le rôle de la sédentarité
5
Voir le glossaire pour la définition.
doit également être envisagé de manière plus systématique dans les futures études. En effet, de nouvelles données suggèrent que la sédentarité représente un risque spécifique pour la santé de patients atteints de cancer (Lynch, 2010

; Bourke et coll., 2014

). Les mécanismes biologiques expliquant les effets de la sédentarité sur la sévérité de la maladie doivent être élucidés (Inca, 2017

).
Références
[1] Adams SC, Segal RJ, McKenzie DC, et al . Impact of resistance and aerobic exercise on sarcopenia and dynapenia in breast cancer patients receiving adjuvant chemotherapy: a multicenter randomized controlled trial.
Breast Cancer Res Treat. 2016;
158:497
-507

[2] Ades F, Zardavas D, Pinto AC, et al . Cardiotoxicity of systemic agents used in breast cancer.
Breast. 2014;
23:317
-28

[3] Albrecht TA, Taylor AG. Physical activity in patients with advanced-stage cancer: a systematic review of the literature.
Clin J Oncol Nurs. 2012;
16:293
-300

[4] Arem H, Pfeiffer RM, Moore SC, et al . Body mass index, physical activity, and television time in relation to mortality risk among endometrial cancer survivors in the NIH-AARP Diet and Health Study cohort.
Cancer Causes Control. 2016;
27:1403
-9

[5] Argiles JM, Busquets S, Stemmler B, et al . Cancer cachexia: understanding the molecular basis.
Nat Rev Cancer. 2014;
14:754
-62

[6] Ashcraft KA, Peace RM, Betof AS, et al . Efficacy and mechanisms of aerobic exercise on cancer initiation, progression, and metastasis: a critical systematic review of in vivo preclinical data.
Cancer Res. 2016;
76:4032
-50

[7] Baade PD, Meng X, Youl PH, et al . The impact of body mass index and physical activity on mortality among patients with colorectal cancer in Queensland, Australia.
Cancer Epidemiol Biomarkers Prev. 2011;
20:1410
-20

[8] Babatunde OA, Adams SA, Orekoya O, et al . Effect of physical activity on quality of life as perceived by endometrial cancer survivors: a systematic review.
Int J Gynecol Cancer. 2016;
26:1727
-40

[9] Ballard-Barbash R, Friedenreich CM, Courneya KS, et al . Physical activity, biomarkers, and disease outcomes in cancer survivors: a systematic review.
J Natl Cancer Inst. 2012;
104:815
-40

[10] Ballard-Barbash R, Hunsberger S, Alciati MH, et al . Physical activity, weight control, and breast cancer risk and survival : clinical trial rationale and design considerations.
J Natl Cancer Inst. 2009;
101:630
-43

[11] Beasley JM, Kwan ML, Chen WY, et al . Meeting the physical activity guidelines and survival after breast cancer: findings from the after breast cancer pooling project.
Breast Cancer Res Treat. 2012;
131:637
-43

[12] Beaton R, Pagdin-Friesen W, Robertson C, et al . Effects of exercise intervention on persons with metastatic cancer: a systematic review.
Physiother Can. 2009;
61:141
-53

[13] Bertram LA, Stefanick ML, Saquib N, et al . Physical activity, additional breast cancer events, and mortality among early-stage breast cancer survivors: findings from the WHEL study.
Cancer Causes Control. 2011;
22:427
-35

[14] Blanchard CM, Cokkinides V, Courneya KS, et al . A comparison of physical activity of posttreatment breast cancer survivors and noncancer controls.
Behav Med. 2003;
28:140
-9

[15] Bluethmann SM, Vernon SW, Gabriel KP, et al . Taking the next step: a systematic review and meta-analysis of physical activity and behavior change interventions in recent post-treatment breast cancer survivors.
Breast Cancer Res Treat. 2015;
149:331
-42

[16] Boereboom C, Doleman B, Lund JN, et al . Systematic review of pre-operative exercise in colorectal cancer patients.
Tech Coloproctol. 2016;
20:81
-9

[17] Bonn SE, Sjolander A, Lagerros YT, et al . Physical activity and survival among men diagnosed with prostate cancer.
Cancer Epidemiol Biomarkers Prev. 2015;
24:57
-64

[18] Bouillet T, Bigard X, Brami C, et al . Role of physical activity and sport in oncology: scientific commission of the National federation sport and cancer CAMI.
Crit Rev Oncol Hematol. 2015;
94:74
-86

[19] Bourke L, Homer KE, Thaha MA, et al . Interventions for promoting habitual exercise in people living with and beyond cancer.
Cochrane Database Syst Rev. 2013;
9:CD010192

[20] Bourke L, Homer KE, Thaha MA, et al . Interventions to improve exercise behaviour in sedentary people living with and beyond cancer: a systematic review.
Br J Cancer. 2014;
110:831
-41

[21] Bourke L, Smith D, Steed L, et al . Exercise for men with prostate cancer: a systematic review and meta-analysis.
Eur Urol. 2016;
69:693
-703

[22] Bradshaw PT, Ibrahim JG, Khankari N, et al . Post-diagnosis physical activity and survival after breast cancer diagnosis: the long island breast cancer study.
Breast Cancer Res Treat. 2014;
145:735
-42

[23] Brown JC, Huedo-Medina TB, Pescatello LS, et al . Efficacy of exercise interventions in modulating cancer-related fatigue among adult cancer survivors: a meta-analysis.
Cancer Epidemiol Biomarkers Prev. 2011;
20:123
-33

[24] Brown JC, Lin LL, Segal S, et al . Physical activity, daily walking, and lower limb lymphedema associate with physical function among uterine cancer survivors.
Support Care Cancer. 2014;
22:3017
-25

[25] Brown JC, Schmitz KH. The prescription or proscription of exercise in colorectal cancer care.
Med Sci Sports Exerc. 2014;
46:2202
-9

[26] Buffart LM, Kalter J, Sweegers MG, et al . Effects and moderators of exercise on quality of life and physical function in patients with cancer: an individual patient data meta-analysis of 34 RCTs.
Cancer Treat Rev. 2017;
52:91
-104

[27] Buffart LM, van Uffelen JG, Riphagen II, et al . Physical and psychosocial benefits of yoga in cancer patients and survivors, a systematic review and meta-analysis of randomized controlled trials.
BMC Cancer. 2012;
12:559

[28] Burnett D, Kluding P, Porter C, et al . Cardiorespiratory fitness in breast cancer survivors.
Springerplus. 2013;
2:68

[29] Campbell KL, Neil SE, Winters-Stone KM. Review of exercise studies in breast cancer survivors: attention to principles of exercise training.
Br J Sports Med. 2012;
46:909
-16

[30] Campbell PT, Patel AV, Newton CC, et al . Associations of recreational physical activity and leisure time spent sitting with colorectal cancer survival.
J Clin Oncol. 2013;
31:876
-85

[31] Cannioto RA, Lamonte MJ, Kelemen LE, et al . Recreational physical inactivity and mortality in women with invasive epithelial ovarian cancer: evidence from the ovarian cancer association consortium.
Br J Cancer. 2016;
115:95
-101

[32] Cantwell M, Walsh D, Furlong B, et al . Healthcare professionals’ knowledge and practice of physical activity promotion in cancer care : challenges and solutions.
Eur J Cancer Care (Engl). 2018 [Epub 2017 Nov 29];
27:e12795

[33] Capozzi LC, Nishimura KC, McNeely ML, et al . The impact of physical activity on health-related fitness and quality of life for patients with head and neck cancer: a systematic review.
Br J Sports Med. 2016;
50:325
-38

[34] Carayol M, Bernard P, Boiche J, et al . Psychological effect of exercise in women with breast cancer receiving adjuvant therapy: what is the optimal dose needed?.
Ann Oncol. 2013;
24:291
-300

[35] Carayol M, Delpierre C, Bernard P, et al . Population-, intervention- and methodology-related characteristics of clinical trials impact exercise efficacy during adjuvant therapy for breast cancer: a meta-regression analysis.
Psychooncology. 2015;
24:737
-47

[36] Carvalho AP, Vital FM, Soares BG. Exercise interventions for shoulder dysfunction in patients treated for head and neck cancer.
Cochrane Database Syst Rev. 2012;
4:CD008693

[37] Cavalheri V, Tahirah F, Nonoyama M, et al . Exercise training for people following lung resection for non-small cell lung cancer: a Cochrane systematic review.
Cancer Treat Rev. 2014;
40:585
-94

[38] Chan DN, Lui LY, So WK. Effectiveness of exercise programmes on shoulder mobility and lymphoedema after axillary lymph node dissection for breast cancer: systematic review.
J Adv Nurs. 2010;
66:1902
-14

[39] Chan DS, Vieira AR, Aune D, et al . Body mass index and survival in women with breast cancer-systematic literature review and meta-analysis of 82 follow-up studies.
Ann Oncol. 2014;
25:1901
-14

[40] Cheema BS, Kilbreath SL, Fahey PP, et al . Safety and efficacy of progressive resistance training in breast cancer: a systematic review and meta-analysis.
Breast Cancer Res Treat. 2014;
148:249
-68

[41] Chen X, Lu W, Zheng W, et al . Exercise after diagnosis of breast cancer in association with survival.
Cancer Prev Res (Phila). 2011;
4:1409
-18

[42] Cho OH, Yoo YS, Kim NC. Efficacy of comprehensive group rehabilitation for women with early breast cancer in South Korea.
Nurs Health Sci. 2006;
8:140
-6

[43] Christensen JF, Jones LW, Andersen JL, et al . Muscle dysfunction in cancer patients.
Ann Oncol. 2014;
25:947
-58

[44] Coffey VG, Hawley JA. Concurrent exercise training: do opposites distract?.
J Physiol. 2017;
595:2883
-96

[45] Cormier JN, Askew RL, Mungovan KS, et al . Lymphedema beyond breast cancer: a systematic review and meta-analysis of cancer-related secondary lymphedema.
Cancer. 2010;
116:5138
-49

[46] Courneya KS. Physical Activity and cancer survivorship: a simple framework for a complex field.
Exerc Sport Sci Rev. 2014;
42:102
-9

[47] Courneya KS, Rogers LQ, Campbell KL, et al . Top 10 research questions related to physical activity and cancer survivorship.
Res Q Exerc Sport. 2015;
86:107
-16

[48] Courneya KS, Segal RJ, Mackey JR, et al . Effects of aerobic and resistance exercise in breast cancer patients receiving adjuvant chemotherapy: a multicenter randomized controlled trial.
J Clin Oncol. 2007;
25:4396
-404

[49] Courneya KS, Sellar CM, Stevinson C, et al . Randomized controlled trial of the effects of aerobic exercise on physical functioning and quality of life in lymphoma patients.
J Clin Oncol. 2009;
27:4605
-12

[50] Cramp F, Byron-Daniel J. Exercise for the management of cancer-related fatigue in adults.
Cochrane Database Syst Rev. 2012;
11:CD006145

[51] Crandall K, Maguire R, Campbell A, et al . Exercise intervention for patients surgically treated for non-small cell lung cancer (NSCLC) : a systematic review.
Surg Oncol. 2014;
23:17
-30

[52] Dankel SJ, Loenneke JP, Loprinzi PD. Cancer-specific mortality relative to engagement in muscle-strengthening activities and lower extremity strength.
J Phys Act Health. 2018;
15:144
-9

[53] De Jong N, Courtens AM, Abu-Saad HH, et al . Fatigue in patients with breast cancer receiving adjuvant chemotherapy: a review of the literature.
Cancer Nurs. 2002;
25:283
-97

[54] Dennett AM, Peiris CL, Shields N, et al . Moderate-intensity exercise reduces fatigue and improves mobility in cancer survivors: a systematic review and meta-regression.
J Physiother. 2016;
62:68
-82

[55] Des Guetz G, Uzzan B, Bouillet T, et al . Impact of physical activity on cancer-specific and overall survival of patients with colorectal cancer.
Gastroenterol Res Pract. 2013;
2013:340851

[56] Dittus KL, Gramling RE, Ades PA. Exercise interventions for individuals with advanced cancer: a systematic review.
Prev Med. 2017;
104:124
-32

[57] Dolinsky VW, Rogan KJ, Sung MM, et al . Both aerobic exercise and resveratrol supplementation attenuate doxorubicin-induced cardiac injury in mice.
Am J Physiol Endocrinol Metab. 2013;
305:E243
-53

[58] Druesne-Pecollo N, Touvier M, Barrandon E, et al . Excess body weight and second primary cancer risk after breast cancer: a systematic review and meta-analysis of prospective studies.
Breast Cancer Res Treat. 2012;
135:647
-54

[59] Duggan C, Irwin ML, Xiao L, et al . Associations of insulin resistance and adiponectin with mortality in women with breast cancer.
J Clin Oncol. 2011;
29:32
-9

[60] Duggan C, Wang CY, Neuhouser ML, et al . Associations of insulin-like growth factor and insulin-like growth factor binding protein-3 with mortality in women with breast cancer.
Int J Cancer. 2013;
132:1191
-200

[61] Duijts SF, Faber MM, Oldenburg HS, et al . Effectiveness of behavioral techniques and physical exercise on psychosocial functioning and health-related quality of life in breast cancer patients and survivors – a meta-analysis.
Psycho-Oncology. 2011;
20:115
-26

[62] Duijts SF, Kieffer JM, van MP, et al . Sustained employability and health-related quality of life in cancer survivors up to four years after diagnosis.
Acta Oncol. 2017;
56:174
-82

[63] Duregon F, Vendramin B, Bullo V, et al . Effects of exercise on cancer patients suffering chemotherapy-induced peripheral neuropathy undergoing treatment: a systematic review.
Crit Rev Oncol Hematol. 2018;
121:90
-100

[64] Eakin EG, Youlden DR, Baade PD, et al . Health behaviors of cancer survivors: data from an Australian population-based survey.
Cancer Causes Control. 2007;
18:881
-94

[65] Fassier P, Zelek L, Partula V, et al . Variations of physical activity and sedentary behavior between before and after cancer diagnosis: results from the prospective population-based NutriNet-Sante cohort.
Medicine (Baltimore). 2016;
95:e4629

[66] Ferrer RA, Huedo-Medina TB, Johnson BT, et al . Exercise interventions for cancer survivors: a meta-analysis of quality of life outcomes.
Ann Behav Med. 2011;
41:32
-47

[67] Fillion L, Gagnon P, Leblond F, et al . A brief intervention for fatigue management in breast cancer survivors.
Cancer Nurs. 2008;
31:145
-59

[68] Fong DY, Ho JW, Hui BP, et al . Physical activity for cancer survivors: meta-analysis of randomised controlled trials.
BMJ. 2012;
344:e70

[69] Foucaut AM. L’activité physique adaptee en senologie : des preuves scientiques a la mise en œuvre de programmes auprès des patientes atteintes de cancer du sein. Thèse.
Université Claude Bernard-Lyon I;
2013.

[70] Friedenreich CM, Wang Q, Neilson HK, et al . Physical activity and survival after prostate cancer.
Eur Urol. 2016;
70:576
-85

[71] Furmaniak AC, Menig M, Markes MH. Exercise for women receiving adjuvant therapy for breast cancer.
Cochrane Database Syst Rev. 2016;
9:CD005001

[72] Gaillard S, Stearns V. Aromatase inhibitor-associated bone and musculoskeletal effects: new evidence defining etiology and strategies for management.
Breast Cancer Res. 2011;
13:205

[73] Galiano-Castillo N, Cantarero-Villanueva I, Fernandez-Lao C, et al . Telehealth system: a randomized controlled trial evaluating the impact of an internet-based exercise intervention on quality of life, pain, muscle strength, and fatigue in breast cancer survivors.
Cancer. 2016;
122:3166
-74

[74] Gardner JR, Livingston PM, Fraser SF. Effects of exercise on treatment-related adverse effects for patients with prostate cancer receiving androgen-deprivation therapy: a systematic review.
J Clin Oncol. 2014;
32:335
-46

[75] Goh J, Niksirat N, Campbell KL. Exercise training and immune crosstalk in breast cancer microenvironment: exploring the paradigms of exercise-induced immune modulation and exercise-induced myokines.
Am J Transl Res. 2014;
6:422
-38

[76] Goodwin PJ, Ennis M, Pritchard KI, et al . Fasting insulin and outcome in early-stage breast cancer: results of a prospective cohort study.
J Clin Oncol. 2002;
20:42
-51

[77] Grande AJ, Silva V, Riera R, et al . Exercise for cancer cachexia in adults.
Cochrane Database Syst Rev. 2014;
11:CD010804

[78] Granger CL, McDonald CF, Berney S, et al . Exercise intervention to improve exercise capacity and health related quality of life for patients with non-small cell lung cancer: a systematic review.
Lung Cancer. 2011;
72:139
-53

[79] Hartog H, Boezen HM, de Jong MM, et al . Prognostic value of insulin-like growth factor 1 and insulin-like growth factor binding protein 3 blood levels in breast cancer.
Breast. 2013;
22:1155
-60

[80] Haydon AM, MacInnis RJ, English DR, et al . Physical activity, insulin-like growth factor 1, insulin-like growth factor binding protein 3, and survival from colorectal cancer.
Gut. 2006;
55:689
-94

[81] Hayes BD, Brady L, Pollak M, et al . Exercise and prostate cancer: evidence and proposed mechanisms for disease modification.
Cancer Epidemiol Biomarkers Prev. 2016;
25:1281
-8

[82] Haykowsky MJ, Beaudry R, Brothers RM, et al . Pathophysiology of exercise intolerance in breast cancer survivors with preserved left ventricular ejection fraction.
Clin Sci (Lond). 2016;
130:2239
-44

[83] Haykowsky MJ, Mackey JR, Thompson RB, et al . Adjuvant trastuzumab induces ventricular remodeling despite aerobic exercise training.
Clin Cancer Res. 2009;
15:4963
-7

[84] Haykowsky MJ, Scott JM, Hudson K, et al . Lifestyle interventions to improve cardiorespiratory fitness and reduce breast cancer recurrence.
Am Soc Clin Oncol Educ Book. 2017;
37:57
-64

[85] Hershman DL, Shao T, Kushi LH, et al . Early discontinuation and non-adherence to adjuvant hormonal therapy are associated with increased mortality in women with breast cancer.
Breast Cancer Res Treat. 2011;
126:529
-37

[86] Heywood R, McCarthy AL, Skinner TL. Safety and feasibility of exercise interventions in patients with advanced cancer: a systematic review.
Support Care Cancer. 2017;
25:3031
-50

[87] Hoedjes M, van Stralen MM, Joe STA, et al . Toward the optimal strategy for sustained weight loss in overweight cancer survivors: a systematic review of the literature.
J Cancer Surviv. 2017;
11:360
-85

[88] Hojan K, Milecki P, Molinska-Glura M, et al . Effect of physical activity on bone strength and body composition in breast cancer premenopausal women during endocrine therapy.
Eur J Phys Rehabil Med. 2013;
49:331
-9

[89] Holick CN, Newcomb PA, Trentham-Dietz A, et al . Physical activity and survival after diagnosis of invasive breast cancer.
Cancer Epidemiol Biomarkers Prev. 2008;
17:379
-86

[90] Holmes MD, Chen WY, Feskanich D, et al . Physical activity and survival after breast cancer diagnosis.
JAMA. 2005;
293:2479
-86

[91] Hwang CL, Yu CJ, Shih JY, et al . Effects of exercise training on exercise capacity in patients with non-small cell lung cancer receiving targeted therapy.
Support Care Cancer. 2012;
20:3169
-77

[92] Hwang JH, Chang HJ, Shim YH, et al . Effects of supervised exercise therapy in patients receiving radiotherapy for breast cancer.
Yonsei Med J. 2008;
49:443
-50

[93] Ibrahim EM, Al-Homaidh A. Physical activity and survival after breast cancer diagnosis: meta-analysis of published studies.
Med Oncol. 2011;
28:753
-65

[94]Inca. La vie deux ans après un diagnostic de cancer – De l’annonce à l’après cancer.
Collection Études et enquêtes. Paris:Inca;
2014;

[95]Inca. Bénéfices de l’activité physique pendant et après cancer – Des connaissances aux repères pratiques.
Paris:Inca;
2017.

[96] Inca , Mazeau-Woynar V, Cerf N. Survie attendue des patients atteints de cancers en France : état des lieux.
Paris : Inca;
2010.
56p.

[97] Irwin ML, Cartmel B, Gross CP, et al . Randomized exercise trial of aromatase inhibitor-induced arthralgia in breast cancer survivors.
J Clin Oncol. 2015;
33:1104
-11

[98] Irwin ML, Duggan C, Wang CY, et al . Fasting C-peptide levels and death resulting from all causes and breast cancer: the health, eating, activity, and lifestyle study.
J Clin Oncol. 2011a;
29:47
-53

[99] Irwin ML, McTiernan A, Manson JE, et al . Physical activity and survival in postmenopausal women with breast cancer: results from the women’s health initiative.
Cancer Prev Res (Phila). 2011b;
4:522
-9

[100] Irwin ML, Smith AW, McTiernan A, et al . Influence of pre- and postdiagnosis physical activity on mortality in breast cancer survivors: the health, eating, activity, and lifestyle study.
J Clin Oncol. 2008;
26:3958
-64

[101] Jacobs LA, Shulman LN. Follow-up care of cancer survivors: challenges and solutions.
Lancet Oncol. 2017;
18:
-e19

[102] Janelsins MC, Kesler SR, Ahles TA, et al . Prevalence, mechanisms, and management of cancer-related cognitive impairment.
Int Rev Psychiatry. 2014;
26:102
-13

[103] Je Y, Jeon JY, Giovannucci EL, et al . Association between physical activity and mortality in colorectal cancer: a meta-analysis of prospective cohort studies.
Int J Cancer. 2013;
133:1905
-13

[104] Jegu J, Colonna M, Daubisse-Marliac L, et al . The effect of patient characteristics on second primary cancer risk in France.
BMC Cancer. 2014;
14:94

[105] Jones LW. Evidence-based risk assessment and recommendations for physical activity clearance: cancer.
Appl Physiol Nutr Metab. 2011;
36 (suppl 1):S101
-12

[106] Jones LW, Fels DR, West M, et al . Modulation of circulating angiogenic factors and tumor biology by aerobic training in breast cancer patients receiving neoadjuvant chemotherapy.
Cancer Prev Res (Phila). 2013;
6:925
-37

[107] Jones LW, Habel LA, Weltzien E, et al . Exercise and risk of cardiovascular events in women with nonmetastatic breast cancer.
J Clin Oncol. 2016;
34:2743
-9

[108] Jones LW, Liang Y, Pituskin EN, et al . Effect of exercise training on peak oxygen consumption in patients with cancer: a meta-analysis.
Oncologist. 2011;
16:112
-20

[109] Jung HS, Myung SK, Kim BS, et al . Metabolic syndrome in adult cancer survivors: a meta-analysis.
Diabetes Res Clin Pract. 2012;
95:275
-82

[110] Kampshoff CS, Jansen F, van MW, et al . Determinants of exercise adherence and maintenance among cancer survivors: a systematic review.
Int J Behav Nutr Phys Act. 2014;
11:80
-0

[111] Kang DW, Lee J, Suh SH, et al . Effects of exercise on insulin, IGF axis, adipocytokines, and inflammatory markers in breast cancer survivors: a systematic review and meta-analysis.
Cancer Epidemiol Biomarkers Prev. 2017;
26:355
-65

[112] Keats MR, Cui Y, Grandy SA, et al . Cardiovascular disease and physical activity in adult cancer survivors: a nested, retrospective study from the Atlantic PATH cohort.
J Cancer Surviv. 2017;
11:264
-73

[113] Keilani M, Hasenoehrl T, Neubauer M, et al . Resistance exercise and secondary lymphedema in breast cancer survivors-a systematic review.
Support Care Cancer. 2016;
24:1907
-16

[114] Kenfield SA, Stampfer MJ, Giovannucci E, et al . Physical activity and survival after prostate cancer diagnosis in the health professionals follow-up study.
J Clin Oncol. 2011;
29:726
-32

[115] Khosrow-Khavar F, Filion KB, Al-Qurashi S, et al . Cardiotoxicity of aromatase inhibitors and tamoxifen in postmenopausal women with breast cancer: a systematic review and meta-analysis of randomized controlled trials.
Ann Oncol. 2017;
28:487
-96

[116] Kim CJ, Kang DH, Park JW. A meta-analysis of aerobic exercise interventions for women with breast cancer.
West J Nurs Res. 2009;
31:437
-61

[117] Kim JY, Han W, Moon HG, et al . Prognostic effect of preoperative serum estradiol level in postmenopausal breast cancer.
BMC Cancer. 2013a;
13:503

[118] Kim RB, Phillips A, Herrick K, et al . Physical activity and sedentary behavior of cancer survivors and non-cancer individuals: results from a national survey.
PLoS One. 2013b;
8:e57598

[119] Kirkham AA, Davis MK. Exercise prevention of cardiovascular disease in breast cancer survivors.
J Oncol. 2015;
2015:917606

[120] Kleckner IR, Kamen C, Gewandter JS, et al . Effects of exercise during chemotherapy on chemotherapy-induced peripheral neuropathy: a multicenter, randomized controlled trial.
Support Care Cancer. 2017;
26:1019
-28

[121] Knobf MT, Winters-Stone K. Exercise and cancer.
Annu Rev Nurs Res. 2013;
31:327
-65

[122] Koelwyn GJ, Wennerberg E, Demaria S, et al . Exercise in regulation of inflammation-immune axis function in cancer initiation and progression.
Oncology (Williston Park). 2015;
29:908
-22

[123] Kruijsen-Jaarsma M, Revesz D, Bierings MB, et al . Effects of exercise on immune function in patients with cancer: a systematic review.
Exerc Immunol Rev. 2013;
19:120
-43

[124] Kuehr L, Wiskemann J, Abel U, et al . Exercise in patients with non-small cell lung cancer.
Med Sci Sports Exerc. 2014;
46:656
-63

[125] Kuiper JG, Phipps AI, Neuhouser ML, et al . Recreational physical activity, body mass index, and survival in women with colorectal cancer.
Cancer Causes Control. 2012;
23:1939
-48

[126] Kwan ML, Sternfeld B, Ergas IJ, et al . Change in physical activity during active treatment in a prospective study of breast cancer survivors.
Breast Cancer Res Treat. 2012;
131:679
-90

[127] Kwiatkowski F, Mouret-Reynier MA, Duclos M, et al . Long-term improvement of breast cancer survivors’ quality of life by a 2-week group physical and educational intervention: 5-year update of the PACThe trial.
Br J Cancer. 2017;
116:1389
-93

[128] Lahart IM, Metsios GS, Nevill AM, et al . Physical activity, risk of death and recurrence in breast cancer survivors: a systematic review and meta-analysis of epidemiological studies.
Acta Oncol. 2015;
54:635
-54

[129] Lakoski SG, Eves ND, Douglas PS, et al . Exercise rehabilitation in patients with cancer.
Nat Rev Clin Oncol. 2012;
9:288
-96

[130] Lashinger LM, Rossi EL, Hursting SD. Obesity and resistance to cancer chemotherapy: interacting roles of inflammation and metabolic dysregulation.
Clin Pharmacol Ther. 2014;
96:458
-63

[131] Lee MS, Choi TY, Ernst E. Tai chi for breast cancer patients: a systematic review.
Breast Cancer Res Treat. 2010;
120:309
-16

[132] Li T, Wei S, Shi Y, et al . The dose-response effect of physical activity on cancer mortality: findings from 71 prospective cohort studies.
Br J Sports Med. 2016;
50:339
-45

[133] Ligibel JA, Giobbie-Hurder A, Shockro L, et al . Randomized trial of a physical activity intervention in women with metastatic breast cancer.
Cancer. 2016;
122:1169
-77

[134] Löf M, Bergstrom K, Weiderpass E. Physical activity and biomarkers in breast cancer survivors: a systematic review.
Maturitas. 2012;
73:134
-42

[135] Loughney L, West MA, Kemp GJ, et al . Exercise intervention in people with cancer undergoing neoadjuvant cancer treatment and surgery: a systematic review.
Eur J Surg Oncol. 2016;
42:28
-38

[136] Lowe SS, Watanabe SM, Courneya KS. Physical activity as a supportive care intervention in palliative cancer patients: a systematic review.
J Support Oncol. 2009;
7:27
-34

[137] Lynch BM. Sedentary behavior and cancer: a systematic review of the literature and proposed biological mechanisms.
Cancer Epidemiol Biomarkers Prev. 2010;
19:2691
-709

[138] Lynch BM, Dunstan DW, Vallance JK, et al . Don’t take cancer sitting down: a new survivorship research agenda.
Cancer. 2013;
119:1928
-35

[139] Mainini C, Rebelo PF, Bardelli R, et al . Perioperative physical exercise interventions for patients undergoing lung cancer surgery: What is the evidence?.
SAGE Open Med. 2016;
4:2050312116673855

[140] Markes M, Brockow T, Resch KL. Exercise for women receiving adjuvant therapy for breast cancer.
Cochrane Database Syst Rev. 2006;
4:CD005001

[141] Mas S, Quantin X, Ninot G. Barriers to, and facilitators of physical activity in patients receiving chemotherapy for lung cancer: an exploratory study.
J Palliat Care. 2015;
31:89
-96

[142] McMillan EM, Newhouse IJ. Exercise is an effective treatment modality for reducing cancer-related fatigue and improving physical capacity in cancer patients and survivors: a meta-analysis.
Appl Physiol Nutr Metab. 2011;
36:892
-903

[143] McNeely ML, Campbell K, Ospina M, et al . Exercise interventions for upper-limb dysfunction due to breast cancer treatment.
Cochrane Database Syst Rev. 2010;
6:CD005211

[144] McNeely ML, Campbell KL, Rowe BH, et al . Effects of exercise on breast cancer patients and survivors: a systematic review and meta-analysis.
CMAJ. 2006;
175:34
-41

[145] McNeely ML, Parliament MB, Seikaly H, et al . Effect of exercise on upper extremity pain and dysfunction in head and neck cancer survivors: a randomized controlled trial.
Cancer. 2008;
113:214
-22

[146] Meneses-Echavez JF, Correa-Bautista JE, Gonzalez-Jimenez E, et al . The effect of exercise training on mediators of inflammation in breast cancer survivors: a systematic review with meta-analysis.
Cancer Epidemiol Biomarkers Prev. 2016;
25:1009
-17

[147] Meneses-Echavez JF, Gonzalez-Jimenez E, Ramirez-Velez R. Supervised exercise reduces cancer-related fatigue: a systematic review.
J Physiother. 2015a;
61:3
-9

[148] Meneses-Echavez JF, Ramirez-Velez R, Gonzalez-Jimenez E. Effects of supervised exercise on cancer-related fatigue in breast cancer survivors: a systematic review and meta-analysis.
BMC Cancer. 2015b;
15:1069

[149] Meyerhardt JA, Giovannucci EL, Holmes MD, et al . Physical activity and survival after colorectal cancer diagnosis.
J Clin Oncol. 2006a;
24:3527
-34

[150] Meyerhardt JA, Giovannucci EL, Ogino S, et al . Physical activity and male colorectal cancer survival.
Arch Intern Med. 2009;
169:2102
-8

[151] Meyerhardt JA, Heseltine D, Niedzwiecki D, et al . Impact of physical activity on cancer recurrence and survival in patients with stage III colon cancer: findings from CALGB 89803.
J Clin Oncol. 2006b;
24:3535
-41

[152] Mishra SI, Scherer RW, Geigle PM, et al . Exercise interventions on health-related quality of life for cancer survivors.
Cochrane Database Syst Rev. 2012a;
8:CD007566

[153] Mishra SI, Scherer RW, Snyder C, et al . Exercise interventions on health-related quality of life for people with cancer during active treatment.
Cochrane Database Syst Rev. 2012b;
8:CD008465

[154] Morey MC, Snyder DC, Sloane R, et al . Effects of home-based diet and exercise on functional outcomes among older, overweight long-term cancer survivors: RENEW: a randomized controlled trial.
JAMA. 2009;
301:1883
-91

[155] Morton LM, Swerdlow AJ, Schaapveld M, et al . Current knowledge and future research directions in treatment-related second primary malignancies.
EJC Suppl. 2014;
12:5
-17

[156] Moudgil R, Yeh ET. Mechanisms of cardiotoxicity of cancer chemotherapeutic agents: cardiomyopathy and beyond.
Can J Cardiol. 2016;
32:863
-70

[157] Mustian KM, Alfano CM, Heckler C, et al . Comparison of pharmaceutical, psychological, and exercise treatments for cancer-related fatigue: a meta-analysis.
JAMA Oncol. 2017;
3:961
-96

[158] Myers JS, Erickson KI, Sereika SM, et al . Exercise as an intervention to mitigate decreased cognitive function from cancer and cancer treatment: an integrative review.
Cancer Nurs. 2018;
41:327
-343

[159]NCCN. National comprehensive cancer network (NCCN) clinical practice guidelines in oncology. survivorship.
Plymouth Meeting (PA):NCCN Guidelines;
2017.

[160] Nelson SH, Marinac CR, Patterson RE, et al . Impact of very low physical activity, BMI, and comorbidities on mortality among breast cancer survivors.
Breast Cancer Res Treat. 2016;
155:551
-7

[161] Ni HJ, Pudasaini B, Yuan XT, et al . Exercise training for patients pre- and postsurgically treated for non-small cell lung cancer: A systematic review and meta-analysis.
Integr Cancer Ther. 2017 [Epub 2016 May 5];
16:63
-73

[162] Oldervoll LM, Loge JH, Lydersen S, et al . Physical exercise for cancer patients with advanced disease: a randomized controlled trial.
Oncologist. 2011;
16:1649
-57

[163] Paramanandam VS, Roberts D. Weight training is not harmful for women with breast cancer-related lymphoedema: a systematic review.
J Physiother. 2014;
60:136
-43

[164] Pastakia K, Kumar S. Exercise parameters in the management of breast cancer: a systematic review of randomized controlled trials.
Physiother Res Int. 2011;
16:237
-44

[165] Peterson SJ, Mozer M. Differentiating sarcopenia and cachexia among patients with cancer.
Nutr Clin Pract. 2017;
32:30
-9

[166] Pollak M. Insulin and insulin-like growth factor signalling in neoplasia.
Nat Rev Cancer. 2008;
8:915
-28

[167] Porporato PE. Understanding cachexia as a cancer metabolism syndrome.
Oncogenesis. 2016;
5:e200

[168] Puetz TW, Herring MP. Differential effects of exercise on cancer-related fatigue during and following treatment: a meta-analysis.
Am J Prev Med. 2012;
43:e1
-24

[169] Quist M, Adamsen L, Rorth M, et al . The impact of a multidimensional exercise intervention on physical and functional capacity, anxiety, and depression in patients with advanced-stage lung cancer undergoing chemotherapy.
Integr Cancer Ther. 2015;
14:341
-9

[170] Richman EL, Kenfield SA, Stampfer MJ, et al . Physical activity after diagnosis and risk of prostate cancer progression: data from the cancer of the prostate strategic urologic research endeavor.
Cancer Res. 2011;
71:3889
-95

[171] Rief H, Petersen LC, Omlor G, et al . The effect of resistance training during radiotherapy on spinal bone metastases in cancer patients: a randomized trial.
Radiother Oncol. 2014;
112:133
-9

[172] Roberts BM, Frye GS, Ahn B, et al . Cancer cachexia decreases specific force and accelerates fatigue in limb muscle.
Biochem Biophys Res Commun. 2013;
435:488
-92

[173] Rock CL, Doyle C, Demark-Wahnefried W, et al . Nutrition and physical activity guidelines for cancer survivors.
CA Cancer J Clin. 2012;
62:243
-74

[174] Rock CL, Flatt SW, Laughlin GA, et al . Reproductive steroid hormones and recurrence-free survival in women with a history of breast cancer.
Cancer Epidemiol Biomarkers Prev. 2008;
17:614
-20

[175] Romieu I, Touillaud M, Ferrari P, et al . Physical activity and cancer survival.
Bull Cancer. 2012;
99:979
-94

[176] Saarto T, Sievänen H, Kellokumpu LP, et al . Effect of supervised and home exercise training on bone mineral density among breast cancer patients. A 12-month randomised controlled trial.
Osteoporos Int. 2012;
23:1601
-12

[177] Sasso JP, Eves ND, Christensen JF, et al . A framework for prescription in exercise-oncology research.
J Cachexia Sarcopenia Muscle. 2015;
6:115
-24

[178] Schmid D, Leitzmann MF. Association between physical activity and mortality among breast cancer and colorectal cancer survivors: a systematic review and meta-analysis.
Ann Oncol. 2014;
25:1293
-311

[179] Schmidt K, Vogt L, Thiel C, et al . Validity of the six-minute walk test in cancer patients.
Int J Sports Med. 2013;
34:631
-6

[180] Schmidt ME, Meynkohn A, Habermann N, et al . Resistance exercise and inflammation in breast cancer patients undergoing adjuvant radiation therapy: mediation analysis from a randomized, controlled intervention trial.
Int J Radiat Oncol Biol Phys. 2016;
94:329
-37

[181] Schmitz KH, Courneya KS, Matthews C, et al . American college of sports medicine roundtable on exercise guidelines for cancer survivors.
Med Sci Sports Exerc. 2010;
42:1409
-26

[182] Scott JM, Adams SC, Koelwyn GJ, et al . Cardiovascular late effects and exercise treatment in breast cancer: current evidence and future directions.
Can J Cardiol. 2016;
32:881
-90

[183] Scott SE, Breckon JD, Copeland RJ, et al . Determinants and strategies for physical activity maintenance in chronic health conditions: a qualitative study.
J Phys Act Health. 2015 [Epub 2014 Jun 4];
12:733
-40

[184] Sebio GR, Yanez Brage MI, Gimenez ME, et al . Functional and postoperative outcomes after preoperative exercise training in patients with lung cancer: a systematic review and meta-analysis.
Interact Cardiovasc Thorac Surg. 2016;
23:486
-97

[185] Segal R, Zwaal C, Green E, et al . Exercise for people with cancer: a clinical practice guideline.
Curr Oncol. 2017;
24:40
-6

[186] Shachar SS, Williams GR, Muss HB, et al . Prognostic value of sarcopenia in adults with solid tumours: a meta-analysis and systematic review.
Eur J Cancer. 2016;
57:58
-67

[187] Sheean PM, Hoskins K, Stolley M. Body composition changes in females treated for breast cancer: a review of the evidence.
Breast Cancer Res Treat. 2012;
135:663
-80

[188] Siegel R, DeSantis C, Virgo K, et al . Cancer treatment and survivorship statistics, 2012.
CA Cancer J Clin. 2012;
62:220
-41

[189] Singh B, Buchan J, Box R, et al . Compression use during an exercise intervention and associated changes in breast cancer-related lymphedema.
Asia Pac J Clin Oncol. 2016a;
12:216
-24

[190] Singh B, Disipio T, Peake J, et al . Systematic review and meta-analysis of the effects of exercise for those with cancer-related lymphedema.
Arch Phys Med Rehabil. 2016b;
97:302
-15

[191] Singh F, Newton RU, Galvao DA, et al . A systematic review of pre-surgical exercise intervention studies with cancer patients.
Surg Oncol. 2013;
22:92
-104

[192] Speck RM, Courneya KS, Masse LC, et al . An update of controlled physical activity trials in cancer survivors: a systematic review and meta-analysis.
J Cancer Surviv. 2010;
4:87
-100

[193] Steindorf K, Schmidt ME, Klassen O, et al . Randomized, controlled trial of resistance training in breast cancer patients receiving adjuvant radiotherapy: results on cancer-related fatigue and quality of life.
Ann Oncol. 2014;
25:2237
-43

[194] Stene GB, Helbostad JL, Balstad TR, et al . Effect of physical exercise on muscle mass and strength in cancer patients during treatment: a systematic review.
Crit Rev Oncol Hematol. 2013;
88:573
-93

[195] Sternfeld B, Weltzien E, Quesenberry CP Jr, et al . Physical activity and risk of recurrence and mortality in breast cancer survivors: findings from the LACE study.
Cancer Epidemiol Biomarkers Prev. 2009;
18:87
-95

[196] Strasser B, Steindorf K, Wiskemann J, et al . Impact of resistance training in cancer survivors: a meta-analysis.
Med Sci Sports Exerc. 2013;
45:2080
-90

[197] Sweegers MG, Altenburg TM, Chinapaw MJ, et al . Which exercise prescriptions improve quality of life and physical function in patients with cancer during and following treatment? A systematic review and meta-analysis of randomised controlled trials.
Br J Sports Med. 2018 [Epub 2017 Sep 27.];
52:505
-13

[198] Thomas GA, Cartmel B, Harrigan M, et al . The effect of exercise on body composition and bone mineral density in breast cancer survivors taking aromatase inhibitors.
Obesity (Silver Spring). 2017;
25:346
-51

[199] Tian L, Lu HJ, Lin L, et al . Effects of aerobic exercise on cancer-related fatigue: a meta-analysis of randomized controlled trials.
Support Care Cancer. 2016;
24:969
-83

[200] Tomlinson D, Diorio C, Beyene J, et al . Effect of exercise on cancer-related fatigue: a meta-analysis.
Am J Phys Med Rehabil. 2014;
93:675
-86

[201] Vadgama JV, Wu Y, Datta G, et al . Plasma insulin-like growth factor-I and serum IGF-binding protein 3 can be associated with the progression of breast cancer, and predict the risk of recurrence and the probability of survival in African-American and Hispanic women.
Oncology. 1999;
57:330
-40

[202] Vallance JK, Boyle T, Courneya KS, et al . Associations of objectively assessed physical activity and sedentary time with health-related quality of life among colon cancer survivors.
Cancer. 2014;
120:2919
-26

[203] Van Blarigan EL, Meyerhardt JA. Role of physical activity and diet after colorectal cancer diagnosis.
J Clin Oncol. 2015;
33:1825
-34

[204] Van Vulpen JK, Peeters PH, Velthuis MJ, et al . Effects of physical exercise during adjuvant breast cancer treatment on physical and psychosocial dimensions of cancer-related fatigue: a meta-analysis.
Maturitas. 2016;
85:104
-11

[205] Van Waart H, Stuiver MM, van Harten WH, et al . Effect of low-intensity physical activity and moderate- to high-intensity physical exercise during adjuvant chemotherapy on physical fitness, fatigue, and chemotherapy completion rates: results of the PACES randomized clinical trial.
J Clin Oncol. 2015;
33:1918
-27

[206] Velthuis MJ, Agasi-Idenburg SC, Aufdemkampe G, et al . The effect of physical exercise on cancer-related fatigue during cancer treatment: a meta-analysis of randomised controlled trials.
Clin Oncol (R Coll Radiol). 2010;
22:208
-21

[207] Vijayvergia N, Denlinger CS. Lifestyle factors in cancer survivorship: where we are and where we are headed.
J Pers Med. 2015;
5:243
-63

[208] Williams PT. Significantly greater reduction in breast cancer mortality from post-diagnosis running than walking.
Int J Cancer. 2014;
135:1195
-202

[209] Winters-Stone KM, Leo MC, Schwartz A. Exercise effects on hip bone mineral density in older, post-menopausal breast cancer survivors are age dependent.
Arch Osteoporos. 2012;
7:301
-6

[210] Winters-Stone KM, Schwartz A, Nail LM. A review of exercise interventions to improve bone health in adult cancer survivors.
J Cancer Surviv. 2010;
4:187
-201

[211] Wolin KY, Ruiz JR, Tuchman H, et al . Exercise in adult and pediatric hematological cancer survivors: an intervention review.
Leukemia. 2010;
24:1113
-20

[212] World Cancer Research Fund International. Diet, nutrition, physical activity and breast cancer survivors.
London : WCRF;
2014.
56p.

[213] Wu W, Guo F, Ye J, et al . Pre- and post-diagnosis physical activity is associated with survival benefits of colorectal cancer patients: a systematic review and meta-analysis.
Oncotarget. 2016;
7:52095
-103

[214] Yang B, Wang J. Effects of exercise on cancer-related fatigue and quality of life in prostate cancer patients undergoing androgen deprivation therapy: a meta-analysis of randomized clinical trials.
Chin Med Sci J. 2017;
32:13
-21

[215] Yu AF, Jones LW. Breast cancer treatment-associated cardiovascular toxicity and effects of exercise countermeasures.
Cardiooncology. 2016;
2:1

[216] Yunfeng G, Weiyang H, Xueyang H, et al . Exercise overcome adverse effects among prostate cancer patients receiving androgen deprivation therapy: an update meta-analysis.
Medicine (Baltimore). 2017;
96:e7368

[217] Zeng Y, Huang M, Cheng AS, et al . Meta-analysis of the effects of exercise intervention on quality of life in breast cancer survivors.
Breast Cancer. 2014;
21:262
-74

[218] Zhong S, Jiang T, Ma T, et al . Association between physical activity and mortality in breast cancer: a meta-analysis of cohort studies.
Eur J Epidemiol. 2014;
29:391
-404

[219] Zhou Y, Chlebowski R, Lamonte MJ, et al . Body mass index, physical activity, and mortality in women diagnosed with ovarian cancer: results from the Women’s health initiative.
Gynecol Oncol. 2014;
133:4
-10

[220] Zimmer P, Baumann FT, Oberste M, et al . Effects of exercise interventions and physical activity behavior on cancer related cognitive impairments: a systematic review.
Biomed Res Int. 2016;
2016:1820954

→ Aller vers SYNTHESE
 ). Cependant, les effets secondaires à court, moyen et long termes, variables en fonction du type de cancer, de l’évolution de la maladie et des traitements, sont nombreux et conduisent à une altération de l’état général et de la qualité de vie des patients. Un déconditionnement physique et psychosocial associé à une altération des capacités cardiorespiratoires et une diminution de la force et de la masse musculaires (sarcopénie), sont couramment observés, indépendamment du stade de la maladie et de l’état nutritionnel (Lakoski et coll., 2012
). Cependant, les effets secondaires à court, moyen et long termes, variables en fonction du type de cancer, de l’évolution de la maladie et des traitements, sont nombreux et conduisent à une altération de l’état général et de la qualité de vie des patients. Un déconditionnement physique et psychosocial associé à une altération des capacités cardiorespiratoires et une diminution de la force et de la masse musculaires (sarcopénie), sont couramment observés, indépendamment du stade de la maladie et de l’état nutritionnel (Lakoski et coll., 2012 ; Siegel et coll., 2012
; Siegel et coll., 2012 ). Les mécanismes sous-jacents restent à préciser, mais impliquent entre autres des processus inflammatoires systémiques et métaboliques (Siegel et coll., 2012
). Les mécanismes sous-jacents restent à préciser, mais impliquent entre autres des processus inflammatoires systémiques et métaboliques (Siegel et coll., 2012  ; Lakoski et coll., 2012
; Lakoski et coll., 2012  ; Christensen et coll., 2014
; Christensen et coll., 2014 ). D’origine multifactorielle, le déconditionnement est une conséquence des processus néoplasiques, des traitements, notamment de la chimiothérapie, et de la baisse fréquente de l’activité physique. Il se trouve aggravé par l’existence de comorbidités cardiovasculaires ou métaboliques (diabète de type2, obésité), présentes selon les études, chez 30 à 80 % des patients (Christensen et coll., 2014
). D’origine multifactorielle, le déconditionnement est une conséquence des processus néoplasiques, des traitements, notamment de la chimiothérapie, et de la baisse fréquente de l’activité physique. Il se trouve aggravé par l’existence de comorbidités cardiovasculaires ou métaboliques (diabète de type2, obésité), présentes selon les études, chez 30 à 80 % des patients (Christensen et coll., 2014 ). Le déconditionnement cardiorespiratoire, l’altération du fonctionnement musculaire et la sarcopénie constituent des facteurs de mauvais pronostic et sont associés à une augmentation des effets secondaires, une moindre efficacité des traitements et une diminution significative de la survie globale des tumeurs solides, indépendamment du stade au diagnostic (Christensen et coll., 2014
). Le déconditionnement cardiorespiratoire, l’altération du fonctionnement musculaire et la sarcopénie constituent des facteurs de mauvais pronostic et sont associés à une augmentation des effets secondaires, une moindre efficacité des traitements et une diminution significative de la survie globale des tumeurs solides, indépendamment du stade au diagnostic (Christensen et coll., 2014  ; Shachar et coll., 2016
; Shachar et coll., 2016 ). Le déconditionnement est à l’origine d’une fatigue invalidante, d’une diminution de la qualité de vie et d’une intolérance à l’exercice (Siegel et coll., 2012
). Le déconditionnement est à l’origine d’une fatigue invalidante, d’une diminution de la qualité de vie et d’une intolérance à l’exercice (Siegel et coll., 2012  ; Burnett et coll., 2013
; Burnett et coll., 2013 ; Christensen et coll., 2014
; Christensen et coll., 2014  ; Inca, 2017
; Inca, 2017 ).
). ). Elle est fréquemment associée à la dépression, une diminution de la qualité de vie et de la qualité du sommeil, ainsi qu’à la douleur (de Jong et coll., 2002
). Elle est fréquemment associée à la dépression, une diminution de la qualité de vie et de la qualité du sommeil, ainsi qu’à la douleur (de Jong et coll., 2002 ). La baisse fréquente de l’activité physique (Kwan et coll., 2012
). La baisse fréquente de l’activité physique (Kwan et coll., 2012 ; Foucaut, 2013
; Foucaut, 2013 ; Van Blarigan et Meyerhardt, 2015
; Van Blarigan et Meyerhardt, 2015 ; Fassier et coll., 2016
; Fassier et coll., 2016 ), et l’existence d’une sédentarité, plus importante qu’en population générale (Kim et coll., 2013b
), et l’existence d’une sédentarité, plus importante qu’en population générale (Kim et coll., 2013b ) peuvent conduire le patient vers un cercle vicieux d’aggravation du déconditionnement physique et augmenter la fatigue (Inca, 2017
) peuvent conduire le patient vers un cercle vicieux d’aggravation du déconditionnement physique et augmenter la fatigue (Inca, 2017 ). Par ailleurs, la sédentarité, facteur de risque de certains cancers, indépendant de l’activité physique, pourrait également avoir un impact sur la santé des patients après un cancer (Lynch, 2010
). Par ailleurs, la sédentarité, facteur de risque de certains cancers, indépendant de l’activité physique, pourrait également avoir un impact sur la santé des patients après un cancer (Lynch, 2010 ; Lynch et coll., 2013
; Lynch et coll., 2013 ; Vallance et coll., 2014
; Vallance et coll., 2014 ; Nelson et coll., 2016
; Nelson et coll., 2016 ).
). ). La plupart des études a porté sur les cancers du sein, du côlon et de la prostate, et la grande majorité s’est intéressée aux personnes atteintes de cancer à un stade précoce. Les études ont évalué l’effet de l’activité physique pendant et après la fin des traitements. Peu de travaux ont porté sur l’impact de l’activité physique en situation néo-adjuvante ou chez des personnes atteintes de cancer à un stade avancé.
). La plupart des études a porté sur les cancers du sein, du côlon et de la prostate, et la grande majorité s’est intéressée aux personnes atteintes de cancer à un stade précoce. Les études ont évalué l’effet de l’activité physique pendant et après la fin des traitements. Peu de travaux ont porté sur l’impact de l’activité physique en situation néo-adjuvante ou chez des personnes atteintes de cancer à un stade avancé. ). Le présent chapitre a pris en compte les conclusions de cette expertise, tout en étudiant davantage l’effet de l’activité physique sur les effets secondaires et conséquences des traitements.
). Le présent chapitre a pris en compte les conclusions de cette expertise, tout en étudiant davantage l’effet de l’activité physique sur les effets secondaires et conséquences des traitements. ). L’hétérogénéité des études rend certaines comparaisons difficiles et pourrait contribuer à une éventuelle sous-estimation des effets de l’activité physique. Ainsi, le recrutement basé sur le volontariat, aurait pu conduire à un recrutement de patients plus actifs, et peu d’études ont sélectionné ou stratifié les patients en fonction du niveau d’activité physique de départ. Dennett et coll. (2016
). L’hétérogénéité des études rend certaines comparaisons difficiles et pourrait contribuer à une éventuelle sous-estimation des effets de l’activité physique. Ainsi, le recrutement basé sur le volontariat, aurait pu conduire à un recrutement de patients plus actifs, et peu d’études ont sélectionné ou stratifié les patients en fonction du niveau d’activité physique de départ. Dennett et coll. (2016 ) dans une méta-analyse de 42 essais randomisés, notent un taux d’inclusion médian de 63 % des patients éligibles. Très peu d’études ont rapporté les caractéristiques des non-participants (âge, niveau d’activité physique, caractéristiques socioéconomiques) et les raisons de non-participation, ce qui rend difficile d’apprécier l’existence d’un biais de sélection pouvant être à l’origine d’une sur- ou sous-estimation de l’effet (Dennett et coll., 2016
) dans une méta-analyse de 42 essais randomisés, notent un taux d’inclusion médian de 63 % des patients éligibles. Très peu d’études ont rapporté les caractéristiques des non-participants (âge, niveau d’activité physique, caractéristiques socioéconomiques) et les raisons de non-participation, ce qui rend difficile d’apprécier l’existence d’un biais de sélection pouvant être à l’origine d’une sur- ou sous-estimation de l’effet (Dennett et coll., 2016 ). Un manque de puissance, notamment pour les effets de l’activité physique évalués en tant qu’objectif secondaire, a également pu contribuer à une sous-estimation dans certaines études. Enfin, l’augmentation de l’activité physique chez les patients du groupe contrôle a pu impacter les résultats de certaines études, mais peu d’informations sont disponibles pour apprécier un éventuel biais de contamination. Enfin, on note, pour grand nombre d’études, l’absence de progressivité du niveau d’activité physique dans le protocole d’entraînement (Campbell et coll., 2012
). Un manque de puissance, notamment pour les effets de l’activité physique évalués en tant qu’objectif secondaire, a également pu contribuer à une sous-estimation dans certaines études. Enfin, l’augmentation de l’activité physique chez les patients du groupe contrôle a pu impacter les résultats de certaines études, mais peu d’informations sont disponibles pour apprécier un éventuel biais de contamination. Enfin, on note, pour grand nombre d’études, l’absence de progressivité du niveau d’activité physique dans le protocole d’entraînement (Campbell et coll., 2012 ; Sasso et coll., 2015
; Sasso et coll., 2015 ).
). ). Nous reportons ici les principales méta-analyses sur le sujet.
). Nous reportons ici les principales méta-analyses sur le sujet. ) incluant 66 essais randomisés (83 % de femmes atteintes de cancer du sein) ayant évalué la mise en œuvre d’un programme d’activité physique au cours (40 %) ou dans les suites du traitement (programmes de 5 semaines en moyenne, 80 % activité physique de type aérobie seule ou combinée, d’une intensité modérée à intense1
), montre une amélioration modérée, mais significative des capacités cardiorespiratoires pendant les traitements (17 études, taille de l’effet moyennes pondérées 0,33 ; IC 95 % [0,08-0,57], p = 0,009, I2 = 73 %) et après les traitements (14 études, taille de l’effet moyennes pondérées 0,32 ; IC 95 % [0,036-0,59], p = 0,03, I2 = 65,6 %) (Speck et coll., 2010
) incluant 66 essais randomisés (83 % de femmes atteintes de cancer du sein) ayant évalué la mise en œuvre d’un programme d’activité physique au cours (40 %) ou dans les suites du traitement (programmes de 5 semaines en moyenne, 80 % activité physique de type aérobie seule ou combinée, d’une intensité modérée à intense1
), montre une amélioration modérée, mais significative des capacités cardiorespiratoires pendant les traitements (17 études, taille de l’effet moyennes pondérées 0,33 ; IC 95 % [0,08-0,57], p = 0,009, I2 = 73 %) et après les traitements (14 études, taille de l’effet moyennes pondérées 0,32 ; IC 95 % [0,036-0,59], p = 0,03, I2 = 65,6 %) (Speck et coll., 2010 ). Le suivi et les modalités d’évaluation ne sont pas précisés.
). Le suivi et les modalités d’évaluation ne sont pas précisés. ). L’hétérogénéité des études ne permet pas d’identifier l’influence du type d’exercice sur les réponses physiologiques. À noter que l’amélioration de V̇O2pic est plus importante pour l’activité physique après traitement que pendant les traitements (3,36 mL.min-1.kg-1versus 1,21 mL.min-1.kg-1) (p < 0,001).
). L’hétérogénéité des études ne permet pas d’identifier l’influence du type d’exercice sur les réponses physiologiques. À noter que l’amélioration de V̇O2pic est plus importante pour l’activité physique après traitement que pendant les traitements (3,36 mL.min-1.kg-1versus 1,21 mL.min-1.kg-1) (p < 0,001). ).
). ) de 56 essais randomisés (4 826 patients atteints de différents types de cancer, âge moyen dans les études entre 40 et 71 ans) a évalué les effets d’un programme d’activité physique sur différentes composantes, dont les capacités fonctionnelles (mesures principalement par questionnaire ou parfois combinées à des tests de performances) pour des intensités d’exercices physiques modérées à élevées. Les auteurs rapportent une amélioration des capacités fonctionnelles à 12 semaines (8 études, 540 patients, différence moyenne standardisée (DMS) 0,69 ; IC 95 % [0,16-1,22]) ou à 6 mois (4 études, 305 patients, DMS 0,28 ; IC 95 % [0,00-0,55]).
) de 56 essais randomisés (4 826 patients atteints de différents types de cancer, âge moyen dans les études entre 40 et 71 ans) a évalué les effets d’un programme d’activité physique sur différentes composantes, dont les capacités fonctionnelles (mesures principalement par questionnaire ou parfois combinées à des tests de performances) pour des intensités d’exercices physiques modérées à élevées. Les auteurs rapportent une amélioration des capacités fonctionnelles à 12 semaines (8 études, 540 patients, différence moyenne standardisée (DMS) 0,69 ; IC 95 % [0,16-1,22]) ou à 6 mois (4 études, 305 patients, DMS 0,28 ; IC 95 % [0,00-0,55]). ).
). ). En revanche, les deux essais ayant évalué l’impact sur la fonction pulmonaire, ne retrouvent pas de différence significative.
). En revanche, les deux essais ayant évalué l’impact sur la fonction pulmonaire, ne retrouvent pas de différence significative. ).
). ), mise à jour de la méta-analyse de Markes (Markes et coll., 2006
), mise à jour de la méta-analyse de Markes (Markes et coll., 2006 de 32 essais randomisés évaluant l’effet de l’activité physique pendant les traitements (néo)adjuvants (radiothérapie, chimiothérapie) chez des femmes atteintes de cancer du sein, montre sur la base de 15 essais (1 310 femmes, suivi 18 semaines à 6 mois) une amélioration significative de la capacité cardiorespiratoire (différence moyenne standardisée DMS 0,42 ; IC 95 % [0,25-0,59] ; p < 0,00001, I2 = 49 %), évaluée par le V̇O2pic (12 études) et/ou la distance de marche (8 études).
de 32 essais randomisés évaluant l’effet de l’activité physique pendant les traitements (néo)adjuvants (radiothérapie, chimiothérapie) chez des femmes atteintes de cancer du sein, montre sur la base de 15 essais (1 310 femmes, suivi 18 semaines à 6 mois) une amélioration significative de la capacité cardiorespiratoire (différence moyenne standardisée DMS 0,42 ; IC 95 % [0,25-0,59] ; p < 0,00001, I2 = 49 %), évaluée par le V̇O2pic (12 études) et/ou la distance de marche (8 études). ).
). ).
). ; Furmaniak et coll., 2016
; Furmaniak et coll., 2016 ) et de la prostate (Yunfeng et coll., 2017
) et de la prostate (Yunfeng et coll., 2017 ). L’amélioration des capacités cardiorespiratoires a été montrée lorsque le programme d’activité physique est initié au début de la chimiothérapie, dès la fin des traitements, ou à distance de ceux-ci (niveau de preuve A).
). L’amélioration des capacités cardiorespiratoires a été montrée lorsque le programme d’activité physique est initié au début de la chimiothérapie, dès la fin des traitements, ou à distance de ceux-ci (niveau de preuve A). ; Schmidt et coll., 2013
; Schmidt et coll., 2013 ). Le test de marche de 6 minutes peut donc a priori être utilisé pour évaluer la capacité aérobie d’un patient atteint de cancer. La différence minimale considérée comme cliniquement importante chez les patients atteints de cancer est de 25 m (Fong et coll., 2012
). Le test de marche de 6 minutes peut donc a priori être utilisé pour évaluer la capacité aérobie d’un patient atteint de cancer. La différence minimale considérée comme cliniquement importante chez les patients atteints de cancer est de 25 m (Fong et coll., 2012 ). L’amélioration du V̇O2pic couramment observée varie de 1,7 à 3,4 mL.min-1.kg-1, soit approximativement de 8 à 12 % des valeurs initiales, et ce pour des programmes de six à huit semaines. Dans le même temps, les données montrent, de façon convergente, une baisse des valeurs de V̇O2pic chez les patients des groupes contrôle. Pendant les traitements, l’activité physique peut donc prévenir une baisse des capacités aérobies, et améliorer de façon significative le V̇O2pic. Les programmes d’intensité modérée et élevée ont permis d’obtenir des résultats positifs. Cependant, plus la période d’observation est prolongée, moins les effets de l’activité physique sur l’augmentation des valeurs de V̇O2pic sont marqués (Yu et Jones, 2016
). L’amélioration du V̇O2pic couramment observée varie de 1,7 à 3,4 mL.min-1.kg-1, soit approximativement de 8 à 12 % des valeurs initiales, et ce pour des programmes de six à huit semaines. Dans le même temps, les données montrent, de façon convergente, une baisse des valeurs de V̇O2pic chez les patients des groupes contrôle. Pendant les traitements, l’activité physique peut donc prévenir une baisse des capacités aérobies, et améliorer de façon significative le V̇O2pic. Les programmes d’intensité modérée et élevée ont permis d’obtenir des résultats positifs. Cependant, plus la période d’observation est prolongée, moins les effets de l’activité physique sur l’augmentation des valeurs de V̇O2pic sont marqués (Yu et Jones, 2016 ). L’absence d’adaptation et de progressivité de l’intensité de l’exercice au cours du programme pourrait expliquer ces observations (Sasso et coll., 2015
). L’absence d’adaptation et de progressivité de l’intensité de l’exercice au cours du programme pourrait expliquer ces observations (Sasso et coll., 2015 ). Cela souligne l’importance de l’observance et de l’ajustement de l’intensité des exercices dans le temps (Sasso et coll., 2015
). Cela souligne l’importance de l’observance et de l’ajustement de l’intensité des exercices dans le temps (Sasso et coll., 2015  ; Inca, 2017
; Inca, 2017 ). Aussi, les modalités et déterminants de l’activité physique au-delà des programmes supervisés initiaux restent à déterminer (Kampshoff et coll., 2014
). Aussi, les modalités et déterminants de l’activité physique au-delà des programmes supervisés initiaux restent à déterminer (Kampshoff et coll., 2014 ). En situation de cancer avancé, l’activité physique permet d’améliorer ou maintenir les capacités cardiorespiratoires. Il semblerait qu’il y ait un effet de l’intensité des exercices sur l’augmentation des capacités cardiorespiratoires et leur maintien dans le temps (Inca, 2017
). En situation de cancer avancé, l’activité physique permet d’améliorer ou maintenir les capacités cardiorespiratoires. Il semblerait qu’il y ait un effet de l’intensité des exercices sur l’augmentation des capacités cardiorespiratoires et leur maintien dans le temps (Inca, 2017 ).
). ). Une moindre force musculaire est associée à une mortalité spécifique accrue après cancer (Dankel et coll., 2018
). Une moindre force musculaire est associée à une mortalité spécifique accrue après cancer (Dankel et coll., 2018 ). La sarcopénie et le syndrome cachectique concernent respectivement 15 à 50 % et 25 à 80 % des patients atteints de cancer et peuvent être présents simultanément (Argiles et coll., 2014
). La sarcopénie et le syndrome cachectique concernent respectivement 15 à 50 % et 25 à 80 % des patients atteints de cancer et peuvent être présents simultanément (Argiles et coll., 2014 ; Peterson et Mozer, 2017
; Peterson et Mozer, 2017 ).
). ).
). ) ne retrouve pas d’impact de l’activité physique sur la masse musculaire (Fong et coll., 2012
) ne retrouve pas d’impact de l’activité physique sur la masse musculaire (Fong et coll., 2012 ) (évalué dans 7 essais de patientes atteintes de cancer du sein, I2 = 0 %). L’étude rapporte en revanche une amélioration significative de la force musculaire, évaluée par différents tests (poids de la presse de banc (muscles de l’épaule, pectoraux, biceps) (6 kg ; IC 95 % [4-8], p < 0,01) et poids de la presse à cuisses (19 kg ; IC 95 % [9-28], p < 0,01), force de préhension des mains et avant-bras (3,5 kg ; IC 95 % [0,3-6,7], p < 0,001) dans 5 essais (I2 [54-71 %]). L’amélioration de la force de préhension des mains et avant-bras droits (évaluée par le test de serrage grip test) n’est pas jugée cliniquement pertinente. La revue de Stene et coll. (2013
) (évalué dans 7 essais de patientes atteintes de cancer du sein, I2 = 0 %). L’étude rapporte en revanche une amélioration significative de la force musculaire, évaluée par différents tests (poids de la presse de banc (muscles de l’épaule, pectoraux, biceps) (6 kg ; IC 95 % [4-8], p < 0,01) et poids de la presse à cuisses (19 kg ; IC 95 % [9-28], p < 0,01), force de préhension des mains et avant-bras (3,5 kg ; IC 95 % [0,3-6,7], p < 0,001) dans 5 essais (I2 [54-71 %]). L’amélioration de la force de préhension des mains et avant-bras droits (évaluée par le test de serrage grip test) n’est pas jugée cliniquement pertinente. La revue de Stene et coll. (2013 ) de 16 essais randomisés a évalué l’activité physique de type aérobie, renforcement musculaire ou combiné, chez des patients en cours de traitement (cancers du sein, de la prostate et du côlon, hémopathies malignes). Seules six études (cancer du sein, prostate, pathologies hématologiques) ont étudié la masse musculaire et ont montré un maintien de cette masse musculaire chez les patients bénéficiant du programme d’activité physique, par rapport aux patients sans activité physique. Quatorze essais ont évalué la force musculaire. Respectivement 5, 3 et 7 essais rapportent une amélioration de la force musculaire avec de l’activité physique aérobie, de renforcement musculaire ou combinée (Stene et coll., 2013
) de 16 essais randomisés a évalué l’activité physique de type aérobie, renforcement musculaire ou combiné, chez des patients en cours de traitement (cancers du sein, de la prostate et du côlon, hémopathies malignes). Seules six études (cancer du sein, prostate, pathologies hématologiques) ont étudié la masse musculaire et ont montré un maintien de cette masse musculaire chez les patients bénéficiant du programme d’activité physique, par rapport aux patients sans activité physique. Quatorze essais ont évalué la force musculaire. Respectivement 5, 3 et 7 essais rapportent une amélioration de la force musculaire avec de l’activité physique aérobie, de renforcement musculaire ou combinée (Stene et coll., 2013 ).
). ).
). ).
). ).
). ) a évalué chez 200 patientes atteintes de cancer du sein localisé de façon spécifique, l’effet d’une intervention d’activité physique pendant la chimiothérapie adjuvante sur la sarcopénie (rapport masse maigre (évaluée par DEXA) en kg/taille en m2, – 1 à 2 DS par rapport à la moyenne pour l’âge et le sexe) et la force musculaire (poids levé (kg)/masse corporelle (kg), – 1 à 2 DS par rapport à la moyenne pour l’âge et le sexe). Pour les exercices de renforcement (66 patientes), les résultats montrent une amélioration significative de la sarcopénie (0,32 kg/m2, p = 0,017) et de la force musculaire des membres supérieurs (0,12 kg de poids soulevé/kg de masse corporelle ; p < 0,001) et inférieurs (0,27 kg de poids soulevé/kg de masse corporelle ; p < 0,001). L’activité physique de renforcement est également supérieure comparativement aux groupes « soins courants » (70 patientes) et « activité physique aérobie » (64 patientes) réunis, pour la sarcopénie (p = 0,039) et la force musculaire (p = 0,019).
) a évalué chez 200 patientes atteintes de cancer du sein localisé de façon spécifique, l’effet d’une intervention d’activité physique pendant la chimiothérapie adjuvante sur la sarcopénie (rapport masse maigre (évaluée par DEXA) en kg/taille en m2, – 1 à 2 DS par rapport à la moyenne pour l’âge et le sexe) et la force musculaire (poids levé (kg)/masse corporelle (kg), – 1 à 2 DS par rapport à la moyenne pour l’âge et le sexe). Pour les exercices de renforcement (66 patientes), les résultats montrent une amélioration significative de la sarcopénie (0,32 kg/m2, p = 0,017) et de la force musculaire des membres supérieurs (0,12 kg de poids soulevé/kg de masse corporelle ; p < 0,001) et inférieurs (0,27 kg de poids soulevé/kg de masse corporelle ; p < 0,001). L’activité physique de renforcement est également supérieure comparativement aux groupes « soins courants » (70 patientes) et « activité physique aérobie » (64 patientes) réunis, pour la sarcopénie (p = 0,039) et la force musculaire (p = 0,019). ). L’activité physique de renforcement pendant et dans les suites des traitements améliore la force des groupes musculaires sollicités (Niveau de preuve A). Les résultats en termes d’impact sur la masse musculaire sont hétérogènes (Niveau de preuve C). Ce paramètre a été évalué dans un plus petit nombre d’études, et la plupart d’entre elles avaient un suivi à court terme. L’hétérogénéité peut résulter en partie de la technique de mesure de la masse musculaire qui n’est pas facile à évaluer en pratique courante. L’activité physique aérobie semble avoir des effets moins complets sur les qualités du muscle. Les données de la littérature relatives aux pratiques d’entraînement chez les personnes indemnes de cancer, suggèrent que la pratique d’activités aérobies (avec les activités de renforcement musculaire) peut atténuer l’augmentation de la masse musculaire, mais les mécanismes de cet effet « d’interférence » ne sont pas connus (Coffey et Hawley, 2017
). L’activité physique de renforcement pendant et dans les suites des traitements améliore la force des groupes musculaires sollicités (Niveau de preuve A). Les résultats en termes d’impact sur la masse musculaire sont hétérogènes (Niveau de preuve C). Ce paramètre a été évalué dans un plus petit nombre d’études, et la plupart d’entre elles avaient un suivi à court terme. L’hétérogénéité peut résulter en partie de la technique de mesure de la masse musculaire qui n’est pas facile à évaluer en pratique courante. L’activité physique aérobie semble avoir des effets moins complets sur les qualités du muscle. Les données de la littérature relatives aux pratiques d’entraînement chez les personnes indemnes de cancer, suggèrent que la pratique d’activités aérobies (avec les activités de renforcement musculaire) peut atténuer l’augmentation de la masse musculaire, mais les mécanismes de cet effet « d’interférence » ne sont pas connus (Coffey et Hawley, 2017 ).
). ). Le syndrome cachectique, conséquence du processus tumoral et des traitements, est un facteur de mauvais pronostic et est associé à une mortalité augmentée (Shachar et coll., 2016
). Le syndrome cachectique, conséquence du processus tumoral et des traitements, est un facteur de mauvais pronostic et est associé à une mortalité augmentée (Shachar et coll., 2016 ). Différentes modifications métaboliques contribuent à la perte de la masse musculaire associée à la cachexie cancéreuse et contribuent à cette perte musculaire (anomalies dans la synthèse et dégradation (protéolyse) des protéines et du métabolisme des acides aminés (transport et oxydation) ; augmentation de l’apoptose et diminution de la capacité de régénération) (Argiles et coll., 2014
). Différentes modifications métaboliques contribuent à la perte de la masse musculaire associée à la cachexie cancéreuse et contribuent à cette perte musculaire (anomalies dans la synthèse et dégradation (protéolyse) des protéines et du métabolisme des acides aminés (transport et oxydation) ; augmentation de l’apoptose et diminution de la capacité de régénération) (Argiles et coll., 2014 ). Le syndrome cachectique est responsable d’une diminution de l’activité physique, d’une augmentation de la fatigue, et est associé à une augmentation des effets indésirables et une moindre efficacité des traitements (Inca, 2017
). Le syndrome cachectique est responsable d’une diminution de l’activité physique, d’une augmentation de la fatigue, et est associé à une augmentation des effets indésirables et une moindre efficacité des traitements (Inca, 2017 ).
). ), n’a pas permis d’identifier des essais randomisés ayant étudié le bénéfice de l’activité physique sur la masse musculaire chez des patients atteints de syndrome cachectique, ni son acceptabilité ou la sécurité de l’exercice dans cette population.
), n’a pas permis d’identifier des essais randomisés ayant étudié le bénéfice de l’activité physique sur la masse musculaire chez des patients atteints de syndrome cachectique, ni son acceptabilité ou la sécurité de l’exercice dans cette population. ), données comparables à la population générale du même âge ; et 40 % des patients passent dans une catégorie IMC supérieure pendant ou après les traitements. Cette prise de poids, qui concerne plus particulièrement les femmes atteintes de cancer du sein, est favorisée par l’âge jeune au diagnostic, la chimiothérapie, le manque d’activité physique et l’existence d’un surpoids ou d’une obésité avant le diagnostic. Le surpoids et l’obésité chez des patients atteints de cancer sont associés à une augmentation significative de la mortalité globale et spécifique, notamment pour le cancer du sein (Chan et coll., 2014
), données comparables à la population générale du même âge ; et 40 % des patients passent dans une catégorie IMC supérieure pendant ou après les traitements. Cette prise de poids, qui concerne plus particulièrement les femmes atteintes de cancer du sein, est favorisée par l’âge jeune au diagnostic, la chimiothérapie, le manque d’activité physique et l’existence d’un surpoids ou d’une obésité avant le diagnostic. Le surpoids et l’obésité chez des patients atteints de cancer sont associés à une augmentation significative de la mortalité globale et spécifique, notamment pour le cancer du sein (Chan et coll., 2014 ).
). ; Kim et coll., 2009
; Kim et coll., 2009  ; Speck et coll., 2010
; Speck et coll., 2010  ; Wolin et coll., 2010
; Wolin et coll., 2010 ; Fong et coll., 2012
; Fong et coll., 2012  ; Sheean et coll., 2012
; Sheean et coll., 2012 ; Strasser et coll., 2013
; Strasser et coll., 2013 ) ont évalué l’impact de l’activité physique, pendant et après le traitement, sur la composition corporelle. La plupart des études concernent les femmes atteintes de cancer du sein. Malgré la grande diversité des programmes d’activité physique rapportés dans les méta-analyses, l’activité physique commencée pendant et/ou après le traitement est le plus souvent associée à une réduction de poids, d’IMC, et de masse grasse (Niveau de preuve A). Les données en termes d’impact sur la masse musculaire sont hétérogènes (Niveau de preuve C). Cette divergence peut être liée à différents facteurs pouvant influencer la composition corporelle : statut ménopausique, régimes alimentaires, types d’activité physique, durée et intensité des programmes (Sheean et coll., 2012
) ont évalué l’impact de l’activité physique, pendant et après le traitement, sur la composition corporelle. La plupart des études concernent les femmes atteintes de cancer du sein. Malgré la grande diversité des programmes d’activité physique rapportés dans les méta-analyses, l’activité physique commencée pendant et/ou après le traitement est le plus souvent associée à une réduction de poids, d’IMC, et de masse grasse (Niveau de preuve A). Les données en termes d’impact sur la masse musculaire sont hétérogènes (Niveau de preuve C). Cette divergence peut être liée à différents facteurs pouvant influencer la composition corporelle : statut ménopausique, régimes alimentaires, types d’activité physique, durée et intensité des programmes (Sheean et coll., 2012 ). D’après les données de plusieurs méta-analyses, un programme d’activité physique comprenant du renforcement musculaire, a un effet plus important sur la masse musculaire et la composition corporelle qu’une activité aérobie seule (McNeely et coll., 2006
). D’après les données de plusieurs méta-analyses, un programme d’activité physique comprenant du renforcement musculaire, a un effet plus important sur la masse musculaire et la composition corporelle qu’une activité aérobie seule (McNeely et coll., 2006  ; Kim et coll., 2009
; Kim et coll., 2009  ; Speck et coll., 2010
; Speck et coll., 2010  ; Wolin et coll., 2010
; Wolin et coll., 2010  ; Fong et coll., 2012
; Fong et coll., 2012  ; Inca, 2017
; Inca, 2017 ). La combinaison optimale des deux types d’activité physique reste à déterminer (Sasso et coll., 2015
). La combinaison optimale des deux types d’activité physique reste à déterminer (Sasso et coll., 2015 ).
). ) (Niveau de preuve A). Dans une revue systématique récente, les interventions qui se sont avérées efficaces chez les patients atteints d’un cancer, obèses ou en surpoids, combinaient l’activité physique et une prise en charge nutritionnelle (Hoedjes et coll., 2017
) (Niveau de preuve A). Dans une revue systématique récente, les interventions qui se sont avérées efficaces chez les patients atteints d’un cancer, obèses ou en surpoids, combinaient l’activité physique et une prise en charge nutritionnelle (Hoedjes et coll., 2017 ). Ces approches permettent d’éviter la perte de masse musculaire, observée pour des interventions nutritionnelles seules (Hoedjes et coll., 2017
). Ces approches permettent d’éviter la perte de masse musculaire, observée pour des interventions nutritionnelles seules (Hoedjes et coll., 2017 ).
). ). Un bénéfice significatif sur la fatigue a été observé pour les études ayant évalué un programme d’activité physique après traitement (effet moyennes pondérées -0,54 ; IC 95 % [-0,90 à -0,19] ; p < 0,003 ; I2 = 84,9 %).
). Un bénéfice significatif sur la fatigue a été observé pour les études ayant évalué un programme d’activité physique après traitement (effet moyennes pondérées -0,54 ; IC 95 % [-0,90 à -0,19] ; p < 0,003 ; I2 = 84,9 %). ). La réduction significative de la fatigue est observée chez les patients porteurs de cancer du sein et de la prostate, mais pas pour les hémopathies malignes. L’effet significatif est observé pour des programmes d’activité physique aérobie (DMS -0,22 ; IC 95 % [-0,34 ;-0,10], I2 = 20,0 %), mais pas pour des programmes de renforcement musculaire (DMS -0,18 ; IC 95 % [-0,39-0,02], I2 = 0 %). Aucun effet n’a été rapporté pour des interventions « corps-esprit » (mind-body interventions, yoga, Chi Gong) (DMS -0,10 ; IC 95 % [-0,39-0,19], I2 = 0 %).
). La réduction significative de la fatigue est observée chez les patients porteurs de cancer du sein et de la prostate, mais pas pour les hémopathies malignes. L’effet significatif est observé pour des programmes d’activité physique aérobie (DMS -0,22 ; IC 95 % [-0,34 ;-0,10], I2 = 20,0 %), mais pas pour des programmes de renforcement musculaire (DMS -0,18 ; IC 95 % [-0,39-0,02], I2 = 0 %). Aucun effet n’a été rapporté pour des interventions « corps-esprit » (mind-body interventions, yoga, Chi Gong) (DMS -0,10 ; IC 95 % [-0,39-0,19], I2 = 0 %). ). L’activité physique comportait des activités à dominante aérobie (45 %), de renforcement musculaire (12 %) ou combinant les 2 (33 %), dans des programmes supervisés (55 %) ou libres (45 %), réalisés ou non en centre spécialisé, de deux semaines à un an. L’analyse poolée de 34 études montre une diminution significative de la fatigue (DMS 0,32 ; IC 95 % [0,13-0,52], I2 = 82 %). Celle-ci est plus importante pour les programmes d’activité physique mis en œuvre dès le début des traitements (26 études, 1 909 patients ; DMS 0,33 ; IC 95 % [0,12-0,53], I2 = 81 %), que dans les suites de traitements (8 études, 833 patients ; DMS 0,19 ; IC 95 % [-0,19-0,58], I2 = 81 %). L’effet de l’activité physique est plus marqué pour les tumeurs solides (DMS 0,37 ; IC 95 % [0,16-0,58], I2 = 82 %) et non significatif dans les études portant sur les hémopathies malignes (4 études) ou combinant les deux. Les programmes d’activité physique associant exercices aérobies et renforcement musculaire ont un effet plus important (DMS 0,41 ; IC 95 % [0,06-0,75]) que les programmes ne contenant que des exercices aérobies (DMS 0,27 ; IC 95 % [0,00-0,54]), ou de renforcement musculaire seuls (DMS 0,19 ; IC 95 % [-0,24-0,62]). Enfin, l’analyse dose-réponse montre un effet maximal pour une activité physique de niveau modéré à intense. Au-delà, la relation dose-réponse entre l’intensité de l’exercice aérobie et l’effet sur la fatigue a tendance à s’inverser (Dennett et coll., 2016
). L’activité physique comportait des activités à dominante aérobie (45 %), de renforcement musculaire (12 %) ou combinant les 2 (33 %), dans des programmes supervisés (55 %) ou libres (45 %), réalisés ou non en centre spécialisé, de deux semaines à un an. L’analyse poolée de 34 études montre une diminution significative de la fatigue (DMS 0,32 ; IC 95 % [0,13-0,52], I2 = 82 %). Celle-ci est plus importante pour les programmes d’activité physique mis en œuvre dès le début des traitements (26 études, 1 909 patients ; DMS 0,33 ; IC 95 % [0,12-0,53], I2 = 81 %), que dans les suites de traitements (8 études, 833 patients ; DMS 0,19 ; IC 95 % [-0,19-0,58], I2 = 81 %). L’effet de l’activité physique est plus marqué pour les tumeurs solides (DMS 0,37 ; IC 95 % [0,16-0,58], I2 = 82 %) et non significatif dans les études portant sur les hémopathies malignes (4 études) ou combinant les deux. Les programmes d’activité physique associant exercices aérobies et renforcement musculaire ont un effet plus important (DMS 0,41 ; IC 95 % [0,06-0,75]) que les programmes ne contenant que des exercices aérobies (DMS 0,27 ; IC 95 % [0,00-0,54]), ou de renforcement musculaire seuls (DMS 0,19 ; IC 95 % [-0,24-0,62]). Enfin, l’analyse dose-réponse montre un effet maximal pour une activité physique de niveau modéré à intense. Au-delà, la relation dose-réponse entre l’intensité de l’exercice aérobie et l’effet sur la fatigue a tendance à s’inverser (Dennett et coll., 2016 ).
). ). Les résultats suggèrent que l’activité physique pendant les traitements adjuvants réduit la sensation de fatigue au cours du cancer du sein, mais de façon plus limitée si elle est d’intensité élevée. Un volume hebdomadaire d’activité physique < 12 MET h/semaine semble être la situation la plus favorable pour l’amélioration de la fatigue. Les programmes d’intervention ciblant une augmentation progressive de l’activité physique selon la phase de chimiothérapie, de 2 à 5 MET h/semaine d’activité physique au cours des 10 premiers jours suivant l’administration de la chimiothérapie, et 5 à 10 MET h/semaine pendant les jours suivants, apparaissent bien adaptés pour réduire la fatigue.
). Les résultats suggèrent que l’activité physique pendant les traitements adjuvants réduit la sensation de fatigue au cours du cancer du sein, mais de façon plus limitée si elle est d’intensité élevée. Un volume hebdomadaire d’activité physique < 12 MET h/semaine semble être la situation la plus favorable pour l’amélioration de la fatigue. Les programmes d’intervention ciblant une augmentation progressive de l’activité physique selon la phase de chimiothérapie, de 2 à 5 MET h/semaine d’activité physique au cours des 10 premiers jours suivant l’administration de la chimiothérapie, et 5 à 10 MET h/semaine pendant les jours suivants, apparaissent bien adaptés pour réduire la fatigue. ), mise à jour de la méta-analyse de Markes (Markes et coll., 2006
), mise à jour de la méta-analyse de Markes (Markes et coll., 2006 ), montre un bénéfice significatif en termes de réduction de la fatigue (DMS -0,28 ; IC 95 % [-0,41 ; -0,16], I2 = 29 %) dans l’analyse de 19 essais randomisés chez des femmes atteintes de cancer du sein (1 698 femmes). À noter que seuls deux essais avaient individuellement montré des résultats significatifs.
), montre un bénéfice significatif en termes de réduction de la fatigue (DMS -0,28 ; IC 95 % [-0,41 ; -0,16], I2 = 29 %) dans l’analyse de 19 essais randomisés chez des femmes atteintes de cancer du sein (1 698 femmes). À noter que seuls deux essais avaient individuellement montré des résultats significatifs. ), montre un bénéfice significatif en termes de réduction de la fatigue comparable pour l’exercice (taille de l’effet moyennes pondérées 0,30 ; IC 95 % [0,25-0,36]), l’intervention psychologique (0,27 ; IC 95 % [0,21-0,33]) et des approches combinant les deux (0,26 ; IC 95 % [0,13-0,38]), tandis que les interventions médicamenteuses (chlorhydrate de paroxétine, modafinil ou armodafinil, chlorhydrate de méthylphénidate ou dexyméthylphénidate, dexamphétamine, méthylprednisolone) ne montrent pas de bénéfice.
), montre un bénéfice significatif en termes de réduction de la fatigue comparable pour l’exercice (taille de l’effet moyennes pondérées 0,30 ; IC 95 % [0,25-0,36]), l’intervention psychologique (0,27 ; IC 95 % [0,21-0,33]) et des approches combinant les deux (0,26 ; IC 95 % [0,13-0,38]), tandis que les interventions médicamenteuses (chlorhydrate de paroxétine, modafinil ou armodafinil, chlorhydrate de méthylphénidate ou dexyméthylphénidate, dexamphétamine, méthylprednisolone) ne montrent pas de bénéfice. ; Velthuis et coll., 2010
; Velthuis et coll., 2010 ; McMillan et Newhouse, 2011
; McMillan et Newhouse, 2011 ; Brown et coll., 2011
; Brown et coll., 2011 ; Fong et coll., 2012
; Fong et coll., 2012  ; Cramp et Byron-Daniel, 2012
; Cramp et Byron-Daniel, 2012  ; Mishra et coll., 2012a
; Mishra et coll., 2012a ; Mishra et coll., 2012b
; Mishra et coll., 2012b  ; Tomlinson et coll., 2014
; Tomlinson et coll., 2014 ; Dennett et coll., 2016
; Dennett et coll., 2016  ; Furmaniak et coll., 2016
; Furmaniak et coll., 2016  ; Bourke et coll., 2016
; Bourke et coll., 2016 ; van Vulpen et coll., 2016
; van Vulpen et coll., 2016 ; Tian et coll., 2016
; Tian et coll., 2016 ; Inca, 2017
; Inca, 2017 ) (niveau de preuve A). Le bénéfice sur la réduction de la fatigue semble moindre chez les patients porteurs d’hémopathies malignes, sans que les raisons en soient élucidées (Cramp et Byron-Daniel, 2012
) (niveau de preuve A). Le bénéfice sur la réduction de la fatigue semble moindre chez les patients porteurs d’hémopathies malignes, sans que les raisons en soient élucidées (Cramp et Byron-Daniel, 2012  ; Tomlinson et coll., 2014
; Tomlinson et coll., 2014  ; Dennett et coll., 2016
; Dennett et coll., 2016 ). Les données suggèrent également des effets bénéfiques de l’activité physique sur la fatigue pour d’autres tumeurs solides (cancers gynécologiques (endomètre et ovaire), ORL (poumon), mais les données sont plus limitées et hétérogènes (Tian et coll., 2016
). Les données suggèrent également des effets bénéfiques de l’activité physique sur la fatigue pour d’autres tumeurs solides (cancers gynécologiques (endomètre et ovaire), ORL (poumon), mais les données sont plus limitées et hétérogènes (Tian et coll., 2016  ; Inca, 2017
; Inca, 2017 ) (niveau de preuve B/C). À noter que globalement peu d’études incluses dans les méta-analyses montrent individuellement des résultats significatifs.
) (niveau de preuve B/C). À noter que globalement peu d’études incluses dans les méta-analyses montrent individuellement des résultats significatifs. ; Brown et coll., 2011
; Brown et coll., 2011  ; Duijts et coll., 2011
; Duijts et coll., 2011 ; McMillan et Newhouse, 2011
; McMillan et Newhouse, 2011  ; Fong et coll., 2012
; Fong et coll., 2012  ; Puetz et Herring, 2012
; Puetz et Herring, 2012 ; Mishra et coll., 2012b
; Mishra et coll., 2012b  ; Meneses-Echavez et coll., 2015a
; Meneses-Echavez et coll., 2015a ) qu’après les traitements (Speck et coll., 2010
) qu’après les traitements (Speck et coll., 2010  ; Brown et coll., 2011
; Brown et coll., 2011  ; Duijts et coll., 2011
; Duijts et coll., 2011  ; Cramp et Byron-Daniel, 2012
; Cramp et Byron-Daniel, 2012  ; Fong et coll., 2012
; Fong et coll., 2012  ; Puetz et Herring, 2012
; Puetz et Herring, 2012  ; Mishra et coll., 2012a
; Mishra et coll., 2012a  ; Meneses-Echavez et coll., 2015b
; Meneses-Echavez et coll., 2015b ). Les données les plus récentes suggèrent un bénéfice plus important lorsque l’activité physique est proposée dès le début des traitements (Dennett et coll., 2016
). Les données les plus récentes suggèrent un bénéfice plus important lorsque l’activité physique est proposée dès le début des traitements (Dennett et coll., 2016 ). Par ailleurs, la méta-analyse de Tomlinson et coll. (2014
). Par ailleurs, la méta-analyse de Tomlinson et coll. (2014 ) retrouve un effet plus important pour les études publiées depuis 2009 (DMS -0,61 ; IC 95 % [-0,79 ; -0,43], p < 0,001) comparé aux études publiées avant 2009 (DMS -0,25 ; IC 95 % [-0,40 ; -0,10], p = 0,001) (Tomlinson et coll., 2014
) retrouve un effet plus important pour les études publiées depuis 2009 (DMS -0,61 ; IC 95 % [-0,79 ; -0,43], p < 0,001) comparé aux études publiées avant 2009 (DMS -0,25 ; IC 95 % [-0,40 ; -0,10], p = 0,001) (Tomlinson et coll., 2014 ).
). ; Cramp et Byron-Daniel, 2012
; Cramp et Byron-Daniel, 2012  ; Tian et coll., 2016
; Tian et coll., 2016 ), mais pas pour l’activité physique de renforcement musculaire (McMillan et Newhouse, 2011
), mais pas pour l’activité physique de renforcement musculaire (McMillan et Newhouse, 2011  ; Cramp et Byron-Daniel, 2012
; Cramp et Byron-Daniel, 2012  ; Strasser et coll., 2013
; Strasser et coll., 2013  ; Meneses-Echavez et coll., 2015a
; Meneses-Echavez et coll., 2015a ). La méta-analyse de Dennett rapporte un effet plus important pour des programmes d’activité physique mixte (Dennett et coll., 2016
). La méta-analyse de Dennett rapporte un effet plus important pour des programmes d’activité physique mixte (Dennett et coll., 2016 ).
). ; Cramp et Byron-Daniel, 2012
; Cramp et Byron-Daniel, 2012  ; Buffart et coll., 2012
; Buffart et coll., 2012 ), et une activité physique d’intensité élevée, d’autre part (Mishra et coll., 2012a
), et une activité physique d’intensité élevée, d’autre part (Mishra et coll., 2012a  ; Carayol et coll., 2015
; Carayol et coll., 2015 ; Dennett et coll., 2016
; Dennett et coll., 2016 ). Le bénéfice semble plus important lorsque l’activité physique est réalisée dans le cadre d’un programme supervisé, comparé à l’activité physique non supervisée (Velthuis et coll., 2010
). Le bénéfice semble plus important lorsque l’activité physique est réalisée dans le cadre d’un programme supervisé, comparé à l’activité physique non supervisée (Velthuis et coll., 2010  ; McMillan et Newhouse, 2011
; McMillan et Newhouse, 2011  ; van Vulpen et coll., 2016
; van Vulpen et coll., 2016 ).
). ; Zimmer et coll., 2016
; Zimmer et coll., 2016 ; Myers et coll., 2017). Cette altération concerne plus particulièrement les patients recevant une chimiothérapie (jusqu’à 75 % des patients), mais est observée également après d’autres types de traitement, comme la radiothérapie, la chirurgie ou l’hormonothérapie (Zimmer et coll., 2016
; Myers et coll., 2017). Cette altération concerne plus particulièrement les patients recevant une chimiothérapie (jusqu’à 75 % des patients), mais est observée également après d’autres types de traitement, comme la radiothérapie, la chirurgie ou l’hormonothérapie (Zimmer et coll., 2016 ). Une revue systématique de 19 études (expérimentales chez l’animal : 5 études ; chez des patients atteints de cancer : 14 études dont 6 essais randomisés) suggère un possible bénéfice de l’activité physique sur les capacités cognitives (Zimmer et coll., 2016
). Une revue systématique de 19 études (expérimentales chez l’animal : 5 études ; chez des patients atteints de cancer : 14 études dont 6 essais randomisés) suggère un possible bénéfice de l’activité physique sur les capacités cognitives (Zimmer et coll., 2016 ). Si les données suggèrent que l’activité physique pourrait être une intervention potentielle pour améliorer la fonction cognitive après cancer, les données sont préliminaires et hétérogènes et des questions demeurent concernant les modalités optimales (Zimmer et coll., 2016
). Si les données suggèrent que l’activité physique pourrait être une intervention potentielle pour améliorer la fonction cognitive après cancer, les données sont préliminaires et hétérogènes et des questions demeurent concernant les modalités optimales (Zimmer et coll., 2016  ; Myers et coll., 2017).
; Myers et coll., 2017). ). Les douleurs sont le plus souvent liées directement à la maladie, mais la fréquence et la gravité des douleurs iatrogènes (post-opératoires, mucites, douleurs musculaires ou osseuses associées à la chimiothérapie ou l’hormonothérapie, douleurs d’origine inflammatoire et nécroses suite à la radiothérapie) seraient souvent sous-estimées (Inca, 2017
). Les douleurs sont le plus souvent liées directement à la maladie, mais la fréquence et la gravité des douleurs iatrogènes (post-opératoires, mucites, douleurs musculaires ou osseuses associées à la chimiothérapie ou l’hormonothérapie, douleurs d’origine inflammatoire et nécroses suite à la radiothérapie) seraient souvent sous-estimées (Inca, 2017 ). Deux revues Cochrane portant sur la qualité de vie (Mishra et coll., 2012a
). Deux revues Cochrane portant sur la qualité de vie (Mishra et coll., 2012a  ; Mishra et coll., 2012b
; Mishra et coll., 2012b ) ont inclus une analyse de l’impact de l’activité physique sur les douleurs. Pendant les traitements (Mishra et coll., 2012b
) ont inclus une analyse de l’impact de l’activité physique sur les douleurs. Pendant les traitements (Mishra et coll., 2012b ), les auteurs suggèrent une tendance positive sur la base d’un faible nombre d’études avec une très grande hétérogénéité des programmes d’activité physique et d’outils d’évaluation. Après cancer (Mishra et coll., 2012a
), les auteurs suggèrent une tendance positive sur la base d’un faible nombre d’études avec une très grande hétérogénéité des programmes d’activité physique et d’outils d’évaluation. Après cancer (Mishra et coll., 2012a ), les auteurs, sur la base de 4 études (289 patients), rapportent une diminution significative de la douleur à 12 semaines de suivi (DMS -0,29 ; IC 95 % [-0,55 ; -0,04]), mais pas avec un suivi plus long. L’importante hétérogénéité des études cliniques est là aussi notée par les auteurs. Le rapport de l’Inca (2017
), les auteurs, sur la base de 4 études (289 patients), rapportent une diminution significative de la douleur à 12 semaines de suivi (DMS -0,29 ; IC 95 % [-0,55 ; -0,04]), mais pas avec un suivi plus long. L’importante hétérogénéité des études cliniques est là aussi notée par les auteurs. Le rapport de l’Inca (2017 ), sur la base de 3 essais randomisés chez des patientes atteintes de cancer du sein, suggère un bénéfice significatif de l’activité physique (renforcement musculaire ± assouplissement) pendant la radiothérapie sur les douleurs au niveau de l’épaule et du bras du côté opéré (Inca, 2017
), sur la base de 3 essais randomisés chez des patientes atteintes de cancer du sein, suggère un bénéfice significatif de l’activité physique (renforcement musculaire ± assouplissement) pendant la radiothérapie sur les douleurs au niveau de l’épaule et du bras du côté opéré (Inca, 2017 ). Les effets antalgiques de l’activité physique seraient liés à la réduction de l’inflammation induite par la radiothérapie, évaluée par des concentrations circulantes d’IL-6 et du rapport IL-6/IL-1ra (Schmidt et coll., 2016
). Les effets antalgiques de l’activité physique seraient liés à la réduction de l’inflammation induite par la radiothérapie, évaluée par des concentrations circulantes d’IL-6 et du rapport IL-6/IL-1ra (Schmidt et coll., 2016 ).
). ), sont évaluées comme étant modérées à sévères pour 70 % des patients et fréquemment à l’origine d’un arrêt des AA (Hershman et coll., 2011
), sont évaluées comme étant modérées à sévères pour 70 % des patients et fréquemment à l’origine d’un arrêt des AA (Hershman et coll., 2011 ). Ces symptômes apparaissent 6 à 12 mois après le démarrage du traitement et disparaissent le plus souvent à l’arrêt des AA. La douleur a un effet délétère sur la qualité de vie et en affecte l’ensemble des dimensions physiques et psychologiques. Un essai randomisé ayant évalué un programme d’activité physique de 12 mois chez 121 patientes (âge moyen 61 ans, < 90 min activité physique/semaine) traitées par AA et présentant des arthralgies (apparition sous traitement ou aggravation d’arthralgies préexistantes), montre une amélioration significative de la douleur à 12 mois (Irwin et coll., 2015
). Ces symptômes apparaissent 6 à 12 mois après le démarrage du traitement et disparaissent le plus souvent à l’arrêt des AA. La douleur a un effet délétère sur la qualité de vie et en affecte l’ensemble des dimensions physiques et psychologiques. Un essai randomisé ayant évalué un programme d’activité physique de 12 mois chez 121 patientes (âge moyen 61 ans, < 90 min activité physique/semaine) traitées par AA et présentant des arthralgies (apparition sous traitement ou aggravation d’arthralgies préexistantes), montre une amélioration significative de la douleur à 12 mois (Irwin et coll., 2015 ).
). ), montre une réduction significative du score douleur (DM -6,26 ; IC 95 % [-12,20 ; -0,31]) et une amélioration des scores de mobilité de l’épaule.
), montre une réduction significative du score douleur (DM -6,26 ; IC 95 % [-12,20 ; -0,31]) et une amélioration des scores de mobilité de l’épaule. ; Steindorf et coll., 2014
; Steindorf et coll., 2014 ; Irwin et coll., 2015
; Irwin et coll., 2015  ; Galiano-Castillo et coll., 2016
; Galiano-Castillo et coll., 2016 ) et patients atteints de cancer ORL (McNeely et coll., 2008
) et patients atteints de cancer ORL (McNeely et coll., 2008 ; Carvalho et coll., 2012
; Carvalho et coll., 2012 ), et notamment sur la récupération de l’épaule et sur les douleurs associées. L’activité physique régulière semble améliorer certaines douleurs liées aux cancers et aux traitements (niveau de preuve C).
), et notamment sur la récupération de l’épaule et sur les douleurs associées. L’activité physique régulière semble améliorer certaines douleurs liées aux cancers et aux traitements (niveau de preuve C). ). Un essai randomisé de 355 patients (56 ± 11 ans, 79 % de femmes atteintes d’un cancer du sein) a évalué le bénéfice d’un programme d’activité physique concomitant à une chimiothérapie à base de taxanes, platines ou vinca-alcaloïdes, associant activité physique aérobie et de renforcement musculaire d’intensité modérée, à domicile, de 6 semaines (Kleckner et coll., 2017
). Un essai randomisé de 355 patients (56 ± 11 ans, 79 % de femmes atteintes d’un cancer du sein) a évalué le bénéfice d’un programme d’activité physique concomitant à une chimiothérapie à base de taxanes, platines ou vinca-alcaloïdes, associant activité physique aérobie et de renforcement musculaire d’intensité modérée, à domicile, de 6 semaines (Kleckner et coll., 2017 ). Les résultats montrent une diminution significative de la prévalence et de la gravité des symptômes de NPCI (sensibilité à la chaleur et au froid dans les mains et pieds, engourdissement et picotements) dans le groupe ayant bénéficié du programme d’activité physique.
). Les résultats montrent une diminution significative de la prévalence et de la gravité des symptômes de NPCI (sensibilité à la chaleur et au froid dans les mains et pieds, engourdissement et picotements) dans le groupe ayant bénéficié du programme d’activité physique. ). Selon la sévérité des limitations, une rééducation ou prise en charge adaptée par des professionnels de santé peut être requise (Décret no 2016-1990)4
.
). Selon la sévérité des limitations, une rééducation ou prise en charge adaptée par des professionnels de santé peut être requise (Décret no 2016-1990)4
. ; Ades et coll., 2014
; Ades et coll., 2014 ; Khosrow-Khavar et coll., 2017
; Khosrow-Khavar et coll., 2017 ). La toxicité cardiovasculaire varie selon les substances, les doses et le schéma, l’âge du patient, et peut se déclarer durant le traitement ou à distance, jusqu’à plusieurs années après le traitement. L’existence de facteurs de risque (obésité, intolérance à l’exercice, diabète, hyperlipidémie), ou de comorbidités cardiovasculaires (hypertension), peuvent augmenter le risque de morbidité et de mortalité (Haykowsky et coll., 2017
). La toxicité cardiovasculaire varie selon les substances, les doses et le schéma, l’âge du patient, et peut se déclarer durant le traitement ou à distance, jusqu’à plusieurs années après le traitement. L’existence de facteurs de risque (obésité, intolérance à l’exercice, diabète, hyperlipidémie), ou de comorbidités cardiovasculaires (hypertension), peuvent augmenter le risque de morbidité et de mortalité (Haykowsky et coll., 2017 ). Les effets cardiovasculaires peuvent se manifester sous forme d’insuffisance cardiaque, d’ischémie du myocarde, d’hypertension artérielle ou d’arythmie ainsi que d’accidents vasculaires cérébraux et de thromboses artérielles et veineuses (Moudgil et Yeh, 2016
). Les effets cardiovasculaires peuvent se manifester sous forme d’insuffisance cardiaque, d’ischémie du myocarde, d’hypertension artérielle ou d’arythmie ainsi que d’accidents vasculaires cérébraux et de thromboses artérielles et veineuses (Moudgil et Yeh, 2016 ). Comparativement aux femmes de même âge, les femmes atteintes d’un cancer du sein ont 1,7 fois plus de risque de mortalité cardiovasculaire, 1,3 fois plus de risque de maladie cardiovasculaire (coronaropathie, AVC, insuffisance cardiaque) et 1,3 à 3,1 fois plus de facteurs de risque de maladie cardiovasculaire (hypertension, diabète, dyslipidémie), conséquence des traitements et du déconditionnement (Scott et coll., 2016
). Comparativement aux femmes de même âge, les femmes atteintes d’un cancer du sein ont 1,7 fois plus de risque de mortalité cardiovasculaire, 1,3 fois plus de risque de maladie cardiovasculaire (coronaropathie, AVC, insuffisance cardiaque) et 1,3 à 3,1 fois plus de facteurs de risque de maladie cardiovasculaire (hypertension, diabète, dyslipidémie), conséquence des traitements et du déconditionnement (Scott et coll., 2016 ). Les mécanismes biologiques impliqués dans les lésions cardiaques secondaires aux traitements restent en partie incompris.
). Les mécanismes biologiques impliqués dans les lésions cardiaques secondaires aux traitements restent en partie incompris. ; Haykowsky et coll., 2017
; Haykowsky et coll., 2017 ). Une amélioration du pic de V̇O2 associé à l’exercice a été suggérée chez les femmes atteintes de cancer du sein avec insuffisance cardiaque et fraction d’éjection préservée, mais les mécanismes responsables de cette amélioration restent à élucider (Haykowsky et coll., 2016
). Une amélioration du pic de V̇O2 associé à l’exercice a été suggérée chez les femmes atteintes de cancer du sein avec insuffisance cardiaque et fraction d’éjection préservée, mais les mécanismes responsables de cette amélioration restent à élucider (Haykowsky et coll., 2016 ). Une étude prospective issue de deux cohortes, incluant 2 973 femmes après un cancer du sein localisé (suivi médian 8,6 ans), a mis en évidence une diminution de 23 % du risque d’événements cardiovasculaires chez les femmes ayant une activité physique ≥ 9 MET h/semaine (soit au moins 2 heures/semaine à une intensité modérée de 4,5 MET) comparativement aux femmes ne les atteignant pas (Jones et coll., 2016
). Une étude prospective issue de deux cohortes, incluant 2 973 femmes après un cancer du sein localisé (suivi médian 8,6 ans), a mis en évidence une diminution de 23 % du risque d’événements cardiovasculaires chez les femmes ayant une activité physique ≥ 9 MET h/semaine (soit au moins 2 heures/semaine à une intensité modérée de 4,5 MET) comparativement aux femmes ne les atteignant pas (Jones et coll., 2016 ). L’étude observe une relation dose-effet avec l’augmentation du nombre de MET h/semaine. Il n’existait pas d’interaction avec le type de traitement adjuvant (anthracyclines, anti-aromatase).
). L’étude observe une relation dose-effet avec l’augmentation du nombre de MET h/semaine. Il n’existait pas d’interaction avec le type de traitement adjuvant (anthracyclines, anti-aromatase). ; Kirkham et Davis, 2015
; Kirkham et Davis, 2015 ). Un effet sur la fonction des cellules endothéliales a également été suggéré (Jones et coll., 2013
). Un effet sur la fonction des cellules endothéliales a également été suggéré (Jones et coll., 2013 ; Kirkham et Davis, 2015
; Kirkham et Davis, 2015 ). Ces mécanismes restent cependant à démontrer chez l’homme.
). Ces mécanismes restent cependant à démontrer chez l’homme. ; Knobf et Winters-Stone, 2013
; Knobf et Winters-Stone, 2013 ) suggèrent que l’activité physique pourrait prévenir la perte de la DMO associée à l’hormonothérapie et la ménopause précoce, chez les femmes atteintes de cancer du sein. Cet effet semble davantage exister chez les femmes plus jeunes, préménopausées au moment du diagnostic, et a été observé aussi bien dans des études avec l’activité physique aérobie, qu’avec des activités de renforcement ou une combinaison des deux (Saarto et coll., 2012
) suggèrent que l’activité physique pourrait prévenir la perte de la DMO associée à l’hormonothérapie et la ménopause précoce, chez les femmes atteintes de cancer du sein. Cet effet semble davantage exister chez les femmes plus jeunes, préménopausées au moment du diagnostic, et a été observé aussi bien dans des études avec l’activité physique aérobie, qu’avec des activités de renforcement ou une combinaison des deux (Saarto et coll., 2012 ; Winters-Stone et coll., 2012
; Winters-Stone et coll., 2012 ; Hojan et coll., 2013
; Hojan et coll., 2013 ). À noter qu’un essai randomisé récent ayant évalué une activité physique aérobie et de renforcement chez 121 femmes traitées par inhibiteur de l’aromatase n’a pas retrouvé ce bénéfice (Thomas et coll., 2017
). À noter qu’un essai randomisé récent ayant évalué une activité physique aérobie et de renforcement chez 121 femmes traitées par inhibiteur de l’aromatase n’a pas retrouvé ce bénéfice (Thomas et coll., 2017 ).
). ). Enfin, un essai randomisé de 60 patients (âge moyen 62,7 ans ; principalement cancers du sein, du poumon et de la prostate), présentant des métastases osseuses, rapporte un bénéfice de l’activité physique associée à l’irradiation versus l’irradiation seule sur la densité osseuse des métastases spinales (Rief et coll., 2014
). Enfin, un essai randomisé de 60 patients (âge moyen 62,7 ans ; principalement cancers du sein, du poumon et de la prostate), présentant des métastases osseuses, rapporte un bénéfice de l’activité physique associée à l’irradiation versus l’irradiation seule sur la densité osseuse des métastases spinales (Rief et coll., 2014 ).
). ). Ces quinze dernières années, la technique du ganglion sentinelle a permis de réduire l’incidence du lymphœdème, avec des taux rapportés de l’ordre de 7 % (Cormier et coll., 2010
). Ces quinze dernières années, la technique du ganglion sentinelle a permis de réduire l’incidence du lymphœdème, avec des taux rapportés de l’ordre de 7 % (Cormier et coll., 2010 ). Le taux de lymphœdème est augmenté lorsque la chirurgie au niveau de l’aisselle est associée à de la radiothérapie, avec des taux de près de 45 % (Cormier et coll., 2010
). Le taux de lymphœdème est augmenté lorsque la chirurgie au niveau de l’aisselle est associée à de la radiothérapie, avec des taux de près de 45 % (Cormier et coll., 2010 ). Le lymphœdème peut apparaître quelques semaines ou mois après l’intervention mais également plus tardivement (plusieurs années à distance du traitement). Les autres facteurs de risque de lymphœdème sont l’âge, l’obésité et la prise de poids après traitement, les traumatismes et les infections au niveau de la main ou du bras du côté opéré et possiblement le manque d’activité physique.
). Le lymphœdème peut apparaître quelques semaines ou mois après l’intervention mais également plus tardivement (plusieurs années à distance du traitement). Les autres facteurs de risque de lymphœdème sont l’âge, l’obésité et la prise de poids après traitement, les traumatismes et les infections au niveau de la main ou du bras du côté opéré et possiblement le manque d’activité physique. ; Chan et coll., 2010
; Chan et coll., 2010 ; Cheema et coll., 2014
; Cheema et coll., 2014 ; Paramanandam et Roberts, 2014
; Paramanandam et Roberts, 2014 ; Nelson et coll., 2016
; Nelson et coll., 2016 ; Keilani et coll., 2016
; Keilani et coll., 2016 ; Singh et coll., 2016b
; Singh et coll., 2016b ; Inca, 2017
; Inca, 2017 ). Les études montrent également de façon convergente une amélioration de la fonction scapulo-humérale avec augmentation de l’amplitude des mouvements, de la force du haut et du bas du corps (McNeely et coll., 2010
). Les études montrent également de façon convergente une amélioration de la fonction scapulo-humérale avec augmentation de l’amplitude des mouvements, de la force du haut et du bas du corps (McNeely et coll., 2010 ; Cheema et coll., 2014
; Cheema et coll., 2014 ). Une méta-analyse de 5 essais randomisés (patients âgés de 46 à 62 ans) ayant évalué l’impact de l’activité physique de type renforcement musculaire note une diminution significative de l’incidence et/ou réduction de la progression du lymphœdème (Cheema et coll., 2014
). Une méta-analyse de 5 essais randomisés (patients âgés de 46 à 62 ans) ayant évalué l’impact de l’activité physique de type renforcement musculaire note une diminution significative de l’incidence et/ou réduction de la progression du lymphœdème (Cheema et coll., 2014 ). Une méta-analyse Cochrane montre, sur la base de 10 études (âge moyen 49 à 62 ans), un bénéfice significatif sur le plan fonctionnel d’un exercice précoce (débuté entre J1 et J3 post-opératoire) comparé à un début plus tardif (≥ J4), mais rapporte une augmentation du volume et de la durée du drainage post-opératoire (McNeely et coll., 2010
). Une méta-analyse Cochrane montre, sur la base de 10 études (âge moyen 49 à 62 ans), un bénéfice significatif sur le plan fonctionnel d’un exercice précoce (débuté entre J1 et J3 post-opératoire) comparé à un début plus tardif (≥ J4), mais rapporte une augmentation du volume et de la durée du drainage post-opératoire (McNeely et coll., 2010 ). Les auteurs montrent l’absence d’augmentation de risque de lymphœdème pour l’activité physique concomitante aux traitements adjuvants.
). Les auteurs montrent l’absence d’augmentation de risque de lymphœdème pour l’activité physique concomitante aux traitements adjuvants. ).
). ). L’interdiction à pratiquer un exercice physique impliquant le membre supérieur du côté opéré n’est plus indiquée (Inca, 2017
). L’interdiction à pratiquer un exercice physique impliquant le membre supérieur du côté opéré n’est plus indiquée (Inca, 2017  ; NCCN, 2017
; NCCN, 2017 ).
). ).
). ; van Waart et coll., 2015
; van Waart et coll., 2015 ) et de lymphomes (Courneya et coll., 2009
) et de lymphomes (Courneya et coll., 2009 ). Ces résultats nécessitent confirmation.
). Ces résultats nécessitent confirmation. ; Duijts et coll., 2011
; Duijts et coll., 2011  ; Carayol et coll., 2013
; Carayol et coll., 2013  ; Zeng et coll., 2014
; Zeng et coll., 2014 ).
). ). La qualité de vie est améliorée lorsque l’activité physique est pratiquée dès le début (DMS 0,13 ; IC 95 % [0,005-0,260]) ou après les traitements du cancer (DMS 0,29 ; IC 95 % [0,03-0,54]).
). La qualité de vie est améliorée lorsque l’activité physique est pratiquée dès le début (DMS 0,13 ; IC 95 % [0,005-0,260]) ou après les traitements du cancer (DMS 0,29 ; IC 95 % [0,03-0,54]). ).
). ). Les auteurs rapportent une relation dose-effet inversement associée au bénéfice sur la qualité de vie lors de la période du traitement adjuvant du cancer du sein. Ainsi, la prescription d’une quantité d’activité physique hebdomadaire inférieure à 20 MET h/semaine, est plus efficace pour l’amélioration de la qualité de vie qu’une quantité hebdomadaire supérieure (Carayol, 2013). La prescription d’une quantité d’activité physique modérée (quotidienne ou hebdomadaire) est associée à un plus fort taux d’adhésion des patientes, comparée à de simples recommandations transmises oralement (p < 0,001). Les effets des programmes d’activité physique sur la qualité de vie sont plus prononcés si leur durée est supérieure à 18 semaines (Carayol et coll., 2013
). Les auteurs rapportent une relation dose-effet inversement associée au bénéfice sur la qualité de vie lors de la période du traitement adjuvant du cancer du sein. Ainsi, la prescription d’une quantité d’activité physique hebdomadaire inférieure à 20 MET h/semaine, est plus efficace pour l’amélioration de la qualité de vie qu’une quantité hebdomadaire supérieure (Carayol, 2013). La prescription d’une quantité d’activité physique modérée (quotidienne ou hebdomadaire) est associée à un plus fort taux d’adhésion des patientes, comparée à de simples recommandations transmises oralement (p < 0,001). Les effets des programmes d’activité physique sur la qualité de vie sont plus prononcés si leur durée est supérieure à 18 semaines (Carayol et coll., 2013 ).
). ). Dans les 25 essais randomisés contrôlés analysés, les programmes d’activité physique proposés sont très divers : exercice aérobie (11 études), exercice anaérobie (4 études), yoga (3 études), Tai Chi (2 études), exercice aérobie et étirements (2 études), renforcement musculaire (1 étude), activité physique combinant exercice aérobie et renforcement musculaire (1 étude), combinant renforcement musculaire et étirements (1 étude). Les séances d’activité physique sont proposées une à cinq fois par semaine pendant 15 à 90 min sur quatre à 52 semaines. La méta-analyse de Buffart et coll. (2012) analyse l’effet de la pratique d’activité physique de faible intensité comme le yoga supervisé (comprenant un travail postural associé à des exercices de relaxation, respiration ou méditation) sur la qualité de vie des patientes atteintes de cancer du sein ou de lymphome (Buffart et coll., 2012
). Dans les 25 essais randomisés contrôlés analysés, les programmes d’activité physique proposés sont très divers : exercice aérobie (11 études), exercice anaérobie (4 études), yoga (3 études), Tai Chi (2 études), exercice aérobie et étirements (2 études), renforcement musculaire (1 étude), activité physique combinant exercice aérobie et renforcement musculaire (1 étude), combinant renforcement musculaire et étirements (1 étude). Les séances d’activité physique sont proposées une à cinq fois par semaine pendant 15 à 90 min sur quatre à 52 semaines. La méta-analyse de Buffart et coll. (2012) analyse l’effet de la pratique d’activité physique de faible intensité comme le yoga supervisé (comprenant un travail postural associé à des exercices de relaxation, respiration ou méditation) sur la qualité de vie des patientes atteintes de cancer du sein ou de lymphome (Buffart et coll., 2012 ). Pendant et après les traitements, cette pratique (sur une durée moyenne de 7 semaines, avec une à trois séances de 30 à 120 min par semaine) s’avère bénéfique sur la qualité de vie (DMS 0,37 [0,11-0,62]). Par contre, une méta-analyse de sept études (dont 3 essais randomisés) incluant 201 patientes atteintes de cancer du sein ayant évalué le Tai Chi ne retrouve pas d’amélioration de la qualité de vie des patients (DMS 0,45 [0,25-1,14] ; p = 0,21) (Lee et coll., 2010
). Pendant et après les traitements, cette pratique (sur une durée moyenne de 7 semaines, avec une à trois séances de 30 à 120 min par semaine) s’avère bénéfique sur la qualité de vie (DMS 0,37 [0,11-0,62]). Par contre, une méta-analyse de sept études (dont 3 essais randomisés) incluant 201 patientes atteintes de cancer du sein ayant évalué le Tai Chi ne retrouve pas d’amélioration de la qualité de vie des patients (DMS 0,45 [0,25-1,14] ; p = 0,21) (Lee et coll., 2010 ). L’absence d’effet décelable de ce type de pratique peut s’expliquer par l’origine des patientes incluses, majoritairement d’origine asiatique. La pratique du Tai Chi étant une pratique « courante » dans cette culture, l’absence d’effet pourrait être la conséquence d’un effet de « lissage » des résultats.
). L’absence d’effet décelable de ce type de pratique peut s’expliquer par l’origine des patientes incluses, majoritairement d’origine asiatique. La pratique du Tai Chi étant une pratique « courante » dans cette culture, l’absence d’effet pourrait être la conséquence d’un effet de « lissage » des résultats. ). L’ampleur de l’effet de l’intervention sur la qualité de la vie pendant toute la période de suivi était de 0,33 [0,23-0,43].
). L’ampleur de l’effet de l’intervention sur la qualité de la vie pendant toute la période de suivi était de 0,33 [0,23-0,43]. ; Mishra et coll., 2012b
; Mishra et coll., 2012b ). Les deux méta-analyses incluent des essais randomisés contrôlés comportant un groupe activité physique (de type aérobie, comme la marche ou le vélo, douces comme le yoga, le Chi Gong ou le Tai Chi, ou de renforcement musculaire comme la gymnastique) comparé à un groupe contrôle. Dans cette méta-analyse de 56 essais cliniques, incluant 4 826 patients atteints de différents types de cancer, la qualité de vie liée à la santé est améliorée après 12 semaines de suivi (DMS 0,47 ; IC 95 % [0,16-0,79] (Mishra et coll., 2012a
). Les deux méta-analyses incluent des essais randomisés contrôlés comportant un groupe activité physique (de type aérobie, comme la marche ou le vélo, douces comme le yoga, le Chi Gong ou le Tai Chi, ou de renforcement musculaire comme la gymnastique) comparé à un groupe contrôle. Dans cette méta-analyse de 56 essais cliniques, incluant 4 826 patients atteints de différents types de cancer, la qualité de vie liée à la santé est améliorée après 12 semaines de suivi (DMS 0,47 ; IC 95 % [0,16-0,79] (Mishra et coll., 2012a ). Lorsque le programme est mis en place après les traitements, l’amélioration de la qualité de vie liée à la santé est observée après 12 semaines d’intervention (DMS 0,48 ; IC 95 % [0,16-0,81]), ainsi qu’après six mois de suivi (0,46 ; IC 95 % [0,09-0,84]) (Mishra et coll., 2012b
). Lorsque le programme est mis en place après les traitements, l’amélioration de la qualité de vie liée à la santé est observée après 12 semaines d’intervention (DMS 0,48 ; IC 95 % [0,16-0,81]), ainsi qu’après six mois de suivi (0,46 ; IC 95 % [0,09-0,84]) (Mishra et coll., 2012b ). Les auteurs soulignent l’hétérogénéité importante des programmes d’activité physique (Mishra et coll., 2012a
). Les auteurs soulignent l’hétérogénéité importante des programmes d’activité physique (Mishra et coll., 2012a  ; Mishra et coll., 2012b
; Mishra et coll., 2012b ). Pendant et après les traitements, l’activité physique d’une intensité modérée à élevée est associée à un bénéfice supérieur par rapport à un programme d’activité physique de faible intensité (Mishra et coll., 2012a
). Pendant et après les traitements, l’activité physique d’une intensité modérée à élevée est associée à un bénéfice supérieur par rapport à un programme d’activité physique de faible intensité (Mishra et coll., 2012a  ; Mishra et coll., 2012b
; Mishra et coll., 2012b ).
). ). Cette méta-analyse suggère que pour une durée moyenne d’intervention de 26 semaines, une activité physique aérobie d’intensité modérée comme la marche (3-4 MET) donne peu ou pas d’amélioration de la qualité de vie, contrairement à une activité physique aérobie d’intensité plus élevée (modérément « haute », 6 MET) comme par exemple la pratique du vélo. Par ailleurs, la durée du programme influence la qualité de vie. Les interventions inférieures à huit semaines ne montrent pas d’amélioration de la qualité de vie, et ce, quelle que soit l’intensité de l’activité physique. De plus, l’effet de la pratique de l’activité physique est plus marqué pour les programmes proposés aux femmes. Cela justifie de développer davantage de recherches sur les programmes les mieux adaptés aux hommes atteints de cancer souvent sous-représentés dans les essais d’intervention.
). Cette méta-analyse suggère que pour une durée moyenne d’intervention de 26 semaines, une activité physique aérobie d’intensité modérée comme la marche (3-4 MET) donne peu ou pas d’amélioration de la qualité de vie, contrairement à une activité physique aérobie d’intensité plus élevée (modérément « haute », 6 MET) comme par exemple la pratique du vélo. Par ailleurs, la durée du programme influence la qualité de vie. Les interventions inférieures à huit semaines ne montrent pas d’amélioration de la qualité de vie, et ce, quelle que soit l’intensité de l’activité physique. De plus, l’effet de la pratique de l’activité physique est plus marqué pour les programmes proposés aux femmes. Cela justifie de développer davantage de recherches sur les programmes les mieux adaptés aux hommes atteints de cancer souvent sous-représentés dans les essais d’intervention. ; Yang et Wang, 2017
; Yang et Wang, 2017 ). Sur la base de 7 essais (912 patients, suivi médian 12 semaines) et 10 essais (841 patients) respectivement, les auteurs suggèrent une amélioration significative de la qualité de vie. L’effet semble plus important dans les études de bonne qualité (Bourke et coll., 2016
). Sur la base de 7 essais (912 patients, suivi médian 12 semaines) et 10 essais (841 patients) respectivement, les auteurs suggèrent une amélioration significative de la qualité de vie. L’effet semble plus important dans les études de bonne qualité (Bourke et coll., 2016 ). Une amélioration de la qualité de vie chez des patients atteints de cancer ORL (Capozzi et coll., 2016
). Une amélioration de la qualité de vie chez des patients atteints de cancer ORL (Capozzi et coll., 2016 ) et de l’endomètre (Babatunde et coll., 2016
) et de l’endomètre (Babatunde et coll., 2016 ) a été suggérée dans deux revues systématiques, mais le nombre d’essais ayant évalué l’impact sur la qualité de vie est limité. En revanche, l’activité physique avant traitement chirurgical chez des patients atteints de cancer broncho-pulmonaire non à petites cellules ne semble pas montrer d’amélioration sur la qualité de vie (Granger et coll., 2011
) a été suggérée dans deux revues systématiques, mais le nombre d’essais ayant évalué l’impact sur la qualité de vie est limité. En revanche, l’activité physique avant traitement chirurgical chez des patients atteints de cancer broncho-pulmonaire non à petites cellules ne semble pas montrer d’amélioration sur la qualité de vie (Granger et coll., 2011 ), mais le nombre d’essais est limité et les études très hétérogènes. Par ailleurs, deux méta-analyses récentes (Sweegers et coll., 2017
), mais le nombre d’essais est limité et les études très hétérogènes. Par ailleurs, deux méta-analyses récentes (Sweegers et coll., 2017 ; Buffart et coll., 2017
; Buffart et coll., 2017 ) montrent que la prescription de l’activité physique dans des programmes supervisés a un bénéfice supérieur en termes de qualité de vie, comparé à des programmes non-supervisés.
) montrent que la prescription de l’activité physique dans des programmes supervisés a un bénéfice supérieur en termes de qualité de vie, comparé à des programmes non-supervisés. ) et sa prescription par un médecin semblent indispensables. L’augmentation progressive de la dose d’activité physique pour des patients physiquement inactifs et sédentaires l’est aussi. L’association avec un conseil diététique et/ou un soutien psychologique peut être favorable à la qualité de vie. Par exemple, la méta-analyse de Duijts évalue les effets de la pratique d’activité physique auprès de femmes atteintes de cancer du sein pendant et après traitement ainsi que ceux des thérapies cognitivo-comportementales (thérapie cognitive, hypnose, thérapie de soutien, techniques de relaxation, etc.) sur la qualité de vie (Duijts et coll., 2011
) et sa prescription par un médecin semblent indispensables. L’augmentation progressive de la dose d’activité physique pour des patients physiquement inactifs et sédentaires l’est aussi. L’association avec un conseil diététique et/ou un soutien psychologique peut être favorable à la qualité de vie. Par exemple, la méta-analyse de Duijts évalue les effets de la pratique d’activité physique auprès de femmes atteintes de cancer du sein pendant et après traitement ainsi que ceux des thérapies cognitivo-comportementales (thérapie cognitive, hypnose, thérapie de soutien, techniques de relaxation, etc.) sur la qualité de vie (Duijts et coll., 2011 ). Les auteurs se basent sur deux études pour montrer que l’association des techniques cognitivo-comportementales avec un programme d’activité physique pratiqué en groupe dans les suites de traitements, améliore la qualité de vie de manière plus importante que la pratique de l’activité physique seule, ou le recours seul à une thérapie comportementale (Cho et coll., 2006
). Les auteurs se basent sur deux études pour montrer que l’association des techniques cognitivo-comportementales avec un programme d’activité physique pratiqué en groupe dans les suites de traitements, améliore la qualité de vie de manière plus importante que la pratique de l’activité physique seule, ou le recours seul à une thérapie comportementale (Cho et coll., 2006 ; Fillion et coll., 2008
; Fillion et coll., 2008 ). De même, les études de Fong et de Scott montrent qu’une pratique d’activité physique associée à des entretiens motivationnels en face-à-face, complété par un suivi téléphonique, est le moyen le plus efficace de générer un changement positif sur la qualité de vie (Fong et coll., 2012
). De même, les études de Fong et de Scott montrent qu’une pratique d’activité physique associée à des entretiens motivationnels en face-à-face, complété par un suivi téléphonique, est le moyen le plus efficace de générer un changement positif sur la qualité de vie (Fong et coll., 2012  ; Scott et coll., 2014
; Scott et coll., 2014 ). Réfléchir aux conditions d’implémentation est une manière de faire profiter à toutes et tous des bénéfices à court et moyen termes de l’activité physique sur la qualité de vie, quitte à cumuler plusieurs interventions différentes pour les personnes les plus précaires et les plus affectées par un cancer et ses conséquences.
). Réfléchir aux conditions d’implémentation est une manière de faire profiter à toutes et tous des bénéfices à court et moyen termes de l’activité physique sur la qualité de vie, quitte à cumuler plusieurs interventions différentes pour les personnes les plus précaires et les plus affectées par un cancer et ses conséquences. ; Ballard-Barbash et coll., 2012
; Ballard-Barbash et coll., 2012 ). Une amélioration non significative à 8 ans de la survie globale et sans récidive a été suggérée dans l’essai randomisé Start portant sur 242 patientes atteintes de cancer du sein, mais l’essai manquait de puissance (Ballard-Barbash et coll., 2009
). Une amélioration non significative à 8 ans de la survie globale et sans récidive a été suggérée dans l’essai randomisé Start portant sur 242 patientes atteintes de cancer du sein, mais l’essai manquait de puissance (Ballard-Barbash et coll., 2009 ; Courneya, 2014
; Courneya, 2014 ).
). ).
). ; Holick et coll., 2008
; Holick et coll., 2008 ; Irwin et coll., 2008
; Irwin et coll., 2008 ; Sternfeld et coll., 2009
; Sternfeld et coll., 2009 ; Bertram et coll., 2011
; Bertram et coll., 2011 ; Chen et coll., 2011
; Chen et coll., 2011 ; Irwin et coll., 2011b
; Irwin et coll., 2011b ; Beasley et coll., 2012
; Beasley et coll., 2012 ; Bradshaw et coll., 2014
; Bradshaw et coll., 2014 ; Williams, 2014
; Williams, 2014 ) avec entre 933 et 13 302 sujets, ont été incluses dans des méta-analyses (Ibrahim et Al-Homaidh, 2011
) avec entre 933 et 13 302 sujets, ont été incluses dans des méta-analyses (Ibrahim et Al-Homaidh, 2011 ; Schmid et Leitzmann, 2014
; Schmid et Leitzmann, 2014 ; Zhong et coll., 2014
; Zhong et coll., 2014 ; World Cancer Research Fund International, 2014
; World Cancer Research Fund International, 2014 ; Lahart et coll., 2015
; Lahart et coll., 2015 )
) ). La méta-analyse observe également une diminution de la mortalité globale de 46 % (HR 0,54 [0,38-0,76]) et une diminution de la mortalité par cancer du sein de 33 % (HR 0,67 [0,50-0,90]) pour une activité physique post-diagnostic conforme aux recommandations (≥ 8 MET h/semaine) versus une activité physique < 8 MET h/semaine.
). La méta-analyse observe également une diminution de la mortalité globale de 46 % (HR 0,54 [0,38-0,76]) et une diminution de la mortalité par cancer du sein de 33 % (HR 0,67 [0,50-0,90]) pour une activité physique post-diagnostic conforme aux recommandations (≥ 8 MET h/semaine) versus une activité physique < 8 MET h/semaine. ). L’effet bénéfique sur la mortalité globale s’observe aussi bien pour l’activité physique totale (HR 0,63 [0,41-0,97]) que pour l’activité physique de loisir (HR 0,61 [0,52-0,74]). Les résultats des méta-analyses de Zhong et coll. (2014
). L’effet bénéfique sur la mortalité globale s’observe aussi bien pour l’activité physique totale (HR 0,63 [0,41-0,97]) que pour l’activité physique de loisir (HR 0,61 [0,52-0,74]). Les résultats des méta-analyses de Zhong et coll. (2014 ) et de Schmid et Leitzmann (2014
) et de Schmid et Leitzmann (2014 ) regroupent les quatre mêmes études (21 373 femmes) (Holick et coll., 2008
) regroupent les quatre mêmes études (21 373 femmes) (Holick et coll., 2008 ; Irwin et coll., 2008
; Irwin et coll., 2008  ; Irwin et coll., 2011b
; Irwin et coll., 2011b  ; Beasley et coll., 2012
; Beasley et coll., 2012 ) et vont dans le même sens (Zhong et coll., 2014
) et vont dans le même sens (Zhong et coll., 2014 ; Schmid et Leitzmann, 2014
; Schmid et Leitzmann, 2014 ). La pratique d’une activité physique après diagnostic (comparaison des niveaux d’activité les plus élevés aux niveaux les plus bas) est associée à une réduction de la mortalité globale de 48 % (RR = 0,52 [0,42-0,64]) et à une diminution de la mortalité spécifique de 28 % (RR = 0,72 [0,60 -0,85]) (Schmid et Leitzmann, 2014
). La pratique d’une activité physique après diagnostic (comparaison des niveaux d’activité les plus élevés aux niveaux les plus bas) est associée à une réduction de la mortalité globale de 48 % (RR = 0,52 [0,42-0,64]) et à une diminution de la mortalité spécifique de 28 % (RR = 0,72 [0,60 -0,85]) (Schmid et Leitzmann, 2014 ).
). ).
). ; World Cancer Research Fund International, 2014
; World Cancer Research Fund International, 2014 ; Zhong et coll., 2014
; Zhong et coll., 2014 ) rapportent une relation dose-réponse linéaire pour l’activité physique pratiquée en post-diagnostic. Schmid et Leitzmann (2014
) rapportent une relation dose-réponse linéaire pour l’activité physique pratiquée en post-diagnostic. Schmid et Leitzmann (2014 ) décrivent une réduction significative du risque de mortalité globale et spécifique avec l’augmentation du niveau d’activité physique. Ainsi, pour une augmentation de l’activité physique de 5, 10 et 15 MET h/semaine, les auteurs rapportent une diminution de la mortalité globale respectivement de 13 % (RR = 0,87 [0,80-0,94]), 24 % (RR = 0,76 [0,64-0,89]) et 34 % (RR = 0,66 [0,52-0,84]).
) décrivent une réduction significative du risque de mortalité globale et spécifique avec l’augmentation du niveau d’activité physique. Ainsi, pour une augmentation de l’activité physique de 5, 10 et 15 MET h/semaine, les auteurs rapportent une diminution de la mortalité globale respectivement de 13 % (RR = 0,87 [0,80-0,94]), 24 % (RR = 0,76 [0,64-0,89]) et 34 % (RR = 0,66 [0,52-0,84]). ) analysent l’impact de l’évolution de l’activité physique avant et après le diagnostic (3 études, dont deux portant sur le cancer du sein (Irwin et coll., 2008
) analysent l’impact de l’évolution de l’activité physique avant et après le diagnostic (3 études, dont deux portant sur le cancer du sein (Irwin et coll., 2008  ; Irwin et coll., 2011b
; Irwin et coll., 2011b ) et une sur le cancer colorectal (Meyerhardt et coll., 2006a
) et une sur le cancer colorectal (Meyerhardt et coll., 2006a ). Concernant les femmes atteintes de cancer du sein, comparées aux femmes ayant maintenu le même niveau d’activité physique avant et après le diagnostic, l’augmentation du niveau d’activité physique après diagnostic est associée à une diminution significative du risque de mortalité globale (RR = 0,61 [0,46-0,80]) et une diminution non significative du risque de mortalité spécifique (RR = 0,71 [0,45-1,12]). Une baisse du niveau d’activité physique après diagnostic est associée à une augmentation non significative du risque de mortalité globale (RR = 1,72 [0,76-3,87]) et spécifique (RR = 1,28 [0,87-1,90]).
). Concernant les femmes atteintes de cancer du sein, comparées aux femmes ayant maintenu le même niveau d’activité physique avant et après le diagnostic, l’augmentation du niveau d’activité physique après diagnostic est associée à une diminution significative du risque de mortalité globale (RR = 0,61 [0,46-0,80]) et une diminution non significative du risque de mortalité spécifique (RR = 0,71 [0,45-1,12]). Une baisse du niveau d’activité physique après diagnostic est associée à une augmentation non significative du risque de mortalité globale (RR = 1,72 [0,76-3,87]) et spécifique (RR = 1,28 [0,87-1,90]). ). Aucune diminution significative n’est retrouvée pour les femmes non-ménopausées. Les données en fonction du statut des récepteurs hormonaux, notamment des récepteurs d’œstrogènes (ER) sont divergentes (Ibrahim et Al-Homaidh, 2011 ; World Cancer Research Fund International, 2014
). Aucune diminution significative n’est retrouvée pour les femmes non-ménopausées. Les données en fonction du statut des récepteurs hormonaux, notamment des récepteurs d’œstrogènes (ER) sont divergentes (Ibrahim et Al-Homaidh, 2011 ; World Cancer Research Fund International, 2014 ; Lahart et coll., 2015
; Lahart et coll., 2015 ). Schmid et coll. (2014) n’observent pas de différence de bénéfice en fonction de l’IMC, du statut ménopausique et du statut des récepteurs hormonaux (Schmid et Leitzmann, 2014
). Schmid et coll. (2014) n’observent pas de différence de bénéfice en fonction de l’IMC, du statut ménopausique et du statut des récepteurs hormonaux (Schmid et Leitzmann, 2014 ). Ces auteurs ne retrouvent pas non plus de différence de bénéfice, en fonction de l’ajustement ou non sur le traitement du cancer et le tabagisme.
). Ces auteurs ne retrouvent pas non plus de différence de bénéfice, en fonction de l’ajustement ou non sur le traitement du cancer et le tabagisme. ; Je et coll., 2013
; Je et coll., 2013 ; Schmid et Leitzmann, 2014
; Schmid et Leitzmann, 2014 ; Wu et coll., 2016
; Wu et coll., 2016 ). Les trois premières méta-analyses regroupent six études prospectives avec 6 348 patients (Meyerhardt et coll., 2006a
). Les trois premières méta-analyses regroupent six études prospectives avec 6 348 patients (Meyerhardt et coll., 2006a ; Meyerhardt et coll., 2006b
; Meyerhardt et coll., 2006b ; Meyerhardt et coll., 2009
; Meyerhardt et coll., 2009 ; Baade et coll., 2011
; Baade et coll., 2011 ; Kuiper et coll., 2012
; Kuiper et coll., 2012 ; Campbell et coll., 2013
; Campbell et coll., 2013 ), la méta-analyse de Wu inclut en plus l’étude de Arem et coll. (Arem et coll., 2016
), la méta-analyse de Wu inclut en plus l’étude de Arem et coll. (Arem et coll., 2016 ).
). ; Je et coll., 2013
; Je et coll., 2013 ; Schmid et Leitzmann, 2014
; Schmid et Leitzmann, 2014 ; Wu et coll., 2016
; Wu et coll., 2016 ). Dans les méta-analyses de Je et de Wu, une diminution significative de la mortalité globale est également observée pour les actifs (tous niveaux d’activité physique regroupés) versus les inactifs avec des RR respectivement de 0,76 [0,64-0,90] et de 0,71 [0,63-0,81] (Je et coll., 2013
). Dans les méta-analyses de Je et de Wu, une diminution significative de la mortalité globale est également observée pour les actifs (tous niveaux d’activité physique regroupés) versus les inactifs avec des RR respectivement de 0,76 [0,64-0,90] et de 0,71 [0,63-0,81] (Je et coll., 2013 ; Wu et coll., 2016
; Wu et coll., 2016 ). Une activité physique post-diagnostic (de niveau élevé versus faible) permet également une diminution significative de la mortalité spécifique de 35 % à 44 % selon les méta-analyses (Je et coll., 2013
). Une activité physique post-diagnostic (de niveau élevé versus faible) permet également une diminution significative de la mortalité spécifique de 35 % à 44 % selon les méta-analyses (Je et coll., 2013 ; Des Guetz et coll., 2013
; Des Guetz et coll., 2013 ; Schmid et Leitzmann, 2014
; Schmid et Leitzmann, 2014 ; Wu et coll., 2016
; Wu et coll., 2016 ). Les bénéfices de l’activité physique observés dans l’étude de Meyerhardt (668 hommes, âge médian 70 ans, stades I-III), comparables aux résultats des méta-analyses, en termes de diminution de la mortalité globale et spécifique (RR 0,59 [0,41-0,86] et 0,47 [0,24-0,92], respectivement pour une activité physique ≥ 27 MET h/semaine comparée à une activité physique < 3 MET h/semaine), se traduisent par un gain de survie globale à 10 ans de 9 % (Meyerhardt et coll., 2009
). Les bénéfices de l’activité physique observés dans l’étude de Meyerhardt (668 hommes, âge médian 70 ans, stades I-III), comparables aux résultats des méta-analyses, en termes de diminution de la mortalité globale et spécifique (RR 0,59 [0,41-0,86] et 0,47 [0,24-0,92], respectivement pour une activité physique ≥ 27 MET h/semaine comparée à une activité physique < 3 MET h/semaine), se traduisent par un gain de survie globale à 10 ans de 9 % (Meyerhardt et coll., 2009 ).
). ; Kenfield et coll., 2011
; Kenfield et coll., 2011 ; Bonn et coll., 2015
; Bonn et coll., 2015 ; Friedenreich et coll., 2016
; Friedenreich et coll., 2016 ), mais n’ont pas fait l’objet d’une méta-analyse.
), mais n’ont pas fait l’objet d’une méta-analyse. ). Une diminution significative de la mortalité spécifique a été observée pour la marche ou le vélo > 20 min/jour (HR = 0,61 [0,43-0,87]) et de l’exercice physique ≥ 1 h par semaine (HR = 0,68 [0,48-0,94]). Enfin, Friedenreich et coll. (2016), dans une étude prospective de 835 patients atteints de cancer de la prostate (stades II-IV, âge moyen 67,3 ans, suivi médian 15,5 ans), rapportent une diminution significative de la mortalité globale associée à un niveau d’activité physique plus élevé, avec une relation dose-réponse pour l’activité physique totale (diminution de 42 % pour une activité physique > 119 versus < 42 MET h/semaine, p < 0,01), l’activité physique de loisir, l’activité physique professionnelle, l’activité physique intense (≥ 6 MET). Pour la mortalité spécifique, seule l’activité physique de loisir montre un effet significatif, avec une relation dose-réponse (diminution de 40 % pour activité physique > 13 versus < 4 MET h/semaine, p trend 0,01) (Friedenreich et coll., 2016
). Une diminution significative de la mortalité spécifique a été observée pour la marche ou le vélo > 20 min/jour (HR = 0,61 [0,43-0,87]) et de l’exercice physique ≥ 1 h par semaine (HR = 0,68 [0,48-0,94]). Enfin, Friedenreich et coll. (2016), dans une étude prospective de 835 patients atteints de cancer de la prostate (stades II-IV, âge moyen 67,3 ans, suivi médian 15,5 ans), rapportent une diminution significative de la mortalité globale associée à un niveau d’activité physique plus élevé, avec une relation dose-réponse pour l’activité physique totale (diminution de 42 % pour une activité physique > 119 versus < 42 MET h/semaine, p < 0,01), l’activité physique de loisir, l’activité physique professionnelle, l’activité physique intense (≥ 6 MET). Pour la mortalité spécifique, seule l’activité physique de loisir montre un effet significatif, avec une relation dose-réponse (diminution de 40 % pour activité physique > 13 versus < 4 MET h/semaine, p trend 0,01) (Friedenreich et coll., 2016 ).
). ). Une analyse poolée de 57 études portant sur l’effet de l’activité physique sur la mortalité spécifique et incluant des patients avec différents types de tumeurs solides, essentiellement des cancers du sein et du côlon, rapporte un effet plus important pour l’activité physique post-diagnostic (HR 0,60 [0,50-0,71], I2 = 53,8 %) comparé à l’activité physique pré-diagnostic (HR = 0,86 [0,80-0,90], I2 = 16,7 %) (Li et coll., 2016
). Une analyse poolée de 57 études portant sur l’effet de l’activité physique sur la mortalité spécifique et incluant des patients avec différents types de tumeurs solides, essentiellement des cancers du sein et du côlon, rapporte un effet plus important pour l’activité physique post-diagnostic (HR 0,60 [0,50-0,71], I2 = 53,8 %) comparé à l’activité physique pré-diagnostic (HR = 0,86 [0,80-0,90], I2 = 16,7 %) (Li et coll., 2016 ). Deux études prospectives suggèrent un bénéfice significatif de l’activité physique pré-diagnostic sur la survie après un cancer de l’ovaire (Zhou et coll., 2014
). Deux études prospectives suggèrent un bénéfice significatif de l’activité physique pré-diagnostic sur la survie après un cancer de l’ovaire (Zhou et coll., 2014 ; Cannioto et coll., 2016
; Cannioto et coll., 2016 ), mais le bénéfice de l’activité physique après diagnostic sur la survie n’a pas été évalué.
), mais le bénéfice de l’activité physique après diagnostic sur la survie n’a pas été évalué. ).
). ; Duggan et coll., 2011
; Duggan et coll., 2011 ). Un taux sanguin augmenté d’Insulin-like Growth Factor-1 (IGF-1) est associé à un mauvais pronostic (Vadgama et coll., 1999
). Un taux sanguin augmenté d’Insulin-like Growth Factor-1 (IGF-1) est associé à un mauvais pronostic (Vadgama et coll., 1999 ; Hartog et coll., 2013
; Hartog et coll., 2013 ) et une augmentation de la mortalité globale (Duggan et coll., 2013
) et une augmentation de la mortalité globale (Duggan et coll., 2013 ). L’insuline est impliquée dans la croissance tumorale et l’inhibition de l’apoptose secondaires à l’augmentation de synthèse et d’activité de l’IGF-1 (Pollak, 2008
). L’insuline est impliquée dans la croissance tumorale et l’inhibition de l’apoptose secondaires à l’augmentation de synthèse et d’activité de l’IGF-1 (Pollak, 2008 ). L’association entre l’obésité, l’augmentation des taux d’IGF-1 et le développement et/ou la progression du cancer est bien établie. Des réponses biologiques à l’IGF-1 impliquent une augmentation de la prolifération tumorale et du caractère invasif, une résistance à l’apoptose et la promotion d’un microenvironnement tumoral inflammatoire. L’IGF Binding Protein-3 (IGFBP-3) a un effet favorable sur l’induction de l’apoptose et l’inhibition de la croissance cellulaire.
). L’association entre l’obésité, l’augmentation des taux d’IGF-1 et le développement et/ou la progression du cancer est bien établie. Des réponses biologiques à l’IGF-1 impliquent une augmentation de la prolifération tumorale et du caractère invasif, une résistance à l’apoptose et la promotion d’un microenvironnement tumoral inflammatoire. L’IGF Binding Protein-3 (IGFBP-3) a un effet favorable sur l’induction de l’apoptose et l’inhibition de la croissance cellulaire. ; Löf et coll., 2012
; Löf et coll., 2012 ; Meneses-Echavez et coll., 2016
; Meneses-Echavez et coll., 2016 ; Kang et coll., 2017
; Kang et coll., 2017 ). Une méta-analyse de 5 essais randomisés (Meneses-Echavez et coll., 2016
). Une méta-analyse de 5 essais randomisés (Meneses-Echavez et coll., 2016 ) incluant au total 235 patientes atteintes de cancer du sein (48 ± 3,2 ans), rapporte une diminution significative associée à l’activité physique après traitement adjuvant des taux circulants d’IGF-1, d’IGF-2, et une augmentation d’IGFBP-1 (IGF Binding Protein-1) et d’IGFBP-3, de l’insulinémie à jeun et de la résistance à l’insuline. Une méta-analyse de 7 essais randomisés incluant 369 patientes atteintes de cancer du sein décrit une diminution significative de l’insulinémie, mais n’observe pas de différence significative en termes de résistance à l’insuline (5 études), de taux d’IGF-1 (4 études) et d’IGFBP-3 (4 études) (Kang et coll., 2017
) incluant au total 235 patientes atteintes de cancer du sein (48 ± 3,2 ans), rapporte une diminution significative associée à l’activité physique après traitement adjuvant des taux circulants d’IGF-1, d’IGF-2, et une augmentation d’IGFBP-1 (IGF Binding Protein-1) et d’IGFBP-3, de l’insulinémie à jeun et de la résistance à l’insuline. Une méta-analyse de 7 essais randomisés incluant 369 patientes atteintes de cancer du sein décrit une diminution significative de l’insulinémie, mais n’observe pas de différence significative en termes de résistance à l’insuline (5 études), de taux d’IGF-1 (4 études) et d’IGFBP-3 (4 études) (Kang et coll., 2017 ). Les différences observées entre les deux méta-analyses, intégrant en grande partie les mêmes études, sont partiellement expliquées par l’utilisation de différentes mesures pour estimer la taille de l’effet : différence moyenne pondérée (Kang et coll., 2017
). Les différences observées entre les deux méta-analyses, intégrant en grande partie les mêmes études, sont partiellement expliquées par l’utilisation de différentes mesures pour estimer la taille de l’effet : différence moyenne pondérée (Kang et coll., 2017 ) et différence moyenne standardisée (Meneses-Echavez et coll., 2016
) et différence moyenne standardisée (Meneses-Echavez et coll., 2016 ). Cette dernière semble préférable pour les études dont les critères de jugement, continus, sont semblables mais utilisent des outils de mesure différents.
). Cette dernière semble préférable pour les études dont les critères de jugement, continus, sont semblables mais utilisent des outils de mesure différents. ; Löf et coll., 2012
; Löf et coll., 2012 ). Si les taux plasmatiques d’IGF-1 sont soit augmentés, soit diminués, on retrouve de manière plus reproductible une augmentation des taux plasmatiques d’IGFBP-3, cohérente avec une baisse de la disponibilité d’IGF-1 libre biologiquement actif (Inca, 2017
). Si les taux plasmatiques d’IGF-1 sont soit augmentés, soit diminués, on retrouve de manière plus reproductible une augmentation des taux plasmatiques d’IGFBP-3, cohérente avec une baisse de la disponibilité d’IGF-1 libre biologiquement actif (Inca, 2017 ).
). ).
). ).
). ).
). ). La méta-analyse de Meneses-Echávez et coll. (2016) ayant analysé 8 essais randomisés, incluant 475 femmes atteintes de cancer du sein (54 ± 4 ans), rapporte une diminution significative des taux d’IL6 (8 études), de TNFα (6 études) et d’IL8 (4 études), mais pas de différence significative des taux d’IL2 (2 études), d’IL10 (2 études) et de CRP (2 études) (Meneses-Echavez et coll., 2016
). La méta-analyse de Meneses-Echávez et coll. (2016) ayant analysé 8 essais randomisés, incluant 475 femmes atteintes de cancer du sein (54 ± 4 ans), rapporte une diminution significative des taux d’IL6 (8 études), de TNFα (6 études) et d’IL8 (4 études), mais pas de différence significative des taux d’IL2 (2 études), d’IL10 (2 études) et de CRP (2 études) (Meneses-Echavez et coll., 2016 ).
). ).
). ).
). ). La méta-analyse de Kang et coll. (2017), sur la base de trois essais randomisés (65 patients) rapporte une augmentation non significative du taux d’adiponectine associé à l’activité physique (Kang et coll., 2017
). La méta-analyse de Kang et coll. (2017), sur la base de trois essais randomisés (65 patients) rapporte une augmentation non significative du taux d’adiponectine associé à l’activité physique (Kang et coll., 2017 ).
). ; Kim et coll., 2013a
; Kim et coll., 2013a ). À notre connaissance, aucune étude n’a évalué l’effet de l’activité physique sur le taux d’estradiol chez les femmes atteintes de cancer du sein.
). À notre connaissance, aucune étude n’a évalué l’effet de l’activité physique sur le taux d’estradiol chez les femmes atteintes de cancer du sein. ). Cependant, la question de savoir si la modulation du système immunitaire contribue aux propriétés antitumorales potentielles de l’exercice n’a pas été examinée en profondeur (Goh et coll., 2014
). Cependant, la question de savoir si la modulation du système immunitaire contribue aux propriétés antitumorales potentielles de l’exercice n’a pas été examinée en profondeur (Goh et coll., 2014 ).
). ).
). ; Schmitz et coll., 2010
; Schmitz et coll., 2010 ; Jones, 2011
; Jones, 2011 ; Crandall et coll., 2014
; Crandall et coll., 2014 ; Gardner et coll., 2014 ; Meneses-Echavez et coll., 2015b
; Gardner et coll., 2014 ; Meneses-Echavez et coll., 2015b  ; Dennett et coll., 2016
; Dennett et coll., 2016  ; Furmaniak et coll., 2016
; Furmaniak et coll., 2016 ). La fréquence des effets secondaires dans le bras intervention semble comparable à celle du bras contrôle ou de la population générale (Morey et coll., 2009
). La fréquence des effets secondaires dans le bras intervention semble comparable à celle du bras contrôle ou de la population générale (Morey et coll., 2009 ; Bourke et coll., 2016
; Bourke et coll., 2016 ). Jones (2011
). Jones (2011 ) a revu 118 études d’activité physique (44 % d’essais randomisés ; 5 529 patients atteints de cancer (36 % cancer du sein, 20 % cancer du poumon et 34 % incluant plusieurs types de tumeurs solides), âge moyen 53 ± 11 ans, 56 % de femmes) (Jones, 2011
) a revu 118 études d’activité physique (44 % d’essais randomisés ; 5 529 patients atteints de cancer (36 % cancer du sein, 20 % cancer du poumon et 34 % incluant plusieurs types de tumeurs solides), âge moyen 53 ± 11 ans, 56 % de femmes) (Jones, 2011 ). La majorité des études portait sur l’activité physique après chirurgie, dont 41 % pendant et 24 % après les traitements adjuvants. Seules 16 études (14 %) avaient évalué spécifiquement les effets indésirables et avaient enregistré, au total, 101 effets indésirables très variés (88 durant un test d’exercice et 13 durant l’activité physique), correspondant à un taux de 6,3 %. Pendant les tests d’exercice, les effets indésirables les plus fréquents étaient cardiovasculaires (64 %, sous-décalage du segment ST (n = 32), réponse réduite de la fréquence cardiaque ou de la pression artérielle (n = 13), ischémie (n = 11)) et des douleurs (13 %). Les 13 effets indésirables survenus durant l’exercice, dont un décès (cause de décès non précisée), étaient de nature et de gravité très variables.
). La majorité des études portait sur l’activité physique après chirurgie, dont 41 % pendant et 24 % après les traitements adjuvants. Seules 16 études (14 %) avaient évalué spécifiquement les effets indésirables et avaient enregistré, au total, 101 effets indésirables très variés (88 durant un test d’exercice et 13 durant l’activité physique), correspondant à un taux de 6,3 %. Pendant les tests d’exercice, les effets indésirables les plus fréquents étaient cardiovasculaires (64 %, sous-décalage du segment ST (n = 32), réponse réduite de la fréquence cardiaque ou de la pression artérielle (n = 13), ischémie (n = 11)) et des douleurs (13 %). Les 13 effets indésirables survenus durant l’exercice, dont un décès (cause de décès non précisée), étaient de nature et de gravité très variables. ) ont renseigné les effets indésirables. Au total, 13 effets indésirables pour 571 patients adultes (2,3 %) ont été rapportés, deux au cours de tests d’exercices cardiorespiratoires, neuf au cours de l’activité physique, dont un infarctus du myocarde, ainsi que deux chez des patients des groupes contrôle (Jones, 2011
) ont renseigné les effets indésirables. Au total, 13 effets indésirables pour 571 patients adultes (2,3 %) ont été rapportés, deux au cours de tests d’exercices cardiorespiratoires, neuf au cours de l’activité physique, dont un infarctus du myocarde, ainsi que deux chez des patients des groupes contrôle (Jones, 2011 ). Parmi les 82 études incluses dans la méta-analyse de Speck et coll. (2010, voir ci-dessus), 36 (44 %) ont documenté la présence ou l’absence d’effets secondaires durant l’intervention d’activité physique, dont 29 (80 %) rapportent l’absence d’effets indésirables (Speck et coll., 2010
). Parmi les 82 études incluses dans la méta-analyse de Speck et coll. (2010, voir ci-dessus), 36 (44 %) ont documenté la présence ou l’absence d’effets secondaires durant l’intervention d’activité physique, dont 29 (80 %) rapportent l’absence d’effets indésirables (Speck et coll., 2010 ). Morey et coll. (2009) dans leur essai randomisé de 641 patients (survivants d’un cancer colorectal, du sein ou de la prostate, âgés de 65 à 91 ans, IMC ≥ 25 et < 40), rapportent 201 événements, sans différence entre les 2 bras. Seuls 5 effets étaient attribuables à l’activité physique (Morey et coll., 2009
). Morey et coll. (2009) dans leur essai randomisé de 641 patients (survivants d’un cancer colorectal, du sein ou de la prostate, âgés de 65 à 91 ans, IMC ≥ 25 et < 40), rapportent 201 événements, sans différence entre les 2 bras. Seuls 5 effets étaient attribuables à l’activité physique (Morey et coll., 2009 ).
). ). D’autres effets secondaires sans impact sur la participation, incluaient des douleurs du dos, des jambes ou des inconforts post exercice. Les effets secondaires ne sont pas augmentés par l’activité physique comparés au bras contrôle et ne diffèrent pas en fonction du type et de l’intensité de l’activité physique.
). D’autres effets secondaires sans impact sur la participation, incluaient des douleurs du dos, des jambes ou des inconforts post exercice. Les effets secondaires ne sont pas augmentés par l’activité physique comparés au bras contrôle et ne diffèrent pas en fonction du type et de l’intensité de l’activité physique. ) ayant évalué l’activité physique en pré- et/ou post-opératoire, neuf études (45 %) ont évalué les effets indésirables de l’activité physique. Seuls deux essais rapportent des complications attribuables à l’activité physique : une baisse de la pression artérielle systolique supérieure à 20 mmHg chez deux patients et des douleurs ostéo-articulaires chez trois patients ; les sept autres études ne rapportent aucun effet indésirable. Chez les femmes atteintes de cancer du sein, plusieurs essais randomisés et méta-analyses (McNeely et coll., 2010
) ayant évalué l’activité physique en pré- et/ou post-opératoire, neuf études (45 %) ont évalué les effets indésirables de l’activité physique. Seuls deux essais rapportent des complications attribuables à l’activité physique : une baisse de la pression artérielle systolique supérieure à 20 mmHg chez deux patients et des douleurs ostéo-articulaires chez trois patients ; les sept autres études ne rapportent aucun effet indésirable. Chez les femmes atteintes de cancer du sein, plusieurs essais randomisés et méta-analyses (McNeely et coll., 2010 ; Cheema et coll., 2014
; Cheema et coll., 2014 ; Paramanandam et Roberts, 2014
; Paramanandam et Roberts, 2014 ; Keilani et coll., 2016
; Keilani et coll., 2016 ; Singh et coll., 2016b
; Singh et coll., 2016b ) montrent l’absence de complications ou de détérioration du lymphœdème associées à la pratique d’une activité physique pendant ou après le traitement adjuvant (voir ci-dessus).
) montrent l’absence de complications ou de détérioration du lymphœdème associées à la pratique d’une activité physique pendant ou après le traitement adjuvant (voir ci-dessus). ; Segal et coll., 2017
; Segal et coll., 2017 ) concluent, sur la base des données de la littérature, que la pratique d’une activité physique est sans risque pour des patients atteints de cancer, pendant et après les traitements, et que la fréquence des effets indésirables est similaire à celle observée chez des personnes indemnes de cancer. Il n’existe pas de contre-indications absolues à la pratique d’une activité physique. Il est nécessaire d’évaluer en préalable à la pratique d’une activité physique les comorbidités, notamment cardiovasculaires, et effets latents des traitements pouvant engendrer un risque pour le patient, et adapter l’activité physique aux conditions du patient (Schmitz et coll., 2010
) concluent, sur la base des données de la littérature, que la pratique d’une activité physique est sans risque pour des patients atteints de cancer, pendant et après les traitements, et que la fréquence des effets indésirables est similaire à celle observée chez des personnes indemnes de cancer. Il n’existe pas de contre-indications absolues à la pratique d’une activité physique. Il est nécessaire d’évaluer en préalable à la pratique d’une activité physique les comorbidités, notamment cardiovasculaires, et effets latents des traitements pouvant engendrer un risque pour le patient, et adapter l’activité physique aux conditions du patient (Schmitz et coll., 2010 ; Segal et coll., 2017
; Segal et coll., 2017 ; Inca, 2017
; Inca, 2017  ; NCCN, 2017
; NCCN, 2017 ).
). ; Rock et coll., 2012
; Rock et coll., 2012 ; Brown et Schmitz, 2014
; Brown et Schmitz, 2014 ; Bouillet et coll., 2015
; Bouillet et coll., 2015 ; Inca, 2017
; Inca, 2017  ; NCCN, 2017
; NCCN, 2017 ) ont établi des recommandations listant les situations cliniques, les comorbidités et les médications représentant des contre-indications relatives ou temporaires à la pratique d’une activité physique et nécessitant en conséquence une adaptation des exercices. Les états suivants constituent des contre-indications à l’exercice physique : fatigue extrême, anémie prononcée (hémoglobine ≤ 8 g.dL-1), plaquettes < 50 000/mm3, leucocytes < 1 500/mm3, suites précoces de chirurgie (risque de déhiscence de cicatrice, d’hémorragie), syndrome infectieux sévère en cours d’évolution, décompensation de pathologie cardiopulmonaire, lésions osseuses lytiques du rachis ou des os longs (la contre-indication concerne la mobilisation du membre atteint), dénutrition sévère. Si ces situations représentent des contre-indications à la pratique d’une activité physique, la majorité peuvent être temporaires.
) ont établi des recommandations listant les situations cliniques, les comorbidités et les médications représentant des contre-indications relatives ou temporaires à la pratique d’une activité physique et nécessitant en conséquence une adaptation des exercices. Les états suivants constituent des contre-indications à l’exercice physique : fatigue extrême, anémie prononcée (hémoglobine ≤ 8 g.dL-1), plaquettes < 50 000/mm3, leucocytes < 1 500/mm3, suites précoces de chirurgie (risque de déhiscence de cicatrice, d’hémorragie), syndrome infectieux sévère en cours d’évolution, décompensation de pathologie cardiopulmonaire, lésions osseuses lytiques du rachis ou des os longs (la contre-indication concerne la mobilisation du membre atteint), dénutrition sévère. Si ces situations représentent des contre-indications à la pratique d’une activité physique, la majorité peuvent être temporaires. ). Les patients présentant une fatigue importante peuvent être encouragés à pratiquer 10 min d’exercice de faible intensité par jour.
). Les patients présentant une fatigue importante peuvent être encouragés à pratiquer 10 min d’exercice de faible intensité par jour. ) ;
) ; ).
). ).
). ; Sebio et coll., 2016
; Sebio et coll., 2016 ; Mainini et coll., 2016
; Mainini et coll., 2016 . Ni et coll. (2016
. Ni et coll. (2016 ), dans une méta-analyse de 15 études (350 patients, âge 54-70 ans), rapportent une diminution significative de la durée d’hospitalisation de 5 jours et des complications post-opératoires, associée à l’activité physique en pré-opératoire. La méta-analyse de Sebio-Garcia (Sebio et coll., 2016
), dans une méta-analyse de 15 études (350 patients, âge 54-70 ans), rapportent une diminution significative de la durée d’hospitalisation de 5 jours et des complications post-opératoires, associée à l’activité physique en pré-opératoire. La méta-analyse de Sebio-Garcia (Sebio et coll., 2016 ), sur la base de 21 études (1 189 patients, âge moyen 64,6 ans), rapporte une amélioration significative de la fonction pulmonaire et une diminution significative de l’hospitalisation post-opératoire de 5 jours. Mainini et coll. (2016), dans une revue qualitative de six études, concluent que les données sont hétérogènes et ne permettent pas de trancher sur le type d’activité physique pré-opératoire le plus approprié (Mainini et coll., 2016
), sur la base de 21 études (1 189 patients, âge moyen 64,6 ans), rapporte une amélioration significative de la fonction pulmonaire et une diminution significative de l’hospitalisation post-opératoire de 5 jours. Mainini et coll. (2016), dans une revue qualitative de six études, concluent que les données sont hétérogènes et ne permettent pas de trancher sur le type d’activité physique pré-opératoire le plus approprié (Mainini et coll., 2016 ). Boereboom et coll. (2016), dans une revue qualitative de 8 études (âge 58-70 ans) dans le cancer colorectal, concluent à une amélioration de la condition physique pré-opératoire, mais les données sont insuffisantes pour conclure à une diminution du risque péri-opératoire ou une amélioration des résultats post-opératoires (Boereboom et coll., 2016
). Boereboom et coll. (2016), dans une revue qualitative de 8 études (âge 58-70 ans) dans le cancer colorectal, concluent à une amélioration de la condition physique pré-opératoire, mais les données sont insuffisantes pour conclure à une diminution du risque péri-opératoire ou une amélioration des résultats post-opératoires (Boereboom et coll., 2016 ). Une revue systématique de 4 études de petite taille ayant évalué l’activité physique concomitante à des traitements néo-adjuvants dans le cancer du sein (3 études) et cancer du rectum localement avancé (1 études), montre la faisabilité de l’activité physique et une bonne observance (Loughney et coll., 2016
). Une revue systématique de 4 études de petite taille ayant évalué l’activité physique concomitante à des traitements néo-adjuvants dans le cancer du sein (3 études) et cancer du rectum localement avancé (1 études), montre la faisabilité de l’activité physique et une bonne observance (Loughney et coll., 2016 ). En revanche, les auteurs concluent à l’insuffisance des données pour juger de l’impact sur d’autres paramètres. Dans le cancer de la prostate, la pratique d’une activité physique préalable à une prostatectomie pourrait prévenir le risque d’incontinence, mais l’impact sur la réduction des effets indésirables post-chirurgie ou post-radiothérapie reste à confirmer (Inca, 2017
). En revanche, les auteurs concluent à l’insuffisance des données pour juger de l’impact sur d’autres paramètres. Dans le cancer de la prostate, la pratique d’une activité physique préalable à une prostatectomie pourrait prévenir le risque d’incontinence, mais l’impact sur la réduction des effets indésirables post-chirurgie ou post-radiothérapie reste à confirmer (Inca, 2017 ).
). ; Fassier et coll., 2016
; Fassier et coll., 2016 ). Le fait d’avoir un cancer à un stade avancé, de recevoir une chimiothérapie, la fatigue et des douleurs sont des facteurs associés à une baisse plus importante de l’activité physique. Les méta-analyses montrent de façon convergente de nombreux bénéfices et l’absence de risque à pratiquer une activité physique en post-opératoire et pendant la phase de traitement par chimiothérapie, hormonothérapie et radiothérapie. Les bénéfices démontrés concernent notamment l’amélioration des capacités cardiorespiratoires, de la force musculaire, de la qualité de vie et la réduction de la fatigue. Il a été suggéré que l’activité physique pendant les traitements contribue à contenir l’installation de la fatigue, alors qu’après les traitements, l’activité physique favorise la récupération (Puetz et Herring, 2012
). Le fait d’avoir un cancer à un stade avancé, de recevoir une chimiothérapie, la fatigue et des douleurs sont des facteurs associés à une baisse plus importante de l’activité physique. Les méta-analyses montrent de façon convergente de nombreux bénéfices et l’absence de risque à pratiquer une activité physique en post-opératoire et pendant la phase de traitement par chimiothérapie, hormonothérapie et radiothérapie. Les bénéfices démontrés concernent notamment l’amélioration des capacités cardiorespiratoires, de la force musculaire, de la qualité de vie et la réduction de la fatigue. Il a été suggéré que l’activité physique pendant les traitements contribue à contenir l’installation de la fatigue, alors qu’après les traitements, l’activité physique favorise la récupération (Puetz et Herring, 2012  ; Inca, 2017
; Inca, 2017 ).
). ).
). ; Mishra et coll., 2012b
; Mishra et coll., 2012b  ; Carayol et coll., 2013
; Carayol et coll., 2013  ; Dennett et coll., 2016
; Dennett et coll., 2016 ). Comparé à un niveau d’intensité élevé, une activité physique de niveau modéré à intense semble favoriser l’adhésion des patients et le maintien dans la durée (Segal et coll., 2017
). Comparé à un niveau d’intensité élevé, une activité physique de niveau modéré à intense semble favoriser l’adhésion des patients et le maintien dans la durée (Segal et coll., 2017 ). En revanche, le bénéfice d’activité physique de faible intensité 7n’a pas montré de bénéfice sur la réduction du niveau de fatigue comparé à des groupes contrôles (Cramp et Byron-Daniel, 2012
). En revanche, le bénéfice d’activité physique de faible intensité 7n’a pas montré de bénéfice sur la réduction du niveau de fatigue comparé à des groupes contrôles (Cramp et Byron-Daniel, 2012  ; Buffart et coll., 2012
; Buffart et coll., 2012 ). Trois méta-analyses montrent que la prescription de l’activité physique dans des programmes supervisés (Sweegers et coll., 2017
). Trois méta-analyses montrent que la prescription de l’activité physique dans des programmes supervisés (Sweegers et coll., 2017  ; Buffart et coll., 2017
; Buffart et coll., 2017 ) ou semi-supervisés (Bluethmann et coll., 2015
) ou semi-supervisés (Bluethmann et coll., 2015 ) a un bénéfice supérieur comparé à des programmes non-supervisés en termes de capacité physique et de qualité de vie (Sweegers et coll., 2017
) a un bénéfice supérieur comparé à des programmes non-supervisés en termes de capacité physique et de qualité de vie (Sweegers et coll., 2017  ; Buffart et coll., 2017
; Buffart et coll., 2017 ) et de changement de pratiques d’activité physique (Bluethmann et coll., 2015
) et de changement de pratiques d’activité physique (Bluethmann et coll., 2015 ).
). ; Sasso et coll., 2015
; Sasso et coll., 2015  ; Inca, 2017
; Inca, 2017  ; Segal et coll., 2017
; Segal et coll., 2017 ). D’après les données de plusieurs méta-analyses, un programme d’activité physique combinant activité aérobie et renforcement musculaire a un effet plus important sur l’IMC, la masse musculaire et la composition corporelle qu’une activité aérobie seule (McNeely et coll., 2006
). D’après les données de plusieurs méta-analyses, un programme d’activité physique combinant activité aérobie et renforcement musculaire a un effet plus important sur l’IMC, la masse musculaire et la composition corporelle qu’une activité aérobie seule (McNeely et coll., 2006 ; Kim et coll., 2009
; Kim et coll., 2009  ; Speck et coll., 2010
; Speck et coll., 2010  ; Wolin et coll., 2010
; Wolin et coll., 2010  ; Fong et coll., 2012
; Fong et coll., 2012  ; Inca, 2017
; Inca, 2017 ). La combinaison optimale des deux types d’activité physique reste à déterminer (Sasso et coll., 2015
). La combinaison optimale des deux types d’activité physique reste à déterminer (Sasso et coll., 2015 ). La méta-analyse de Kim et coll. (2009), sur la base d’une analyse en sous-groupes, rapporte un effet plus important sur la masse musculaire et le pourcentage de masse grasse lorsque l’activité physique est réalisée pendant les traitements comparé à l’activité physique débutée après traitement (Kim et coll., 2009
). La méta-analyse de Kim et coll. (2009), sur la base d’une analyse en sous-groupes, rapporte un effet plus important sur la masse musculaire et le pourcentage de masse grasse lorsque l’activité physique est réalisée pendant les traitements comparé à l’activité physique débutée après traitement (Kim et coll., 2009 ).
). ). Les taux de survie à 5 ans, tous stades confondus, se situent entre 80 et 90 % pour les cancers du sein et de la prostate et de 50 à 60 % pour le cancer colorectal. Les symptômes, tels que la fatigue, une capacité cardiovasculaire et une force musculaire réduites, une diminution de la qualité de vie, des douleurs, un lymphœdème et une neuropathie peuvent perdurer dans le temps. Selon l’INCa (étude VICAN5), 50 % des personnes rapportent une fatigue cliniquement significative 5 ans après un cancer.
). Les taux de survie à 5 ans, tous stades confondus, se situent entre 80 et 90 % pour les cancers du sein et de la prostate et de 50 à 60 % pour le cancer colorectal. Les symptômes, tels que la fatigue, une capacité cardiovasculaire et une force musculaire réduites, une diminution de la qualité de vie, des douleurs, un lymphœdème et une neuropathie peuvent perdurer dans le temps. Selon l’INCa (étude VICAN5), 50 % des personnes rapportent une fatigue cliniquement significative 5 ans après un cancer. ; Eakin et coll., 2007
; Eakin et coll., 2007 ). Selon l’enquête française Vican2 « La vie deux ans après un diagnostic de cancer », menée en France en 2012 auprès de 4 349 patients atteints de cancer, parmi les personnes qui avaient au moment du diagnostic une activité physique régulière (domestique et/ou professionnelle), la moitié ont diminué ou arrêté l’activité physique. Seuls 10 % l’ont augmentée (Inca, 2014
). Selon l’enquête française Vican2 « La vie deux ans après un diagnostic de cancer », menée en France en 2012 auprès de 4 349 patients atteints de cancer, parmi les personnes qui avaient au moment du diagnostic une activité physique régulière (domestique et/ou professionnelle), la moitié ont diminué ou arrêté l’activité physique. Seuls 10 % l’ont augmentée (Inca, 2014 ). L’étude de cohorte française Nutrinet a comparé l’activité physique avant diagnostic à l’activité physique post-diagnostic chez 942 patients atteints de cancer (âge moyen 59 ans, temps de suivi moyen 42 ± 16,7 mois). Les principales localisations concernaient le cancer du sein (n = 342), de la prostate (n = 152), de la peau (n = 102), et du côlon-rectum (n = 64). Le niveau d’activité physique totale et l’activité physique intense diminuaient de façon significative après le diagnostic, notamment chez les patients de plus de 60 ans, les hommes et les patients ayant arrêté leur activité professionnelle. Une augmentation significative de la sédentarité, notamment chez les femmes, les patients de plus de 60 ans et les patients ayant arrêté leur activité professionnelle est observée (Fassier et coll., 2016
). L’étude de cohorte française Nutrinet a comparé l’activité physique avant diagnostic à l’activité physique post-diagnostic chez 942 patients atteints de cancer (âge moyen 59 ans, temps de suivi moyen 42 ± 16,7 mois). Les principales localisations concernaient le cancer du sein (n = 342), de la prostate (n = 152), de la peau (n = 102), et du côlon-rectum (n = 64). Le niveau d’activité physique totale et l’activité physique intense diminuaient de façon significative après le diagnostic, notamment chez les patients de plus de 60 ans, les hommes et les patients ayant arrêté leur activité professionnelle. Une augmentation significative de la sédentarité, notamment chez les femmes, les patients de plus de 60 ans et les patients ayant arrêté leur activité professionnelle est observée (Fassier et coll., 2016 ).
). ; Morton et coll., 2014
; Morton et coll., 2014 ), des maladies cardiovasculaires, un syndrome métabolique et une ostéoporose (Jung et coll., 2012
), des maladies cardiovasculaires, un syndrome métabolique et une ostéoporose (Jung et coll., 2012 ; Jacobs et Shulman, 2017
; Jacobs et Shulman, 2017 ). Les pathologies cardiovasculaires constituent une cause de décès prépondérante chez les survivants 10 ans après un cancer du sein, de l’endomètre ou d’un cancer colorectal (Vijayvergia et Denlinger, 2015
). Les pathologies cardiovasculaires constituent une cause de décès prépondérante chez les survivants 10 ans après un cancer du sein, de l’endomètre ou d’un cancer colorectal (Vijayvergia et Denlinger, 2015 ). Dans une étude de cohorte canadienne incluant 1 526 survivants du cancer et 6 034 témoins, âgés de 35 à 69 ans (tous type de cancer confondus), les survivants du cancer présentaient un risque augmenté de pathologies cardiovasculaires, d’hypertension et de diabète (Keats et coll., 2017
). Dans une étude de cohorte canadienne incluant 1 526 survivants du cancer et 6 034 témoins, âgés de 35 à 69 ans (tous type de cancer confondus), les survivants du cancer présentaient un risque augmenté de pathologies cardiovasculaires, d’hypertension et de diabète (Keats et coll., 2017 ). Comparé au groupe ayant un faible niveau d’activité physique, ceux ayant un niveau modéré ou élevé d’activité physique développaient significativement moins de facteurs de risque (hypertension OR = 0,73 ; IC 95 % [0,64-0,84] ; diabète OR = 0,66 ; IC 95 % [0,58-0,76]), et ceci également après ajustement sur le tabagisme, l’alcool, la consommation de fruits et légumes, la sédentarité, le tour de taille, l’IMC (mais pas après ajustement sur l’adiposité abdominale).
). Comparé au groupe ayant un faible niveau d’activité physique, ceux ayant un niveau modéré ou élevé d’activité physique développaient significativement moins de facteurs de risque (hypertension OR = 0,73 ; IC 95 % [0,64-0,84] ; diabète OR = 0,66 ; IC 95 % [0,58-0,76]), et ceci également après ajustement sur le tabagisme, l’alcool, la consommation de fruits et légumes, la sédentarité, le tour de taille, l’IMC (mais pas après ajustement sur l’adiposité abdominale). ; World Cancer Research Fund International, 2014
; World Cancer Research Fund International, 2014 ), mais l’impact de l’activité physique sur le risque de 2e cancer n’a pas été étudié (World Cancer Research Fund International, 2014
), mais l’impact de l’activité physique sur le risque de 2e cancer n’a pas été étudié (World Cancer Research Fund International, 2014 ). De même, les effets de l’activité physique sur les maladies cardiovasculaires et le diabète n’ont pas été étudiés spécifiquement chez les survivants d’un cancer, mais il est raisonnable de penser que les effets bénéfiques de l’activité physique ne différeraient pas de ceux observés dans la population générale.
). De même, les effets de l’activité physique sur les maladies cardiovasculaires et le diabète n’ont pas été étudiés spécifiquement chez les survivants d’un cancer, mais il est raisonnable de penser que les effets bénéfiques de l’activité physique ne différeraient pas de ceux observés dans la population générale. ). Au contraire, dans une visée palliative, l’amélioration de la qualité de vie est la finalité pour celui qui conçoit un programme d’activité physique. Le plaisir ressenti lors de la pratique est déterminant. En revanche, il faut se garder de donner de faux espoirs à des patients en stade avancé en leur faisant croire à des vertus curatives du cancer par l’activité physique.
). Au contraire, dans une visée palliative, l’amélioration de la qualité de vie est la finalité pour celui qui conçoit un programme d’activité physique. Le plaisir ressenti lors de la pratique est déterminant. En revanche, il faut se garder de donner de faux espoirs à des patients en stade avancé en leur faisant croire à des vertus curatives du cancer par l’activité physique. ). Pourtant, cinq revues systématiques chez des patients atteints de cancer avancé suggèrent la faisabilité et la sécurité de la pratique d’activité physique (Lowe et coll., 2009
). Pourtant, cinq revues systématiques chez des patients atteints de cancer avancé suggèrent la faisabilité et la sécurité de la pratique d’activité physique (Lowe et coll., 2009 ; Beaton et coll., 2009
; Beaton et coll., 2009 ; Albrecht et Taylor, 2012
; Albrecht et Taylor, 2012 ; Dittus et coll., 2017
; Dittus et coll., 2017  ; Heywood et coll., 2017
; Heywood et coll., 2017 ). La revue systématique de Dittus et coll. (2017
). La revue systématique de Dittus et coll. (2017 ) de 26 études avec des populations hétérogènes suggère que l’activité physique, chez des personnes atteintes d’un cancer avancé, permet de maintenir ou d’améliorer la condition physique et les fonctions physiques, de diminuer la fatigue et d’améliorer la qualité de vie. Une étude contrôlée randomisée (Oldervoll et coll., 2011
) de 26 études avec des populations hétérogènes suggère que l’activité physique, chez des personnes atteintes d’un cancer avancé, permet de maintenir ou d’améliorer la condition physique et les fonctions physiques, de diminuer la fatigue et d’améliorer la qualité de vie. Une étude contrôlée randomisée (Oldervoll et coll., 2011 ), menée auprès de 231 patients atteints de différents cancers métastatiques, a montré une amélioration des capacités physiques fonctionnelles chez les patients randomisés dans le groupe interventionnel (n = 131, 81 femmes, 40 hommes ; activité physique supervisée de 8 semaines) mais pas de changement du niveau de fatigue, par rapport au groupe contrôle (n = 110 avec n = 63 femmes et n = 47 hommes). D’autres études chez des patients atteints de différents types de cancer à un stade avancé ont également suggéré une amélioration des capacités fonctionnelles, mais sans amélioration de la qualité de vie, de l’anxiété ou la symptomatologie dépressive (Hwang et coll., 2012
), menée auprès de 231 patients atteints de différents cancers métastatiques, a montré une amélioration des capacités physiques fonctionnelles chez les patients randomisés dans le groupe interventionnel (n = 131, 81 femmes, 40 hommes ; activité physique supervisée de 8 semaines) mais pas de changement du niveau de fatigue, par rapport au groupe contrôle (n = 110 avec n = 63 femmes et n = 47 hommes). D’autres études chez des patients atteints de différents types de cancer à un stade avancé ont également suggéré une amélioration des capacités fonctionnelles, mais sans amélioration de la qualité de vie, de l’anxiété ou la symptomatologie dépressive (Hwang et coll., 2012 ; Kuehr et coll., 2014
; Kuehr et coll., 2014 ; Quist et coll., 2015
; Quist et coll., 2015 ; Ligibel et coll., 2016
; Ligibel et coll., 2016 ). Cependant, la dose d’activité physique réalisable et optimale, chez les patients atteints de cancer avancé, reste à déterminer.
). Cependant, la dose d’activité physique réalisable et optimale, chez les patients atteints de cancer avancé, reste à déterminer. ). Il est nécessaire d’évaluer davantage le bénéfice de l’activité physique dans des populations de patients insuffisamment étudiés à ce jour, notamment les patients âgés et/ou ayant des comorbidités, les patients inactifs, présentant une qualité de vie détériorée, ainsi que les patients en situation précaire. L’évaluation des bénéfices de l’activité physique dans ces différentes populations de patients doit s’accompagner d’une meilleure documentation des caractéristiques des non-participants ainsi que d’une évaluation plus systématique des effets secondaires. Compte tenu du rôle possible indépendant de la sédentarité sur la santé des patients après un cancer, celle-ci doit être mieux évaluée et ses mécanismes analysés. Dans la littérature, la nécessité de coupler les programmes d’activité physique avec une intervention nutritionnelle est rappelée (Inca, 2017
). Il est nécessaire d’évaluer davantage le bénéfice de l’activité physique dans des populations de patients insuffisamment étudiés à ce jour, notamment les patients âgés et/ou ayant des comorbidités, les patients inactifs, présentant une qualité de vie détériorée, ainsi que les patients en situation précaire. L’évaluation des bénéfices de l’activité physique dans ces différentes populations de patients doit s’accompagner d’une meilleure documentation des caractéristiques des non-participants ainsi que d’une évaluation plus systématique des effets secondaires. Compte tenu du rôle possible indépendant de la sédentarité sur la santé des patients après un cancer, celle-ci doit être mieux évaluée et ses mécanismes analysés. Dans la littérature, la nécessité de coupler les programmes d’activité physique avec une intervention nutritionnelle est rappelée (Inca, 2017 ).
). ), sont favorablement influencées par l’activité physique. L’étude de l’impact de l’activité physique sur la résistance thérapeutique, notamment chez les patients en surpoids ou obèses serait pertinente.
), sont favorablement influencées par l’activité physique. L’étude de l’impact de l’activité physique sur la résistance thérapeutique, notamment chez les patients en surpoids ou obèses serait pertinente. ). Compte tenu des bénéfices démontrés de l’activité physique, comparer dans de futurs essais l’activité physique versus l’absence d’activité physique semble aujourd’hui discutable d’un point de vue éthique (Inca, 2017
). Compte tenu des bénéfices démontrés de l’activité physique, comparer dans de futurs essais l’activité physique versus l’absence d’activité physique semble aujourd’hui discutable d’un point de vue éthique (Inca, 2017 ). En conséquence, les études devraient proposer de comparer différentes modalités d’activité physique.
). En conséquence, les études devraient proposer de comparer différentes modalités d’activité physique. ; Romieu et coll., 2012
; Romieu et coll., 2012 ). La réalisation d’un essai randomisé de cette taille doit donc se faire impérativement de façon multicentrique, à un niveau national, voire international. Identifier et valider des marqueurs biologiques intermédiaires dans la voie causale entre l’activité physique et la survie comme critères de substitution de la survie globale (surrogate endpoints) faciliterait ce type d’études.
). La réalisation d’un essai randomisé de cette taille doit donc se faire impérativement de façon multicentrique, à un niveau national, voire international. Identifier et valider des marqueurs biologiques intermédiaires dans la voie causale entre l’activité physique et la survie comme critères de substitution de la survie globale (surrogate endpoints) faciliterait ce type d’études. ; Hayes et coll., 2016
; Hayes et coll., 2016 ).
). ). Les études devraient également s’efforcer de mieux comprendre les facteurs modifiant l’effet de l’activité physique, tels que l’IMC, la perte/prise de poids, le statut ménopausique, le statut des récepteurs d’œstrogènes pour les cancers du sein, mais également l’interaction de l’activité physique avec l’impact métabolique des traitements (hormonothérapie, chimiothérapie).
). Les études devraient également s’efforcer de mieux comprendre les facteurs modifiant l’effet de l’activité physique, tels que l’IMC, la perte/prise de poids, le statut ménopausique, le statut des récepteurs d’œstrogènes pour les cancers du sein, mais également l’interaction de l’activité physique avec l’impact métabolique des traitements (hormonothérapie, chimiothérapie). ; Bourke et coll., 2014
; Bourke et coll., 2014 ). Les mécanismes biologiques expliquant les effets de la sédentarité sur la sévérité de la maladie doivent être élucidés (Inca, 2017
). Les mécanismes biologiques expliquant les effets de la sédentarité sur la sévérité de la maladie doivent être élucidés (Inca, 2017 ).
).