II. Approches par pathologies
2019
| ANALYSE |
8-
Obésité et diabète de type 2
Activité physique et mortalité
Personnes obèses
 ). La méta-analyse récente de Barry et coll. (2014)
). La méta-analyse récente de Barry et coll. (2014) inclut 10 études prospectives de cohorte, soit plus de 90 000 sujets entre 45 et 65 ans, avec un suivi de 8 à 14 ans et 5 600 décès. Les sujets ont été divisés en fonction de leur indice de masse corporelle (IMC) (i.e. normal, surpoids, obèse) et de leur niveau de condition physique évaluée par une épreuve d’effort maximal ou de V̇O2pic (i.e. en bonne ou mauvaise forme physique). Le résultat marquant est que la personne obèse, dès lors qu’elle est en bonne forme physique, présente un risque relatif de mortalité toutes causes identique aux individus actifs normo-pondérés. Fogelholm et coll. (2010)
inclut 10 études prospectives de cohorte, soit plus de 90 000 sujets entre 45 et 65 ans, avec un suivi de 8 à 14 ans et 5 600 décès. Les sujets ont été divisés en fonction de leur indice de masse corporelle (IMC) (i.e. normal, surpoids, obèse) et de leur niveau de condition physique évaluée par une épreuve d’effort maximal ou de V̇O2pic (i.e. en bonne ou mauvaise forme physique). Le résultat marquant est que la personne obèse, dès lors qu’elle est en bonne forme physique, présente un risque relatif de mortalité toutes causes identique aux individus actifs normo-pondérés. Fogelholm et coll. (2010) , dans leur revue incluant 36 études avec un suivi de 8 à 24 ans, montrent un rôle encore plus positif d’une bonne forme physique sur la mortalité cardiovasculaire, avec un risque relatif moindre chez les personnes actives avec une obésité modérée, comparé aux normo-pondérés inactifs. En revanche, les personnes obèses en mauvaise condition physique présentent un risque de mortalité toutes causes deux fois plus élevé (Barry et coll., 2014
, dans leur revue incluant 36 études avec un suivi de 8 à 24 ans, montrent un rôle encore plus positif d’une bonne forme physique sur la mortalité cardiovasculaire, avec un risque relatif moindre chez les personnes actives avec une obésité modérée, comparé aux normo-pondérés inactifs. En revanche, les personnes obèses en mauvaise condition physique présentent un risque de mortalité toutes causes deux fois plus élevé (Barry et coll., 2014 ). Il semble que la pratique d’activité physique 3 h/semaine, d’intensité modérée à forte, protège plus la femme obèse que l’homme (Vatten et coll., 2006
). Il semble que la pratique d’activité physique 3 h/semaine, d’intensité modérée à forte, protège plus la femme obèse que l’homme (Vatten et coll., 2006 ). Il est mis en avant que la mesure objective de la condition physique est un meilleur prédicteur qu’une déclaration de pratique d’activité physique, souvent évaluée par questionnaires (Pedersen et coll., 2007
). Il est mis en avant que la mesure objective de la condition physique est un meilleur prédicteur qu’une déclaration de pratique d’activité physique, souvent évaluée par questionnaires (Pedersen et coll., 2007 ; Fogelholm et coll., 2010
; Fogelholm et coll., 2010 ). Le concept « fat but fit » se développe (Hainer et coll., 2009
). Le concept « fat but fit » se développe (Hainer et coll., 2009 ; McAuley et coll., 2012
; McAuley et coll., 2012 ) : une bonne condition physique pourrait ainsi contrebalancer les effets néfastes de l’adiposité sur la santé. D’après les données de la cohorte Aerobics Center Longitudinal Study (suivi de 6,4 ans), chaque augmentation de 1 équivalent métabolique (1 MET Metabolic Equivalent of Task) de condition physique est associée à une diminution de 15 % de la mortalité toutes causes et de 19 % de la mortalité cardiovasculaire, après ajustement sur les facteurs confondants et les changements d’IMC (Lee et coll., 2011
) : une bonne condition physique pourrait ainsi contrebalancer les effets néfastes de l’adiposité sur la santé. D’après les données de la cohorte Aerobics Center Longitudinal Study (suivi de 6,4 ans), chaque augmentation de 1 équivalent métabolique (1 MET Metabolic Equivalent of Task) de condition physique est associée à une diminution de 15 % de la mortalité toutes causes et de 19 % de la mortalité cardiovasculaire, après ajustement sur les facteurs confondants et les changements d’IMC (Lee et coll., 2011 ). Ainsi, pour les personnes obèses n’arrivant pas à perdre du poids, la promotion de l’activité physique devient primordiale. Pour autant, les personnes obèses même en bonne condition physique ou avec une pratique d’activité physique importante présentent des niveaux d’incidence et prévalence de pathologies cardiovasculaires ou de diabète de type 2 supérieurs aux sujets normo-pondérés actifs ou non (Li et coll., 2006
). Ainsi, pour les personnes obèses n’arrivant pas à perdre du poids, la promotion de l’activité physique devient primordiale. Pour autant, les personnes obèses même en bonne condition physique ou avec une pratique d’activité physique importante présentent des niveaux d’incidence et prévalence de pathologies cardiovasculaires ou de diabète de type 2 supérieurs aux sujets normo-pondérés actifs ou non (Li et coll., 2006 ; Rana et coll., 2007
; Rana et coll., 2007 ; Fogelholm et coll., 2010
; Fogelholm et coll., 2010 ; Carlsson et coll., 2016
; Carlsson et coll., 2016 ). Cependant, certaines personnes obèses présentant des complications cardiovasculaires avérées ont un meilleur pronostic que des patients normo-pondérés ou minces avec les mêmes complications : c’est le paradoxe de l’obésité (De Schutter et coll., 2014
). Cependant, certaines personnes obèses présentant des complications cardiovasculaires avérées ont un meilleur pronostic que des patients normo-pondérés ou minces avec les mêmes complications : c’est le paradoxe de l’obésité (De Schutter et coll., 2014 ; Lavie et coll., 2015
; Lavie et coll., 2015 ). Le niveau de condition physique impacte ce paradoxe de l’obésité. Par exemple, chez 9 563 patients porteurs d’une insuffisance cardiaque, seuls ceux ayant la condition physique la plus élevée présentaient un fort paradoxe de l’obésité : une mortalité toutes causes et cardiovasculaire plus élevée chez les personnes plus légères et plus faible chez les plus lourdes (McAuley et coll., 2012
). Le niveau de condition physique impacte ce paradoxe de l’obésité. Par exemple, chez 9 563 patients porteurs d’une insuffisance cardiaque, seuls ceux ayant la condition physique la plus élevée présentaient un fort paradoxe de l’obésité : une mortalité toutes causes et cardiovasculaire plus élevée chez les personnes plus légères et plus faible chez les plus lourdes (McAuley et coll., 2012 ). Le message de santé publique reste donc de lutter non seulement contre l’obésité (compliquée ou non) mais aussi contre un faible niveau de condition physique.
). Le message de santé publique reste donc de lutter non seulement contre l’obésité (compliquée ou non) mais aussi contre un faible niveau de condition physique.Patients atteints de diabète de type 2
 ). En France, l’Institut national de veille sanitaire (InVS) a recensé plus de 32 150 décès ayant pour cause première le diabète. On observe une diminution significative de la mortalité pour les personnes actives en population générale (-30 à -50 %) (Oguma et coll., 2002
). En France, l’Institut national de veille sanitaire (InVS) a recensé plus de 32 150 décès ayant pour cause première le diabète. On observe une diminution significative de la mortalité pour les personnes actives en population générale (-30 à -50 %) (Oguma et coll., 2002 ; Leitzmann et coll., 2007
; Leitzmann et coll., 2007 ), ce qui incite à vivement encourager les patients diabétiques de type 2 à pratiquer une activité physique. Plusieurs méta-analyses incluant des cohortes importantes de patients se sont intéressées aux effets de l’activité physique sur la mortalité. Ces travaux révèlent une relation linéaire inverse entre la dose d’activité physique et les mortalités toutes causes et cardiovasculaire (-20 à -50 %) (Sluik et coll., 2012
), ce qui incite à vivement encourager les patients diabétiques de type 2 à pratiquer une activité physique. Plusieurs méta-analyses incluant des cohortes importantes de patients se sont intéressées aux effets de l’activité physique sur la mortalité. Ces travaux révèlent une relation linéaire inverse entre la dose d’activité physique et les mortalités toutes causes et cardiovasculaire (-20 à -50 %) (Sluik et coll., 2012 ; Kodama et coll., 2013
; Kodama et coll., 2013 ). Néanmoins, la question du seuil ou de la dose d’activité nécessaire pour réduire la mortalité est souvent posée, car il est difficile de déterminer avec précision les différents niveaux ou volumes d’activités physiques pratiquées dans les études. Dans une méta-analyse récente de Kodama et coll.
). Néanmoins, la question du seuil ou de la dose d’activité nécessaire pour réduire la mortalité est souvent posée, car il est difficile de déterminer avec précision les différents niveaux ou volumes d’activités physiques pratiquées dans les études. Dans une méta-analyse récente de Kodama et coll. (2013), incluant 17 études, la réduction de la mortalité toutes causes (RR = 0,61 [0,52-0,70]) et de la mortalité cardiovasculaire (RR = 0,71 [0,60-0,84]) est plus importante chez les patients les plus actifs comparée aux moins actifs. Depuis cette méta-analyse, deux études incluant un nombre important de patients ont été publiées. Ainsi, la cohorte randomisée et contrôlée Advance, incluant 11 140 patients avec un suivi médian de 5 ans et le recensement de 1 031 décès, confirme une diminution de la mortalité chez les patients diabétiques pratiquant une activité physique modérée à forte (Blomster et coll., 2013
(2013), incluant 17 études, la réduction de la mortalité toutes causes (RR = 0,61 [0,52-0,70]) et de la mortalité cardiovasculaire (RR = 0,71 [0,60-0,84]) est plus importante chez les patients les plus actifs comparée aux moins actifs. Depuis cette méta-analyse, deux études incluant un nombre important de patients ont été publiées. Ainsi, la cohorte randomisée et contrôlée Advance, incluant 11 140 patients avec un suivi médian de 5 ans et le recensement de 1 031 décès, confirme une diminution de la mortalité chez les patients diabétiques pratiquant une activité physique modérée à forte (Blomster et coll., 2013 ) en comparaison des patients ne pratiquant pas ou peu d’activité physique. L’étude prospective EPIC (European Prospective Investigation Into Cancer and Nutrition) publiée en 2012 s’est intéressée à cette question chez 5 859 patients diabétiques après un suivi médian de 9,4 ans et la survenue de 755 décès (Sluik et coll., 2012
) en comparaison des patients ne pratiquant pas ou peu d’activité physique. L’étude prospective EPIC (European Prospective Investigation Into Cancer and Nutrition) publiée en 2012 s’est intéressée à cette question chez 5 859 patients diabétiques après un suivi médian de 9,4 ans et la survenue de 755 décès (Sluik et coll., 2012 ). Le groupe présentant la plus importante réduction de la mortalité était celui qui avait soit une activité physique totale modérée (RR = 0,53 [0,42-0,66]), soit les temps de loisirs actifs les plus importants (RR = 0,64 [0,50-0,80]). De manière intéressante, il faut noter dans cette étude que les patients qui déclaraient marcher plus de 9 heures par semaine présentaient une mortalité cardiovasculaire significativement diminuée par rapport aux autres groupes (marchant entre 0 et 2 h ; 2 et 4,5 h ; 4,6 et 9 h), même si des travaux antérieurs de Gregg et coll. (2003)
). Le groupe présentant la plus importante réduction de la mortalité était celui qui avait soit une activité physique totale modérée (RR = 0,53 [0,42-0,66]), soit les temps de loisirs actifs les plus importants (RR = 0,64 [0,50-0,80]). De manière intéressante, il faut noter dans cette étude que les patients qui déclaraient marcher plus de 9 heures par semaine présentaient une mortalité cardiovasculaire significativement diminuée par rapport aux autres groupes (marchant entre 0 et 2 h ; 2 et 4,5 h ; 4,6 et 9 h), même si des travaux antérieurs de Gregg et coll. (2003) , basés sur le suivi de 2 896 patients sur 8 années, présentent un taux de mortalité toutes causes réduit à partir de 2 h de marche par semaine.
, basés sur le suivi de 2 896 patients sur 8 années, présentent un taux de mortalité toutes causes réduit à partir de 2 h de marche par semaine.Sédentarité et niveaux d’activité physique
Personnes obèses
 ; DeLany et coll., 2013
; DeLany et coll., 2013  ; Hansen et coll., 2013
; Hansen et coll., 2013 ). Plus le degré d’obésité est important, plus le niveau d’activité physique global est faible (DeLany et coll., 2013
). Plus le degré d’obésité est important, plus le niveau d’activité physique global est faible (DeLany et coll., 2013 ). La part relative de la dépense énergétique liée aux activités physiques renseigne sur l’engagement et le type d’activités physiques pratiquées. De manière intéressante, Drenowatz et coll.
). La part relative de la dépense énergétique liée aux activités physiques renseigne sur l’engagement et le type d’activités physiques pratiquées. De manière intéressante, Drenowatz et coll. (2015) rapportent ainsi que les personnes obèses présentent une augmentation de leur dépense énergétique totale par la pratique de la natation et des sports de force, alors que chez les normo-pondérés, ce sont les activités physiques et sports d’endurance qui contribuent à cette augmentation. Ce résultat reste à confirmer, mais il pose la question de la recommandation des activités physiques en décharge chez les personnes obèses. La Haute Autorité de santé (HAS) recommande aux personnes en surpoids de pratiquer 225 à 300 min d’activité physique par semaine, à intensité modérée, sans détailler quel type d’activité physique. Dans la cohorte Ipen regroupant 10 pays, 5 712 adultes, Van Dyck et coll.
(2015) rapportent ainsi que les personnes obèses présentent une augmentation de leur dépense énergétique totale par la pratique de la natation et des sports de force, alors que chez les normo-pondérés, ce sont les activités physiques et sports d’endurance qui contribuent à cette augmentation. Ce résultat reste à confirmer, mais il pose la question de la recommandation des activités physiques en décharge chez les personnes obèses. La Haute Autorité de santé (HAS) recommande aux personnes en surpoids de pratiquer 225 à 300 min d’activité physique par semaine, à intensité modérée, sans détailler quel type d’activité physique. Dans la cohorte Ipen regroupant 10 pays, 5 712 adultes, Van Dyck et coll. (2015) rapportent une relation curviligne entre IMC et activité physique modérée à forte. L’IMC diminue linéairement avec une augmentation de l’activité physique modérée de 0 à 40-50 min/j. Ces résultats soutiennent ainsi les recommandations de 60 min/jour d’activité physique modérée à forte pour éviter la prise de poids chez les adultes en population générale. Pour autant, dans la cohorte américaine Nhanes, seuls 3,2 % de la population totale respectent les recommandations de santé publique des 30 min/jour d’activité physique modérée (Tudor-Locke et coll., 2010
(2015) rapportent une relation curviligne entre IMC et activité physique modérée à forte. L’IMC diminue linéairement avec une augmentation de l’activité physique modérée de 0 à 40-50 min/j. Ces résultats soutiennent ainsi les recommandations de 60 min/jour d’activité physique modérée à forte pour éviter la prise de poids chez les adultes en population générale. Pour autant, dans la cohorte américaine Nhanes, seuls 3,2 % de la population totale respectent les recommandations de santé publique des 30 min/jour d’activité physique modérée (Tudor-Locke et coll., 2010 ). Chez les personnes obèses, ce pourcentage est inférieur à 2 %. Il est donc pertinent de s’interroger sur le sens de la relation entre activité physique et obésité. Est-ce la diminution de pratique d’activité physique qui développe l’obésité ou est-ce l’obésité qui conduit à moins de pratique d’activité physique ? Il s’agit probablement d’un « cercle vicieux ». Le contexte nutritionnel et l’environnement sont indissociables de cette discussion.
). Chez les personnes obèses, ce pourcentage est inférieur à 2 %. Il est donc pertinent de s’interroger sur le sens de la relation entre activité physique et obésité. Est-ce la diminution de pratique d’activité physique qui développe l’obésité ou est-ce l’obésité qui conduit à moins de pratique d’activité physique ? Il s’agit probablement d’un « cercle vicieux ». Le contexte nutritionnel et l’environnement sont indissociables de cette discussion. ), c’est-à-dire sans aucun désordre métabolique, même si aucune définition consensuelle du MHO n’existe (Stefan et coll., 2014). Les mécanismes explicatifs proposés sont une sensibilité à l’insuline préservée, une localisation de la masse grasse moins viscérale et ectopique, une infiltration moindre de cellules immunitaires dans le tissu adipeux et une production plus faible d’adipokines. Dans une étude, les personnes obèses métaboliquement saines rapportent des volumes d’activité physique totale supérieurs aux personnes obèses non métaboliquement saines (Kanagasabai et coll., 2015
), c’est-à-dire sans aucun désordre métabolique, même si aucune définition consensuelle du MHO n’existe (Stefan et coll., 2014). Les mécanismes explicatifs proposés sont une sensibilité à l’insuline préservée, une localisation de la masse grasse moins viscérale et ectopique, une infiltration moindre de cellules immunitaires dans le tissu adipeux et une production plus faible d’adipokines. Dans une étude, les personnes obèses métaboliquement saines rapportent des volumes d’activité physique totale supérieurs aux personnes obèses non métaboliquement saines (Kanagasabai et coll., 2015 ), limitant ainsi la prévalence du diabète de type 2 dans cette catégorie de patients.
), limitant ainsi la prévalence du diabète de type 2 dans cette catégorie de patients.Patients atteints de diabète de type 2
 ), ou encore la Health Professionnals Follow-up Study pour les hommes (Hu et coll., 2003a
), ou encore la Health Professionnals Follow-up Study pour les hommes (Hu et coll., 2003a ), ont rapporté, par exemple, une relation positive entre l’incidence du diabète de type 2 et le temps passé par semaine devant la télévision. Mais la question du niveau de sédentarité reste posée lorsque les patients sont déjà diagnostiqués, d’autant plus qu’ils ont tendance à surestimer leur niveau d’activité physique spontanée (Janevic et coll., 2012
), ont rapporté, par exemple, une relation positive entre l’incidence du diabète de type 2 et le temps passé par semaine devant la télévision. Mais la question du niveau de sédentarité reste posée lorsque les patients sont déjà diagnostiqués, d’autant plus qu’ils ont tendance à surestimer leur niveau d’activité physique spontanée (Janevic et coll., 2012 ). Peu de données sont disponibles à ce jour, mais elles tendent à démontrer une sédentarité supérieure chez les patients diabétiques, impactant directement l’évolution des niveaux d’insuline, ainsi que le tour de taille (Cooper et coll., 2014
). Peu de données sont disponibles à ce jour, mais elles tendent à démontrer une sédentarité supérieure chez les patients diabétiques, impactant directement l’évolution des niveaux d’insuline, ainsi que le tour de taille (Cooper et coll., 2014 ). La plus importante étude à ce jour, publiée très récemment dans Diabetologia, a inclus 2 497 participants de la cohorte Maastricht Study qui ont porté un accéléromètre durant 8 jours consécutifs, 24 h sur 24 h (van der Berg et coll., 2016
). La plus importante étude à ce jour, publiée très récemment dans Diabetologia, a inclus 2 497 participants de la cohorte Maastricht Study qui ont porté un accéléromètre durant 8 jours consécutifs, 24 h sur 24 h (van der Berg et coll., 2016 ). Afin de déterminer le niveau de tolérance au glucose, ces sujets ont été soumis à un test d’hyperglycémie provoquée par voie orale. 714 patients (28,6 %) ont été diagnostiqués diabétiques de type 2 et présentaient un IMC et une hémoglobine glyquée supérieurs aux deux autres groupes, normo-glycémique ou intolérant au glucose. Durant la période d’éveil, ces patients présentaient un temps de position assise ou allongée supérieur ainsi que des périodes moins importantes en position debout ou en mouvement. Ainsi, cette étude démontre que chaque heure sédentaire supplémentaire augmente de 22 % le risque d’être diabétique de type 2, et ceci de manière indépendante de l’activité physique. Lorsque l’on s’intéresse à l’activité physique et non plus à la sédentarité, l’étude Entred rapporte que les tâches domestiques représentent la source d’activité principale dans la vie quotidienne, notamment chez les femmes (étude Entred, Cloix et coll., 2014
). Afin de déterminer le niveau de tolérance au glucose, ces sujets ont été soumis à un test d’hyperglycémie provoquée par voie orale. 714 patients (28,6 %) ont été diagnostiqués diabétiques de type 2 et présentaient un IMC et une hémoglobine glyquée supérieurs aux deux autres groupes, normo-glycémique ou intolérant au glucose. Durant la période d’éveil, ces patients présentaient un temps de position assise ou allongée supérieur ainsi que des périodes moins importantes en position debout ou en mouvement. Ainsi, cette étude démontre que chaque heure sédentaire supplémentaire augmente de 22 % le risque d’être diabétique de type 2, et ceci de manière indépendante de l’activité physique. Lorsque l’on s’intéresse à l’activité physique et non plus à la sédentarité, l’étude Entred rapporte que les tâches domestiques représentent la source d’activité principale dans la vie quotidienne, notamment chez les femmes (étude Entred, Cloix et coll., 2014 ).
). ), ce qui impose de s’interroger sur le niveau d’activité physique des patients identifiés diabétiques de type 2. En effet, des travaux plus récents réalisés aux États-Unis montrent que seuls 25 à 42 % des 18 370 patients inclus dans une étude atteignent les recommandations 2007 et 2008 du Departement of Health and Human Disease et de l’American Diabetes Association (ADA) (sur la base des recommandations de 150 min par semaine pour des intensités faibles à modérées ou 75 à 90 minutes par semaine pour des intensités modérées à fortes) (Zhao et coll., 2011
), ce qui impose de s’interroger sur le niveau d’activité physique des patients identifiés diabétiques de type 2. En effet, des travaux plus récents réalisés aux États-Unis montrent que seuls 25 à 42 % des 18 370 patients inclus dans une étude atteignent les recommandations 2007 et 2008 du Departement of Health and Human Disease et de l’American Diabetes Association (ADA) (sur la base des recommandations de 150 min par semaine pour des intensités faibles à modérées ou 75 à 90 minutes par semaine pour des intensités modérées à fortes) (Zhao et coll., 2011 ). L’âge supérieur à 75 ans, le sexe féminin, l’origine afro-américaine, les pathologies cardiovasculaires ou encore les handicaps favorisent la sédentarité dans cette population. Janevic et coll.
). L’âge supérieur à 75 ans, le sexe féminin, l’origine afro-américaine, les pathologies cardiovasculaires ou encore les handicaps favorisent la sédentarité dans cette population. Janevic et coll. (2012) présentent des résultats plus encourageants (57 % des patients répondent aux recommandations de l’ADA) mais démontrent que plus d’un quart de ces patients surestiment le temps d’activité physique hebdomadaire. Mu et coll. (2014)
(2012) présentent des résultats plus encourageants (57 % des patients répondent aux recommandations de l’ADA) mais démontrent que plus d’un quart de ces patients surestiment le temps d’activité physique hebdomadaire. Mu et coll. (2014) démontrent enfin de manière rétrospective sur une population de 55 234 patients américains, que seuls 12 et 41 % d’entre eux atteignent les recommandations spécifiques de l’ADA pour l’endurance et le renforcement musculaire, respectivement. Au regard de ces données, il semble donc important de promouvoir le temps d’activité physique volontaire et quotidien chez les patients diabétiques de type 2. Dans ce sens, l’ADA a récemment proposé d’instaurer une activité physique, même minime, toutes les 90 minutes (ADA Standards of Care for Diabetes, 2015).
démontrent enfin de manière rétrospective sur une population de 55 234 patients américains, que seuls 12 et 41 % d’entre eux atteignent les recommandations spécifiques de l’ADA pour l’endurance et le renforcement musculaire, respectivement. Au regard de ces données, il semble donc important de promouvoir le temps d’activité physique volontaire et quotidien chez les patients diabétiques de type 2. Dans ce sens, l’ADA a récemment proposé d’instaurer une activité physique, même minime, toutes les 90 minutes (ADA Standards of Care for Diabetes, 2015).Contre-indications et attention particulière à la pratique d’activités physiques
Personnes obèses
 ; DeLany et coll., 2013
; DeLany et coll., 2013 ). Lors de la marche et selon les vitesses de marche, les personnes obèses présentent plus de charges sur les articulations et les tissus mous, une pronation du pied, une moindre stabilité posturale et une angulation articulaire diminuée (Runhaar et coll., 2011
). Lors de la marche et selon les vitesses de marche, les personnes obèses présentent plus de charges sur les articulations et les tissus mous, une pronation du pied, une moindre stabilité posturale et une angulation articulaire diminuée (Runhaar et coll., 2011 ; Butterworth et coll., 2014
; Butterworth et coll., 2014 et 2015
et 2015 ).
). ; Bernhard, 2013
; Bernhard, 2013 ), d’arthrose et de tendinite (Gaida et coll., 2009
), d’arthrose et de tendinite (Gaida et coll., 2009 ) chez certains patients obèses et d’obésité sarcopénique chez le sujet âgé, c’est-à-dire la coexistence d’une faible masse ou fonction musculaire et d’une masse grasse élevée (Zamboni et coll., 2008
) chez certains patients obèses et d’obésité sarcopénique chez le sujet âgé, c’est-à-dire la coexistence d’une faible masse ou fonction musculaire et d’une masse grasse élevée (Zamboni et coll., 2008 ; Lee et coll., 2016
; Lee et coll., 2016 ) sont à prendre en compte lors de la prescription d’exercice. Dès lors se pose la question de savoir si la pratique d’activité physique peut ou non présenter des risques de blessures. Dans l’essai randomisé de Janney et coll. (2010)
) sont à prendre en compte lors de la prescription d’exercice. Dès lors se pose la question de savoir si la pratique d’activité physique peut ou non présenter des risques de blessures. Dans l’essai randomisé de Janney et coll. (2010) , à la question posée « au cours des 6 derniers mois, est-ce qu’une blessure-maladie a affecté votre capacité à faire de l’activité physique ? » 32 % des participants ont rapporté au moins une blessure attribuée à l’exercice au cours des 18 mois d’intervention, soit un taux de blessure de 1,8 % par mois. Aucune différence significative entre le groupe exercice participant au programme de marche rapide 5 fois par semaine (de 150 à 300 min par semaine) et le groupe contrôle n’était notée. Les blessures musculo-squelettiques, notamment au genou, étaient les plus couramment rapportées. Les personnes obèses avec les IMC les plus élevés étaient blessées plus tôt et plus souvent. Un programme d’activité physique plus intensif (60-85 % FCmax – Fréquence cardiaque maximale) engendre le même type de résultat (Campbell et coll., 2012
, à la question posée « au cours des 6 derniers mois, est-ce qu’une blessure-maladie a affecté votre capacité à faire de l’activité physique ? » 32 % des participants ont rapporté au moins une blessure attribuée à l’exercice au cours des 18 mois d’intervention, soit un taux de blessure de 1,8 % par mois. Aucune différence significative entre le groupe exercice participant au programme de marche rapide 5 fois par semaine (de 150 à 300 min par semaine) et le groupe contrôle n’était notée. Les blessures musculo-squelettiques, notamment au genou, étaient les plus couramment rapportées. Les personnes obèses avec les IMC les plus élevés étaient blessées plus tôt et plus souvent. Un programme d’activité physique plus intensif (60-85 % FCmax – Fréquence cardiaque maximale) engendre le même type de résultat (Campbell et coll., 2012 ). Par contre, les événements indésirables sont plus fréquents quand l’intensité est maximale. Pour exemple, Lunt et coll.
). Par contre, les événements indésirables sont plus fréquents quand l’intensité est maximale. Pour exemple, Lunt et coll. (2014) rapportent 25 % d’arrêt pour blessure dans le seul groupe à intensité maximale (répétition de sprints de 30 s intercalés de 4 min de récupération sur 12 semaines d’intervention). À noter également un fort taux d’abandon dans ce groupe. Il importe de souligner que les études citées ne s’intéressent qu’à des personnes avec une obésité modérée.
(2014) rapportent 25 % d’arrêt pour blessure dans le seul groupe à intensité maximale (répétition de sprints de 30 s intercalés de 4 min de récupération sur 12 semaines d’intervention). À noter également un fort taux d’abandon dans ce groupe. Il importe de souligner que les études citées ne s’intéressent qu’à des personnes avec une obésité modérée.Patients atteints de diabète de type 2
 ) est préconisé afin de limiter la survenue des événements indésirables au cours d’une période d’exercice (plus d’informations sont disponibles dans la communication « Diabète de type 1 et exercice »). Même des niveaux élevés de glycémie ne sont pas contre-indiqués avec une pratique d’activité physique, même de forte intensité (ADA, 2004
) est préconisé afin de limiter la survenue des événements indésirables au cours d’une période d’exercice (plus d’informations sont disponibles dans la communication « Diabète de type 1 et exercice »). Même des niveaux élevés de glycémie ne sont pas contre-indiqués avec une pratique d’activité physique, même de forte intensité (ADA, 2004  ; Colberg et coll., 2010
; Colberg et coll., 2010 ). Dans ce cas, il est recommandé de vérifier la bonne hydratation des pratiquants. Les patients diabétiques sont également concernés par d’autres médicamentations, notamment dans le cadre du traitement de pathologies ou risques cardiovasculaires (bêtabloquants, diurétiques, inhibiteurs de l’enzyme de conversion de l’angiotensine, aspirine à faible dose, hypolipidémiants), mais dans l’ensemble, cette médicamentation n’entraîne pas de modifications des réponses à l’effort. Les bêtabloquants, au-delà de leurs effets sur la limitation de la réponse maximale de la fréquence cardiaque, peuvent augmenter le risque d’hypoglycémie non détectée au cours d’un effort physique (Sigal et coll., 1994
). Dans ce cas, il est recommandé de vérifier la bonne hydratation des pratiquants. Les patients diabétiques sont également concernés par d’autres médicamentations, notamment dans le cadre du traitement de pathologies ou risques cardiovasculaires (bêtabloquants, diurétiques, inhibiteurs de l’enzyme de conversion de l’angiotensine, aspirine à faible dose, hypolipidémiants), mais dans l’ensemble, cette médicamentation n’entraîne pas de modifications des réponses à l’effort. Les bêtabloquants, au-delà de leurs effets sur la limitation de la réponse maximale de la fréquence cardiaque, peuvent augmenter le risque d’hypoglycémie non détectée au cours d’un effort physique (Sigal et coll., 1994 ), mais peu de données sont disponibles à ce jour sur ce sujet.
), mais peu de données sont disponibles à ce jour sur ce sujet. ). Ces observations restent à confirmer chez les patients diabétiques de type 2, mais cela ne peut pas être une contre-indication à la pratique d’activité physique (Marwick et coll., 2009
). Ces observations restent à confirmer chez les patients diabétiques de type 2, mais cela ne peut pas être une contre-indication à la pratique d’activité physique (Marwick et coll., 2009 ). Une attention particulière doit être portée sur l’existence potentielle d’une atteinte cardiaque spécifique chez le diabétique de type 2, appelée « cardiomyopathie diabétique » (Derumeaux, 2014
). Une attention particulière doit être portée sur l’existence potentielle d’une atteinte cardiaque spécifique chez le diabétique de type 2, appelée « cardiomyopathie diabétique » (Derumeaux, 2014 ). À ce jour, il n’existe aucun essai clinique randomisé sur les effets de la prise en charge par l’activité physique ayant pour critère d’inclusion cette insuffisance cardiaque diabétique. De manière générale, si les patients associent plusieurs facteurs de risque cardiovasculaire, il semble pertinent de réaliser une épreuve d’effort, mais en dehors de ce cadre, elle n’est pas indispensable pour tous les patients. Ceux qui sont sujets à de l’angor ou à haut risque cardiovasculaire doivent débuter par des programmes d’activités physiques structurés et encadrés par un professionnel (Colberg et coll., 2010
). À ce jour, il n’existe aucun essai clinique randomisé sur les effets de la prise en charge par l’activité physique ayant pour critère d’inclusion cette insuffisance cardiaque diabétique. De manière générale, si les patients associent plusieurs facteurs de risque cardiovasculaire, il semble pertinent de réaliser une épreuve d’effort, mais en dehors de ce cadre, elle n’est pas indispensable pour tous les patients. Ceux qui sont sujets à de l’angor ou à haut risque cardiovasculaire doivent débuter par des programmes d’activités physiques structurés et encadrés par un professionnel (Colberg et coll., 2010 ).
). ). Ces éléments renforcent la nécessité de surveillance afin de limiter l’incidence des pathologies cardiovasculaires discutées plus haut. C’est pourquoi, l’activité physique n’est pas déconseillée chez les patients atteints de rétinopathies. Le principal risque de l’exercice sur une rétinopathie est l’augmentation importante de la pression sanguine dans l’œil ou des secousses importantes qui pourraient enclencher une hémorragie rétinienne. Néanmoins, plusieurs études anciennes incluant plusieurs centaines de patients, ont clairement rapporté l’absence ou un très faible risque d’hémorragie ou d’aggravation de la pathologie au cours de la pratique d’un exercice (Cruickshanks et coll., 1992
). Ces éléments renforcent la nécessité de surveillance afin de limiter l’incidence des pathologies cardiovasculaires discutées plus haut. C’est pourquoi, l’activité physique n’est pas déconseillée chez les patients atteints de rétinopathies. Le principal risque de l’exercice sur une rétinopathie est l’augmentation importante de la pression sanguine dans l’œil ou des secousses importantes qui pourraient enclencher une hémorragie rétinienne. Néanmoins, plusieurs études anciennes incluant plusieurs centaines de patients, ont clairement rapporté l’absence ou un très faible risque d’hémorragie ou d’aggravation de la pathologie au cours de la pratique d’un exercice (Cruickshanks et coll., 1992 ; Schneider et coll., 1992
; Schneider et coll., 1992 ; Cruickshanks et coll., 1995
; Cruickshanks et coll., 1995 ). De plus, Praidou et coll. (2016)
). De plus, Praidou et coll. (2016) ont rapporté, chez 320 patients diabétiques de type 2, que le niveau d’atteinte rétinienne et le niveau d’activité physique étaient inversement corrélés, indépendamment des niveaux d’hémoglobine glyquée HbA1c ou des valeurs de l’indice de masse corporelle. Pour la majorité des patients, il n’y a donc pas de restriction de pratique d’activités physiques, après conseil auprès d’un ophtalmologiste. Pour les cas les plus graves, il semble néanmoins important comme le préconise l’ADA d’éviter des activités physiques très intenses qui pourraient augmenter la pression artérielle au-delà de 170 mmHg ou d’entraîner un risque de manœuvre de Vasalva (Aiello et coll., 2001
ont rapporté, chez 320 patients diabétiques de type 2, que le niveau d’atteinte rétinienne et le niveau d’activité physique étaient inversement corrélés, indépendamment des niveaux d’hémoglobine glyquée HbA1c ou des valeurs de l’indice de masse corporelle. Pour la majorité des patients, il n’y a donc pas de restriction de pratique d’activités physiques, après conseil auprès d’un ophtalmologiste. Pour les cas les plus graves, il semble néanmoins important comme le préconise l’ADA d’éviter des activités physiques très intenses qui pourraient augmenter la pression artérielle au-delà de 170 mmHg ou d’entraîner un risque de manœuvre de Vasalva (Aiello et coll., 2001 ).
). ; Lazarevic et coll., 2007
; Lazarevic et coll., 2007 ) et l’augmentation de la pratique d’activité physique est associée à une diminution du risque de développer une néphropathie. En effet, plusieurs travaux récents (Lin et coll., 2014
) et l’augmentation de la pratique d’activité physique est associée à une diminution du risque de développer une néphropathie. En effet, plusieurs travaux récents (Lin et coll., 2014 ), dont la célèbre The Look Ahead Study (2014)
), dont la célèbre The Look Ahead Study (2014) avec 5 145 patients et un suivi de 8 ans, ont démontré une incidence du développement d’une néphropathie très largement inférieure chez les patients qui ont bénéficié d’une prise en charge supervisée par l’activité physique, mais associée à un programme nutritionnel (HR = 0,69 ; IC 95 % [0,55-0,87] ; p = 0,0016). Le stade d’insuffisance rénale peut également être impacté positivement par l’activité physique en plus de son efficacité sur la qualité de vie (Sheng et coll., 2014
avec 5 145 patients et un suivi de 8 ans, ont démontré une incidence du développement d’une néphropathie très largement inférieure chez les patients qui ont bénéficié d’une prise en charge supervisée par l’activité physique, mais associée à un programme nutritionnel (HR = 0,69 ; IC 95 % [0,55-0,87] ; p = 0,0016). Le stade d’insuffisance rénale peut également être impacté positivement par l’activité physique en plus de son efficacité sur la qualité de vie (Sheng et coll., 2014 ) et doit désormais être inclus dans la prise en charge de ces patients (Wilkinson et coll., 2016
) et doit désormais être inclus dans la prise en charge de ces patients (Wilkinson et coll., 2016 ). Ainsi, comme récemment recommandé par la Société Francophone du Diabète, la complication néphropathique chez le patient diabétique de type 2 n’est pas un frein à la prescription de l’activité physique (Duclos et coll., 2011
). Ainsi, comme récemment recommandé par la Société Francophone du Diabète, la complication néphropathique chez le patient diabétique de type 2 n’est pas un frein à la prescription de l’activité physique (Duclos et coll., 2011 et 2013
et 2013 ).
). ; Fernando et coll., 2014
; Fernando et coll., 2014 ). De manière intéressante, dans une étude randomisée contrôlée chez 78 patients présentant des complications neuropathiques du pied, LeMaster et coll. (2008)
). De manière intéressante, dans une étude randomisée contrôlée chez 78 patients présentant des complications neuropathiques du pied, LeMaster et coll. (2008) se sont intéressés aux effets d’activités physiques en charge sur les blessures du pied. Quelles que soient les lésions plantaires considérées, aucune différence n’est rapportée après 6 et 12 mois de programme, confirmant ainsi des observations antérieures (LeMaster et coll., 2003
se sont intéressés aux effets d’activités physiques en charge sur les blessures du pied. Quelles que soient les lésions plantaires considérées, aucune différence n’est rapportée après 6 et 12 mois de programme, confirmant ainsi des observations antérieures (LeMaster et coll., 2003 ). Armstrong et coll. (2004)
). Armstrong et coll. (2004) rapportent également que le risque d’ulcérations du pied n’augmente pas chez les patients actifs, même avec des activités physiques en charge. Ainsi, la marche, la marche nordique ou encore la course à pied ne sont donc pas à exclure des programmes chez les patients diabétiques avec ou sans neuropathies périphériques, même si les précautions habituelles doivent être respectées (inspection quotidienne des pieds et utilisation de chaussures adaptées pour limiter le risque de chute, visite annuelle chez un spécialiste) (Boulton et coll., 2008
rapportent également que le risque d’ulcérations du pied n’augmente pas chez les patients actifs, même avec des activités physiques en charge. Ainsi, la marche, la marche nordique ou encore la course à pied ne sont donc pas à exclure des programmes chez les patients diabétiques avec ou sans neuropathies périphériques, même si les précautions habituelles doivent être respectées (inspection quotidienne des pieds et utilisation de chaussures adaptées pour limiter le risque de chute, visite annuelle chez un spécialiste) (Boulton et coll., 2008 ; Crews et coll., 2016
; Crews et coll., 2016 ).
). ). Si la prévalence de ces complications ainsi que le risque de mortalité liés à l’exercice physique semblent très faibles, il reste désormais à conduire d’autres travaux afin de renforcer les niveaux de preuve. Les complications doivent donc être identifiées systématiquement afin de permettre une pratique adaptée, en toute sécurité et limitant l’apparition de nouvelles complications ou une aggravation de celles-ci (Riddell et Burr, 2011
). Si la prévalence de ces complications ainsi que le risque de mortalité liés à l’exercice physique semblent très faibles, il reste désormais à conduire d’autres travaux afin de renforcer les niveaux de preuve. Les complications doivent donc être identifiées systématiquement afin de permettre une pratique adaptée, en toute sécurité et limitant l’apparition de nouvelles complications ou une aggravation de celles-ci (Riddell et Burr, 2011 ; Mendes et coll., 2013
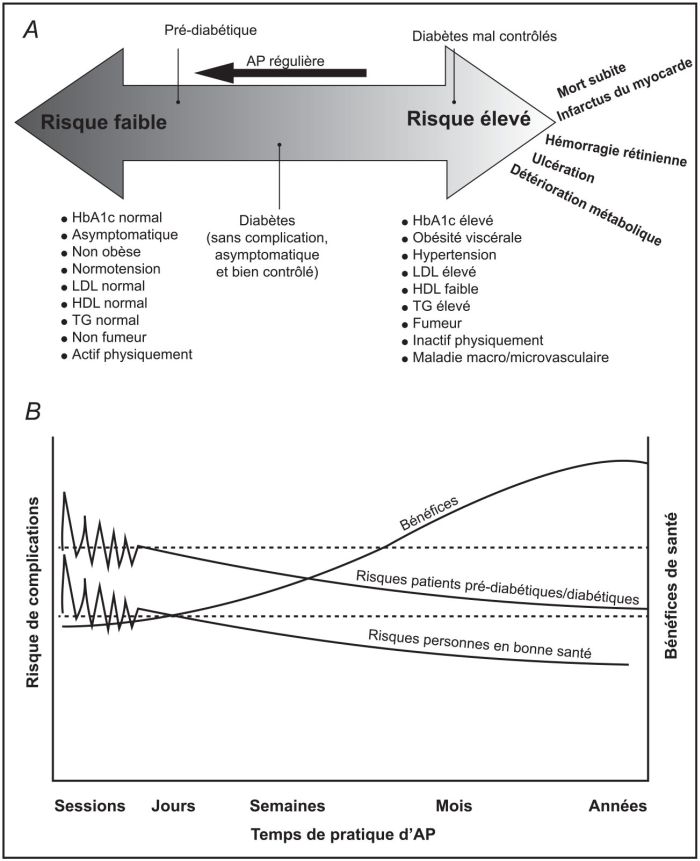
; Mendes et coll., 2013 ) (figure 8.1B
) (figure 8.1B ). Ces mesures préventives sont également indispensables afin de réduire, chez ces patients, la peur de la pratique qui pourrait les conduire à rester sédentaires. Dans ce sens, une étude randomisée contrôlée récente n’a pas rapporté d’effets indésirables graves en lien avec la pratique d’activité physique, quel que soit le programme : endurance, renforcement musculaire ou mixte proposé aux 262 patients suivis sur une année (Church et coll., 2012). Également, Yang et coll.
). Ces mesures préventives sont également indispensables afin de réduire, chez ces patients, la peur de la pratique qui pourrait les conduire à rester sédentaires. Dans ce sens, une étude randomisée contrôlée récente n’a pas rapporté d’effets indésirables graves en lien avec la pratique d’activité physique, quel que soit le programme : endurance, renforcement musculaire ou mixte proposé aux 262 patients suivis sur une année (Church et coll., 2012). Également, Yang et coll. (2014), sur la base de 5 études randomisées contrôlées sur 12 incluses, n’ont pas démontré de différences d’effets indésirables, chez des patients avec ou sans complications, que ce soit avec les programmes d’endurance ou de renforcement musculaire. Au total, il s’agissait de 34 sur 117 et 45 sur 121 événements indésirables respectivement, pour les patients dans les groupes de renforcement musculaire et d’endurance (RR : 1,17 [0,77-1,79] ; p > 0,05). Par conséquent, il est essentiel de rappeler aux patients que les effets bénéfiques de l’activité physique sont nettement supérieurs à ses effets potentiellement indésirables (Riddell et Burr, 2011
(2014), sur la base de 5 études randomisées contrôlées sur 12 incluses, n’ont pas démontré de différences d’effets indésirables, chez des patients avec ou sans complications, que ce soit avec les programmes d’endurance ou de renforcement musculaire. Au total, il s’agissait de 34 sur 117 et 45 sur 121 événements indésirables respectivement, pour les patients dans les groupes de renforcement musculaire et d’endurance (RR : 1,17 [0,77-1,79] ; p > 0,05). Par conséquent, il est essentiel de rappeler aux patients que les effets bénéfiques de l’activité physique sont nettement supérieurs à ses effets potentiellement indésirables (Riddell et Burr, 2011 ).
). ). Cette classification permettrait ainsi d’associer à chacun de ces groupes des natures et niveaux de complications différentes. Un diagnostic plus personnalisé de la pathologie apporterait très certainement une prescription par l’activité physique encore plus adaptée, avec une prise en compte des complications de la maladie et des risques associés.
). Cette classification permettrait ainsi d’associer à chacun de ces groupes des natures et niveaux de complications différentes. Un diagnostic plus personnalisé de la pathologie apporterait très certainement une prescription par l’activité physique encore plus adaptée, avec une prise en compte des complications de la maladie et des risques associés.Bénéfices de l’activité physique sur la condition physique
Personnes obèses
 confirment une meilleure efficacité des entraînements en endurance ou mixte par rapport à l’entraînement en renforcement musculaire pour augmenter le V̇O2max. Plusieurs ERC discutent les effets des différentes modalités des programmes en endurance. À même intensité et même nombre de séances, la V̇O2max augmente dans les mêmes proportions quelle que soit la durée de la séance (Donnelly et coll., 2012
confirment une meilleure efficacité des entraînements en endurance ou mixte par rapport à l’entraînement en renforcement musculaire pour augmenter le V̇O2max. Plusieurs ERC discutent les effets des différentes modalités des programmes en endurance. À même intensité et même nombre de séances, la V̇O2max augmente dans les mêmes proportions quelle que soit la durée de la séance (Donnelly et coll., 2012 ; Rosenkilde et coll., 2012
; Rosenkilde et coll., 2012 ). À même intensité et même volume total, les différences de fréquence de séances par semaine (i.e. 5 séances de 30 min versus 2 séances de 75 min intercalées au minimum d’un jour) n’influencent pas l’augmentation de V̇O2max (Manthou et coll., 2015
). À même intensité et même volume total, les différences de fréquence de séances par semaine (i.e. 5 séances de 30 min versus 2 séances de 75 min intercalées au minimum d’un jour) n’influencent pas l’augmentation de V̇O2max (Manthou et coll., 2015 ). Ces résultats suggèrent une relative flexibilité dans la planification hebdomadaire des séances qui peut s’avérer intéressante, notamment chez les sujets confrontés à un manque de temps ressenti ou avéré au cours de la semaine. Le type d’entraînement intermittent intensif apparaît également comme efficace, avec un gain de temps. En revanche, les protocoles intermittents intensifs proposés sont variables en intensité d’exercice, en cycle exercice-récupération, en type et intensité de récupération, ce qui rend difficile la comparaison entre études. Celles comparant un protocole modéré continu à un protocole intermittent intensif en environnement contrôlé (i.e. laboratoire) rapportent des effets similaires ou supérieurs sur le V̇O2max en intermittent intensif, chez des personnes avec une obésité modérée ou sévère (Sijie et coll., 2012
). Ces résultats suggèrent une relative flexibilité dans la planification hebdomadaire des séances qui peut s’avérer intéressante, notamment chez les sujets confrontés à un manque de temps ressenti ou avéré au cours de la semaine. Le type d’entraînement intermittent intensif apparaît également comme efficace, avec un gain de temps. En revanche, les protocoles intermittents intensifs proposés sont variables en intensité d’exercice, en cycle exercice-récupération, en type et intensité de récupération, ce qui rend difficile la comparaison entre études. Celles comparant un protocole modéré continu à un protocole intermittent intensif en environnement contrôlé (i.e. laboratoire) rapportent des effets similaires ou supérieurs sur le V̇O2max en intermittent intensif, chez des personnes avec une obésité modérée ou sévère (Sijie et coll., 2012 ; Keating et coll., 2014
; Keating et coll., 2014 ; Cocks et coll., 2016
; Cocks et coll., 2016 ). Sur le terrain (séances supervisées en extérieur dans un parc), Lunt et coll. (2014)
). Sur le terrain (séances supervisées en extérieur dans un parc), Lunt et coll. (2014) ont comparé les effets de trois protocoles d’entraînement de 3 séances hebdomadaires pendant 12 semaines chez des hommes et femmes entre 45 et 50 ans avec une obésité modérée : un modéré continu, un intensif intermittent sous-maximal et un intensif intermittent épuisant (« all-out »). Le faible niveau d’adhésion dans les 2 groupes intensifs (9/16 participants dans les 2 groupes à la fin du programme) et la faible augmentation de V̇O2max dans le seul groupe intensif intermittent limitent la conclusion sur la prescription de tels programmes chez les personnes obèses. Dans ce sens, Decker et Ekkekakis (2017)
ont comparé les effets de trois protocoles d’entraînement de 3 séances hebdomadaires pendant 12 semaines chez des hommes et femmes entre 45 et 50 ans avec une obésité modérée : un modéré continu, un intensif intermittent sous-maximal et un intensif intermittent épuisant (« all-out »). Le faible niveau d’adhésion dans les 2 groupes intensifs (9/16 participants dans les 2 groupes à la fin du programme) et la faible augmentation de V̇O2max dans le seul groupe intensif intermittent limitent la conclusion sur la prescription de tels programmes chez les personnes obèses. Dans ce sens, Decker et Ekkekakis (2017) ont participé au débat sur les protocoles intensif intermittent versus continu modéré, en évaluant leurs effets aigus sur la valence affective et le plaisir post-effort chez des jeunes femmes obèses inactives. L’exercice intensif intermittent est considéré comme plus dur, moins agréable et moins plaisant.
ont participé au débat sur les protocoles intensif intermittent versus continu modéré, en évaluant leurs effets aigus sur la valence affective et le plaisir post-effort chez des jeunes femmes obèses inactives. L’exercice intensif intermittent est considéré comme plus dur, moins agréable et moins plaisant. ; Bateman et coll., 2011
; Bateman et coll., 2011 ; Tibana et coll., 2013
; Tibana et coll., 2013 ).
).Patients atteints de diabète de type 2
 ). Une étude publiée dans JAMA en 2010 a démontré également que la capacité aérobie était améliorée avec un programme combinant aérobie et renforcement musculaire en comparaison de programmes strictement en endurance ou de renforcement musculaire (Church et coll., 2010
). Une étude publiée dans JAMA en 2010 a démontré également que la capacité aérobie était améliorée avec un programme combinant aérobie et renforcement musculaire en comparaison de programmes strictement en endurance ou de renforcement musculaire (Church et coll., 2010 ). Cependant, la significativité clinique peut être questionnée puisque cette augmentation de V̇O2max était de 1 (0,5 à 2) mL.min-1.kg-1 après un programme de 9 mois chez les patients diabétiques. Il semble évident également, d’après cette compilation des données, que les meilleures améliorations des capacités fonctionnelles cardiorespiratoires sont obtenues avec les niveaux d’intensité d’exercice les plus importants chez les patients diabétiques de type 2 (Boulé et coll., 2003 ; Balducci et coll., 2012
). Cependant, la significativité clinique peut être questionnée puisque cette augmentation de V̇O2max était de 1 (0,5 à 2) mL.min-1.kg-1 après un programme de 9 mois chez les patients diabétiques. Il semble évident également, d’après cette compilation des données, que les meilleures améliorations des capacités fonctionnelles cardiorespiratoires sont obtenues avec les niveaux d’intensité d’exercice les plus importants chez les patients diabétiques de type 2 (Boulé et coll., 2003 ; Balducci et coll., 2012 ), même si ce n’est pas confirmé par toutes les études (Hansen et coll., 2009
), même si ce n’est pas confirmé par toutes les études (Hansen et coll., 2009 ). Dans ce sens, comme pour les patients obèses, les programmes proposant des exercices intermittents à haute intensité semblent intéressants. En effet, chez des sujets en bonne santé, ces programmes permettent d’obtenir des effets supérieurs à ceux d’un programme à intensité faible à modérée, avec une durée de pratique réduite (Gibala et coll., 2012
). Dans ce sens, comme pour les patients obèses, les programmes proposant des exercices intermittents à haute intensité semblent intéressants. En effet, chez des sujets en bonne santé, ces programmes permettent d’obtenir des effets supérieurs à ceux d’un programme à intensité faible à modérée, avec une durée de pratique réduite (Gibala et coll., 2012 ; Jelleyman et coll., 2015
; Jelleyman et coll., 2015 ). Néanmoins, le peu de travaux et la faible population de patients diabétiques de type 2 inclus dans les études ne permettent pas de conclure à l’efficacité de ces programmes sur les capacités aérobies (Jung et coll., 2015
). Néanmoins, le peu de travaux et la faible population de patients diabétiques de type 2 inclus dans les études ne permettent pas de conclure à l’efficacité de ces programmes sur les capacités aérobies (Jung et coll., 2015 ; Ramos et coll., 2016
; Ramos et coll., 2016 ). Mais, au-delà de l’augmentation de la consommation maximale d’oxygène, l’amélioration des facteurs de risque cardiométaboliques passe par une augmentation importante de la dépense énergétique (Bouchard et coll., 1990
). Mais, au-delà de l’augmentation de la consommation maximale d’oxygène, l’amélioration des facteurs de risque cardiométaboliques passe par une augmentation importante de la dépense énergétique (Bouchard et coll., 1990 ; Duncan et coll., 1991
; Duncan et coll., 1991 ), ce qui n’est pas toujours possible avec les exercices à haute intensité sur des périodes très courtes. La dépense énergétique doit donc être suffisante pour améliorer la condition physique, mais aussi pour améliorer la condition « métabolique » (Desprès et Ross, 2007
), ce qui n’est pas toujours possible avec les exercices à haute intensité sur des périodes très courtes. La dépense énergétique doit donc être suffisante pour améliorer la condition physique, mais aussi pour améliorer la condition « métabolique » (Desprès et Ross, 2007 ). Les programmes basés essentiellement sur des exercices de renforcement musculaire ont un impact moindre sur l’amélioration de la capacité à l’effort aérobie, mais permettent la réduction de certains facteurs de risque cardiovasculaires (métabolisme du glucose et sensibilité à l’insuline, profil lipidique et pression artérielle notamment) (Thomas et coll., 2006
). Les programmes basés essentiellement sur des exercices de renforcement musculaire ont un impact moindre sur l’amélioration de la capacité à l’effort aérobie, mais permettent la réduction de certains facteurs de risque cardiovasculaires (métabolisme du glucose et sensibilité à l’insuline, profil lipidique et pression artérielle notamment) (Thomas et coll., 2006 ; Gordon et coll., 2009
; Gordon et coll., 2009 ). De plus, ils permettent une amélioration des capacités musculaires (force notamment), sachant qu’il a été largement démontré à ce jour qu’elles participent à un meilleur contrôle glycémique chez le patient diabétique de type 2 (Colberg et coll., 2010
). De plus, ils permettent une amélioration des capacités musculaires (force notamment), sachant qu’il a été largement démontré à ce jour qu’elles participent à un meilleur contrôle glycémique chez le patient diabétique de type 2 (Colberg et coll., 2010 ). Dans ce sens, la mise en place d’un programme combiné ou d’une activité physique permettant d’associer les deux qualités physiques semble indiquée chez le patient diabétique de type 2.
). Dans ce sens, la mise en place d’un programme combiné ou d’une activité physique permettant d’associer les deux qualités physiques semble indiquée chez le patient diabétique de type 2. ). Ces recommandations existantes pour les personnes âgées peuvent être transférables dans le diabète de type 2, dont la prévalence est importante chez les plus de 65 ans (Fagot-Campagna et coll., 2005
). Ces recommandations existantes pour les personnes âgées peuvent être transférables dans le diabète de type 2, dont la prévalence est importante chez les plus de 65 ans (Fagot-Campagna et coll., 2005 ). Des travaux ont démontré l’importance du développement de ces capacités chez les patients diabétiques de type 2 (Morrison et coll., 2010
). Des travaux ont démontré l’importance du développement de ces capacités chez les patients diabétiques de type 2 (Morrison et coll., 2010 ; Salsabili et coll., 2011
; Salsabili et coll., 2011 ).
).Bénéfices de l’activité physique sur les variables biologiques et physiologiques majeures
Patients obèses
 rapportent une diminution de -2,03 kg dans les groupes exercice seul par rapport aux groupes contrôles (12 ERC). L’exercice associé à une diète majore légèrement les effets de la diète seule (Shaw et coll., 2006
rapportent une diminution de -2,03 kg dans les groupes exercice seul par rapport aux groupes contrôles (12 ERC). L’exercice associé à une diète majore légèrement les effets de la diète seule (Shaw et coll., 2006 ; Miller et coll., 2013
; Miller et coll., 2013 ). Plus récemment, Washburn et coll. (2014)
). Plus récemment, Washburn et coll. (2014) , dans leur revue incluant 20 ERC axées sur les effets à long terme (au minimum 6 mois de suivi) de régime seul, d’exercice seul ou les deux associés sur la perte de poids, concluent à un niveau d’évidence faible sur la supériorité des interventions associant diète – exercice par rapport aux deux premières. Seuls les programmes en endurance et mixte (endurance et renforcement musculaire) engendrent une perte de poids, sans différence entre ces deux modalités, un programme en renforcement musculaire étant inefficace (Thorogood, 2011
, dans leur revue incluant 20 ERC axées sur les effets à long terme (au minimum 6 mois de suivi) de régime seul, d’exercice seul ou les deux associés sur la perte de poids, concluent à un niveau d’évidence faible sur la supériorité des interventions associant diète – exercice par rapport aux deux premières. Seuls les programmes en endurance et mixte (endurance et renforcement musculaire) engendrent une perte de poids, sans différence entre ces deux modalités, un programme en renforcement musculaire étant inefficace (Thorogood, 2011 ; Schwingshackl, 2013
; Schwingshackl, 2013 ; Pattyn, 2013
; Pattyn, 2013 ). Quand l’exercice est associé à une diète, il semble que la meilleure combinaison pour perdre du poids et modifier la composition corporelle soit l’association diète et programme en renforcement musculaire (Clark, 2015
). Quand l’exercice est associé à une diète, il semble que la meilleure combinaison pour perdre du poids et modifier la composition corporelle soit l’association diète et programme en renforcement musculaire (Clark, 2015 ). L’exercice à forte intensité paraît plus efficace que l’exercice à faible intensité pour perdre du poids. Ce résultat rapporté par la revue Cochrane de Shaw
). L’exercice à forte intensité paraît plus efficace que l’exercice à faible intensité pour perdre du poids. Ce résultat rapporté par la revue Cochrane de Shaw (2006) est confirmé par la méta-analyse récente de Clark (2015)
(2006) est confirmé par la méta-analyse récente de Clark (2015) incluant 66 études. L’exercice en endurance à forte intensité mais également l’exercice fractionné engendre une diminution plus importante de poids (Clark, 2015
incluant 66 études. L’exercice en endurance à forte intensité mais également l’exercice fractionné engendre une diminution plus importante de poids (Clark, 2015 ). Il importe de noter que des programmes de marche à pied permettent aussi de diminuer légèrement le poids (-1,27 kg ; IC 95 % [-1,85 à -0,70 kg]) (Richardson et coll., 2008
). Il importe de noter que des programmes de marche à pied permettent aussi de diminuer légèrement le poids (-1,27 kg ; IC 95 % [-1,85 à -0,70 kg]) (Richardson et coll., 2008 ). La pratique du yoga diminue l’IMC chez les personnes obèses (SMD = -0,99 ; IC 95 % [-1,67 à -0,31] ; p = 0,004) même s’il faut noter une hétérogénéité importante dans les études inclues dans la méta-analyse récente de Lauche et coll. (2016)
). La pratique du yoga diminue l’IMC chez les personnes obèses (SMD = -0,99 ; IC 95 % [-1,67 à -0,31] ; p = 0,004) même s’il faut noter une hétérogénéité importante dans les études inclues dans la méta-analyse récente de Lauche et coll. (2016) . Les différences de volume d’entraînement (300 ou 400 kcal/session versus 600 kcal/session) induisent paradoxalement les mêmes diminutions chez des personnes en surpoids ou avec une obésité modérée (Church et coll., 2009 ; Rosenkilde et coll., 2012
. Les différences de volume d’entraînement (300 ou 400 kcal/session versus 600 kcal/session) induisent paradoxalement les mêmes diminutions chez des personnes en surpoids ou avec une obésité modérée (Church et coll., 2009 ; Rosenkilde et coll., 2012 ; Donnelly et coll., 2013). La différence entre la perte de poids attendue et réelle, notamment dans les hautes doses d’exercice, s’explique principalement par un apport calorique augmenté compensatoire et/ou une dose d’activité physique trop faible (Rosenkilde et coll., 2012
; Donnelly et coll., 2013). La différence entre la perte de poids attendue et réelle, notamment dans les hautes doses d’exercice, s’explique principalement par un apport calorique augmenté compensatoire et/ou une dose d’activité physique trop faible (Rosenkilde et coll., 2012 ; Thomas et coll., 2012
; Thomas et coll., 2012 ; Alkahtani et coll., 2014
; Alkahtani et coll., 2014 ). Des modifications du métabolisme de base et/ou de masse musculaire peuvent également être impliquées (Rosenkilde et coll., 2012
). Des modifications du métabolisme de base et/ou de masse musculaire peuvent également être impliquées (Rosenkilde et coll., 2012 ). Ces différents facteurs explicatifs évoluent différemment chez les répondeurs (perte de poids ≥ 5 %) et les non-répondeurs (perte de poids < 5 %) (Herrmann et coll., 2015
). Ces différents facteurs explicatifs évoluent différemment chez les répondeurs (perte de poids ≥ 5 %) et les non-répondeurs (perte de poids < 5 %) (Herrmann et coll., 2015 ). L’effet du genre sur la perte de poids reste peu étudié car il existe une sous-représentation des hommes dans les études interventionnelles dont l’objectif principal est la perte de poids (27 % d’hommes versus 73 % femmes) et ce, quelle que soit la modalité d’intervention (exercice, diète ou les deux) (Pagoto et coll., 2012
). L’effet du genre sur la perte de poids reste peu étudié car il existe une sous-représentation des hommes dans les études interventionnelles dont l’objectif principal est la perte de poids (27 % d’hommes versus 73 % femmes) et ce, quelle que soit la modalité d’intervention (exercice, diète ou les deux) (Pagoto et coll., 2012 ).
). ; Kukkonen-Harjula et coll., 2005
; Kukkonen-Harjula et coll., 2005 ). Ils rapportent des résultats divergents en partie expliqués par une faible adhésion au programme, une prescription de la quantité d’exercice variable et des différences dans les durées de suivi (Catenacci et coll., 2007
). Ils rapportent des résultats divergents en partie expliqués par une faible adhésion au programme, une prescription de la quantité d’exercice variable et des différences dans les durées de suivi (Catenacci et coll., 2007 ). La meilleure combinaison pour le maintien de la perte de poids est l’association : amélioration des habitudes alimentaires et augmentation de l’activité physique. Ainsi, le maintien de plus de 10 % de perte de poids à 2 ans était obtenu seulement dans le groupe de patients obèses pratiquant 275 min/semaine d’activité physique (Jakicic et coll., 2008
). La meilleure combinaison pour le maintien de la perte de poids est l’association : amélioration des habitudes alimentaires et augmentation de l’activité physique. Ainsi, le maintien de plus de 10 % de perte de poids à 2 ans était obtenu seulement dans le groupe de patients obèses pratiquant 275 min/semaine d’activité physique (Jakicic et coll., 2008 ). Dans sa méta-analyse incluant des ERC centrées sur les effets de médicaments anti-obésité, de diète et/ou d’exercice (3 ERC, n = 146) sur le maintien de la perte de poids suite à un régime à faibles ou très faibles calories, Johansson et coll. (2014)
). Dans sa méta-analyse incluant des ERC centrées sur les effets de médicaments anti-obésité, de diète et/ou d’exercice (3 ERC, n = 146) sur le maintien de la perte de poids suite à un régime à faibles ou très faibles calories, Johansson et coll. (2014) rapportent un effet non significatif de l’exercice (0,8 kg IC 95 % [-1,2 à 2,8], durée moyenne de suivi de 6 à 10 mois). Les programmes d’activité physique proposés dans les seules 3 ERC incluses dans cette méta-analyse étaient de la marche ou des exercices de renforcement musculaire (Fogelholm et coll., 2000
rapportent un effet non significatif de l’exercice (0,8 kg IC 95 % [-1,2 à 2,8], durée moyenne de suivi de 6 à 10 mois). Les programmes d’activité physique proposés dans les seules 3 ERC incluses dans cette méta-analyse étaient de la marche ou des exercices de renforcement musculaire (Fogelholm et coll., 2000 ; Borg et coll., 2002
; Borg et coll., 2002 ; Christensen et coll., 2013
; Christensen et coll., 2013 ). Les études observationnelles ou rétrospectives concluent elles aussi à une relation forte entre l’activité physique et le maintien de la perte de poids (Catenacci et coll., 2007
). Les études observationnelles ou rétrospectives concluent elles aussi à une relation forte entre l’activité physique et le maintien de la perte de poids (Catenacci et coll., 2007 ; Soleymani et coll., 2016
; Soleymani et coll., 2016 ). Pour exemple, la base de données américaine Registre National du Contrôle du Poids, étude observationnelle sur 10 ans, inclut des personnes avec une perte de poids initiale supérieure à 13,6 kg et un maintien d’au moins un an. Les caractéristiques communes des personnes ayant maintenu leur perte de poids sont une modification de leur régime, une activité physique augmentée, avec la marche comme activité physique la plus fréquente : en moyenne 1 h d’activité physique par jour, un auto-contrôle des apports caloriques et de l’activité physique (Phelan et coll., 2006
). Pour exemple, la base de données américaine Registre National du Contrôle du Poids, étude observationnelle sur 10 ans, inclut des personnes avec une perte de poids initiale supérieure à 13,6 kg et un maintien d’au moins un an. Les caractéristiques communes des personnes ayant maintenu leur perte de poids sont une modification de leur régime, une activité physique augmentée, avec la marche comme activité physique la plus fréquente : en moyenne 1 h d’activité physique par jour, un auto-contrôle des apports caloriques et de l’activité physique (Phelan et coll., 2006 ). Plus récemment, à partir de ce même registre, Catenacci et coll.
). Plus récemment, à partir de ce même registre, Catenacci et coll. (2014) ont réparti les personnes ayant maintenu leur perte de poids en 4 groupes en fonction de leur niveau d’activité physique habituel à l’inclusion (évalué par questionnaire). Les patients rapportant les plus hauts niveaux d’activité physique maintiennent davantage leur perte de poids. Ceux avec un haut niveau d’activité physique à l’inclusion sont aussi engagés dans des habitudes alimentaires plus saines. De façon intéressante, l’étude ancillaire « Look AHEAD Movement and memory » rapporte un maintien de la condition physique (sauf la qualité de force) de 8 ans, chez les patients obèses diabétiques randomisés dans le groupe intervention intensive (diète et exercice) comparé au groupe éducation (Houston et coll., 2015
(2014) ont réparti les personnes ayant maintenu leur perte de poids en 4 groupes en fonction de leur niveau d’activité physique habituel à l’inclusion (évalué par questionnaire). Les patients rapportant les plus hauts niveaux d’activité physique maintiennent davantage leur perte de poids. Ceux avec un haut niveau d’activité physique à l’inclusion sont aussi engagés dans des habitudes alimentaires plus saines. De façon intéressante, l’étude ancillaire « Look AHEAD Movement and memory » rapporte un maintien de la condition physique (sauf la qualité de force) de 8 ans, chez les patients obèses diabétiques randomisés dans le groupe intervention intensive (diète et exercice) comparé au groupe éducation (Houston et coll., 2015 ). Dans le même sens, l’augmentation du niveau de condition physique contribue à la diminution sur le long terme (3 ans) de la masse grasse et de la masse grasse viscérale (programme SYNERGIE) (Borel et coll., 2017
). Dans le même sens, l’augmentation du niveau de condition physique contribue à la diminution sur le long terme (3 ans) de la masse grasse et de la masse grasse viscérale (programme SYNERGIE) (Borel et coll., 2017 ).
). qui rapporte une perte de poids supérieure en moyenne de 3,62 kg dans les groupes exercés par comparaison avec les groupes non-exercés.
qui rapporte une perte de poids supérieure en moyenne de 3,62 kg dans les groupes exercés par comparaison avec les groupes non-exercés. ). Celle-ci diminue significativement suite à un entraînement en endurance ou mixte chez les personnes obèses et les patients ayant un syndrome métabolique (Pattyn et coll., 2013
). Celle-ci diminue significativement suite à un entraînement en endurance ou mixte chez les personnes obèses et les patients ayant un syndrome métabolique (Pattyn et coll., 2013 ; Schwingshackl et coll., 2013
; Schwingshackl et coll., 2013 ; Clark et Goon, 2015
; Clark et Goon, 2015 ). L’exercice en endurance induit une lypolyse par une augmentation des catécholamines, de l’hormone de croissance et des peptides natriurétiques cardiaques ainsi que la baisse de l’insuline. L’entraînement améliore cette utilisation des lipides. L’utilisation des substrats à l’exercice diffère selon l’intensité : un exercice d’intensité modérée, par exemple au Lipoxmax (Pérez-Martin et coll., 2001
). L’exercice en endurance induit une lypolyse par une augmentation des catécholamines, de l’hormone de croissance et des peptides natriurétiques cardiaques ainsi que la baisse de l’insuline. L’entraînement améliore cette utilisation des lipides. L’utilisation des substrats à l’exercice diffère selon l’intensité : un exercice d’intensité modérée, par exemple au Lipoxmax (Pérez-Martin et coll., 2001 ), engendre une oxydation des lipides au cours de l’exercice, tandis qu’un exercice intensif l’engendre au cours de la récupération (Pillard et coll., 2010
), engendre une oxydation des lipides au cours de l’exercice, tandis qu’un exercice intensif l’engendre au cours de la récupération (Pillard et coll., 2010 ). Dès lors, quelle intensité choisir pour une plus grande utilisation des lipides et par suite la perte possible de masse grasse, même si cette relation semble plus complexe ? Chez l’obèse, suite à des programmes courts, les deux types d’entraînement (modéré continu versus intensif intermittent) ont pour effet une même augmentation de l’oxydation des lipides à l’exercice (Alkahtani et coll., 2013
). Dès lors, quelle intensité choisir pour une plus grande utilisation des lipides et par suite la perte possible de masse grasse, même si cette relation semble plus complexe ? Chez l’obèse, suite à des programmes courts, les deux types d’entraînement (modéré continu versus intensif intermittent) ont pour effet une même augmentation de l’oxydation des lipides à l’exercice (Alkahtani et coll., 2013 ; Lanzi et coll., 2015
; Lanzi et coll., 2015 ). Par contre, leurs effets sur la masse grasse totale sont plus controversés, avec soit la même diminution, soit une diminution plus grande suite au protocole intensif intermittent (Sijie et coll., 2012
). Par contre, leurs effets sur la masse grasse totale sont plus controversés, avec soit la même diminution, soit une diminution plus grande suite au protocole intensif intermittent (Sijie et coll., 2012 ; Keating et coll., 2014
; Keating et coll., 2014 ).
). ). En effet, le tissu adipeux abdominal n’est pas métaboliquement inerte mais au contraire physiologiquement actif. Il participe aux régulations métaboliques via la sécrétion d’AGL (acides gras libres), d’adipokines entretenant un état inflammatoire chronique de bas grade. L’analyse de l’état de l’art, reposant notamment sur les méta-analyses de Ohkawara et coll.
). En effet, le tissu adipeux abdominal n’est pas métaboliquement inerte mais au contraire physiologiquement actif. Il participe aux régulations métaboliques via la sécrétion d’AGL (acides gras libres), d’adipokines entretenant un état inflammatoire chronique de bas grade. L’analyse de l’état de l’art, reposant notamment sur les méta-analyses de Ohkawara et coll. (2007), Ismail et coll. (2012)
(2007), Ismail et coll. (2012) , Vissers et coll. (2013)
, Vissers et coll. (2013) et Verheggen et coll. (2016)
et Verheggen et coll. (2016) , permet clairement d’établir que l’entraînement en endurance diminue significativement la masse grasse viscérale avec ou sans perte de poids associé (tableau 8.I). En absence de perte de poids, une diminution de 6,1 % de masse grasse viscérale est observée avec l’exercice (Verheggen et coll., 2016
, permet clairement d’établir que l’entraînement en endurance diminue significativement la masse grasse viscérale avec ou sans perte de poids associé (tableau 8.I). En absence de perte de poids, une diminution de 6,1 % de masse grasse viscérale est observée avec l’exercice (Verheggen et coll., 2016 ). Il est intéressant de noter que l’exercice est plus efficace que la diète pour induire une diminution de la masse grasse viscérale (Verheggen et coll., 2016
). Il est intéressant de noter que l’exercice est plus efficace que la diète pour induire une diminution de la masse grasse viscérale (Verheggen et coll., 2016 ). Autant Ohkawara et coll.
). Autant Ohkawara et coll. (2007) notent une relation linéaire significative (r = -0,75) entre la dose d’exercice aérobie (notion METs h/semaine) et la perte de masse grasse viscérale chez les personnes obèses métaboliquement saines, avec une valeur minimale de 10 METs h/semaine, autant cette relation n’est pas retrouvée dans la méta-analyse d’Ismail et coll. (2012)
(2007) notent une relation linéaire significative (r = -0,75) entre la dose d’exercice aérobie (notion METs h/semaine) et la perte de masse grasse viscérale chez les personnes obèses métaboliquement saines, avec une valeur minimale de 10 METs h/semaine, autant cette relation n’est pas retrouvée dans la méta-analyse d’Ismail et coll. (2012) , qui ne différencie pas les sous-groupes de personnes obèses. Les intensités d’exercice aérobie modérée à forte sont plus efficaces pour diminuer la masse grasse viscérale que les intensités faibles (< 60 % FCmax ou < 45 % V̇O2max) (Vissers et coll., 2013
, qui ne différencie pas les sous-groupes de personnes obèses. Les intensités d’exercice aérobie modérée à forte sont plus efficaces pour diminuer la masse grasse viscérale que les intensités faibles (< 60 % FCmax ou < 45 % V̇O2max) (Vissers et coll., 2013 ). L’entraînement en renforcement musculaire n’engendre pas de modifications significatives de la masse grasse viscérale (Ismail et coll., 2012
). L’entraînement en renforcement musculaire n’engendre pas de modifications significatives de la masse grasse viscérale (Ismail et coll., 2012 ; Vissers et coll., 2013
; Vissers et coll., 2013 ). Ainsi, les 14 ERC inclues dans la méta-analyse d’Ismail et coll.
). Ainsi, les 14 ERC inclues dans la méta-analyse d’Ismail et coll. (2012) évaluant les effets d’exercices de renforcement musculaire sur cette masse grasse viscérale concluent à une absence d’effet (taille de l’effet 0,09, IC 95 % [-0,17 à -0,36], p = 0,49). Au travers des 4 ERC inclues dans la méta-analyse d’Ismail et coll.
(2012) évaluant les effets d’exercices de renforcement musculaire sur cette masse grasse viscérale concluent à une absence d’effet (taille de l’effet 0,09, IC 95 % [-0,17 à -0,36], p = 0,49). Au travers des 4 ERC inclues dans la méta-analyse d’Ismail et coll. (2012), la combinaison de l’entraînement en endurance et l’entraînement de renforcement musculaire n’induit pas de réduction significative de la masse grasse viscérale. Des travaux complémentaires sur cette modalité d’entraînement sont nécessaires afin de mieux appréhender ses effets sur la masse grasse viscérale. En accord avec ces résultats, les auteurs préconisent qu’additionner un entraînement en renforcement musculaire à l’endurance ne devrait pas se faire au détriment du volume consacré à l’endurance.
(2012), la combinaison de l’entraînement en endurance et l’entraînement de renforcement musculaire n’induit pas de réduction significative de la masse grasse viscérale. Des travaux complémentaires sur cette modalité d’entraînement sont nécessaires afin de mieux appréhender ses effets sur la masse grasse viscérale. En accord avec ces résultats, les auteurs préconisent qu’additionner un entraînement en renforcement musculaire à l’endurance ne devrait pas se faire au détriment du volume consacré à l’endurance.Tableau 8.I Effets de l’activité physique seule sur la masse grasse viscérale (MGV) : résultats des méta-analyses publiées
|
Référence
|
N/type études
|
Population
|
Type d’intervention
|
Mesure MGV
|
Résultats
|
||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
|
N
|
Sexe
|
Âge
(ans)
|
IMC
|
Nature
|
Intensité
|
Fréquence
|
Durée
|
||||
|
Ohkawara
et coll.,
|
9 ERC
7 nERC
|
582
|
F-H
|
20-60
|
26,2 à 32,9
|
Aérobie
|
5,9 à 47,1 METs/h/sem
|
3 à 7/sem
|
8 sem à 1 an :
10 groupes ≤ 16 sem
11 groupes > 16 sem
|
CT ou IRM
|
17 études ↓, 4 NS
Relation dose-réponse entre Aérobie et ↓ MGV chez les seules personnes obèses métaboliquement saines (n = 425)
Relation entre METs h/sem et ↓ MGV chez les femmes métaboliquement saines ou non
Intervention ≤ 16 sem plus efficace
|
|
Ismail
et coll.,
|
35 ERC
|
2 145
|
17 ERC F
4 ERC H
11 H-F
|
28-83
|
30 à 36,7 (18 RCT)
25,3 à 29,7 (15 RCT) 22,0 à 23,9 (2 RCT)
|
Aérobie (27 ERC)
Endurance musculaire
(14 ERC)
Mixte (6 ERC)
|
60-75 % FCmax
30-100 % 1-RM
|
1 à 7/sem
2 à 5/sem
3 à 6/sem
|
4 à 52 sem
12 à 104 sem
|
CT ou IRM
|
Aérobie vs Témoin : ↓ avec l’aérobie (ES = -0,33 ; IC 95 % [-0,52 à -0,14] p < 0.01)
↓ MGV présente avec ou sans perte de poids
Force vs Témoin : pas d’effet significatif (ES = 0,09 ; IC 95 % [-0,17 à 0,36] p = 0,49)
Aérobie vs Force : tendance à un effet supérieur de l’aérobie (ES = 0,23 ; IC 95 % [-0,02 à 0,5] p = 0,07)
Combiné vs Témoin : pas d’effet significatif (ES = -0,28 ; IC 95 % [-0,69 à 0,14] p = 0,19)
|
|
Vissers
et coll.,
|
9 ERC
6 nERC
|
852
|
6-F
6-H
2-F-H
|
30 à 73
|
27,4 à 34
|
Aérobie (13 ERC)
Endurance musculaire
(2 ERC)
Mixte (2 ERC)
|
50-80 % FCmax
3 fois
8-12 répétitions/
exercice
|
3 à 7/sem
2 à 3/sem
|
10 sem à 1 an
8 à 12 mois
8 à 12 mois
|
CT ou IRM
|
SMD = -0,464, IC 95 % [-0,313 à -0,616] p < 0,01
Effet sexe : chez les femmes (-0,550) et chez les hommes (-0,589)
Nature ex : ↓ > en Aérobie -0,550) qu’en force (-0,529), pas d’effet avec Combiné
Intensité ex : ↓ significative MGV seulement avec modéré à forte
|
|
Verheggen
et coll.,
|
50 ERC et nERC
|
2 411
|
F-H
|
21 à 73
|
24,9 à 36,9
|
Aérobie
|
Faible à vigoureuse
|
3 à 7/sem
|
4 à 65 sem
|
CT ou IRM
|
SMD = -0,47, IC 95 % [-0,56 à -0,39] p < 0,0001
Corrélation modérée entre perte de poids et diminution MGV (r2 = 0,453, p < 0,001)
|
ERC : Essai Randomisé Contrôlé ; nERC : Essai non Randomisé Contrôlé ; IRM : Imagerie par résonance magnétique ; CT : Tomographie ; ES : Effect size ; SMD : Standard mean difference.
 (2013), dans leur méta-analyse, notent une diminution du tour de taille chez les personnes en surpoids ou obèses avec un entraînement mixte, identique à celui avec un entraînement en endurance seul, mais significativement supérieure par rapport à un entraînement en renforcement musculaire. Pattyn et coll.
(2013), dans leur méta-analyse, notent une diminution du tour de taille chez les personnes en surpoids ou obèses avec un entraînement mixte, identique à celui avec un entraînement en endurance seul, mais significativement supérieure par rapport à un entraînement en renforcement musculaire. Pattyn et coll. (2013) rapportent également, chez des personnes présentant un syndrome métabolique, une réduction du tour de taille suite non seulement à un entraînement en endurance seul (7 ERC) mais aussi à un entraînement en renforcement musculaire (1 ERC) ou encore mixte (2 ERC). Enfin, la perte de masse maigre est conséquente suite à un régime seul, alors qu’elle est réduite si de l’exercice physique est associé au régime (Hunter et coll., 2008
(2013) rapportent également, chez des personnes présentant un syndrome métabolique, une réduction du tour de taille suite non seulement à un entraînement en endurance seul (7 ERC) mais aussi à un entraînement en renforcement musculaire (1 ERC) ou encore mixte (2 ERC). Enfin, la perte de masse maigre est conséquente suite à un régime seul, alors qu’elle est réduite si de l’exercice physique est associé au régime (Hunter et coll., 2008 ; Miller et coll., 2013
; Miller et coll., 2013 ; Clark, 2015
; Clark, 2015 ). Sans régime associé, un entraînement en renforcement musculaire seul ou combiné augmente plus la masse maigre qu’un entraînement en endurance (Schwingshackl et coll., 2013
). Sans régime associé, un entraînement en renforcement musculaire seul ou combiné augmente plus la masse maigre qu’un entraînement en endurance (Schwingshackl et coll., 2013 ). Ce résultat accentue le fait de ne pas se focaliser sur la perte de poids mais bien sur les changements de composition corporelle (c’est-à-dire masse grasse et masse musculaire). Cette prise de masse musculaire entraîne un gain fonctionnel, un métabolisme de base plus élevé et équivaut à une augmentation de tissu insulino-sensible, limitant ainsi le développement de l’insulino-résistance et du diabète de type 2.
). Ce résultat accentue le fait de ne pas se focaliser sur la perte de poids mais bien sur les changements de composition corporelle (c’est-à-dire masse grasse et masse musculaire). Cette prise de masse musculaire entraîne un gain fonctionnel, un métabolisme de base plus élevé et équivaut à une augmentation de tissu insulino-sensible, limitant ainsi le développement de l’insulino-résistance et du diabète de type 2.Patients atteints de diabète de type 2
 ; Hordern et coll., 2012
; Hordern et coll., 2012 ). Les effets de l’activité physique chez le patient diabétique de type 2 ont fait l’objet de très nombreuses études randomisées et contrôlées et qui ont également été compilées dans plusieurs méta-analyses de grande ampleur depuis 2006. Les résultats sont particulièrement intéressants sur le contrôle de la glycémie, largement reconnue comme un facteur de risque majeur d’apparitions des complications de cette pathologie. L’exercice aérobie a longtemps été le type d’activité physique indiqué pour réduire la glycémie et l’insulino-résistance. En effet, une semaine d’exercice suffit à modifier la sensibilité à l’insuline chez le diabétique de type 2, et ceci peut être le cas même lors d’une séance unique avec des effets entre quelques heures à 3 jours (Boulé et coll., 2001
). Les effets de l’activité physique chez le patient diabétique de type 2 ont fait l’objet de très nombreuses études randomisées et contrôlées et qui ont également été compilées dans plusieurs méta-analyses de grande ampleur depuis 2006. Les résultats sont particulièrement intéressants sur le contrôle de la glycémie, largement reconnue comme un facteur de risque majeur d’apparitions des complications de cette pathologie. L’exercice aérobie a longtemps été le type d’activité physique indiqué pour réduire la glycémie et l’insulino-résistance. En effet, une semaine d’exercice suffit à modifier la sensibilité à l’insuline chez le diabétique de type 2, et ceci peut être le cas même lors d’une séance unique avec des effets entre quelques heures à 3 jours (Boulé et coll., 2001 ). Ces effets passent notamment par des mécanismes complexes dont l’augmentation de l’activité des protéines impliquées dans le métabolisme glucidique ou la signalisation de l’insuline (Sylow et coll., 2017
). Ces effets passent notamment par des mécanismes complexes dont l’augmentation de l’activité des protéines impliquées dans le métabolisme glucidique ou la signalisation de l’insuline (Sylow et coll., 2017 ). Le renforcement musculaire améliore également la glycémie et la sensibilité à l’insuline chez les patients diabétiques de type 2 (Yang et coll., 2014
). Le renforcement musculaire améliore également la glycémie et la sensibilité à l’insuline chez les patients diabétiques de type 2 (Yang et coll., 2014 ). Au-delà de l’effet transitoire en réponse à un exercice aigu, l’augmentation de la masse musculaire est un élément essentiel permettant un captage musculaire plus important du glucose (Willey et coll., 2003
). Au-delà de l’effet transitoire en réponse à un exercice aigu, l’augmentation de la masse musculaire est un élément essentiel permettant un captage musculaire plus important du glucose (Willey et coll., 2003 ).
). ). Les recommandations actuelles de la Haute Autorité de santé (HAS) fixent pour objectif une HbA1c inférieure à 7 % pour la plupart des cas de diabète de type 2. Cependant, il est à noter qu’une étude récente basée sur la cohorte ADVANCE a démontré l’intérêt d’un contrôle intensif de la glycémie (cible HbA1c < 6,5 %) pour une réduction plus importante des complications macro et microvasculaires en comparaison avec un objectif standard (cible HbA1c < 7 %) (Van der Leeuw et coll., 2016
). Les recommandations actuelles de la Haute Autorité de santé (HAS) fixent pour objectif une HbA1c inférieure à 7 % pour la plupart des cas de diabète de type 2. Cependant, il est à noter qu’une étude récente basée sur la cohorte ADVANCE a démontré l’intérêt d’un contrôle intensif de la glycémie (cible HbA1c < 6,5 %) pour une réduction plus importante des complications macro et microvasculaires en comparaison avec un objectif standard (cible HbA1c < 7 %) (Van der Leeuw et coll., 2016 ).
). ). Plusieurs revues systématiques et méta-analyses rigoureuses, dont une analyse Cochrane, ont rapporté qu’une activité physique seule, pratiquée avec une intensité modérée à soutenue, a un effet significatif et cliniquement efficient sur l’HbA1c (Thomas et coll., 2006
). Plusieurs revues systématiques et méta-analyses rigoureuses, dont une analyse Cochrane, ont rapporté qu’une activité physique seule, pratiquée avec une intensité modérée à soutenue, a un effet significatif et cliniquement efficient sur l’HbA1c (Thomas et coll., 2006 , 2009 ; Chudyk et Petrella, 2011
, 2009 ; Chudyk et Petrella, 2011 ; Röhling et coll., 2016
; Röhling et coll., 2016 ; Huang et coll., 2016
; Huang et coll., 2016 ). D’autres travaux sur des grands nombres (de 1 000 à plus de 8 000 patients issus de plusieurs dizaines d’essais randomisés contrôlés) ont confirmé ces observations, mais il existait entre 11 et 21 % d’études proposant également une diète alimentaire associée (Snowling et Hopkins, 2006
). D’autres travaux sur des grands nombres (de 1 000 à plus de 8 000 patients issus de plusieurs dizaines d’essais randomisés contrôlés) ont confirmé ces observations, mais il existait entre 11 et 21 % d’études proposant également une diète alimentaire associée (Snowling et Hopkins, 2006 ; Umpierre et coll., 2011
; Umpierre et coll., 2011 ). Toutes les formes d’exercice diminuent de manière faible à modérée l’HbA1c et ces effets sont comparables à ceux retrouvés dans la littérature pour les programmes nutritionnels, l’utilisation de médicaments spécifiques ou de traitements à l’insuline (-0,5 à 1,5 %) (Snowling et Hopkins, 2006
). Toutes les formes d’exercice diminuent de manière faible à modérée l’HbA1c et ces effets sont comparables à ceux retrouvés dans la littérature pour les programmes nutritionnels, l’utilisation de médicaments spécifiques ou de traitements à l’insuline (-0,5 à 1,5 %) (Snowling et Hopkins, 2006 ; Chudyk et Petrella, 2011
; Chudyk et Petrella, 2011 ). Le tableau 8.II
). Le tableau 8.II présente en détail l’ensemble de ces études. Cette amélioration d’HbA1c s’explique notamment par la diminution de la production hépatique du glucose, l’amélioration du transport et de l’utilisation du glucose dans le muscle et surtout la réduction de l’insulino-résistance.
présente en détail l’ensemble de ces études. Cette amélioration d’HbA1c s’explique notamment par la diminution de la production hépatique du glucose, l’amélioration du transport et de l’utilisation du glucose dans le muscle et surtout la réduction de l’insulino-résistance.Type, volume et intensité d’activité physique chez le patient diabétique de type 2
 ; Chudyk et Petrella, 2011
; Chudyk et Petrella, 2011 ; Umpierre et coll., 2011
; Umpierre et coll., 2011 ; Yang et coll., 2013). Il apparaît très clairement des effets significatifs des programmes, en endurance seule ou associée à du renforcement musculaire, sur la baisse de l’HbA1c (-0,51 à -0,73 %) (Snowling et Hopkins, 2006
; Yang et coll., 2013). Il apparaît très clairement des effets significatifs des programmes, en endurance seule ou associée à du renforcement musculaire, sur la baisse de l’HbA1c (-0,51 à -0,73 %) (Snowling et Hopkins, 2006 ; Chudyk et Petrella, 2011
; Chudyk et Petrella, 2011 ; Umpierre et coll., 2011
; Umpierre et coll., 2011 ). Le tableau 8.II présente en détail l’ensemble de ces études. L’endurance seule semble avoir un effet supérieur au renforcement musculaire pour impacter l’équilibre glycémique (Yang et coll., 2014
). Le tableau 8.II présente en détail l’ensemble de ces études. L’endurance seule semble avoir un effet supérieur au renforcement musculaire pour impacter l’équilibre glycémique (Yang et coll., 2014 ). En effet, des résultats contradictoires existent sur les programmes basés uniquement sur le renforcement musculaire. Chudyk et Petrella
). En effet, des résultats contradictoires existent sur les programmes basés uniquement sur le renforcement musculaire. Chudyk et Petrella (2011) ne montrent pas d’effet significatif sur la base de 8 ERC, alors que dans la méta-analyse publiée la même année par Umpierre et coll.
(2011) ne montrent pas d’effet significatif sur la base de 8 ERC, alors que dans la méta-analyse publiée la même année par Umpierre et coll. (2011), le renforcement musculaire semble significativement impacter HbA1c en comparaison du groupe contrôle (-0,33 % versus -0,57 %). Cependant, dans cette dernière publication, seuls les programmes ne proposant que des activités physiques supervisées ont été inclus, soit seulement 4 essais randomisés et contrôlés sélectionnés. Dans ce sens, une revue systématique récente (Röhling et coll., 2016
(2011), le renforcement musculaire semble significativement impacter HbA1c en comparaison du groupe contrôle (-0,33 % versus -0,57 %). Cependant, dans cette dernière publication, seuls les programmes ne proposant que des activités physiques supervisées ont été inclus, soit seulement 4 essais randomisés et contrôlés sélectionnés. Dans ce sens, une revue systématique récente (Röhling et coll., 2016 ) a montré que 3 essais randomisés et contrôlés sur les 4 inclus rapportaient une baisse significative de HbA1c, mais une seule permettait d’atteindre un seuil cliniquement significatif (-1,1 %, Castaneda et coll., 2002
) a montré que 3 essais randomisés et contrôlés sur les 4 inclus rapportaient une baisse significative de HbA1c, mais une seule permettait d’atteindre un seuil cliniquement significatif (-1,1 %, Castaneda et coll., 2002 ). Au regard de ces travaux, il semble que les programmes combinant les deux types d’exercice permettent une baisse plus importante d’HbA1c chez les patients diabétiques de type 2 que les activités seules d’endurance ou de renforcement musculaire (Snowling et Hopkins, 2006
). Au regard de ces travaux, il semble que les programmes combinant les deux types d’exercice permettent une baisse plus importante d’HbA1c chez les patients diabétiques de type 2 que les activités seules d’endurance ou de renforcement musculaire (Snowling et Hopkins, 2006 ; Chudyk et Petrella, 2011
; Chudyk et Petrella, 2011 ; Röhling et coll., 2016
; Röhling et coll., 2016 ). Sur 28 essais randomisés et contrôlés retenus proposant des activités physiques combinées, une revue systématique a identifié 17 études qui ont atteint le seuil cliniquement significatif de réduction de l’HbA1c. Dans 6 études sur 9 proposant des exercices combinés, les patients bénéficiaient de meilleurs résultats sur l’HbA1c que les patients qui ne pratiquaient que des activités d’endurance ou de renforcement musculaire de façon isolée. De plus, le contrôle glycémique semblait impacté positivement lorsque les séances d’endurance ou de renforcement musculaire n’étaient pas réalisées les mêmes jours (Oliveira et coll., 2012
). Sur 28 essais randomisés et contrôlés retenus proposant des activités physiques combinées, une revue systématique a identifié 17 études qui ont atteint le seuil cliniquement significatif de réduction de l’HbA1c. Dans 6 études sur 9 proposant des exercices combinés, les patients bénéficiaient de meilleurs résultats sur l’HbA1c que les patients qui ne pratiquaient que des activités d’endurance ou de renforcement musculaire de façon isolée. De plus, le contrôle glycémique semblait impacté positivement lorsque les séances d’endurance ou de renforcement musculaire n’étaient pas réalisées les mêmes jours (Oliveira et coll., 2012 ). Pour les programmes combinés, il semble cependant que les études n’incluant que des activités aérobies à intensité modérée ne permettaient pas d’amélioration de l’HbA1c (Röhling et coll., 2016
). Pour les programmes combinés, il semble cependant que les études n’incluant que des activités aérobies à intensité modérée ne permettaient pas d’amélioration de l’HbA1c (Röhling et coll., 2016 ).
).Tableau 8.II Effets de l’activité physique seule sur l’hémoglobine glyquée (HbA1c) : résultats des principales méta-analyses publiées
|
Référence
|
N/type études
|
Population
|
Type d’intervention
|
Résultats
|
||||||
|---|---|---|---|---|---|---|---|---|---|---|
|
N
|
Sexe
|
Âge
(années)
|
Durée du diabète (années)
|
Nature
|
Intensité/Volume
|
Fréquence
|
Durée
|
|||
|
Thomas
et coll.,
2005
et 2009
|
14 ERC
|
377
|
NC
|
45 à 65 en moyenne
|
NC
|
Aérobie, fitness ou renforcement musculaire
|
Exercice aérobie continu ou intermittent, exercice de force à intensité progressive, différentes combinaisons aérobie-
renforcement musculaire
|
1 à 5/sem
|
8 à 52 sem
|
Uniquement des ERC qui proposaient une activité physique supervisée d’au moins 8 semaines exclusivement sans aucun programme ou diète alimentaire. Les types d’exercice n’ont pas été différenciés lors de la sélection des études
Exercice vs Témoin : ↓ de 0,60 % (-0,6 DMP, IC 95 % [-0,9 à -0,3])
Les programmes de moins de 3 mois ont permis une réduction plus importante de HbA1c (-0,8 DMP, IC 95 % [-1,2 à -0,4]) en comparaison avec les programmes de 3 à 12 mois
|
|
Snowling
et Hopkins,
|
27 ERC
|
1003
|
55 ± 34 % H
|
55 ± 7
|
4,9±1,8 ans (71±38 % sous traitement)
HbA1c au début du programme : 8,6±1,3 %
|
Aérobie (18 ERC, n = 589)
Force (6 ERC, n = 212)
Combiné (5 ERC, n = 231)
|
Échelle d’intensité 1 (faible) à 5 (> 80 % V̇O2max ou > 85 % 1-RM)
28 % ERC > 3
90 à 270 min/sem
40 % ERC > 3
135 à 300 min/sem
0 % ERC > 3
180 à 225 min/sem
|
2 à 7/sem
3 à 5/sem
3 à 4/sem
|
6 à 104 sem
(volume total : 14 ± 135,2 h)
5 à 26 sem (volume total : 24 à 58,5 h)
8 à 52 sem (volume total : 24 à 156 h)
|
Uniquement les ERC qui proposaient une activité physique supervisée ont été inclus dans cette méta-analyse. 11,1 % des études proposaient une diète alimentaire associée
* Effet global des interventions pour les études avec une durée supérieure à 12 semaines : ↓ de 0,8±0,3 % de HbA1c (< 12 sem : 0,4±0,4 %) Aucune différence significative entre les hommes et les femmes
Aérobie vs Témoin : ↓ -0,37±0,16 (EM ± IC 90 %) ; taille de l’effet : faible
Renforcement musculaire vs Témoin : ↓ -0,29± 0,25 (EM ± IC 90 %) ; taille de l’effet : faible
Combiné vs Témoin : ↓ -0,43±0,29 (EM ± IC 90 %) ; taille de l’effet : faible
|
|
Chudyk
et Petrella,
|
34 ERC
|
NC
|
NC
|
> 18 ans
|
NC
|
Aérobie (21 ERC)
Renforcement musculaire (8 ERC)
Combiné (10 ERC)
|
50 à 85 % V̇O2pic ou 55 à 85 % de Fcmax
5 à 10 groupes musculaires,
50 à 80 % 1-RM
35 à 85 % FCmax
50 à 85 % 1-RM
|
1 à 7/sem
3/sem
3 à 5/sem
|
8 à 52 sem
8 à 36 sem
8 à 104 sem
|
Uniquement les ERC qui proposaient au moins 8 semaines d’intervention exclusivement sans programme ou diète alimentaire (incluant des études avec une activité physique non supervisée) ont été inclus dans cette méta-analyse
Aérobie vs Témoin : ↓ de 0,6 % (-0,62 DMP, IC 95 % [-0,98 à -0,27])
Renforcement musculaire vs Témoin : NS (-0,33 DMP, IC 95 % [-0,72 à -0,05])
Combiné vs Témoin : ↓ de 0,67 % (-0,67 DMP, IC 95 % [-0,93 à -0,40])
|
|
Umpierre
et coll.,
|
47 ERC
|
8 538
|
NC
|
52±7 à 63±8
|
NC
|
Aérobie (18 ERC, n = 848)
Renforcement musculaire (4 ERC, n = 261)
Combiné (7 ERC, n = 404)
Programme d’activité physique conseillé
(24 ERC, n = 7 025)
|
30 à 150 min/sem
5 à 9 groupes musculaires, 15 à 27 séries/séance
40 à 75 min/sem et 9 à 24 séries/séance
45 à 315 min/sem
|
2 à 5/sem
3/sem
3 à 4/sem
2 à 5/sem
|
12 à 52 sem
16 à 39 sem
12 à 52 sem
12 à 104 sem
|
Uniquement des ERC qui proposaient une activité physique supervisée et avec une programmation précise de l’activité physique et des ERC proposant uniquement des conseils pour la réalisation de l’activité physique. 21,2 % des études proposaient une diète alimentaire associée
*Effet global des interventions pour les études avec une supervision (n = 1 533) : ↓ de 0,67 % (IC 95 % [-0,84 à -0,49]) de HbA1c
Aérobie vs Témoin : ↓ de 0,73 % (-0,73 DMP, IC 95 % [-1,06 à -0,40])
Renforcement musculaire vs Témoin : ↓ de 0,57 % (-0,57 DMP, IC 95 % [-1,14 à -0,01])
Combiné vs Témoin : ↓ de 0,51 % (-0,51 DMP, IC 95 % [-0,79 à -0,23])
Conseil vs Témoin : ↓ de 0,43 % (-0,43 DMP, IC 95 % [-0,59 à -0,28])
Aucune différence significative n’est retrouvée pour les programmes incluant uniquement des conseils pour l’activité physique sans préconisations nutritionnelles (14 ERC, n = 712)
|
|
Yang
et coll.,
2013
|
12 ERC
|
626
|
55,0 ±25,4 % F (10 études mixtes, 1 étude F, 1 étude H)
|
48,0±6,0 à 59,0±7,0
|
2,6±1,8 à 12,0±9,0
HbA1c au début du programme : 7 à 9 %
|
Aérobie
Renforcement musculaire
|
50 à 85 % V̇O2pic ou 60 à 75 % de FCmax ou 60 à 85 % FC de réserve
15 à 60 min/séance
5 à 10 groupes musculaires, 2 à 6 séries, 6 à 20 séries/séance. 30 à 60 min/séance
|
2 à 4/sem
2 à 4/sem
|
8 à 52 sem
8 à 52 sem
|
Uniquement des ERC qui proposaient une activité physique supervisée et avec une programmation précise de l’activité physique comparant les activités aérobies aux activités en Renforcement musculaire
* Effet des interventions aérobie vs force : différence de 0,18 % (IC 95 % [-0,01 à 0,36]) de HbA1c en faveur des activités aérobies (Présence d’hétérogénéité dans l’étude : I2 = 51 %, p = 0,02)
Aérobie pré vs post : ↓ de 0,46 % (-0,46 DMP, IC 95 % [-0,64 à -0,29])
Renforcement musculaire pré vs post : ↓ de 0,32 % (-0,32 DMP, IC 95 % [-0,45 à -0,19])
|
|
Röhling
et coll.,
|
13 ERC
|
735
|
40,7±21,7 F (12 études mixtes, 1 H)
|
52±8 à 69±4
|
4 ± 2 à 10 ± 8
(93 % sous traitement)
HbA1c au début du programme : 6,6 à 8,5 %
|
Aérobie (6 ERC, n = 233)
Renforcement musculaire (4 ERC, n = 191)
Combiné (7 ERC, n = 371)
|
Échelle d’intensité :
Modérée, 50-69 % FC de réserve ou 30-65 % 1-RM
Modérement intense, 70-85 % FC de réserve ou 65-80 % 1-RM.
Forte, > 85 % FC de réserve ou > 85 % 1-RM.
Intensité modérée à intensité forte, 30 à 60 min/séance
Intensité modérée à intensité forte, 45 à 60 min/séance
Intensité modérée à intensité forte, 30 à 90 min/séance
|
2 à 5/sem
3 à 4/sem
3 à 5/sem
|
12 à 52 sem
16 à 50 sem
12 à 104 sem
|
Uniquement des ERC qui proposaient une activité physique supervisée et avec une programmation précise de l’activité physique sans restriction calorique
Les auteurs n’ont pas conduit de méta-analyse en raison des différences méthodologiques des programmes d’activité physique
4 études sur 6 avec une ↓ HbA1c significative. Seules 3 études ont atteint le seuil de significativité clinique (de -0,7 à -1,6 %)
3 études sur 4 avec une ↓ HbA1c significative. Seule 1 étude a atteint le seuil de significativité clinique (-1,1 %)
7 études sur 10 avec une ↓ HbA1c significative. Seules 5 études ont atteint le seuil de significativité clinique (de -0,6 à -1,5 %)
4 études sur 5 proposant une intensité modérée n’ont pas réduit significativement HbA1c (+ 0,1 % à -0,5 %)
|
|
Liubaoerjijin
et coll.,
|
8 ERC
|
235
|
36,3 % F (5 études mixtes, 2 études H, 1 étude NC)
|
50,3± 6,3 à 63,0±5,0
|
3,5±2,4 à 20,5±1,5
|
Aérobie à haute intensité intermittent, HIIT (4 ERC)
Aérobie à intensité faible continue, LICT (2 ERC)
Aérobie à intensité modérée continue, MICT (6 ERC)
Aérobie à haute intensité continue, HICT (3 ERC)
|
Pour tous les programmes :
- Intensité faible ≤ 45 % V̇O2max
- Intensité modérée 46 - 63 % V̇O2max
- Intensité forte ≥ 64 % V̇O2max
|
3 à 5/sem
3 à 6/sem
3 à 5/sem
3 à 5/sem
|
12 à 16 sem
12 à 16 sem
12 à 24 sem
12 à 24 sem
|
Uniquement des ERC qui proposaient une comparaison entre des activités aérobies de différentes intensités et modalités
* Effet global des interventions intensités élevées vs intensités faibles : différence de 0,22 % (-0,22 DMP, 95 % IC [-0,38 à 0,06]) de HbA1c en faveur des activités aérobies à intensité élevée
HIIT vs LICT : ↓ de 1,20 % (-1,20 DMP, IC 95 % [-2,91 à -0,51])
HIIT vs MICT : ↓ de 0,23 % (-0,23 DMP, IC 95 % [-0,43 à -0,02])
HICT vs LICT : ↓ de 0,40 % (-0,40 DMP, IC 95 % [-1,12 à -0,32])
HICT vs LICT : ↓ de 0,16 % (-0,16 DMP, IC 95 % -0,42 à -0,10).
|
|
Ishiguro
et coll.,
|
23 ERC
|
954
|
54,3± 23,3 % (20 études mixtes, 2 études F, 1 étude H)
|
44,7 à 68,1
|
4,8 à 8,1 (informations dans 11 ERC)
HbA1c au début du programme : 6,7 à 9,2 %
|
Renforcement musculaire
|
5 à 10 groupes musculaires, 7 à 18 répétitions/série/2,5 à 4 séries/séance
45 à 81 % 1 RM
|
2,5 à 5/sem
|
5 à 52 sem
|
Uniquement des ERC qui s’intéressaient à des programmes de renforcement musculaire incluant un groupe témoin d’au moins 5 semaines
*Effet global des interventions de renforcement musculaire : Réduction de 0,34 % (-0,34 taille d’effet, IC 95 % [-0,53 à -0,16]) de HbA1c en comparaison aux groupes contrôles.
< 21 séries vs > 21 séries : P = 0,03, < 21 (↓ de 0,65 % taille d’effet IC 95 % [-0,97 à -0,32], > 21 (↓ de 0,16 % taille d’effet IC 95 % [-0,38 à -0,05]
Pour chaque incrément de 1 % de HbA1c, taille d’effet est augmentée de 0,036 %
|
HbA1c : hémoglobine glyquée ; ERC : Essai Randomisé Contrôlé ; EM : effet moyen ; ES : taille d’effet ; SMD : standard mean difference ; DMP : différence moyenne pondérée ; NC : non communiqué. Les tailles d’effet sont basées sur l’échelle suivante : < 0,20 : effet trivial ; 0,20 – 0,60 : effet faible ; 0,60 – 1,20 : effet modéré ; > 1,20 : effet fort (Snowling et Hopkins, 2006 ).
).
 ).
). ). 262 femmes et hommes diabétiques de type 2 (55,8±8,7 ans, durée de la pathologie 7,7±1,0) ont été inclus dans des programmes de 9 mois totalement supervisés, soit aérobie (680 MET min/semaine), soit en renforcement musculaire (570 MET min/semaine), soit dans un programme combinant les deux types d’exercice sans régime hypocalorique associé et tout en contrôlant la dépense énergétique hebdomadaire. Cette étude démontre la supériorité et l’efficience du programme combiné sur la réduction de l’HbA1c, avec un volume de pratique d’environ 140 minutes par semaine répondant ainsi aux recommandations américaines pour les patients diabétiques de type 2 (combiné : -0,34 % [-0,64 à -0,03] ; p = 0,03 ; aérobie : -0,24 % [-0,55 à 0,07] ; p = 0,14 ; renforcement musculaire : -0,16 % [-0,46 à 0,15] ; p = 0,32). Il faut noter que les effets les plus significatifs sont retrouvés chez les patients présentant les niveaux d’HbA1c les plus importants (> 7 %) et que l’amélioration de l’équilibre glycémique permet un allègement du traitement médicamenteux (Umpierre et coll., 2011
). 262 femmes et hommes diabétiques de type 2 (55,8±8,7 ans, durée de la pathologie 7,7±1,0) ont été inclus dans des programmes de 9 mois totalement supervisés, soit aérobie (680 MET min/semaine), soit en renforcement musculaire (570 MET min/semaine), soit dans un programme combinant les deux types d’exercice sans régime hypocalorique associé et tout en contrôlant la dépense énergétique hebdomadaire. Cette étude démontre la supériorité et l’efficience du programme combiné sur la réduction de l’HbA1c, avec un volume de pratique d’environ 140 minutes par semaine répondant ainsi aux recommandations américaines pour les patients diabétiques de type 2 (combiné : -0,34 % [-0,64 à -0,03] ; p = 0,03 ; aérobie : -0,24 % [-0,55 à 0,07] ; p = 0,14 ; renforcement musculaire : -0,16 % [-0,46 à 0,15] ; p = 0,32). Il faut noter que les effets les plus significatifs sont retrouvés chez les patients présentant les niveaux d’HbA1c les plus importants (> 7 %) et que l’amélioration de l’équilibre glycémique permet un allègement du traitement médicamenteux (Umpierre et coll., 2011 ; Gordon et coll., 2009
; Gordon et coll., 2009 ). Une analyse per-protocole n’impliquant que les patients présentant une compliance à la prescription de 70 % n’a pas modifié ces résultats. Le volume hebdomadaire est effectivement une question majeure puisqu’une méta-analyse chez plus de 8 000 patients a démontré des résultats supérieurs lorsque les patients pratiquaient plus de 150 minutes par semaine (-0,89 % [-1,26 à 0,51] versus -0,36 % [-0,50 à -0,23] si moins de 150 minutes par semaine) (Umpierre et coll., 2011
). Une analyse per-protocole n’impliquant que les patients présentant une compliance à la prescription de 70 % n’a pas modifié ces résultats. Le volume hebdomadaire est effectivement une question majeure puisqu’une méta-analyse chez plus de 8 000 patients a démontré des résultats supérieurs lorsque les patients pratiquaient plus de 150 minutes par semaine (-0,89 % [-1,26 à 0,51] versus -0,36 % [-0,50 à -0,23] si moins de 150 minutes par semaine) (Umpierre et coll., 2011 ).
). ; Hordern et coll., 201
; Hordern et coll., 201 2 ; Duclos et coll., 2013
2 ; Duclos et coll., 2013 ; ADA Medical Care, 2015), mais finalement peu d’entre elles sont réellement basées sur des niveaux de preuve élevés. En effet, Hansen et coll.
; ADA Medical Care, 2015), mais finalement peu d’entre elles sont réellement basées sur des niveaux de preuve élevés. En effet, Hansen et coll. (2009) ont rapporté qu’un programme à intensité faible à modérée (50 % V̇O2max) avait les mêmes bénéfices sur la fonction cardiorespiratoire et l’HbA1c qu’un programme avec une intensité modérée à soutenue (75 % V̇O2max). De plus, des travaux chez les patients présentant des pathologies coronaires ne montrent pas de corrélation significative entre les intensités d’effort et l’adhésion des patients aux programmes (Hansen et coll., 2012
(2009) ont rapporté qu’un programme à intensité faible à modérée (50 % V̇O2max) avait les mêmes bénéfices sur la fonction cardiorespiratoire et l’HbA1c qu’un programme avec une intensité modérée à soutenue (75 % V̇O2max). De plus, des travaux chez les patients présentant des pathologies coronaires ne montrent pas de corrélation significative entre les intensités d’effort et l’adhésion des patients aux programmes (Hansen et coll., 2012 ). Des études randomisées et contrôlées avec de larges effectifs sont donc indispensables pour clarifier ces questions, notamment chez les patients diabétiques de type 2.
). Des études randomisées et contrôlées avec de larges effectifs sont donc indispensables pour clarifier ces questions, notamment chez les patients diabétiques de type 2. ), les programmes intermittents à haute intensité connaissent un intérêt grandissant, mais peu de données chez les patients atteints de troubles métaboliques existent. Néanmoins, des résultats préliminaires semblent intéressants. Plusieurs études ont démontré une amélioration significative du contrôle glycémique après 1 ou plusieurs séances d’exercice intermittent à haute intensité (90 à 100 % V̇O2max avec une récupération active ou passive) (Little et coll., 2011
), les programmes intermittents à haute intensité connaissent un intérêt grandissant, mais peu de données chez les patients atteints de troubles métaboliques existent. Néanmoins, des résultats préliminaires semblent intéressants. Plusieurs études ont démontré une amélioration significative du contrôle glycémique après 1 ou plusieurs séances d’exercice intermittent à haute intensité (90 à 100 % V̇O2max avec une récupération active ou passive) (Little et coll., 2011 ; Gillen et coll., 2012
; Gillen et coll., 2012 ; Terada et coll., 2013
; Terada et coll., 2013 ; Terada et coll., 2016
; Terada et coll., 2016 ). De plus, ces patients présentaient des hyperglycémies postprandiales et/ou nocturnes moins importantes et moins fréquentes. Ces observations sont majeures puisqu’il est aujourd’hui bien établi que la répétition des phénomènes hyperglycémiques (2 mg.dL-1) sont plus prédictifs de l’apparition des complications cardiovasculaires que la glycémie à jeun (Ceriello et coll., 2005
). De plus, ces patients présentaient des hyperglycémies postprandiales et/ou nocturnes moins importantes et moins fréquentes. Ces observations sont majeures puisqu’il est aujourd’hui bien établi que la répétition des phénomènes hyperglycémiques (2 mg.dL-1) sont plus prédictifs de l’apparition des complications cardiovasculaires que la glycémie à jeun (Ceriello et coll., 2005 ), mais sont également fortement corrélés au niveau d’HbA1c chez les patients diabétiques de type 2 (Praet et coll., 2006
), mais sont également fortement corrélés au niveau d’HbA1c chez les patients diabétiques de type 2 (Praet et coll., 2006 ). Une méta-analyse s’intéressant à des programmes d’au moins 12 semaines (études non randomisées et/ou non contrôlées) a rapporté très récemment, sur la base de 235 patients, que l’intensité soutenue (exercices intermittents ou continus) permet une baisse supérieure de l’HbA1c, en comparaison des intensités plus faibles -0,22 % [-0,38 à 0,06] (Liubaoerjijin et coll., 2016
). Une méta-analyse s’intéressant à des programmes d’au moins 12 semaines (études non randomisées et/ou non contrôlées) a rapporté très récemment, sur la base de 235 patients, que l’intensité soutenue (exercices intermittents ou continus) permet une baisse supérieure de l’HbA1c, en comparaison des intensités plus faibles -0,22 % [-0,38 à 0,06] (Liubaoerjijin et coll., 2016 ). Plus spécifiquement, comparée à des programmes basés sur des intensités faibles ou modérées, l’intensité soutenue permet d’obtenir de meilleurs résultats sur l’HbA1c (respectivement -1,20 % [-2,91 à 0,51] et -0,23 % [-0,43 à -0,02]. Au-delà des bénéfices sur les fonctions cardiorespiratoires chez ces patients, les exercices intermittents à haute intensité peuvent également être des alternatives très intéressantes pour l’amélioration du contrôle glycémique ainsi que pour la réduction des complications associées à la pathologie. De plus, ce type de programmes ne semble pas diminuer l’adhésion des patients, ni augmenter les effets indésirables liés à ces programmes (Liubaoerjijin et coll., 2016
). Plus spécifiquement, comparée à des programmes basés sur des intensités faibles ou modérées, l’intensité soutenue permet d’obtenir de meilleurs résultats sur l’HbA1c (respectivement -1,20 % [-2,91 à 0,51] et -0,23 % [-0,43 à -0,02]. Au-delà des bénéfices sur les fonctions cardiorespiratoires chez ces patients, les exercices intermittents à haute intensité peuvent également être des alternatives très intéressantes pour l’amélioration du contrôle glycémique ainsi que pour la réduction des complications associées à la pathologie. De plus, ce type de programmes ne semble pas diminuer l’adhésion des patients, ni augmenter les effets indésirables liés à ces programmes (Liubaoerjijin et coll., 2016 ). À notre connaissance, une seule étude randomisée contrôlée existe à ce jour et ne s’est intéressée qu’à un groupe de 23 femmes diabétiques. Le programme intermittent à haute intensité de 16 semaines (marche et course entre 90 et 100 % de la FC de réserve) a permis une réduction de 12,8 ± 1,1 % de l’HbA1c, tout en réduisant de 25 à 56 % le volume de pratique par semaine, en comparaison avec les recommandations de 150 min/semaine (Alvarez et coll., 2016
). À notre connaissance, une seule étude randomisée contrôlée existe à ce jour et ne s’est intéressée qu’à un groupe de 23 femmes diabétiques. Le programme intermittent à haute intensité de 16 semaines (marche et course entre 90 et 100 % de la FC de réserve) a permis une réduction de 12,8 ± 1,1 % de l’HbA1c, tout en réduisant de 25 à 56 % le volume de pratique par semaine, en comparaison avec les recommandations de 150 min/semaine (Alvarez et coll., 2016 ). La méta-analyse de Jelleyman et coll.
). La méta-analyse de Jelleyman et coll. (2015) rapporte une baisse significative de l’HbA1c pour les programmes proposant des exercices (64-90 % V̇O2max et 77-95 % FCmax, Garber et coll., 2011) intermittents à haute intensité chez les patients diabétiques par rapport au groupe exercice en continu (-0,25 % [-0,27 à -0,23] ; p < 0,001) ainsi qu’en comparaison avec un groupe contrôle (-0,47 % [-0,92 à -0,01] ; p = 0,04). Néanmoins dans ces travaux, aucune différence n’est observée lorsque les programmes intermittents de haute intensité sont comparés à des programmes plus traditionnels à des intensités continues. Ces observations sur la diminution de l’HbA1c sont confirmées par la dernière étude randomisée à ce jour s’intéressant à des femmes ménopausées diabétiques de type 2 et comparant ces deux modalités d’exercice à raison de 2 sessions sur une période de 16 semaines (exercice intermittent de haute intensité : 60 x 8 sec à 77-85 % FCmax et 12 sec de récupération ; exercice continu modéré : 55-60 % FC de réserve) (Maillard et coll., 2016
(2015) rapporte une baisse significative de l’HbA1c pour les programmes proposant des exercices (64-90 % V̇O2max et 77-95 % FCmax, Garber et coll., 2011) intermittents à haute intensité chez les patients diabétiques par rapport au groupe exercice en continu (-0,25 % [-0,27 à -0,23] ; p < 0,001) ainsi qu’en comparaison avec un groupe contrôle (-0,47 % [-0,92 à -0,01] ; p = 0,04). Néanmoins dans ces travaux, aucune différence n’est observée lorsque les programmes intermittents de haute intensité sont comparés à des programmes plus traditionnels à des intensités continues. Ces observations sur la diminution de l’HbA1c sont confirmées par la dernière étude randomisée à ce jour s’intéressant à des femmes ménopausées diabétiques de type 2 et comparant ces deux modalités d’exercice à raison de 2 sessions sur une période de 16 semaines (exercice intermittent de haute intensité : 60 x 8 sec à 77-85 % FCmax et 12 sec de récupération ; exercice continu modéré : 55-60 % FC de réserve) (Maillard et coll., 2016 ). De plus, la question de l’adhésion est souvent posée pour ces exercices à intensité soutenue (Hansen et coll., 2012
). De plus, la question de l’adhésion est souvent posée pour ces exercices à intensité soutenue (Hansen et coll., 2012 ). Une étude chez le sujet sain montre que ce type d’effort est plus « ludique », ce qui permettrait une adhésion plus importante (Bartlett et coll., 2011
). Une étude chez le sujet sain montre que ce type d’effort est plus « ludique », ce qui permettrait une adhésion plus importante (Bartlett et coll., 2011 ). Des études chez le sujet diabétique de type 2 ne rapportent pas de différences de compliance en comparaison de programmes à base d’exercice continu à intensité faible à modérée (Terada et coll., 2012). Mais des études supplémentaires doivent être menées pour explorer ces questions, même si les efforts à intensité soutenue par intermittence peuvent être facilement adaptés dans différentes formes d’activités physiques, pour des patients présentant des capacités cardiorespiratoires et musculaires limitées (Bird et coll., 2012
). Des études chez le sujet diabétique de type 2 ne rapportent pas de différences de compliance en comparaison de programmes à base d’exercice continu à intensité faible à modérée (Terada et coll., 2012). Mais des études supplémentaires doivent être menées pour explorer ces questions, même si les efforts à intensité soutenue par intermittence peuvent être facilement adaptés dans différentes formes d’activités physiques, pour des patients présentant des capacités cardiorespiratoires et musculaires limitées (Bird et coll., 2012 ).
). ). Néanmoins, très peu d’informations sont disponibles quant à l’intensité, le volume et le type d’exercice en renforcement musculaire à réaliser pour les patients diabétiques de type 2. Avec l’objectif de déterminer le programme idéal de renforcement musculaire pour l’amélioration du contrôle glycémique, Ishiguro et coll.
). Néanmoins, très peu d’informations sont disponibles quant à l’intensité, le volume et le type d’exercice en renforcement musculaire à réaliser pour les patients diabétiques de type 2. Avec l’objectif de déterminer le programme idéal de renforcement musculaire pour l’amélioration du contrôle glycémique, Ishiguro et coll. (2016) ont montré que l’amélioration de l’HbA1c était modeste (-0,34 % [-0,53 à -0,16]) avec des effets plus importants pour les patients présentant une HbA1c > 7,5 %. De manière intéressante, les programmes avec plus de 21 séries par séance (-0,65 % [-0,97 à -0,32]) ont une taille d’effet plus importante que ceux avec moins de 21 séries par séance (-0,16 % [-0,38 à 0,05]). Cependant, ni l’intensité, ni la fréquence ou encore le volume total par semaine n’entraînent de bénéfices supplémentaires. Aucune information n’existe chez le patient diabétique de type 2 sur les effets d’une séance unique sur la sensibilité à l’insuline, mais chez le sujet sain (Black et coll., 2010
(2016) ont montré que l’amélioration de l’HbA1c était modeste (-0,34 % [-0,53 à -0,16]) avec des effets plus importants pour les patients présentant une HbA1c > 7,5 %. De manière intéressante, les programmes avec plus de 21 séries par séance (-0,65 % [-0,97 à -0,32]) ont une taille d’effet plus importante que ceux avec moins de 21 séries par séance (-0,16 % [-0,38 à 0,05]). Cependant, ni l’intensité, ni la fréquence ou encore le volume total par semaine n’entraînent de bénéfices supplémentaires. Aucune information n’existe chez le patient diabétique de type 2 sur les effets d’une séance unique sur la sensibilité à l’insuline, mais chez le sujet sain (Black et coll., 2010 ), une session unique de renforcement musculaire induit une amélioration de la sensibilité à l’insuline, ce qui incite à tester des protocoles d’entraînement en faisant varier le nombre de sessions. Suite à des programmes de 12 à 16 semaines, l’amélioration de ce paramètre semble persister durant 4 à 5 jours, permettant d’appuyer l’hypothèse d’une régulation satisfaisante de la sensibilité à l’insuline avec 2 à 3 séances par semaine (Gordon et coll., 2006
), une session unique de renforcement musculaire induit une amélioration de la sensibilité à l’insuline, ce qui incite à tester des protocoles d’entraînement en faisant varier le nombre de sessions. Suite à des programmes de 12 à 16 semaines, l’amélioration de ce paramètre semble persister durant 4 à 5 jours, permettant d’appuyer l’hypothèse d’une régulation satisfaisante de la sensibilité à l’insuline avec 2 à 3 séances par semaine (Gordon et coll., 2006 ; Brooks et coll., 2006
; Brooks et coll., 2006 ; Way et coll., 2016
; Way et coll., 2016 ). Sur la base de ces données, le renforcement musculaire devrait être effectué, au moins initialement, à une fréquence importante (5 à 7 fois par semaine) pour l’amélioration du contrôle glycémique et de la sensibilité à l’insuline, puis réduit (2 à 3 séances par semaine) pour maintenir les bénéfices. D’autres études sont indispensables pour répondre à ces questions.
). Sur la base de ces données, le renforcement musculaire devrait être effectué, au moins initialement, à une fréquence importante (5 à 7 fois par semaine) pour l’amélioration du contrôle glycémique et de la sensibilité à l’insuline, puis réduit (2 à 3 séances par semaine) pour maintenir les bénéfices. D’autres études sont indispensables pour répondre à ces questions. (2011) démontrent néanmoins que les programmes supervisés et individualisés permettent de bien meilleurs résultats que de simples conseils de pratique. Mais, même dans les études proposant une supervision rapprochée, l’observance d’un programme d’activité structuré semble difficile pour les patients, à moyen et long terme (Look AHEAD research group, 2013
(2011) démontrent néanmoins que les programmes supervisés et individualisés permettent de bien meilleurs résultats que de simples conseils de pratique. Mais, même dans les études proposant une supervision rapprochée, l’observance d’un programme d’activité structuré semble difficile pour les patients, à moyen et long terme (Look AHEAD research group, 2013 ). De plus, la société actuelle et ses évolutions technologiques ont tendance à favoriser de longues périodes passées en position assise. Dans ce questionnement de la mise en activité des patients et de la rupture avec le temps de sédentarité, les activités de type récréatives ou douces peuvent également être envisagées pour améliorer le contrôle glycémique. Des activités alternatives comme le Tai-Chi, le Qi-Qong ou encore le yoga sont aujourd’hui très populaires. Cependant, aucune preuve n’est disponible aujourd’hui pour le Tai-Chi (Yan et coll., 2013
). De plus, la société actuelle et ses évolutions technologiques ont tendance à favoriser de longues périodes passées en position assise. Dans ce questionnement de la mise en activité des patients et de la rupture avec le temps de sédentarité, les activités de type récréatives ou douces peuvent également être envisagées pour améliorer le contrôle glycémique. Des activités alternatives comme le Tai-Chi, le Qi-Qong ou encore le yoga sont aujourd’hui très populaires. Cependant, aucune preuve n’est disponible aujourd’hui pour le Tai-Chi (Yan et coll., 2013 ). Des essais randomisés contrôlés de grande ampleur doivent être menés pour confirmer les effets faibles (sans significativité clinique) de la marche ou du yoga sur l’HbA1c. Néanmoins, les patients pratiquant ce type d’activités à des fréquences importantes (> 5 jours/semaine pour la marche et > 3 jours/semaine pour le yoga) ont des résultats plus probants sur le contrôle glycémique que les pratiquants occasionnels (Pai et coll., 2016
). Des essais randomisés contrôlés de grande ampleur doivent être menés pour confirmer les effets faibles (sans significativité clinique) de la marche ou du yoga sur l’HbA1c. Néanmoins, les patients pratiquant ce type d’activités à des fréquences importantes (> 5 jours/semaine pour la marche et > 3 jours/semaine pour le yoga) ont des résultats plus probants sur le contrôle glycémique que les pratiquants occasionnels (Pai et coll., 2016 ). Une étude randomisée contrôlée très récente a pu démontrer également l’intérêt d’une activité physique à intensité faible après les repas (10 minutes après chaque repas versus 30 minutes dans la journée) sur la régulation postprandiale de la glycémie (Reynolds et coll., 2016
). Une étude randomisée contrôlée très récente a pu démontrer également l’intérêt d’une activité physique à intensité faible après les repas (10 minutes après chaque repas versus 30 minutes dans la journée) sur la régulation postprandiale de la glycémie (Reynolds et coll., 2016 ). Dans le même sens, une étude chez 24 patients diabétiques de type 2 en surpoids ou obèses, démontre qu’une interruption d’une longue période de 7 h en position assise par de courtes sessions de 3 minutes de marche ou d’exercices de résistance (absence de différence entre les modalités), toutes les 30 minutes, permet une réduction de l’hyperglycémie postprandiale d’environ 40 % et de l’hyperinsulinisme d’environ 35 % (Dempsey et coll., 2016
). Dans le même sens, une étude chez 24 patients diabétiques de type 2 en surpoids ou obèses, démontre qu’une interruption d’une longue période de 7 h en position assise par de courtes sessions de 3 minutes de marche ou d’exercices de résistance (absence de différence entre les modalités), toutes les 30 minutes, permet une réduction de l’hyperglycémie postprandiale d’environ 40 % et de l’hyperinsulinisme d’environ 35 % (Dempsey et coll., 2016
 ). Comme l’indiquent les auteurs, ces résultats sont à compléter par des études de grande ampleur, mais ils permettent d’envisager le développement de nouvelles stratégies thérapeutiques. En effet, de courtes périodes d’activité physique peuvent convenir à tous les patients diabétiques de type 2 et permettre potentiellement une adhésion aux recommandations plus importante.
). Comme l’indiquent les auteurs, ces résultats sont à compléter par des études de grande ampleur, mais ils permettent d’envisager le développement de nouvelles stratégies thérapeutiques. En effet, de courtes périodes d’activité physique peuvent convenir à tous les patients diabétiques de type 2 et permettre potentiellement une adhésion aux recommandations plus importante. ; Hordern et coll., 2012
; Hordern et coll., 2012 ; Duclos et coll., 2013
; Duclos et coll., 2013 ; ADA Medical Care, 2015) s’accordent pour recommander un volume hebdomadaire de 2,5 heures à des intensités modérées à fortes, en associant des exercices d’endurance et de renforcement musculaire (tableau 8.III
; ADA Medical Care, 2015) s’accordent pour recommander un volume hebdomadaire de 2,5 heures à des intensités modérées à fortes, en associant des exercices d’endurance et de renforcement musculaire (tableau 8.III ).
).Tableau 8.III Bases théoriques des caractéristiques de prise en charge par l’activité physique pour les patients diabétiques de type 2
|
Type d’exercice
|
Intensité préconisée
|
Durée totale par semaine
|
Fréquence
|
|---|---|---|---|
|
Activités permettant de développer l’endurance (capacité aérobie)
Exercices impliquant une masse musculaire importante
|
Modérée à forte : 60-90 % FCmax
RPE : 5 à 8
Faible à modérée : < 40-60 % FCmax
RPE : < 5
Haute intensité intermittent > 100 % FCmax
RPE : ≥ 9-10
|
Minimum 2,5 h pour les intensités modérées à fortes
Objectif de 3,5 h si l’intensité est faible à modérée pour toutes les séances
|
3 séances par semaine minimum
Possibilité de fractionner les exercices en plusieurs sessions de 10 mn par jour (surtout pour les hautes intensités intermittentes)
Jamais 48 h sans exercice
|
|
Activités permettant de développer le renforcement musculaire
Exercices progressifs impliquant des groupes musculaires importants
|
Modérée à forte : > 50-75 1-RM
> 75 % 1-RM optimal pour la sensibilité à l’insuline
8 à 10 exercices différents
2 à 4 séries
8 à 10 répétitions
1 à 2 min repos
|
2 séances par semaine au minimum
|
|
|
Activité permettant de développer la souplesse et l’équilibre
|
Faibles, activités « alternatives »
Prise en compte des patients vieillissants
|
60 minutes en plus
|
1 séance par semaine minimum
|
FCmax : fréquence cardiaque maximale ; RPE : échelle de pénibilité subjective de l’effort ; 1-RM : charge maximale.
Effets de l’activité physique sur les comorbidités
 ). Un résultat intéressant rapporté par la méta-analyse de Smart et coll. (2016) concerne la diminution des infiltrations graisseuses hépatiques suite à un programme d’exercices. Cette diminution est d’autant plus marquée que la dose d’exercices est importante (Smart et coll., 2016).
). Un résultat intéressant rapporté par la méta-analyse de Smart et coll. (2016) concerne la diminution des infiltrations graisseuses hépatiques suite à un programme d’exercices. Cette diminution est d’autant plus marquée que la dose d’exercices est importante (Smart et coll., 2016). ; Shaw et coll., 2006
; Shaw et coll., 2006 ; Thomas et coll., 2006
; Thomas et coll., 2006 ; Snowling, 2006
; Snowling, 2006 ; Gordon et coll., 2009
; Gordon et coll., 2009 ; Chudyk et Petrella, 2011
; Chudyk et Petrella, 2011 ; Katzmarzyk et coll., 2012
; Katzmarzyk et coll., 2012 ; Yang et coll., 2014
; Yang et coll., 2014 ). Les activités de renforcement musculaire semblent impacter positivement le cholestérol HDL chez le patient diabétique de type 2 (Snowling, 2006
). Les activités de renforcement musculaire semblent impacter positivement le cholestérol HDL chez le patient diabétique de type 2 (Snowling, 2006 ). Les bénéfices éventuels de l’activité physique sur les sous-fractions des lipoprotéines reconnues pour leur athérogénicité restent à confirmer (Dutheil et coll., 2014
). Les bénéfices éventuels de l’activité physique sur les sous-fractions des lipoprotéines reconnues pour leur athérogénicité restent à confirmer (Dutheil et coll., 2014 ). Bien que peu nombreuses, les études qui se sont intéressées aux variables hémodynamiques chez les patients obèses et/ou diabétiques de type 2 ont rapporté une absence d’effet (Thomas et coll., 2006
). Bien que peu nombreuses, les études qui se sont intéressées aux variables hémodynamiques chez les patients obèses et/ou diabétiques de type 2 ont rapporté une absence d’effet (Thomas et coll., 2006 , 2009 ; Yang et coll., 2014
, 2009 ; Yang et coll., 2014 ) ou un effet modeste de l’activité physique seule sur les pressions artérielles diastolique et systolique (Gordon et coll., 2009
) ou un effet modeste de l’activité physique seule sur les pressions artérielles diastolique et systolique (Gordon et coll., 2009 ; Thorogood et coll., 2011
; Thorogood et coll., 2011 ; Katzmarzyk et coll., 2012
; Katzmarzyk et coll., 2012 ). La diminution de pression artérielle systolique avec l’entraînement en endurance apparaît comme un modérateur pour la diminution de la rigidité artérielle (Montero et coll., 2014
). La diminution de pression artérielle systolique avec l’entraînement en endurance apparaît comme un modérateur pour la diminution de la rigidité artérielle (Montero et coll., 2014 ).
). ; You et coll., 2013
; You et coll., 2013 ). Cependant, certains auteurs ne retrouvent pas ce résultat (Katzmarzyk et coll., 2012
). Cependant, certains auteurs ne retrouvent pas ce résultat (Katzmarzyk et coll., 2012 ). Ces différences peuvent s’expliquer par les différences entre les exercices (intensité, durée du programme), des différences des marqueurs inflammatoires testés et du moment de leur bilan (intervalle de temps entre prise de sang et dernière séance d’exercice).
). Ces différences peuvent s’expliquer par les différences entre les exercices (intensité, durée du programme), des différences des marqueurs inflammatoires testés et du moment de leur bilan (intervalle de temps entre prise de sang et dernière séance d’exercice). ). Non seulement les entraînements en aérobie (modérés comme intensifs), mais aussi ceux en renforcement musculaire, engendrent une amélioration de la fonction endothéliale (Swift et coll., 2012
). Non seulement les entraînements en aérobie (modérés comme intensifs), mais aussi ceux en renforcement musculaire, engendrent une amélioration de la fonction endothéliale (Swift et coll., 2012 , Montero et coll., 2013
, Montero et coll., 2013 ; Franklin et coll., 2015
; Franklin et coll., 2015 ; Sawyer et coll., 2016
; Sawyer et coll., 2016 ). Ramos et coll. (2015) rapportent néanmoins, chez 182 patients diabétiques, une supériorité des exercices intermittents à haute intensité en comparaison avec des intensités modérées et continues, pour l’amélioration de la fonction vasculaire.
). Ramos et coll. (2015) rapportent néanmoins, chez 182 patients diabétiques, une supériorité des exercices intermittents à haute intensité en comparaison avec des intensités modérées et continues, pour l’amélioration de la fonction vasculaire.Effets de différentes modalités ou méthodologies d’intervention dans la prise en charge par l’activité physique
 . (2013) : 2 utilisaient des applications mobiles et 5 envoyaient des SMS en complément d’autres interventions (appels téléphoniques, éducation). Les résultats montrent une bonne acceptabilité des sujets à ce mode d’intervention et des effets positifs sur la perte de poids et la pratique d’activité physique. Une étude récente a ainsi rapporté une augmentation de pratique d’activité physique légère et forte grâce à une application déclenchant une alarme dès 30 minutes de sédentarité (Bond et coll., 2014
. (2013) : 2 utilisaient des applications mobiles et 5 envoyaient des SMS en complément d’autres interventions (appels téléphoniques, éducation). Les résultats montrent une bonne acceptabilité des sujets à ce mode d’intervention et des effets positifs sur la perte de poids et la pratique d’activité physique. Une étude récente a ainsi rapporté une augmentation de pratique d’activité physique légère et forte grâce à une application déclenchant une alarme dès 30 minutes de sédentarité (Bond et coll., 2014 ). Pour autant, Modave et coll. (2015)
). Pour autant, Modave et coll. (2015) et Rivera et coll. (2016)
et Rivera et coll. (2016) soulignent la faible qualité des applications mobiles destinées à promouvoir la pratique d’activité physique et la perte de poids.
soulignent la faible qualité des applications mobiles destinées à promouvoir la pratique d’activité physique et la perte de poids. ). Les interventions d’une durée inférieure à 6 mois semblent plus efficaces alors qu’aucun effet du nombre total de sessions et de fréquence n’est rapporté. Ces comportements semblent se maintenir suite à l’intervention.
). Les interventions d’une durée inférieure à 6 mois semblent plus efficaces alors qu’aucun effet du nombre total de sessions et de fréquence n’est rapporté. Ces comportements semblent se maintenir suite à l’intervention.Conclusion
Références

























































































































































































































→ Aller vers SYNTHESE