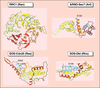
Activation des petites protéines G par leurs facteurs d'échange.
Résumé
Les protéines G sont des commutateurs moléculaires
contrôlant de multiples aspects de la vie cellulaire tels que
la transduction des signaux. Elles sont présentes alternativement
sous forme inactive, liée au GDP, et sous forme
active, liée au GTP, leur activation étant contrôlée par des
« facteurs d’échange ». La connaissance des structures de
ces différents facteurs d’échange et des complexes formés
avec leur petite protéine G cible permet de mieux comprendre
les mécanismes qui provoquent la sortie du GDP
d’une protéine G et son remplacement par le GTP. La flexibilité
de deux régions des petites protéines G appelées
switch joue un rôle essentiel lors de l’échange de nucléotide.
La compréhension du mécanisme par lequel la bréfeldine
A inhibe l’un des facteurs d’échange suggère que les
réarrangements de ces régions pourraient représenter le
« talon d’Achille » par lequel de nouvelles molécules permettraient
d’inhiber certains de ces facteurs d’échange. GTP-binding proteins are molecular switches that control multiple aspects of cellular life and signal transduction. These molecules alternate between an inactive, GDP-bound form and an active, GTP-bound form, and their activation is controlled by 'exchange factors'. The structures of several exchange factors and their complexes formed with target small G proteins provide a better understanding of the mechanisms inducing the release of GDP and its subsequent replacement by GTP. The flexibility of two 'switch' regions is essential during the exchange process and the understanding of the mechanism of inhibition of one of these exchange factors by the drug Brefeldin A suggests that the rearrangements that occur in these switch regions might represent the 'Achille's heel' by which new drugs might inhibit some of these exchange factors.
Pour citer ce document
Chardin, P ; Antonny, B ; Cherfils, J, Activation des protéines G par leurs facteurs d'échange., Med Sci (Paris), 2000, Vol. 16, N° 2; p.228-34