L'actine cytosquelettique et ses protéines associées I. Analyse fondamentale
Résumé
Chez les eucaryotes, le développement de la plupart des
processus biologiques nécessite des remaniements substantiels
du cytosquelette d’actine. Le cycle de polymérisation/
dépolymérisation des filaments d’actine est contrôlé in
vivo par des protéines associées à l’actine, en réponse à
divers signaux intra- et extra-cellulaires. Ces mécanismes
sont au coeur de plusieurs événements fonctionnels de la vie
d’une cellule, tels que la locomotion, la cytokinèse et l’apoptose.
Des altérations dans l’expression, la localisation, la
structure ou la fonction de l’actine elle-même et/ou des protéines
qui lui sont associées, peuvent être à l’origine de
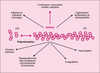
désordres physiologiques invalidants, parfois fatals. Actin is one of the most abundant and highly conserved proteins on earth. Its transient polymerization and depolymerization are essential during changes in cell shape and locomotion. In most eucaryotic cell types, actin is represented either in a monomeric (G actin) or in a polymeric form (F-actin). The filament turnover cycle occurs in vitro (with pure actin) and in vivo. Subsequently, it is thought to proceed through the addition of an ATP-monomer to the barbed end of the filament, the hydrolysis of ATP, the release of Pi, and the dissociation of the ADP-monomer from the pointed end. The rate-limiting step in actin polymerization is nucleation, which is the assembly of the first subunit to generate a new filament. The plus (barbed) end grows five to ten times faster than the minus (pointed) end. Actin has an active role in many cellular functions and is thought to be involved as both a target and mediator of signal transduction through the Rho family of small GTPases. It is also dynamically regulated by a complex army of proteins called Acting-binding proteins. [References: 10]
Pour citer ce document
Fattoum, A, L.actine cytosquelettique et ses protéines associées I. Analyse fondamentale, Med Sci (Paris), 2001, Vol. 17, N° 2; p.193-7