Diversité de signalisation par les récepteurs couplés aux protéines G.
Résumé
L’étude de l’activation des récepteurs couplés aux protéines
G a révélé qu’il s’agit d’un phénomène plus complexe
qu’originellement admis par le passé. Contrairement
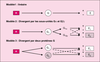
à la théorie classique, il est maintenant établi qu’un même
récepteur peut moduler des voies distinctes de signalisation,
et que la réponse induite par l’activation d’un récepteur
peut varier en fonction du ligand utilisé. Chaque agoniste
pourrait induire ou stabiliser une ou plusieurs
conformations actives du récepteur. La pharmacologie d’un
récepteur est donc hétérogène, et peut varier en fonction
de la voie de signalisation étudiée. Il est ainsi envisageable
d’activer un récepteur de manière sélective, en utilisant des
ligands qui modulent une seule voie de signalisation, et par
conséquent de diminuer les effets secondaires dus à l’activation
d’autres voies. La découverte récente de l’existence
de plusieurs isoformes pour un même récepteur implique
l’existence d’un niveau de complexité supplémentaire dans
sa réponse biologique. Ces isoformes présentent des états
d’activation différents, et ne possèdent pas la même sensibilité
vis-à-vis des agonistes, des agonistes inverses, et par
conséquent des médicaments. Recent discoveries about signalling via G protein-coupled receptors have revealed the complexity of this process. Two key factors contribute principally to this complexity: the possibility that one single receptor subtype may govern multiple effector pathways, and the fact that a receptor subtype may be expressed as a mutant form, or an isoform, due to alternative splicing and RNA editing of the transcript. Whereas it is well established that different agonists do not necessarily elicit the same magnitude of response, it is likely that different ligands may also select between several potential signal transduction pathways. The diversity of receptor signalling via a single receptor subtype may be a consequence of specific agonist: receptor: G protein interactions. A better understanding of the activation state(s) of the G protein-coupled receptor appears to be essential in order to develop new ligands, which may either enhance, attenuate, block or reverse a response mediated by a given receptor: effector pathway. Future efforts should not be limited to the study of a receptor under normal conditions, but also to its behaviour under pathophysiological conditions. Particularly, further investigation is required to understand the relevance of the recently discovered receptor isoforms. [References: 41]
Pour citer ce document
Dupuis, DS ; Pauwels, PJ, Diversité de signalisation par les récepteurs couplés aux protéines G., Med Sci (Paris), 2001, Vol. 17, N° 3; p.320-6