Focal adhesion kinase (FAK), une protéine aux fonctions multiples
Date
2003-06Auteur
Cornillon, Jérôme
Campos, Lydia
Guyotat, Denis
Metadata
Afficher la notice complèteRésumé
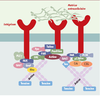
FAK (focal adhesion kinase) est une protéine cytoplasmique ubiquitaire retrouvée au sein du complexe d’adhérence. Son activation par les intégrines mais aussi par différents facteurs de croissance, cytokines ou hormones se traduit par l’autophosphorylation d’un résidu tyrosine (397) libérant un site de liaison pour la protéine Src. Cette liaison va permettre l’activation des protéines du complexe d’adhérence, aboutissant à la transmission de signaux régulateurs pour la migration, la survie et la prolifération cellulaires. Un dérèglement de ce système peut limiter ainsi plusieurs fonctions cellulaires, voire entraîner l’apoptose, et pourrait participer aux processus de cancérogenèse. Cet article présente les mécanismes par lesquels FAK contribue à la régulation cellulaire. Focal adhesion kinase (FAK) is a cytoplasmic protein tyrosine kinase localized to regions called focal adhesions. Many stimuli can induce tyrosine phosphorylation and activation of FAK, including integrins and growth factors. The major site of autophosphorylation, tyrosine 397, is a docking site for the SH2 domains of Src family proteins. The other sites of phosphorylation are phosphorylated by Src kinases. Phosphorylated FAK binds proteins of focal adhesion and can activate them directly or indirectly by phosphorylation. These activated proteins forming the FAK complex facilitate the generation of downstream signals necessary to regulate cell functions, like motility, survival and proliferation. Dysregulation of FAK could participate in the development of cancer. This review will focus upon the mechanisms by which FAK transmits biochemical signals and elicits biological effects.
Pour citer ce document
Cornillon, Jérôme ; Campos, Lydia ; Guyotat, Denis ; Focal adhesion kinase (FAK), une protéine aux fonctions multiples, Med Sci (Paris), 2003, Vol. 19, N° 6-7; p. 743-752 ; DOI : 10.1051/medsci/20031967743



