Les MAGUK : au-delà de l’accrochage des canaux ioniques
Date
2004Auteur
Godreau, David
Neyroud, Nathalie
Vranckx, Roger
Hatem, Stéphane
Metadata
Afficher la notice complèteRésumé
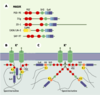
Les protéines appartenant à la famille des MAGUK (membrane associated guanylate kinase) jouent un rôle majeur dans l’organisation des régions spécialisées des membranes plasmiques comme les synapses neuronales, les zones d’adhérence des bordures épithéliales ou encore les disques intercalaires du myocarde. Cette famille comprend les protéines PSD95 (post-synaptic density 95), chapsyne 110, SAP102 (synapse-associated protein 102) ou encore SAP97. Elles possèdent toutes plusieurs domaines d’interaction protéique : domaines PDZ, SH3 et guanylate kinase sur lesquels viennent se fixer différents récepteurs, des canaux ioniques ou des constituants du cytosquelette, pour former de larges complexes protéiques. C’est le cas des canaux potassiques Kv qui présentent dans leur partie carboxy-terminale une séquence de type Thr/Ser-X-Val/Leu qui leur permet d’interagir avec les deux premiers domaines PDZ des MAGUK. Il reste maintenant à comprendre le rôle physiologique de ces protéines et à déterminer leur implication au cours de différents processus pathogènes. A family of anchoring proteins named MAGUK (for membrane associated guanylate kinase) has emerged as a key element in the organization of protein complexes in specialized membrane regions. These proteins are characterized by the presence of multipe protein-protein interaction domains including PDZ and SH3 domains. The MAGUK family comprises the post-synaptic density 95 (PSD-95) protein and closely related molecules such as chapsyn-110, synapse-associated protein 102 (SAP-102), and SAP-97. These are located either on the pre- and/or post-synaptic sides of synapses or at cell-cell adhesion sites of epithelial cells. MAGUK proteins interact with glutamate receptors and various ionic channels. For instance, an interaction has been reported between the first two PDZ domains of MAGUK proteins and several channels via a consensus sequence Thr/Ser-X-Val/Leu usually located at their carboxy terminus. The role of these anchoring proteins in channel function is not fully understood. MAGUK proteins enhance the current density by increasing the number of functional channels to the sarcolemma. They can also facilitate signaling between channels and several enzymes or G protein-dependent signaling pathways. In the heart also, MAGUK proteins are abundantly expressed and they interact with various channels including Shaker Kv1.5 and connexins.
Pour citer ce document
Godreau, David ; Neyroud, Nathalie ; Vranckx, Roger ; Hatem, Stéphane ; Les MAGUK : au-delà de l’accrochage des canaux ioniques, Med Sci (Paris), 2004, Vol. 20, N° 1; p. 84-88 ; DOI : 10.1051/medsci/200420184



