| dc.contributor.author | Génot, Elisabeth | - |
| dc.date.accessioned | 2015-04-29T07:32:44Z | |
| dc.date.available | 2015-04-29T07:32:44Z | |
| dc.date.issued | 2009 | fr_FR |
| dc.identifier.citation | Génot, Elisabeth ; Les podosomes endothéliaux, Med Sci (Paris), 2009, Vol. 25, N° 2; p. 168-174 ; DOI : 10.1051/medsci/2009252168 | fr_FR |
| dc.identifier.issn | 1958-5381 | fr_FR |
| dc.identifier.uri | http://hdl.handle.net/10608/6580 | |
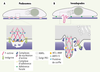
| dc.description.abstract | Les podosomes sont des microdomaines d’adhérence formés au niveau de la membrane plasmique de certaines cellules du lignage hématopoïétique. Ils présentent une organisation caractéristique consistant en un coeur d’actine et de protéines associées à sa polymérisation, encerclé d’un anneau constitué de protéines structurales et de signalisation. Outre la présence de marqueurs spécifiques, ils se distinguent des adhérences focales par la présence de métalloprotéases. Des structures apparentées, de composition moléculaire semblable mais d’architecture distincte, les invadopodes, sont formées dans des cellules fibroblastiques ou épithéliales porteuses de l’oncogène v-src, ainsi que dans des cellules tumorales à fort potentiel invasif. Une propriété commune aux cellules qui forment des podosomes ou des invadopodes est leur capacité à franchir des barrières anatomiques. Les podosomes ont maintenant été identifiés dans des cellules endothéliales, cellules non hématopoïétiques et non tumorales, dotées de propriétés invasives lorsqu’elles sont engagées dans des processus de néo-vascularisation. Dans ces structures, des spécificités des podosomes et des invadopodes coexistent. L’élucidation de la fonction des podosomes des cellules endothéliales constitue un enjeu majeur en termes de physiopathologie vasculaire. | fr |
| dc.description.abstract | Podosomes are highly dynamic adhesion microdomains formed at the ventral membrane of some monocyte-derived cells. Structurally, their most distinguishing feature is their two-part architecture, consisting in a core of F-actin and actin-associated proteins, surrounded by a ring structure consisting of plaque proteins as well as signalling proteins. In addition to the presence of specific markers, they are distinguished from other adhesion structures by the presence of metalloproteases, endowing them with the ability to degrade the extracellular matrix. Invadopodia are related structures, of similar molecular composition but of distinct architecture, made by fibroblasts or epithelial cells transformed by the v-src oncogene or aggressive carcinoma cells. Such membrane-associated cellular devices, now named invadosomes, are thought to have a central role in mediating polarized migration in cells that cross anatomical boundaries. Podosomes have now been shown to form in endothelial cells, non monocytic and non tumoral cells, endowed with tissue invasive activities during vascular remodelling. Here, we summarize the recent advances and developments in this field, discuss how endothelial podosomes combine specificities of monocytic podosomes and invadopodia and provide our provisional outlook into the future understanding of endothelial podosomes. | en |
| dc.language.iso | fr | fr_FR |
| dc.publisher | EDK | fr_FR |
| dc.relation.ispartof | M/S revues : Synthèse | fr_FR |
| dc.rights | Article en libre accès | fr |
| dc.rights | Médecine/Sciences - Inserm - SRMS | fr |
| dc.source | M/S. Médecine sciences [ISSN papier : 0767-0974 ; ISSN numérique : 1958-5381], 2009, Vol. 25, N° 2; p. 168-174 | fr_FR |
| dc.subject.mesh | Actines | fr |
| dc.subject.mesh | Adhérence cellulaire | fr |
| dc.subject.mesh | Membrane cellulaire | fr |
| dc.subject.mesh | Matrice extracellulaire | fr |
| dc.subject.mesh | Humains | fr |
| dc.subject.mesh | Microdomaines membranaires | fr |
| dc.subject.mesh | Metalloproteases | fr |
| dc.subject.mesh | Monocytes | fr |
| dc.title | Les podosomes endothéliaux | fr |
| dc.title.alternative | The endothelial podosome | en |
| dc.type | Article | fr_FR |
| dc.contributor.affiliation | IECB/Inserm U889, 2, rue Robert Escarpit, 33600 Pessac, France | fr_FR |
| dc.identifier.doi | 10.1051/medsci/2009252168 | fr_FR |
| dc.identifier.pmid | 19239849 | fr_FR |