Mode d'action moléculaire des neurotoxines botulique et tétanique
Date
1996Auteur
Deloye, F
Schiavo, G
Doussau, F
Rossetto, O
Montecucco, C
Poulain, B
Voir/
Metadata
Afficher la notice complèteRésumé
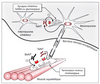
Les neurotoxines tétanique (TeNT) et botuliques (BoNT)
sont responsables de deux maladies sévères : le tétanos et le
botulisme. La TeNT bloque la libération de GABA et de glycine
dans le système nerveux central alors que les BoNT agissent
en périphérie en inhibant la libération d’acétylcholine.
Elles sont composées de deux chaînes : la chaîne lourde est
impliquée dans la liaison spécifique des toxines à des récepteurs
neuronaux et dans la translocation de la chaîne légère
dans le cytoplasme ; la chaîne légère est seule responsable de
l’inhibition intracellulaire de la libération des neurotransmetteurs.
La chaîne légère est une endopeptidase à zinc qui attaque
spécifiquement trois protéines synaptiques impliquées
dans l’exocytose des neurotransmetteurs. La TeNT et quatre
sérotypes de BoNT (B, D, F et G) hydrolysent la VAMP/synaptobrévine,
une protéine intégrale de la membrane des vésicules
synaptiques. La BoNT/A et la BoNT/E attaquent
SNAP25, une protéine associée au plasmalemme. Enfin, la
BoNT/C hydrolyse la HPC1/syntaxine, une protéine intégrale
de la membrane plasmique qui est associée aux canaux calciques
impliqués dans la libération des neurotransmetteurs. Tetanus (TeNT) and botulinum (BoNTs, seven serotypes A-G) neurotoxins are the causal agents of two severe diseases, tetanos and botulism. The TeNT blocks preferentially GABA or glycine release in the central nervous system whereas, BoNTs inhibit acetylcholine release in periphery. These neurotoxins are proteins constituted of a heavy and a light chains. The heavy chain mediates specific binding of toxins to neurone and translocation of light chain into the cytoplasm. The light chain alone is responsible for the intraneuronal blockade of neurotransmitter release. Recently, the light chain was found to be a zinc-endopeptidase. It attacks specifically synaptic proteins of the neuro-exocytotic apparatus. TeNT and BoNT/B, D, F and /G cleave VAMP/synaptobrevin an integral protein of the synaptic BoNT/E attack specifically SNAP-25, a protein associated to the plasma membrane. BoNT/G cleaves HPC1/syntaxin, an integral protein of the plasma membrane that is associated to the calcium channels implicated to the calcium channels implicated in neurotransmitter release.
Pour citer ce document
Deloye, F ; Schiavo, G ; Doussau, F ; Rossetto, O ; Montecucco, C ; Poulain, B, Mode d'action moléculaire des neurotoxines botulique et tétanique, Med Sci (Paris), 1996, Vol. 12, N° 2; p.175-82



