Structure du récepteur Smoothened
Date
2013Auteur
Ruat, Martial
Hoch, Lucile
Faure, Hélène
Rognan, Didier
Metadata
Afficher la notice complèteRésumé
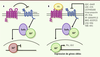
Le récepteur Smoothened (Smo) joue un rôle essentiel dans la transduction de la voie de signalisation Hedgehog (Hh) chez les vertébrés au cours de l’embryogenèse et chez l’adulte. Il constitue une cible privilégiée pour le traitement des tumeurs liées à des mutations de gènes impliqués dans la voie Hh ou associées à une réactivation de cette voie de signalisation. Il appartient à la famille des récepteurs couplés aux protéines G (RCPG). La structure tridimensionnelle du récepteur Smo humain complexé à un anticancéreux en cours de développement clinique vient d’être obtenue. Elle permet de comprendre l’organisation structurale des sept domaines transmembranaires, démontre que le récepteur forme un dimère et fait aussi apparaître une organisation complexe des domaines extracellulaires, qui pourraient jouer un rôle majeur dans l’accessibilité de l’antagoniste à son site de liaison. Ces travaux permettront de mieux comprendre les interactions de petites molécules avec une cible thérapeutique qui suscite un intérêt croissant en cancérologie et en médecine régénérative. The Smoothened (Smo) receptor is a major component involved in signal transduction of the Hedgehog (Hh) morphogens both during embryogenesis and in the adult. Smo antagonists represent a promi-sing alternative for the treatment of cancers linked to abnormal Hh signalling. The crystal structure of the human Smo receptor bound to an antitumour agent demonstrates that this receptor belongs to the superfamily of G-protein coupled receptors. The antagonist binds to a pocket localized at the extracellular side formed by the seven transmembrane domains and the complex arrangement of the unusually long extracellular loops. The structure of the Smo receptor will promote the development of small molecules interacting with a key therapeutic target with interests in regenerative medicine and cancer.
Pour citer ce document
Ruat, Martial ; Hoch, Lucile ; Faure, Hélène ; Rognan, Didier ; Structure du récepteur Smoothened, Med Sci (Paris), 2013, Vol. 29, N° 10 ; p. 855-860 ; DOI : 10.1051/medsci/20132910012



