| dc.contributor.author | Marsolier, Justine | - |
| dc.contributor.author | Weitzman, Jonathan B. | - |
| dc.date.accessioned | 2018-04-24T12:59:39Z | |
| dc.date.available | 2018-04-24T12:59:39Z | |
| dc.date.issued | 2014 | |
| dc.identifier.citation | Marsolier, Justine ; Weitzman, Jonathan B. ; Pin1 : une peptidyl-prolyl cis-trans isomérase multifonctionnelle et une cible anticancéreuse prometteuse, Med Sci (Paris), 2014, Vol. 30, N° 8-9 ; p. 772-778 ; DOI : 10.1051/medsci/20143008015 | |
| dc.identifier.issn | 1958-5381 | |
| dc.identifier.uri | http://hdl.handle.net/10608/8449 | |
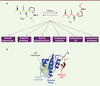
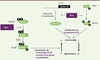
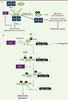
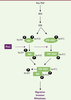
| dc.description.abstract | Les modifications post-traductionnelles sont essentielles pour contrôler finement les fonctions cellulaires des protéines. Un mécanisme peu connu, la peptidyl-prolyl cis-trans isomérisation, joue également un rôle dans la régulation des protéines. Par exemple, la peptidyl-prolyl cis-trans isomérase Pin1 isomérise des motifs phosphorylés, induisant des changements structuraux de ses cibles et modulant ainsi leur stabilité, leur localisation, leur état de phosphorylation, leur activité et/ou leur interaction avec des partenaires. Pin1 est impliquée dans de nombreux processus cellulaires dont la prolifération et l’invasion cellulaires, ou encore l’induction et la maintenance de la pluripotence des cellules souches. De plus, Pin1 est surexprimée dans certains cancers humains. Ainsi, son inhibition constitue une piste thérapeutique prometteuse. | fr |
| dc.description.abstract | Post-translational modifications are critical to modulate protein function. A post-translational mechanism, peptidyl prolyl cis-trans isomerisation, plays a key role in protein regulation. Pin1 is a ubiquitous peptidyl prolyl cis-trans isomerase conserved from Archae to Human. This enzyme binds and isomerizes phospho-serine/threonine-proline motifs. This process can induce conformational change in protein targets and modulates their activity, cellular localization, phosphorylation state, stability and/or protein-protein interactions. Pin1 activity regulates proteins involved in cell proliferation, pluripotency or cellular invasion. Pin1 is overexpressed in several human cancers and contributes to tumorigenesis. Its inactivation constitutes a promising therapeutic strategy. | en |
| dc.language.iso | fr | |
| dc.publisher | Éditions EDK, Groupe EDP Sciences | |
| dc.relation.ispartof | M/S Revues | |
| dc.rights | Article en libre accès | fr |
| dc.rights | Médecine/Sciences - Inserm - SRMS | fr |
| dc.source | M/S. Médecine sciences [ISSN papier : 0767-0974 ; ISSN numérique : 1958-5381], 2014, Vol. 30, N° 8-9; p. 772-778 | |
| dc.subject.mesh | Animaux | fr |
| dc.subject.mesh | Prolifération cellulaire | fr |
| dc.subject.mesh | Transformation cellulaire néoplasique | fr |
| dc.subject.mesh | génétique | fr |
| dc.subject.mesh | métabolisme | fr |
| dc.subject.mesh | Antienzymes | fr |
| dc.subject.mesh | usage thérapeutique | fr |
| dc.subject.mesh | Humains | fr |
| dc.subject.mesh | Thérapie moléculaire ciblée | fr |
| dc.subject.mesh | méthodes | fr |
| dc.subject.mesh | tendances | fr |
| dc.subject.mesh | NIMA-interacting peptidylprolyl isomerase | fr |
| dc.subject.mesh | Tumeurs | fr |
| dc.subject.mesh | traitement médicamenteux | fr |
| dc.subject.mesh | enzymologie | fr |
| dc.subject.mesh | Peptidylpropyl isomerase | fr |
| dc.subject.mesh | antagonistes et inhibiteurs | fr |
| dc.title | Pin1 : une peptidyl-prolyl cis-trans isomérase multifonctionnelle et une cible anticancéreuse prometteuse | fr |
| dc.title.alternative | Pin1: a multi-talented peptidyl prolyl cis-trans isomerase and a promising therapeutic target for human cancers | en |
| dc.type | Article | |
| dc.contributor.affiliation | Sorbonne Paris Cité, université Paris Diderot, UMR7216 CNRS, Épigénétique et destin cellulaire, Laboratoire plasticité des phénotypes cellulaires, 35, rue Hélène Brion, case courrier 7042, 75013 Paris, France | |
| dc.identifier.doi | 10.1051/medsci/20143008015 | |
| dc.identifier.pmid | 25174754 | |