| dc.contributor.author | Taouji, Saïd | - |
| dc.contributor.author | Chevet, Éric | - |
| dc.date.accessioned | 2018-05-30T11:37:37Z | |
| dc.date.available | 2018-05-30T11:37:37Z | |
| dc.date.issued | 2015 | |
| dc.identifier.citation | Taouji, Saïd ; Chevet, Éric ; Modulation pharmacologique de la réponse au stress du réticulum endoplasmique : Potentiel thérapeutique en cancérologie, Med Sci (Paris), 2015, Vol. 31, N° 6-7 ; p. 667-673 ; DOI : 10.1051/medsci/20153106021 | |
| dc.identifier.issn | 1958-5381 | |
| dc.identifier.uri | http://hdl.handle.net/10608/8658 | |
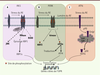
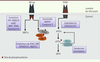
| dc.description.abstract | Un déséquilibre de l’homéostasie protéique provoqué par un stress externe ou interne dans le réticulum endoplasmique déclenche l’initiation des voies de signalisation des capteurs IRE1, PERK et ATF6 vers une réponse adaptative traductionnelle ou transcriptionnelle connue sous le nom de UPR (unfolded protein response). La double fonction de l’UPR peut, selon l’intensité et la durée du stress, conduire à l’adaptation ou à la mort de la cellule. Dans les cellules cancéreuses, les voies de l’UPR sont souvent altérées et conduisent généralement vers une adaptation à un environnement hostile. La contribution de ces voies à diverses conditions pathologiques explique l’essor des stratégies de recherche visant à découvrir et concevoir de nouvelles molécules capables de moduler le stress du réticulum endoplasmique dans un contexte physiopathologique. | fr |
| dc.description.abstract | An imbalance of protein homeostasis caused by external or internal stress in the endoplasmic reticulum triggers the initiation of signalling pathways downstream of the IRE1, ATF6 and PERK sensors to a translational or transcriptional adaptive response known as UPR (Unfolded Protein Response). According to the intensity and duration of stress, the dual function of the UPR leads to either cell adaptation or cell death. UPR pathways in cancer cells are often altered and generally lead to an adaptation to an hostile environment. As the UPR becomes an emerging therapeutic target due to its increasing contribution to various diseases, we describe in this review various strategies that have been developed to discover new compounds enabling to manipulate the magnitude of ER stress in the context of cancer. | en |
| dc.language.iso | fr | |
| dc.publisher | Éditions EDK, Groupe EDP Sciences | |
| dc.relation.ispartof | M/S Revues | |
| dc.rights | Article en libre accès | fr |
| dc.rights | Médecine/Sciences - Inserm - SRMS | fr |
| dc.source | M/S. Médecine sciences [ISSN papier : 0767-0974 ; ISSN numérique : 1958-5381], 2015, Vol. 31, N° 6-7; p. 667-673 | |
| dc.subject.mesh | Animaux | fr |
| dc.subject.mesh | Antinéoplasiques | fr |
| dc.subject.mesh | Stress du réticulum endoplasmique | fr |
| dc.subject.mesh | Endoribonucleases | fr |
| dc.subject.mesh | Humains | fr |
| dc.subject.mesh | Thérapie moléculaire ciblée | fr |
| dc.subject.mesh | Tumeurs | fr |
| dc.subject.mesh | Protein-Serine-Threonine Kinases | fr |
| dc.subject.mesh | Transduction du signal | fr |
| dc.subject.mesh | Réponse aux protéines mal repliées | fr |
| dc.subject.mesh | eIF-2 Kinase | fr |
| dc.subject.mesh | usage thérapeutique | fr |
| dc.subject.mesh | effets des médicaments et substances chimiques | fr |
| dc.subject.mesh | antagonistes et inhibiteurs | fr |
| dc.subject.mesh | métabolisme | fr |
| dc.subject.mesh | méthodes | fr |
| dc.subject.mesh | traitement médicamenteux | fr |
| dc.title | Modulation pharmacologique de la réponse au stress du réticulum endoplasmique : Potentiel thérapeutique en cancérologie | fr |
| dc.title.alternative | Modulating endoplasmic reticulum stress in the treatment of cancer | en |
| dc.type | Article | |
| dc.contributor.affiliation | Inserm U1053, Université de Bordeaux Segalen, 146, rue Léo Saignat, 33076 Bordeaux Cedex, France | |
| dc.contributor.affiliation | BMYscreen, Bordeaux, France | |
| dc.contributor.affiliation | Adresse actuelle : Inserm U916, CRLCC Institut Bergonié, 229, cours de l’Argonne, 33076 Bordeaux Cedex, France | |
| dc.identifier.doi | 10.1051/medsci/20153106021 | |
| dc.identifier.pmid | 26152172 | |