Biosynthèse du monoxyde d'azote (NO) : mécanisme, régulation et contrôle.
Résumé
Le monoxyde d’azote (NO) est un biomédiateur synthétisé
par les NO synthases (NOS), une famille de trois isoenzymes.
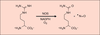
Ces enzymes héminiques catalysent l’oxydation de la
L-arginine en N-hydroxyarginine (NOHA), puis de celle-ci
en NO. Les NOS constituent, par leur structure à deux
domaines, un cas unique chez les mammifères d’oxygénases
à hème-thiolate autosuffisantes. Le mécanisme proposé
de la transformation de la NOHA en NO par les NOS
fait intervenir de manière originale un peroxyde de fer
réactif. Les NOS sont réglées de multiples façons, au
niveau transcriptionnel, par la concentration en calcium,
par certains de leurs co-facteurs ou par leurs substrats et
leurs produits. En faible concentration, NO est un neurotransmetteur
et un agent vasodilatateur ; les fortes concentrations
l’impliquent dans la réponse immunitaire, comme
agent cytostatique et cytotoxique, mais aussi dans nombre
de maladies. Celles-ci soulignent l’importance de l’inhibition
spécifique des NOS, qui devrait être réalisable in vivo
avec des inhibiteurs compétitifs du substrat tels que les
S-alkylisothiourées ou la Nω-propylarginine. Nitric oxide (NO), a reactive molecule, is a biological mediator synthesized by the three isoforms of NO synthase (NOS), two of which are constitutive (NOS-1 and NOS-3), and one inducible (NOS-2). These homodimeric heme enzymes catalyze the oxidation of their substrate, L-arginine, in the presence of NADPH, molecular oxygen and tetrahydrobiopterin, into a hydroxylated intermediate, NOHA, then into citrulline and NO. The heme is probably responsible for both steps of product formation. The C-terminal half of NOS has a sequence homology with cytochrome P450 reductase. In the N-terminal half, where substrate oxidation is carried out, comparison to P450 shows the conservation of several amino-acids surrounding the cysteine responsible of heme coordination. NOS is therefore an autonomous P450 system. Furthermore, the dimeric structure of NOS-2 is essential for its activity, potentially because it is crucial to the constitution of the active site. Two recent crystal structures of NOS-2 (monomer and dimer) show unique features in NOS structure. Oxidation of NOHA into NO by NOS is an atypical monooxygenation because it requires only a half-equivalent of NADPH. NOS-mediated NOHA oxidation into citrulline and NO might be carried out in a unique mechanism by an iron peroxide resulting from molecular oxygen binding to NOSFe(II). The NOS are regulated in a number of ways, including transcriptionally (especially NOS-2), by calcium/calmodulin binding (for the constitutive isoforms), by some of their cofactors, and by their substrates and products. At low levels, NO seems involved in the transmission of information, especially in blood pressure regulation, as a vasodilator, and in the nervous system. NO production at higher doses plays a role in immune response, through its cytostatic and cytotoxic properties, but also in several pathologies, including septic shock. As attempted treatments of the latter have shown, the selectivity of NOS inhibition is crucial to its therapeutic efficacy. Beyond action on its characteristics that are shared by other enzymes, which would therefore lack selectivity, selective NOS inhibition could be obtained by competitive substrate binding inhibitors, like S-alkylisothioureas or N(omega)-propylarginine. [References: 48]
Pour citer ce document
Vadon-Le Goff, S ; Sennequier, N, Biosynthèse du monoxyde d'azote (NO) : mécanisme, régulation et contrôle., Med Sci (Paris), 1998, Vol. 14, N° 11; p.1185-95